Кинетика фазообразования при распаде вюстита
Автор: Тепляков Юрий Николаевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Металлургия чёрных, цветных и редких металлов
Статья в выпуске: 1 т.21, 2021 года.
Бесплатный доступ
На основании высокотемпературного рентгенофазового анализа вюститсодержащей окалины на железе, подвергнутой изотермическому отпуску при температурах ниже 575 °С, исследована кинетика формирования продуктов распада вюстита: стехиометрического вюстита, первичного и вторичного магнетитов, а также дисперсного железа. Установлено, что стехиометрический вюстит формируется как промежуточная фаза при температурах отпуска ниже 400 °С и диффузионном контроле. Возможно, что стехиометрический вюстит - это результат кинетических затруднений распада исходного нестехиометрического вюстита. В зависимости от температуры отпуска распад вюстита протекает по двум механизмам. При температурах выше 400 °C вюстит распадается с одновременным образованием магнетита и железа. При температурах ниже 400 °C распад происходит в две стадии. На первой образуется первичный магнетит и стехиометрический вюстит. После полного распада исходного нестехиометрического вюстита наступает вторая стадия - распад стехиометрического с образованием вторичного магнетита и железа. При температурах отпуска менее 400 °C образуются два магнетита: первичный и вторичный. Отличия между этими фазами заключаются в том, что первый образуется в результате распада исходного нестехиометрического вюстита, а второй является продуктом распада промежуточного стехиометрического вюстита. Это в свою очередь вызывает существенные отличия в кинетике формирования фаз. В частности, скорость роста кристаллических зародышей вторичного магнетита очень мала, что позволяет предположить отсутствие кристаллических дефектов в стехиометрическом вюстите, либо их очень небольшое количество. Также установлено, что формирование всех продуктов распада включает несколько последовательных стадий. Начальные стадии образования новых фаз протекают при диффузионном контроле, и фактором, определяющим скорость процесса, является температура отпуска. Все заключительные стадии контролируются кинетически, а скорость стадий определяется величиной переохлаждения.
Кинетика, вюстит, распад, константа, скорость, энергия активации, стехиометрический вюстит, дисперсное железо, магнетит, контролирующая стадия
Короткий адрес: https://sciup.org/147233972
IDR: 147233972 | УДК: 669.696 | DOI: 10.14529/met210102
Текст научной статьи Кинетика фазообразования при распаде вюстита
Вюстит – основной компонент окалины, образующейся при окислении железа и углеродистых сталей в кислородсодержащих газовых средах. Вюстит не стабилен и при температурах ниже 575 °С распадается на магнетит и железо. Поэтому последующее, после нагрева стального изделия, охлаждение, даже высокоскоростное, до температуры окружающей среды приводит к изменениям фазового состава окалины.
Свойства вюстита и закономерности его распада широко изучались, например [1–6]. Знание этих закономерностей позволяет выбрать такой режим охлаждения стальных изделий, при котором формируется окалина легко растворимая в кислотах, или же защитные оксидные покрытия с повышенной коррозионной стойкостью [7].
Стехиометрический вюстит
Проведенные ранее исследования показали, что распад вюстита, в зависимости от температуры, протекает по двум механизмам. При температурах выше 400 °С распад протекает с одновременным выделением магнетита и железа. Отпуск ниже 400 °С приводит к распаду вюстита в две стадии. На первой образуются первичный магнетит и некоторая промежуточная метастабильная фаза. Как показали измерения, это вюстит с параметром кристаллической решетки а = 4, 326 ⋅10-10 м. Основные рентгенографические данные этой фазы приведены в работе [8]. Установлено [6, 7, 9, 10], что такой вюстит является стехиометрическим или очень близким к нему по составу. После полного распада исходного вюстита Fe1-xO наступает вторая стадия – распад стехиометрического вюстита с образованием вторичного магнетита и дисперсного железа.
Для исследования образования фаз использовался рентгеновский дифрактометр Дрон-3 с высокотемпературной приставкой типа УВД-2000. Измерения проводились в изотермическом режиме в излучении кобальта ( Co k α ). В качестве объекта исследований использовались образцы железа ЖЧК-4 в виде квадратов со стороной 10 мм и толщиной 2,5 мм. Предварительно образцы оксидировались в среде перегретого водяного пара при температуре 900 °С в течение 5 мин, что позволило получить практически однофазное покрытие, состоящее на 98 % из вюстита и на 2 % из магнетита. Толщина оксидного покрытия составила примерно 10 мкм. Охлаждение образцов от температуры оксидирования до комнатной температуры проводилось струей аргона, время охлаждения составило менее 10 с. Выбранный способ охлаждения позволяет предотвратить распад вюстита, растрескивания окалины и ее доокисление. Средний состав исходного вюстита можно выразить Fe0,96O , что соответствует параметру кристаллической реш е тки а = 4, 307 ⋅ 10 - 10 м.
При измерениях образец нагревался до заданной температуры отпуска и выдержи- вался определенное время. В процессе изотермического отпуска контролировался фазовый состав оксидного покрытия через каждые 3–4 мин. В качестве кинетического показателя была выбрана степень превращения α = J I Jmax , где J – текущая интенсивность дифракционного максимума фазы, J – его максимальное значение. max
На рис. 1 представлены кинетические зависимости формирования стехиометрического вюстита для температур отпуска 300, 350 и 400 °С.
Характер приведенных кривых свидетельствует о том, что формирование стехиометрического вюстита включает ряд последовательных стадий.
Начальная стадия протекает с небольшой скоростью и по своему существу представляет собой образование зародышей ядер кристаллов новой фазы (индукционный период).
На последующей стадии зародыши прорастают вглубь кристалла независимо друг от друга, при этом площадь поверхности растущих ядер увеличивается, это в свою очередь вызывает рост скорости реакции, которая достигает максимального значения (точка перегиба на кинетической зависимости). Затем, сливаясь, ядра образуют общий реакционный фронт, площадь поверхности достигает максимального значения. Последний участок соответствует замедлению процесса образования стехиометрического вюстита, что можно объяснить уменьшением количества исходного нестехиометрического вюстита [10–12].
Приведенные зависимости достаточно точно описываются уравнением Ерофеева – Колмогорова:
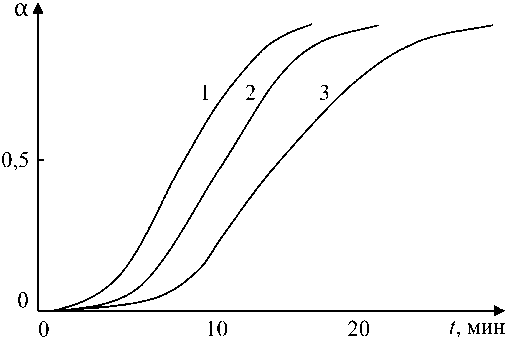
Рис. 1. Кинетические зависимости формирования стехиометрического вюстита Fe1,0O : 1 – 400 °C; 2 – 350 °C; 3 – 300 °C
а = 1- e-Ktm, (1) где K и m – постоянные величины для данной температуры. Двойное логарифмирование уравнения (1) позволяет получить линейную зависимость вида ln[- ln(1 - а)] = m In t - In K (2) и определить значение K и m (рис. 2).
Константа скорости реакции определяется уравнением Саковича с учетом постоянных K и m :
k = m K 1 m . (3)
Обработка данных (см. рис. 1 и 2) позволила получить кинетические параметры формирования стехиометрического вюстита, приведенные в табл. 1.
Зависимость константы скорости реакции k от температуры, приведенная на рис. 3, позволила определить энергию активации формирования стехиометрического вюстита, которая составила 14 кДж/моль. Относительная ошибка измерений не более 7 %.
Значение энергии активации соответствует диффузионному контролю формирования стехиометрического вюстита [13–15]. Малая величина этой энергии объясняется тем, что кристаллическая решетка исходного нестехиометрического вюстита и продукта его распада по своему строению очень близки. Распад сводится к перегруппировке атомов и их диффузии на очень небольшие расстояния – порядка одного параметра кристаллической решетки.
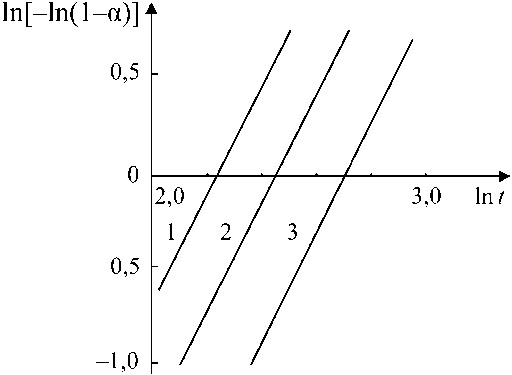
Рис. 2. Кинетика формирования стехиометрического вюстита:
1 – 400 °С; 2 – 350 °С; 3 – 300 °С; t , мин
Параметры процесса формирования стехиометрического вюстита
Таблица 1
|
Т , °С |
K , 1 мин m |
m |
k , 1 мин |
|
300 |
0,2^10 " 3 |
3,1 |
0,203 |
|
350 |
0,5^10 ~ 3 |
3,1 |
0,272 |
|
400 |
0,9^10 " 3 |
3,1 |
0,329 |
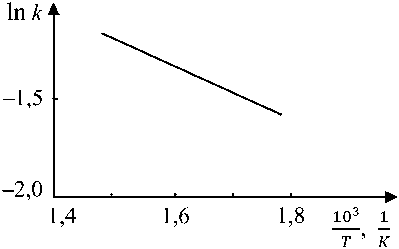
Рис. 3. Зависимость константы скорости роста стехиометрического вюстита от температуры
Показатель степени m = 3 соответствует образованию зародышей новой фазы сферической формы, при этом количество зародышей постоянно [13].
С ростом температуры диффузионное сопротивление образованию продуктов распада уменьшается, в результате чего вероятность образования промежуточной фазы снижается.
Таким образом, можно предполагать, что образование стехиометрического вюстита есть результат кинетических затруднений процесса распада.
Магнетит
При температурах отпуска менее 400 °С образуются два магнетита – первичный и вторичный. Отличие между этими фазами заключается в том, что первый образуется в результате распада исходного нестехиометрического вюстита, а второй является продуктом распада промежуточного, стехиометрического вюсти-та. Характер исходных фаз вызывает отличия в кинетике образования магнетитов, о чем свидетельствуют зависимости, приведенные на рис. 4 и 5. Более наглядное представление дает интерпретация зависимостей в координатах ln t, ln[-In(1- а)] (рис. 6). На каждой зависимости можно видеть три участка.
Начальный участок – формирование первичного Fe3O4 . Следующий участок – участок с нулевой или очень малой скоростью роста магнетита (индукционный участок), на котором образуются зародыши новой фазы – вторичного Fe3O4 в матрице Fe1,0O . Скорость образования вторичного магнетита на индукционном участке очень мала, и метод РФА не позволяет ее определить. Наличие длительного индукционного участка позволяет предположить, что дефекты в Fe1,0O отсут-
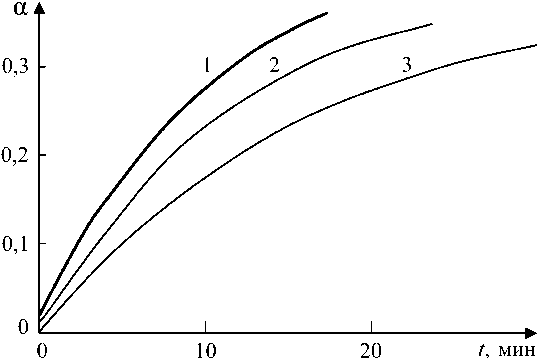
Рис. 4. Кинетика формирования первичного магнетита: 1 – 400 °С; 2 – 350 °С; 3 – 300 °С
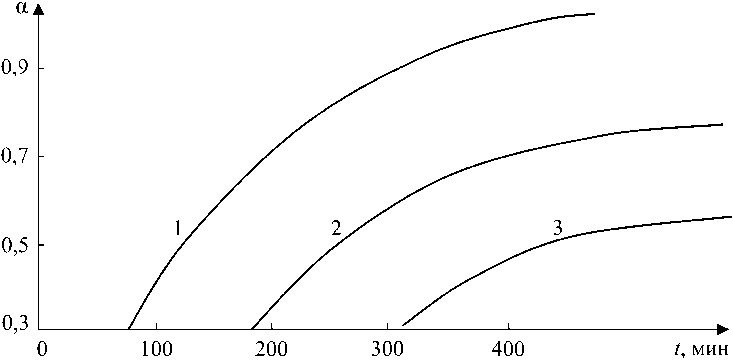
Рис. 5. Кинетика формирования вторичного магнетита: 1 – 400 °С; 2 – 350 °С; 3 – 300 °C
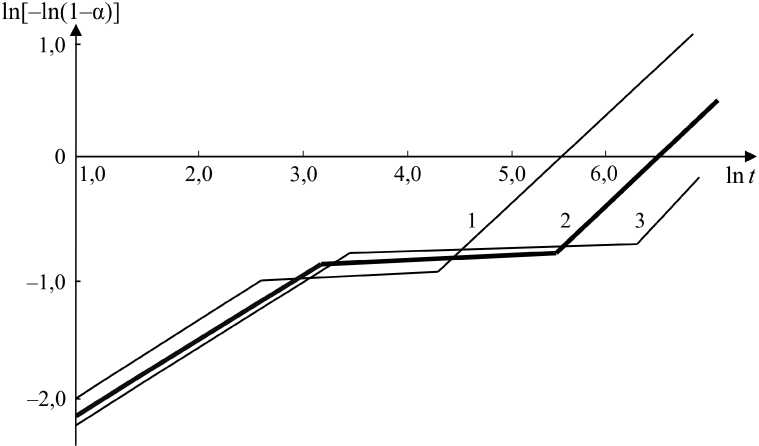
Рис. 6. Формирование первичного и вторичного магнетита:
1 – 400 °С; 2 – 350 °С; 3 – 300 °С; t , мин
Кинетические параметры формирования первичного магнетита
Таблица 2
|
Т , °С |
K , 1 мин m |
k , 1 мин |
m |
|
300 |
0,055 |
0,005 |
0,61 |
|
350 |
0,064 |
0,007 |
0,62 |
|
400 |
O,071 |
0,013 |
0,67 |
Таблица 3
Кинетические параметры формирования вторичного магнетита
Зависимости (см. рис. 6) позволяют определить постоянные величины K и m, входящие в уравнение (1). Кинетику роста вторичного магнетита можно выразить уравнением a = 1-exp[-K(t -10)m], (4) где t0 – время окончания распада стехиометрического вюстита, причем t > 10 .
Полученные данные приведены в табл. 2 и 3.
Зависимость константы скорости реакции от температуры, приведенная на рис. 7, позволяет определить энергию активации формирования первичного и вторичного магнетитов. В первом случае энергия активации составила E = 27,3 кДж/моль, что соответст- 18
вует диффузионно-кинетическому контролю. Об этом же свидетельствует значение показателя степени 0,5 < m < 1,0 .
Энергия активации образования вторичного магнетита составляет E = 35,4 кДж/моль и соответствует кинетическому контролю процесса, этому же соответствует показатель степени m > 1,0.
Магнетит, образующийся при температурах отпуска выше 400 °С, формируется в результате эвтектоидного распада исходного нестехиометрического вюстита без образования промежуточной фазы. Кинетические зависимости роста Fe3O4 для температур отпуска 450, 500, 550 °С приведены на рис. 8.
Зависимости состоят из двух участков. Первый – индукционный, соответствует фор-
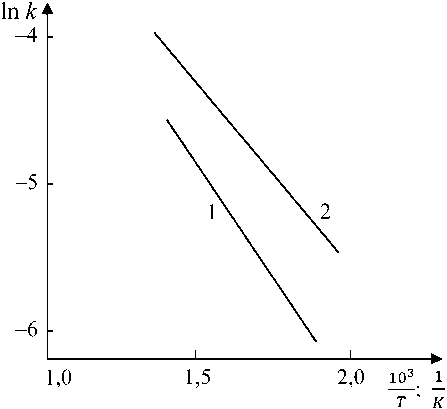
Рис. 7. Зависимость константы роста Fe 3 O 4 от температуры (300, 350, 400 °C): 1 – вторичный магнетит; 2 – первичный магнетит
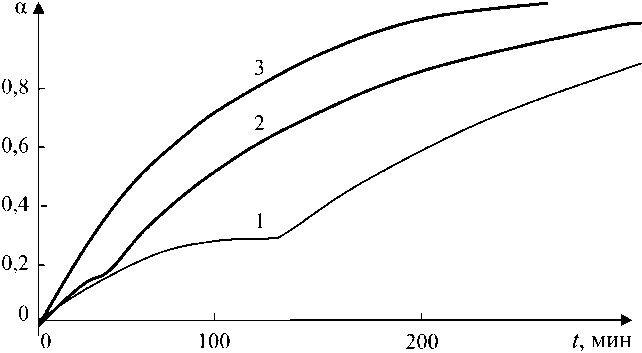
Рис. 8. Кинетика формирования магнетита. Температуры отпуска: 1 – 550 °С; 2 – 500 °С; 3 – 450 °С
мированию кристаллических зародышей, а второй – их росту. Показано, что скорость образования магнетита возрастает с увеличением переохлаждения А Тохл = Т 0 - Т , где T 0 -точка Шадрона (575 °С), Т – температура отпуска.
При формировании вторичного магнетита скорость образования зародышей очень мала. Это можно объяснить тем, что вторичный магнетит формируется из стехиометрического вюстита, имеющего минимальное количество кристаллических дефектов, чего не наблюдается в исходном нестехиометрическом.
Можно видеть, что скорость роста кристаллов (участок 2), а также продолжительность участка 1 определяются величиной переохлаждения А Т охл.
Интерпретация зависимостей в координатах ln t , ln[-ln ( 1- а ) ] (рис. 9) дает возможность определить величины, входящие в уравнение (2) и приведенные в табл. 4.
Значения m на начальном участке свидетельствуют о диффузионном контроле процесса ( m « 0,5). На последующем участке рост Fe3O4 происходит при кинетическом контроле ( m « 1).
Зависимость константы скорости реакции от температуры (рис. 10) также свидетельствует о том, что определяющим фактором формирования магнетита при температурах отпуска 450, 500, 550 °С является величина переохлаждения.
Значения m на начальном участке свидетельствуют о диффузионном контроле процес- са (m ≈ 0,5 ). На втором участке рост Fe3O4 происходит при кинетическом контроле (m ≈ 1).
Зависимость константы скорости реакции от температуры (см. рис. 10) также свидетель- ствует о том, что определяющим фактором формирования магнетита при температурах отпуска 450, 500, 550 °С является величина переохлаждения.
ln[ln-(l-a)J
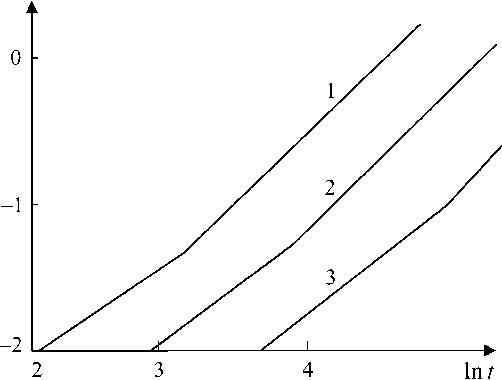
Рис. 9. Кинетика формирования Fe 3 O 4 :
1 – 450 °С; 2 – 500 °С; 3 – 550 °С; t – время, мин
Кинетические параметры формирования магнетита
Таблица 4
|
Т , °С |
Участок 1 |
Участок 2 |
||||
|
K , 1 /мин m |
k , 1 / мин |
m |
K , 1 /мин m |
k , 1 / мин |
m |
|
|
450 |
0,050 |
0,004 |
0,60 |
0,016 |
0,024 |
1,09 |
|
500 |
0,040 |
0,0006 |
0,48 |
0,005 |
0,007 |
1,05 |
|
550 |
0,033 |
0,00003 |
0,48 |
0,0003 |
0,0002 |
0,95 |
In к A
-4 -
-6 -
-8 -
-10 _
---► io3 i_
T ’ К
Рис. 10. Зависимость константы реакции от температуры (450, 500, 550 °С): 1 – участок 2; 2 – участок 1
Железо
Кинетические зависимости формирования железа для температур 300, 350 и 400 °С приведены на рис. 11 и 12.
Результаты расчета параметров уравнения (1) представлены в табл. 5.
Кинетика процесса определяется температурой отпуска. Формирование железа при температурах 450, 500 и 550 °С происходит в результате эвтектоидного распада исходного нестехиометрического вюстита без образования промежуточной фазы.
Зависимости представлены на рис. 13 и 14. Определенные значения постоянных и константы скорости реакции приведены в табл. 6.
Зависимости констант скорости роста железа для исследованных температур, приведенные на рис. 15, доказывают, что при температурах отпуска менее 400 °С, скорость процесса определяется величиной температуры отпуска. Значение энергии активации E = 81,4 кДж/моль, а также значение показателя степени в уравнении (4) m > 1 свидетельствуют о кинетическом контроле процесса.
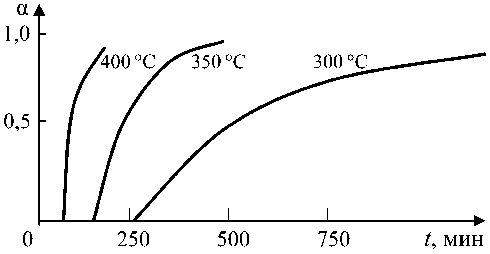
Рис. 11. Кинетика формирования железа при температурах 300, 350, 400 °С
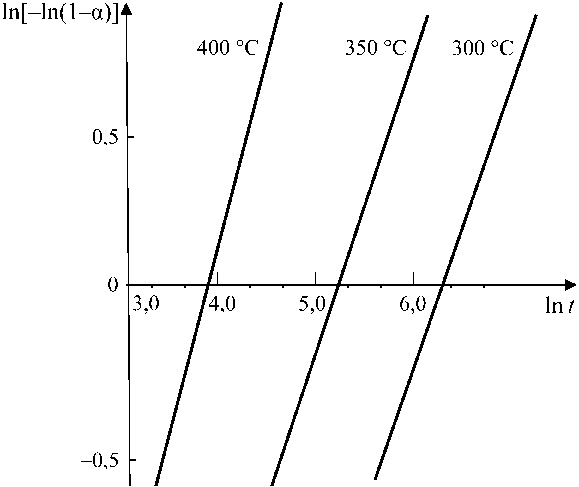
Рис.12. Кинетика формирования железа при температурах отпуска 300, 350, 400 °С; t – время, мин
Кинетические параметры формирования железа
Таблица 5
|
Т , °С |
K , 1 /мин m |
k , 1 / мин |
m |
t 0 , мин |
|
300 |
0,003 |
0,003 |
1,0 |
50 |
|
350 |
0,004 |
0,009 |
1,15 |
150 |
|
400 |
0,006 |
0,035 |
1,39 |
265 |
Таблица 6
|
Т , °С |
K , 1 /мин m |
k , 1 / мин |
m |
|
450 |
0,144 |
0,015 |
0,54 |
|
500 |
0,096 |
0,008 |
0,56 |
|
550 |
0,046 |
0,006 |
0,65 |
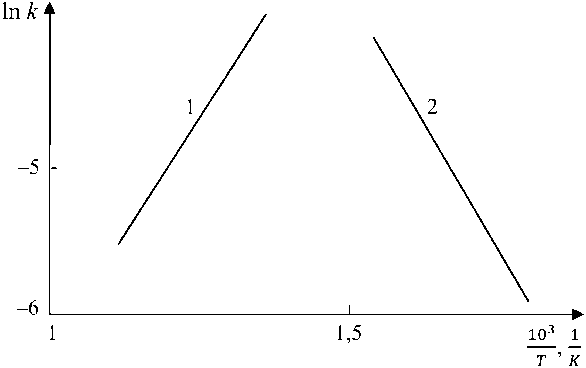
Рис. 15. Зависимость константы скорости формирования железа при температурах: 300, 350, 400 °С (2); 450, 500, 550 °С (1)
При температурах отпуска выше 400 °С кинетика формирования железа определяется величиной переохлаждения, а значение показателя m < 1 соответствует диффузионному контролю.
Выводы
Методами формальной кинетики с помощью рентгенофазового анализа установлено:
-
1. При распаде вюстита, входящего в состав окалины, образуются: стехиометрический вюстит, первичный магнетит, вторичный магнетит и дисперсное железо.
-
2. Стехиометрический вюстит формируется как промежуточная фаза при температу-
-
3. Формирование всех продуктов распада вюстита включает несколько последовательных стадий.
-
4. Начальные стадии формирования продуктов распада вюстита протекают при диффузионном контроле и фактором, определяющим скорость процесса, является температура отпуска. Все заключительные стадии контролируются кинетически, а скорость этих стадий определяется величиной переохлаждения.
рах отпуска ниже 400 °С при высоком диффузионном сопротивлении. Следовательно, стехиометрический вюстит – это результат кинетических затруднений распада исходного нестехиометрического вюстита.
Список литературы Кинетика фазообразования при распаде вюстита
- Ilschner, B. Ausscheidungskinetik in Wüstit (Fe1−xO) / B. Ilschner, E. Mlitzke // Acta Metallurgica. – 1965. – Vol. 13, iss. 7. – P. 855–867. DOI: 10.1016/0001-6160(65)90150-1
- Chaudron, G. Sur les premières recherches relatives instabilité du protoxyde fer / G. Chaudron // Ann. Chim. – 1970. – Vol. 5. – P. 234–239.
- Лыкасов, А.А. Физико-химические свойства вюстита и его растворов / А.А. Лыкасов. – Свердловск: УНЦ АН СССР, 1987. – 227 с.
- Окисление металлов / под ред. Ж. Бенара. – М.: Металлургия, 1967. – Т. 1. – 499 с.
- Есин, О.А. Физическая химия пирометаллургических процессов / О.А. Есин, П.В. Гельд. – Свердловск: Изд-во литературы по черной и цветной металлургии, 1962. – Т. 1. – 671 с.
- Мень, А.И. Физико-химические свойства нестехиометрических окислов / А.Н. Мень, Ю.П. Воробьев, Г.И. Чуфаров. – Л.: Химия, 1973. – 223 с.
- Тепляков, Ю.Н. Распад вюстита и влияние его на коррозионную стойкость оксидированных сталей / Ю.Н. Тепляков // Известия вузов. Серия «Черная металлургия». – 1988. – № 11. – С. 154–155.
- Тепляков, Ю.Н. Распад вюстита, входящего в состав окалины / Ю.Н. Тепляков // Вестник ЮУрГУ. Серия «Химия». – 2009. – № 23 (156). – С. 36–42.
- Benord, I. Decomposition du peroxyde de fer au cours de traitements revenue structure a houte temptrature / I. Benord, T. Herot, I. Monenc // Ann. Chim. – 1970. – Vol. 6. – P. 240–245.
- Katsura, T. High‐Pressure Synthesis of the Stoichiometric Compound FeO / T. Katsura, B. Iwasaki, S. Kimura, S. Akimoto // J. Chem. Phys. – 1967. – Vol. 47. – P. 4559. DOI: 10.1063/1.1701668
- Hoffman, A. Der Zerfallsmechanismus des Wüstite Fe1–xO unterhalb 570 °C / A. Hoffman // Z. Electrochem. – 1959. – Bd. 63, Nr. 2.– S. 207–213.
- Broussard, L. The Disproportionation of Wustite / L. Broussard // J. Phys. Chem. – 1969. – Vol. 73, no. 6. – P. 1848–1854. DOI: 10.1021/j100726a035
- Захарьевский, М.С. Кинетика и катализ / М.С. Захарьевский. – Л.: Изд-во Ленинград. ун-та, 1963. – 314 с.
- Янг, Д. Кинетика разложения твердых веществ / Д. Янг. – М.: Мир, 1969. – 263 с.
- Стромберг, А.Г. Физическая химия / А.Г. Стромберг, Д.П. Семченко. – М.: Высшая школа, 2003. – 527 с.


