Кинетика клеточных популяций тимуса под влиянием инфракрасного лазерного излучения
Автор: Бугаева Ирина Олеговна, Егорова Анна Валериевна, Злобина Ольга Вячеславовна
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Макро- и микроморфология
Статья в выпуске: 1 т.6, 2010 года.
Бесплатный доступ
Исследовано влияние низкоинтенсивного инфракрасного лазерного излучения на морфокинетику клеточ¬ных популяций тимуса здоровых экспериментальных животных. Установлено, что число тимоцитов коркового вещества тимуса под влиянием низкоинтенсивного инфракрасного лазерного излучения стресса снижается, что связано с миграционными процессами и уходом тимоцитов на другие территории. Проникновение тканевых базофилов в строму тимуса и их контакт с ретикуло-эпителиальными клетками является важным фактором для стимуляции процессов пролиферации и дифференцировки тимоцитов
Клеточные популяции, низкоинтенсивное инфракрасное лазерное излучение, тимус
Короткий адрес: https://sciup.org/14917000
IDR: 14917000
Текст научной статьи Кинетика клеточных популяций тимуса под влиянием инфракрасного лазерного излучения
1Введение. Тимус как орган обнаружен первыми анатомами эпохи Возрождения. Однако до последнего времени роль его в организме оставалась загадочной. В начале 60-х годов ХХ века были получены факты, доказавшие участие тимуса в процессе иммуногенеза. По современным представлениям, тимус — это центральный орган системы иммунитета, контролирующий созревание и функциональную активность лимфоцитов, которые осуществляют иммунный надзор в организме [1, 2]. Тимоциты по своим морфологическим свойствам практически не отличаются от обычных лимфоцитов и характеризуются округлыми ядрами с грубым глыбчатым строением хроматина и небольшим количеством цитоплазмы. Тимус является лимфоэпителиальным органом, эпителиальная часть которого — стабильная составляющая, имеющая местное происхождение. Особенностью тимоцитов является высокая митотическая активность и повышенная чувствительность к действию ионизирующего излучения, химических канцерогенов и стероидных гормонов.
Лимфоидные элементы (собственно тимоциты) определяются как транзиторные [3]: их предшественники мигрируют в тимус из красного костного мозга, а большая часть созревших в тимусе Т-лимфоцитов мигрирует в периферический отдел иммунной систе-
410012 г. Саратов, ул. Б. Казачья, 112,
ГОУ ВПО Саратовский ГМУ им. В.И. Разумовского Росздрава Тел.: (8452) 66-98-05, 66-98-04 E-mail: AV_Egorova @ BK. RU мы, где они включаются в функциональный рециркулирующий пул Т-клеток. Это делает тимус чрезвычайно чувствительным к различного рода воздействиям и, в частности, к лучевым.
ИК лазерное излучение обладает высокой проникающей способностью [4]. Т.о., при облучении передней брюшной стенки мышей, воздействию ИК излучения подвергаются все органы и ткани животного. В современной научной литературе крайне скудны и противоречивы сведения о влиянии низкоинтенсивного лазерного излучения на структуру и функции вилочковой железы.
Целью нашего исследования явилось комплексное изучение морфокинетики тимуса здоровых экспериментальных животных под влиянием низкоинтенсивного инфракрасного лазерного излучения с использованием терапевтического лазерного аппарата «Узор». Основными параметрами исследуемой проблемы явились: изучение кинетики клеточных популяций тимуса, измерение относительной массы вилочковой железы, подсчет корково-мозгового индекса в процессе воздействия низкоинтенсивного лазерного излучения на экспериментальных животных.
Методы. Эксперименты проведены на 570 белых крысах-самцах массой 180-200 г. Облучение передней брюшной стенки животных проводилось контактно-зеркальным методом при помощи аппарата АЛТ «Узор», который является полупроводниковым лазерным инжектором на арсениде галлия. Параметры лазерного излучения, генерируемого этим аппаратом: длина волны 890 нм импульсная частота 1500 Гц; экспозиция 128 с. Средняя мощность излучения (Р, по паспорту прибора) составляла для частоты излучения 1500 Гц - 4 мВт. Плотность энергии излучения на поверхности кожи животного (Е) рассчитывалась по формуле
E = fPt, где Е – плотность энергии излучения на поверхности кожи (Дж/см2); f – частота следования импульсов излучения (Гц); t – длительность лазерного импульса (с); Р – средняя мощность лазерного излучения (Вт).
Поглощенная доза (Ԝ) рассчитывалась по формуле:
W = IT (1 – Kft), Six где Ԝ – поглощенная (введенная) доза энергии (Дж/смІ); x - глубина расположения объекта; i – мощность излучения на данной глубине (Вт) (выбирается из специальных таблиц в зависимости от импульсной воздействующей мощности излучения и глубины расположения объекта); T - время экспозиции; K – коэффициент отражения кожи для длины волны 890нм (0,38); f - частота следования импульсов излучения (Гц); S - площадь воздействия на поверхность биоткани (смІ). В условиях проводимого эксперимента T = 128 с, f = 1500 Гц, t = 200 x 10-8 c, S = 6 см, плотность энергии на поверхности кожи для частоты 1500 Гц составила 12,6х10-3 Дж/см2. Облучение животных проводилось ежедневно в течение 10 дней (10 сеансов).
Группу контрольных животных составили 80 крыс-самцов линии Вистар массой 180-200 г, что соответствует возрасту около 3-х месяцев.
Для гистологических и гистохимических исследований выделенный у животных тимус фиксировали в 7% нейтральном формалине. После стандартной гистологической проводки в спиртах возрастающей концентрации материал просветляли в ксилоле и за- ливали в парафин. Серийные срезы тимуса толщиной 5-7 мкм окрашивали:
-
- гематоксилином-эозином (для подсчета клеточных элементов);
-
- толуидиновым синим (для выявления метахромазии тучных клеток).
Подсчет клеточных элементов (малых, средних, больших лимфоцитов, плазмоцитов, тучных клеток, иммунобластов) проводили в различных функциональных зонах тимуса стандартным методом при увеличении 200,400,900,1350 с использованием специализированной морфометрической сетки (Автандилов Г.Г., 1972, 1992) в 10 полях зрения на условной единице площади (6400 мкмІ). Фотосъемка гистологических препаратов проводилась с помощью цифровой фотокамеры SCOPETEK DCM 35 с программой обработки изображений MiniSee 2.0.
Результаты. При измерении относительной массы вилочковой железы облученных животных во все сроки наблюдения существенных изменений, по сравнению с контролем, выявлено не было. Подсчет корковомозгового индекса выявил некоторое снижение этого показателя через сутки после 1-го сеанса облучения с тенденцией к его увеличению на 3-и сутки опыта. На 7-е (7 сеансов облучения) и 15-е (спустя 5 дней после окончания облучения) сутки наблюдалось увеличение корково-мозгового индекса (табл. 1).
К 21-м суткам данный показатель приближался к контрольному и оставался таковым до 30-х суток наблюдения.
Морфокинетика клеточных элементов тимуса характеризовалась незначительным угнетением лим-фоцитопоэза в корковом веществе в 1-е и 3-и сутки наблюдения: количество малых лимфоцитов составило, соответственно, 120,0±4,4 и 115,4±3,06 (при 144,6±3,1 в контроле, p<0,01). Уменьшалась плотность расположения тимоцитов, что было наиболее заметно в субкапсулярной зоне, где обнаруживались
Таблица 1
Значения корково-мозгового индекса в тимусе мышей после воздействия НИЛИ (M±m)
|
Контроль |
ИК лазерное облучение (сутки эксперимента) |
|||||
|
1 |
3 |
7 |
15 |
21 |
30 |
|
|
2,05±0,09 |
1,2±0,09* |
3,1±0,1* |
3,3±0,08* |
2,9±0,09* |
1,95±0,06 |
2,0±0,1 |
Примечание: * – различия достоверны по сравнению с контролем (p<0,05).
Таблица 2
Количественная динамика тимоцитов в корковом веществе вилочковой железы экспериментальных животных при облучении ИК лазером. (абс.число/ед.площади, M±m)
|
Группы |
Название клеточных элементов |
|||
|
сутки эксперимента |
Малые |
Средние |
Бласты |
|
|
Контроль |
144,6±3,1 |
17,2±0,8 |
4,8±0,3 |
|
|
24 часа после первого сеанса (1 сутки эксперимента) |
120,0±4,4* |
8,3±0,5* |
2,1±0,9 |
|
|
3 сутки |
115,4±3,06* |
10,3±0,8* |
6,5±0,1 |
|
|
Облучение |
7 сутки |
149,4±4,3 |
26,7±0,9* |
8,6±0,3* |
|
15 сутки |
150,6±3,6 |
19,4±1,1 |
7,1±0,2 |
|
|
21 сутки |
145,2±4,1 |
17,9±0,7 |
4,9±0,8 |
|
|
30 сутки |
144,6±3,1 |
17,2±0,8 |
4,8±0,3 |
|
Примечание: * – различия достоверны по сравнению с контролем (p<0,05).
единичные тучные клетки с признаками дегрануляции (рис. 1). Угнетение сменялось выраженным усилением пролиферативной активности корковых тимоцитов на 15-е сутки: число малых лимфоцитов составило 154,1±3,6 (при 144,6±3,1 в контроле, р<0,01). Эта тенденция отчетливо проявлялась в наиболее репродуктивной подкапсульной зоне тимуса. Клеточность в этой области увеличивалась, тканевые базофилы сохраняли нетипичную локализацию, оставаясь в субкапсулярной зоне (рис. 2). Эпителиальные клетки на гистологических препаратах были гипертрофированы, в некоторых из них отмечались фигуры митоза.
В кортико-медуллярной зоне на 3-7-е сутки облучения выявлялись признаки активации тимоцитов в виде увеличения размеров, вплоть до бластной трансформации. Иммунобласты составляли 6,5 ± 0,1 на 3-и сутки и 8,6 ± 0,3 - на 7-е сутки (при 2,1 ± 0,09 в контроле, р < 0,01). Эти показатели приближались к контрольным на 21-е и 30-е сутки (табл. 2).
Мозговое вещество тимуса, в первые сутки наблюдения, содержало большее по сравнению с контролем количество средних и малых тимоцитов, что указывает на усиление процессов миграции зрелых клеток в мозговое вещество уже через 24 ч после первого сеанса облучения.
В последующие сроки эксперимента отмечалась тенденция к нарастанию интенсивности дифференцировки и миграции тимоцитов в мозговое вещество. С 7-х по 15-е сутки содержание мозговых тимоцитов было максимальным. В дальнейшем число малых лимфоцитов этой зоны нормализовалось, а уровень средних лимфоцитов оставался существенно выше контрольного.
Содержание тканевых базофилов увеличивалось спустя 24 ч после первого сеанса облучения, нарастало на 3-и и 7-е сутки. Гипертрофированные тучные клетки с признаками дегрануляции в эти сроки наблюдения обнаруживались в паренхиме тимуса в подкапсульной зоне и хорошо выявлялись при окрашивании толуидиновым синим, а также метиловым зеленым и пиронином по Браше.
В последующие дни исследования количество этих клеточных форм заметно снижалось (ниже контрольного показателя) к 15-м суткам эксперимента. Восстановление содержания тканевых базофилов происходило к 30-м суткам наблюдения (табл. 3).
Обсуждение. Таким образом, низкоинтенсивное ИК лазерное излучение оказывает выраженное влияние на клеточный состав паренхимы и стромы тимуса. Обнаруженное нами на 3-и сутки эксперимента уменьшение клеточности тимуса может являться следствием активации под влиянием НИЛИ стресс-реализующих систем и включения механизмов общего адаптационного синдрома [5]. Возникающая при этом стимуляция структур гипоталамо-гипофизарно-надпочечниковой системы приводит к освобождению глюкокортикоидов, которые уменьшают количество тимоцитов в корковом веществе тимуса [3, 6]. Одна-
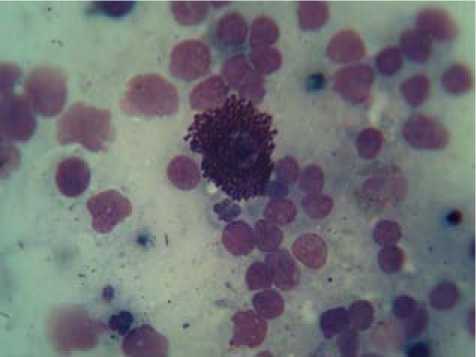
Рис. 1. Тучные клетки тимуса с выраженными признаками дегрануляции (7-е сутки лазерного воздействия). Мазок отпечаток. Окр. по Романовскому-Гимза. Об.90, ок. 15
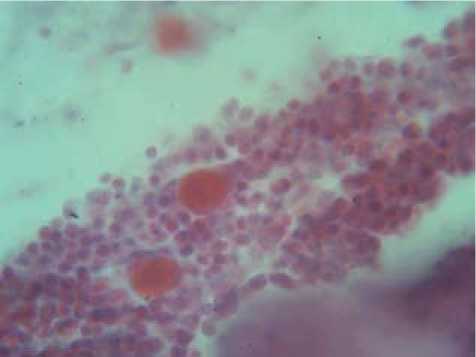
Рис. 2. Тучные клетки в субкапсулярной зоне тимуса (1-3и сутки облучения). Окр. метиовый зеленый, пиронин.
Об.90, ок.15
ко, исследования последних лет [7], показывают, что клеточный состав тимуса на фоне воздействия стрессоров различной природы (звук, вибрация, введение вакцин, помещение в электромагнитное поле) претерпевает самые разнообразные изменения, трактовка которых неоднозначна. В соответствии с представлениями авторов, эти изменения носят фазный характер и касаются всех ростков, а также ретикулоэпите-лиальной стромы. Одним из наиболее характерных моментов при этом является накопление в ткани тимуса широкоплазменных лимфоцитов с повышенной пиронинофилией цитоплазмы. Одновременно наблюдаются изменения, характеризующие некоторые подвижки в метаболических процессах. Число тимоцитов коркового вещества тимуса на ранних этапах стрес-
Динамика содержания тканевых базофилов в мозговом веществе тимуса при облучении ИК лазером (абс.число/ед.площади, M±m)
Таблица 3
|
Контроль |
ИК лазерное облучение (сутки эксперимента) |
|||||
|
3,7±0,1 |
1 |
3 |
7 |
15 |
21 |
30 |
|
4,4±0,2* |
5,3±0,09* |
5,8±0,08* |
1,4±0,1* |
2,2±0,1* |
3,6±0,3 |
|
Примечание: * – различия достоверны по сравнению с контролем (p<0,05).
са снижается, однако традиционная интерпретация этого явления, как следствия разрушения тимоцитов под действием выраженной концентрации кортизона, вряд ли соответствует действительности: количество клеточного детрита, обнаруженного в ткани тимуса в свободном либо захваченном макрофагами состоянии, явно не пропорционально масштабам явления. По мнению авторов [7], речь идет, скорее всего, о миграционных процессах и об уходе тимоцитов на другие территории. Мы в своей работе придерживаемся аналогичной точки зрения.
Известно, что взаимодействие созревающих лимфоцитов с ретикулоэпителиальными клетками служит условием процесса положительной селекции тимоцитов, их дифференцировки и миграции [ 3 ] . Описанная морфологическая картина тимуса при лазерном воздействии согласуется с имеющимися в литературе сведениями о стимулирующем влиянии ИК лазерного излучения на генетический аппарат лимфоидных клеток, а также выработку ретику-лоэпителиальными клетками тимических гормонов (тимозина-Т а , тимулина) [6]. Принимая во внимание заметное увеличение частоты встречаемости фигур митоза в клетках лимфоидного ряда, бласты и большие лимфоциты, очевидно, представляют собой клетки, вышедшие в цикл под влиянием экзогенного стимула (НИЛИ). Это может быть связано с выработкой клеточными элементами тимуса ростовых факторов, в том числе тимозина, в ответ на воздействие ИК лазерным светом.
Эффект лазерного воздействия является обратимым: на 15-е сутки исследования отмечается восстановление клеточности тимуса, сопровождающееся угнетением процессов бласттрансформации и дифференцировки тимоцитов, что, по-видимому, обусловлено уменьшением активности ретикулоэ-пителиальных клеток в отношении продукции цитокинов и тимических гормонов спустя неделю после окончания сеансов облучения.
Весьма распространенным является мнение о пребывании тучных клеток исключительно в капсуле и соединительнотканных прослойках тимуса. Вместе с тем нами установлено, что на 3-и и 7-е сутки после начала облучения ИК лазером тучные клетки обнаруживаются также в субкапсулярной зоне долек тимуса (рис. 1). При этом имеют место тесные контакты субкапсулярных тимоцитов и тканевых базофилов. В самих тучных клетках отмечаются явления гипертрофии и отчетливые морфологические признаки дегрануляции. Эти результаты позволяют предположить, что проникновение тканевых базофилов в строму тимуса и их контакт с ретикулоэпителиальными клетками, наблюдаемые при воздействии низкоинтенсивного ИК лазерного излучения, являются важными факторами для стимуляции процессов пролиферации и дифференцировки тимоцитов.
Заключение.
-
1. Ежедневное транскутанное облучение экспериментальных животных низкоинтенсивным лазерным светом в течение 30 дней приводит к выраженным изменениям клеточного состава тимуса;
-
2. Изменение клеточного состава тимуса под влиянием инфракрасного лазерного излучения имеет определённую временную динамику: на 3-и сутки эксперимента клеточность тимуса уменьшается, отмечается миграция клеток из коркового вещества в мозговое, с 7-го по 15-й сеанс облучения содержание мозговых тимоцитов максимально увеличивается. К 30 сеансу происходит восстановление клеточности тимуса.
-
3. При курсовом инфракрасном лазерном облучении после начального повышения, снижается содержание тучных клеток в корковом веществе.
Список литературы Кинетика клеточных популяций тимуса под влиянием инфракрасного лазерного излучения
- Бернет, Ф. Клеточная иммунология/Ф. Бернет -М.: Мир, 1971. -243 с.
- Хавинсон, В.Х. Иммуномодулирующее действие факторов тимуса в патологии/В.Х. Хавинсон, В.Г. Морозов//Иммунология, 1984. -№5. -С. 28-31.
- Ярилин, А.А. Тимус как орган эндокринной системы/А.А. Ярилин, И.М. Беляков//Иммунология, 1996. -№3. -С. 4-10.
- Козлов, В.И. Лазеротерапия/В.И. Козлов, В.Н. Буйлин. -М.: Медицина, 1993. -149 с. 5. Применение низкоинтенсивного лазерного излучения в качестве физического адаптогена при действии на организм стрессорных факторов/Г.Е. Брилль, Т.П. Романова, О.В. Прошина, Т.А. Беспалова -Саратов, 1998. -123 с.
- Роль цитокинов и других метаболических факторов в механизме инволюции тимуса/Е.П. Киселева, Р.П. Огурцова, А.Н. Суворов и др. -СПб., 2002. -74 с.
- Кузник, Б.И. Иммуногенез, гемостаз и неспецифическая резистентность организма/Б.И. Кузник, Н.В. Васильев, Н.Н. Цыбиков -М.: Медицина, 1989. -280 с.


