Кинетика окисления диметилсульфоксида диоксидом хлора
Автор: Кузиванов И.М., Садыков Р.А., Судариков Д.В., Кучин А.В.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Химические науки
Статья в выпуске: 4 (24), 2015 года.
Бесплатный доступ
Изучена кинетика реакции диоксида хлора ClO2 с диметилсульфоксидом (ДМСО) в растворе тетрахлорметана. Временные зависимости расхода ClO2 в ходе реакции получены методом ЭПР по изменению интегральных интенсивностей сигнала ЭПР. Показано, что термический распад диоксида хлора и реакция с ДМСО протекают параллельно с сопоставимыми скоростями. При малых концентрациях ClO2 (
Диоксид хлора, диметилсульфоксид, кинетика реакции, метод эпр, термический распад
Короткий адрес: https://sciup.org/14992785
IDR: 14992785 | УДК: 544.42:546.143:547.279.52
Текст научной статьи Кинетика окисления диметилсульфоксида диоксидом хлора
Интерес к химии сераорганических соединений вызван перспективами использования тиолов, сульфидов, сульфоксидов и сульфонов в качестве экстрагентов и комплексообразователей металлов, флотореагентов, лекарственных средств, а также их применением в тонком органическом синтезе. Сульфоксиды и сульфоны чаще всего получают окислением тиолов и сульфидов различными окислителями. Одним из интересных и доступных окислителей, выпускаемых в промышленных масштабах, является диоксид хлора (ClO2). Отдельные примеры изучения кинетики и механизма окисления тиолов, сульфидов и дисульфидов диоксидом хлора в органических растворителях можно найти в обзорах [1,2]. Несмотря на широкое применение ClO2 в водоочистке и отбелке целлюлозы [3], сведения о его реакциях с органическими соединениями практически отсутствуют. Реакции диоксида хлора с органическими соединениями серы изучены в основном в водных растворах при малых концентрациях реагентов [4]. Несомненно, оценка возможности использования этого реагента в химии органических соединений серы представляет интерес. Поэтому исследование механизмов реакций и кинетических закономерностей процессов окисления сераорганических соединений диоксидом хлора является актуальным направлением органической и физической химии. Выполненная работа посвящена исследованию кинетики окисления диметилсульфоксида (ДМСО) диоксидом хлора в тетрахлорметане.
Материалы и методы
Диметилсульфоксид (х.ч.) и тетрахлорметан (х.ч.) перед использованием очищали в соответст- вии с известными методиками [5]. Газообразный диоксид хлора получали барботированием его водного раствора аргоном. Полученный таким образом газ очищали от хлора пропусканием через насыщенный раствор карбоната натрия. Для удаления следов воды газ пропускали через концентрированную серную кислоту и хлористый кальций. Раствор диоксида хлора готовили насыщением охлажденного в ледяной бане тетрахлорметана очищенным ClO2. Для определения концентрации полученный раствор титровали иодометрическим способом [6].
Изучение кинетики расхода диоксида хлора в процессе реакции с ДМСО и термического распада проводили методом ЭПР. Для этого раствор диоксида хлора с известной концентрацией (0,01 – 0,16 моль/дм3) в тетрахлорметане или реакционную смесь с ДМСО помещали в стеклянную ампулу диаметром 3 мм. Запаянную ампулу устанавливали в резонатор спектрометра ЭПР с заранее настроенной температурой. Спектры ЭПР диоксида хлора регистрировали через определенные промежутки времени. Концентрацию ClO 2 рассчитывали методом двойного интегрирования с помощью программы управления спектрометром и обработки сигналов. Для измерений использовался спектрометр ЭПР X-диапазона ESR 70-03 XD/2 (Минск).
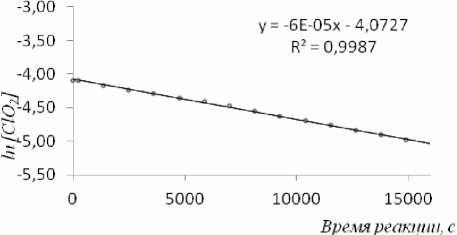
Рис. 1. Кинетика расхода диоксида хлора в координатах «ln[ClO2] – время» при концентрации [ClO 2 ] 0 =0,016 моль/дм 3 , 50 0 С.
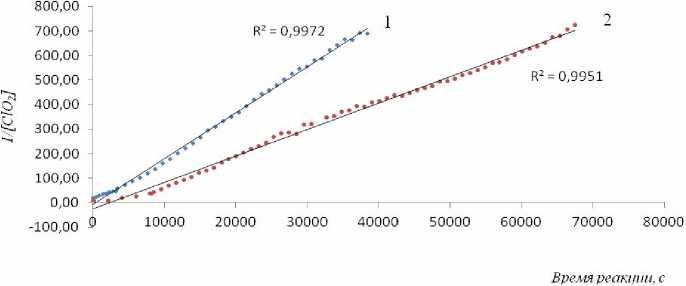
Рис. 2. Зависимость 1/[ClO 2 ] от времени реакции в CCl 4 : (1) – 50 º С, начальная концентрация [ClO 2 ] 0 = 0,16 моль/дм 3 ; (2) – 28 º С, начальная концентрация [ClO 2 ] 0 = 0,16 моль/дм 3 .
Результаты и обсуждение
Для кинетических исследований расход ClO 2 обычно измеряют методом УФ спектроскопии и потенциометрически [1,7]. По условиям эксперимента начальная концентрация в этом случае не должна превышать значения около 5∙10-4 моль/дм3. Для изучения кинетики расходования диоксида хлора в реакции с ДМСО нами был выбран метод ЭПР спектроскопии, который позволяет определять кинетику изменения концентрации диоксида в растворе от 0,006 моль/дм3 до ≈ 0,16 моль/дм3. Нами установлено, что взаимодействие диоксида хлора с ДМСО в тетрахлорметане протекает медленно и термический распад диоксида хлора происходит с соизмеримой скоростью. По этой причине сначала была изучена кинетика термического распада диоксида хлора в тетрахлорметане при 50ºС. Опыты показали, что при малых концентрациях, примерно 0,016 моль/дм3, термический распад происходит по реакции первого порядка, о чем свидетельствует график, приведенный на рис. 1.
При концентрации диоксида хлора 0,16 моль/ дм3 график его расхода приблизительно спрямляется в координатах «1/[ClO 2 ] – время» (рис. 2).
Следовательно, при увеличении концентрации диоксида хлора к мономолекулярному пути его распада параллельно добавляется еще бимолекулярный и становится основным. В таком случае кинетический анализ значительно усложняется.
Поэтому дальнейшие исследования проводили при концентрации диоксида хлора 0,016 моль/дм3.
Кинетику реакции диоксида хлора с ДМСО при концентрации ClO 2 , равной 0,016 моль/дм3, изучали в условиях [ClO 2 ] 0 << [ДМСО] 0 , где [ClO 2 ] 0 и [ДМСО] 0 – начальные концентрации. Полулогарифмические анаморфозы кинетических кривых расходования диоксида хлора при различных концентрациях ДМСО с высоким коэффициентом корреляции 0,990–0,999 описываются уравнением первого порядка (рис. 3).
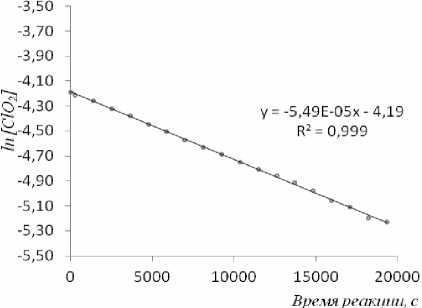
Рис. 3. График расхода диоксида хлора в координатах «ln[ClO 2 ] – время» в реакции с ДМСО в CCl 4 , [ClO 2 ] 0 = 0,015 моль/дм 3 , [ДМСО] 0 = 1,3 моль/дм 3 , Т=50 0 С.
Из кинетических кривых определены эффективные константы скорости первого порядка k eff (см. таблицу).
k eff = k[ДМСО]n, (1) где k – константа скорости реакции, n – порядок реакции по ДМСО. В данном случае n = 1.
Константы скорости распада диоксида хлора при различных условиях
|
Константа скорости |
28 ºC |
50 ºC |
|
|
Эффективная |
k eff, с-1 |
1,85∙10-5 |
1,7∙10-4 |
|
Термического распада |
k d ,с-1 |
1,4∙10-5 |
3,2∙10-5 |
|
Реакции с ДМСО |
k, с-1 |
0,6∙10-5 |
2,2∙10-5 |
На рис. 4 представлена линейная зависимость константы скорости k eff от концентрации ДМСО. Она соответствует уравнению:
k eff = k d + k[DMSO] , (2) где k – константа скорости с ДМСО и k d – константа скорости термического разложения ClO 2 при малых концентрациях. Зависимость, представленная на рис. 4, хорошо иллюстрирует, что значение k d , рассчитанное из зависимости k eff - [ДМСО] 0 , совпадает с величиной k d , , полученной при термическом распаде диоксида хлора в CCl 4 без ДМСО, и равна 3∙10-5 с-1.
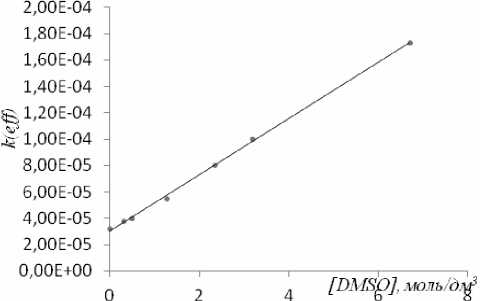
Рис. 4. Зависимость эффективной константы скорости окисления ДМСО диоксидом хлора keff от концентрации ДМСО в CCl 4 при 50 º С. [ClO 2 ] 0 = 0,016 моль/дм 3 .
Как видно из рис. 4, значение k eff линейно зависит от концентрации диметилсульфоксида, что свидетельствует о первом порядке реакции по ДМСО и об отсутствии влияния какой-либо ассоциации ДМСО на реакционную способность диоксида хлора. Величина отрезка, отсекаемого на оси ординат, равна константе термического распада диоксида хлора. Кинетическое уравнение имеет вид:
- l^f = («d + A'[DM50])[C/02]
,
где k d + k[DMSO] = k eff ;
k d – константа термического распада диоксида хлора;
[ClO 2 ] – концентрация диоксида хлора.
Публикации о механизме термического распада диоксида хлора в органических растворителях практически отсутствуют. Известны только работы 1931 г. [8,9], в которых обсуждается механизм термического распада диоксида хлора, и отмечается, что кинетика термического распада диоксида хлора в тетрахлорметане подчиняется уравнению:
-
-d[ClO 2 ]/dt = k [ClO 2 ]4/3 , (4)
т.е. порядок реакции по диоксиду хлора равен 4/3. Этот результат согласуется с нашим выводом о том, что в тетрахлорметане распад протекает по двум каналам: мономолекулярному и бимолекулярному. Учитывая инертность растворителя по отношению к диоксиду хлора, можно полагать, что его термический распад будет во многом аналогичен распаду в газовой фазе. В работе [10] нами согласуется сделанный вывод о протекании реакции термического распада по второму порядку согласно схеме:
2C1O2 - CIO + Clo3
CIO + C1O2 — Cl,o3
CIO * CI7O3 — 2C1 + 0, + cio2
Cl + C102 -2c 10
Cl + C102 — CL * o2
Cl-0,
.
По первому порядку реакция может начинаться с распада молекулы диоксида хлора на атом кислорода и радикал ClO·:
ClO 2 → ClO·+О.
Из наших кинетических исследований в CCl 4 расходование ClO 2 при окислении ДМСО при малых концентрациях диоксида хлора и избытка ДМСО протекает по первому порядку. Следовательно, можно предложить следующий механизм окисления, аналогичный окислению сульфидов до сульфоксидов (см. схему).
H 3Cs H 3 C + .
S o + clo2 3 S .O +
HC HC
H 3 C + . - H 3C x /O
-
3 s+.O + clo-2 3 ; S t +
H3C H3CO
Заключение
Предложена схема взаимодействия диоксида хлора с ДМСО в тетрахлорметане. Установлено, что взаимодействие диоксида хлора с диметилсульфоксидом и термический распад протекают параллельно. Методом ЭПР изучена реакция термического распада диоксида хлора в тетрахлормета-не. Установлено, что в тетрахлорметане термическое разложение диоксида хлора протекает по двум каналам. При малых концентрациях (< 0,02 моль/дм3) наблюдается мономолекулярная реакция распада по первому порядку. При увеличении концентрации ClO2 основным становится бимолекулярный механизм распада по реакции второго порядка. Опреде- лены константы скорости термического распада диоксида хлора при малых концентрациях и константы скорости реакции с ДМСО.
Работа выполнена при поддержке РФФИ №13-03-98807 р_север_а. Исследования проводились с использованием оборудования ИКП «Химия» Института химии Коми НЦ УрО РАН.
Список литературы Кинетика окисления диметилсульфоксида диоксидом хлора
- Ganiev I.М., Timergazin К.К., Kabalnova N.N. еt. аl. Reactions of Chlorine Dioxide with Organic Compounds//Eurasian Chemico-Technological Journal. 2005. Vol. 7. №1. P. 1-31.
- Kabalnova N.N., Grabovskiy S. A. Interaction of the Chlorine Dioxide with Some Organic Compounds//In Chlorine: Properties, Application and Health Effects. Editor: Roger Mangione and Dana Carlyle. 2011. Nova Science Publishers, Inc.
- Рахманин Ю.А., Гоженко А.И., Мокиенко А.В., Петренко Н.Ф. Диоксид хлора как средство оптимизации питьевой водоподготовки//Гигиена и санитария. 2007. Вып. 6. С. 3.
- Кучин А.В., Рубцова С.А., Судариков Д.В., Демакова М.Я. Диоксид хлора в реакциях хемо-и стереоселективного окисления сульфидов//Изв. АН. Сер. хим. 2013. №1. С. 1-5
- Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. С. 541.
- Masschelein W.J. Chlorine Dioxide: Chemistry and Enviromental Impact of Oxychlorine Compounds., Ann Arbor Publishers, Inc. 1979. 418 с.
- Липин И. В., Демин В. А. Кинетика реакции диоксида хлора с остаточным лигнином лиственной сульфатной целлюлозы//Известия Коми научного центра УрО РАН. 2013. Вып. 4 (16). С. 21-24.
- Luther, Hoffman, Z. Physical. Chem. Bodenstein-Festband, 1931. 755 c.
- Luther, Hoffman, Z. Physical. Chem. Abt. A Bd, 1936. Heft 1. 177 s.
- Грицан В.И., Панфилов В.Н. Определение стационарной скорости термического распада газообразной двуокиси хлора//Кинетика и катализ. 1975. Т. 16. Вып. 2. С. 316.


