Кинетика растворения медно-цинкового сплава в азотно-сернокислых растворах
Автор: Вострикова Н.М., Кравцова Е.Д.
Журнал: Журнал Сибирского федерального университета. Серия: Техника и технологии @technologies-sfu
Статья в выпуске: 2 т.12, 2019 года.
Бесплатный доступ
Проведены исследования по растворению медно-цинкового сплава, имитирующего неблагородную основу электронного лома, содержащего благородные металлы в азотно-сернокислых растворах. Получена математическая модель, позволяющая рассчитать скорость перехода меди и цинка в азотно-сернокислые растворы при варьировании концентрации H+-ионов от 1 до 4 моль/дм3 и NO3--ионов от 0,5 до 1,0 моль/дм3. В исследованном диапазоне концентраций H+- и NO3--ионов максимальная скорость перехода меди в раствор составляет 6,5·10-5, а цинка - 4,5·10-5 кг/м2 с. Представлено уравнение регрессии, позволяющее осуществлять выбор условий для протекания с необходимой скоростью химических процессов, имеющих место в металлургической практике.
Медь, цинк, латунь, вторичная переработка
Короткий адрес: https://sciup.org/146281186
IDR: 146281186 | УДК: 669.2 | DOI: 10.17516/1999-494X-0130
Текст научной статьи Кинетика растворения медно-цинкового сплава в азотно-сернокислых растворах
Использование благородных металлов в различных областях народного хозяйства с каждым годом возрастает, что требует еще большего их количества. Благородные металлы также до сих пор добывают из рудного сырья, но его запасов становится все меньше и меньше, и с экономической стороны это невыгодно. Поэтому для получения данного вида металлов предлагается использование вторичного сырья. Таким видом вторичного сырья является электронный лом гражданского и военного назначений. В нем содержится гораздо больше благородных металлов, чем в руде, что служит ключевым фактором в развитии производства по переработке вторичного сырья [1].
В настоящее время при вторичной переработке используют многокомпонентный лом, который сложно перерабатывать; например, сухие батареи требуют предварительного отделения марганца и ртути от меди и цинка [2]. Поэтому появляется необходимость разработать новые эффективные технологии, позволяющие не только получать драгоценные металлы, но также извлекать цветные металлы, тем самым повышая рентабельность производства [3].
Основные виды вторичного сырья – лом электронных систем военной техники, печатные платы, смешанный лом электронных приборов, ЭВМ, элементы переключения, транзисторные и стеклянные изоляторы. Переработке подвергается как смешанный лом, так и отдельные его элементы и узлы, в том числе и медный шлак [4, 5].
Значительная часть электронного лома военного и гражданского назначения, содержащего драгоценные металлы, в качестве «подложки» содержит латунь. Латунь – это двойной или многокомпонентный сплав на основе меди с добавлением цинка. Иногда в составе латуни находится олово, никель, свинец и другие элементы. По сравнению с чистой медью коррозийная стойкость и прочность у латуни выше. Также латунь можно найти в автомобильных запчастях, системах обогрева и кондиционирования, кабелях и деталях электрооборудования [6].
Таким образом, лом, содержащий латунь, как правило, многокомпонентный, что обуславливает применение самых различных подходов к его переработке.
Существуют разнообразные технологии по переработке лома, содержащего драгоценные металлы, анализ которых показал [7], что пирометаллургические операции не обеспечивают глубокое извлечение благородных металлов. Исходя из этого, на практике применяют гидрометаллургические процессы, которые основаны на вскрытии лома азотной кислотой. Но эти процессы приводят к большим потерям благородных металлов.
Таким образом, разработка новых технологических процессов, способствующих повышению извлечения благородных металлов при переработке электронного лома, остается актуальной и сейчас. Целью настоящей работы явилось исследование условий гидрометаллургического растворения неблагородной металлической основы – медно-цинкового сплава в азотно-сернокислых растворах. Основная задача исследования – при использовании латунных пластин как модели неблагородной основы электронного лома, содержащего благородные металлы, определить скорость перехода меди и цинка в азотно-сернокислые растворы.
Обоснование плана проведения факторного эксперимента и факторов, включаемых в эксперимент
Взаимодействие металлов с азотной кислотой – сложный процесс, механизм которого включает несколько стадий, в зависимости от кислотности среды конечным продуктом может являться как моно-, так и диоксид азота:
Me + 4H+ + 2NO 3 - = Me2+ + 2NO2 + 2H2O, (1)
3Me + 8H+ + 2NO3- = 3Me2+ + 2NO + 4H2O, (2)
где M – Cu, Zn, Ni и др.
На основании анализа данного уравнения химической реакции были выделены два основных фактора, позволяющих влиять на скорость растворения: кислотность раствора, концентрация нитрат-ионов. Данные факторы контролируемы и управляемы, что позволило использовать их в качестве переменных при составлении плана активного эксперимента. Зависимой переменной выбрана скорость растворения медно-цинкового сплава.
Скорость элементарной химической реакции ( to ) связана с концентрациями реагентов зависимостью
ω = Π С ibi , (3)
где С – концентрация, моль/дм3; b – порядок реакции по реагенту.
При логарифмировании данного уравнения можно получить линейное уравнение log(to) = b log(Ci) + b2-log(C2) + ... + bk-log(Ck), (4)
анализ которого показывает, что при нахождении зависимости скорости растворения от концентрации реагентов целесообразно пользоваться не концентрациями реагентов, а их логарифмами.
Для построения линейной модели достаточно изменять факторы на двух уровнях. Таким образом, при варьировании двух факторов (концентрация нитрат-ионов и кислотности среды) на двух уровнях необходимо поставить четыре основных и несколько дублирующих опытов в центре плана. В табл. 1 приведены принятые нами для проведения эксперимента значения пределов варьирования концентрации H+- и NO3--ионов, а также значения центра факторного пространства в натуральном и в логарифмическом масштабе. План проведения эксперимента в безразмерном и натуральном масштабах представлен в табл. 2, где четыре основных опыта по-
Таблица 1. Пределы варьирования факторов и центр факторного пространства
Table 1. The limits of variation and the center of the factor space
|
Значение в плане эксперимента |
Н+, моль/дм3 |
NO 3 -, моль/дм3 |
log (Н+), [моль/дм3] |
log (NO 3 -), [моль/дм3] |
|
Максимальное значение |
4,0 |
1,0 |
0,60 |
0,00 |
|
Минимальное значение |
1,0 |
0,5 |
0,00 |
-0,30 |
|
Центр плана |
2,0 |
0,7 |
0,30 |
-0,15 |
Таблица 2. План проведения эксперимента
Table 2. Plan of the experiment
Данный план позволяет получить взаимосвязь скорости перехода меди и/или цинка в раствор в виде log(®) = bflog(H+) + b2-log(NO3—) + b12.log(H+)4og(NO3-). (5)
Методика выполнения эксперимента
Исходным материалом, моделирующим неблагородную основу электронного лома, содержащего благородные металлы, являлся медно-цинковый сплав, содержащий 60 % меди и 40 % цинка. В качестве окислителя были выбраны нитрат-ионы, концентрация которых в соответствии с представленным выше планом эксперимента менялась от 0,5 до 1,0 моль/дм3, аза счет присутствия серной кислоты (от 1 до 4 моль/дм3) варьировалась кислотность среды.
Изучение кинетики растворения образцов проводили по следующей методике. В стеклянные колбы заливали 50 см3 раствора с заданным соотношением NO 3 -- и Н+-ионов, при этом необходимое соотношение вышеупомянутых ионов подбирали, варьируя соотношение серной кислоты, азотной кислоты и нитрата натрия. Образцы медно-цинкового сплава толщиной 0,05 см и площадью около 10 см2 помещали в азотно-сернокислые растворы и ставили на встряхиватель. По истечении заданного интервала времени образцы вынимали из раствора, промывали дистиллированной водой, просушивали в сушильном шкафу до постоянной массы, взвешивали с точностью до третьего знака после запятой. В растворах определяли содержание меди и цинка. Далее эту же пластину медно-цинкового сплава помещали в свежую порцию раствора с идентичной концентрацией NO 3 -- и Н+-ионов.
Скорость растворения образцов может быть определена по убыли массы. Однако такой метод слишком груб и не позволяет раздельно определить переход составляющих компонентов сплава в раствор. Для раздельного определения скорости перехода меди и цинка в раствор устанавливали концентрацию меди в растворе методом йодометрического титрования с крахмалом в качестве индикатора [9], а суммарное содержание меди и цинка - методом комплексонометрического титрования комплексоном III с пиридилазонафтолом в качестве индикатора – 217 –
[10]. Погрешность отдельного аналитического измерения оценивали, выполняя по два параллельных определения содержания меди и цинка в растворе.
Кинетические кривые перехода меди и цинка в азотно-сернокислые растворы
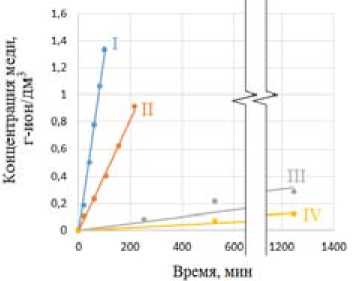
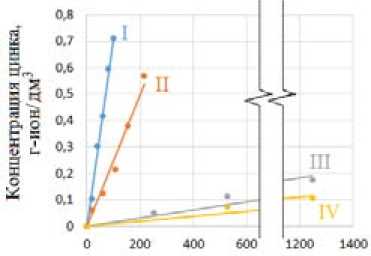
Графики изменения концентрации меди в растворе от времени, отражающие результаты расчетов кумулятивного накопления ионов Cu2+ при растворении медно-цинкового сплава в азотно-сернокислых растворах, представлены на рис. 1 а . Аналогичные данные для кумулятивного накопления ионов Zn2+ приведены на рис. 1 б .
Скорость растворения рассчитывали по начальным участкам кинетических кривых как наклон графика в координатах количество перешедшей меди и/или цинка в раствор – время, кг/м2·с.
Оценки коэффициентов bi могут быть найдены на основании матричных преобразований, эквивалентных применению метода наименьших квадратов:
B = (XT·X)–1·XT·Y, (6)
где Х – матрица условий эксперимента; Y – матрица результатов опытов; B – матрица неизвестных коэффициентов.
Подстановка в уравнение (6) матрицы условий проведения экспериментов
+ 1
+ 1
+ 1
+ 1
+ 1
+ 1
- 1
- 1
+ 1
- 1 + 1 - 1
+ 1
- 1
- 1
+ 1
и результатов расчета скорости перехода меди и цинка в раствор в форме log( ω ), [кг/м2 с]
а
Время, мин
б
Концентрации реагентов, моль/дм3: I – Н+ – 4,0, NO3– – 1,5; Ⅱ – Н+ – 4,0, NO3– – 0,5; Ⅲ – Н+ – 1,0, NO 3 – – 1,5; Ⅳ – Н+ – 1,0, NO 3 – – 0,5
Рис. 1. Кинетические кривые перехода меди (а) и цинка (б) в раствор при окислении медно-цинкового сплава в азотно-сернокислых растворах
Fig. 1. Kinetic curves of transition of copper (a) and zinc (б) into solution during oxidation of copper-zinc alloy in nitrogen-sulfuric acid solutions
Cu
|
- 4,18 |
- 4,30 |
|
|
- 4,79 |
- 5,09 |
|
|
Y = |
||
|
- 5,42 |
, Zn |
- 5,76 |
|
- 5,91 |
- 6,00 |
позволяет получить соответствующие коэффициенты уравнения регрессии.
B =
b 0 b 1 b 2 b 1 2
Для скорости перехода меди и цинка в раствор имеем следующие коэффициенты:
- 5,08
- 5,28
B
Cu
0, 59
0, 27
B„ =
Zn
0, 60
0,26
.
0,03
0,07
Анализ полученных коэффициентов позволяет констатировать, что переход меди и цинка в раствор происходит синхронно. Наибольшее влияние на скорость перехода меди в раствор оказывает не концентрация окислителя (NO 3 -ионов), а кислотность (концентрация Н+-ионов) среды. Фактор совместного влияния концентрации окислителя и Н + -ионов практического значения не имеет, что подтверждается меньшим значением коэффициента двойного взаимодействия b12 по сравнению с коэффициентами b 1 и b2.
Уравнения, связывающие скорость перехода меди и/или цинка в азотно-сернокислые растворы с выбранными факторами, можно представить в виде, удобном для расчета скорости растворения медно-цинкового сплава, содержащего 60 % меди и 40 % цинка:
+
17 \ КГ С АО А СП lOg(H ) - 0,3
logf^Cu), = - 5,08 + 0,59--—---- м • с0,3
log(NO - ) + 0,15 log(H + ) - 0,3 log(NO - ) + 0,15
+0,2 7 + 0,03
0,15 0,30,15
. , . кг , А log(H+) - 0,3
logKn),--- = - 5,28 + 0,60--77---- м • с0,3
log(NO - ) + 0,15 n log(H + ) - 0,3 log(NO - ) + 0,15
+ 0,26 + 0,0 7
0,15 0,30,15
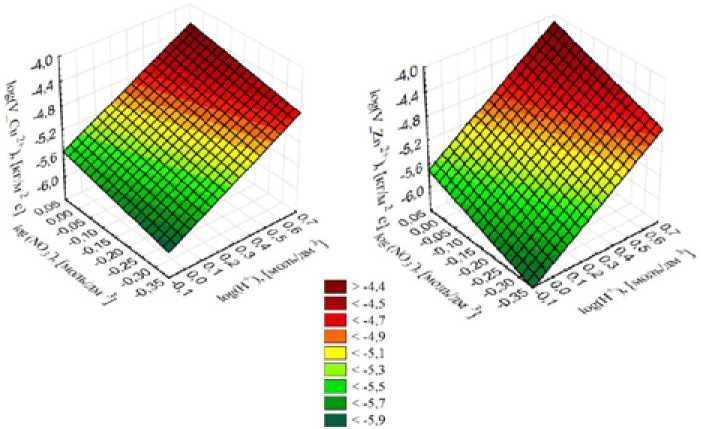
Анализ данных коэффициентов показывает, что с увеличением как кислотности, так и концентрации нитрат-ионов в растворе скорость растворения металлов увеличивается.
Данный вывод удобно продемонстрировать, представив полиномиальную зависимость в виде объемной диаграммы (рис. 2).
Выводы
Исследована скорость перехода меди и цинка из медно-цинковой пластины, моделирующей неблагородную основу электронного лома, содержащего благородные металлы, в азотносернокислых растворах. Эксперименты проведены на основании выбранного полного факторного плана для двух факторов на двух уровнях с двумя параллельными опытами в центре плана.
а
б
Рис. 2. Скорость перехода меди (а) и цинка (б) в раствор при окислении медно-цинковой пластины в азотно-сернокислых средах в зависимости от концентрации NO 3 –- и H+-ионов
Fig. 2. The rate of transition of copper (a) and zinc (б) into solution during oxidation of copper-zinc plate in nitrogen-sulfuric acid media depending on the concentration of NO 3 – and H+ ions
Получена математическая модель, позволяющая рассчитать скорость перехода меди и цинка в азотно-сернокислые растворы при варьировании концентрации H+-ионов от 1 до 4 моль/дм3 и NO3–-ионов от 0,5 до 1,0 моль/дм3.
Выявлено, что при совместном варьировании концентрации H+-ионов от 1 до 4 моль/дм3 и NO3--ионов от 0,5 до 1,0 моль/дм3 скорость перехода меди в раствор составляет (1 ^ 65) - 10— 6 , а цинка - (0,8 ^ 42) - 10-6кг/м2 с.
Показано, что математические модели позволяют правильно подобрать оборудование и осуществить выбор условий для протекания с необходимой скоростью химических процессов, имеющих место в металлургической практике.
Список литературы Кинетика растворения медно-цинкового сплава в азотно-сернокислых растворах
- Колмакова А.А. Физико-химические закономерности процессов вскрытия электронного лома, содержащего благородные металлы, смесью серной и азотной кислот: автореф. дис. … канд. техн. наук. Красноярск, 2004, 20 с.
- Masakatsu Hasegawa Ryo Ueyama Yoshiaki Kashiwaya Tetsuji Hirato Recovery of Zinc from Used Alkali-Manganese Dry Cells, Journal of Sustainable Metallurgy June 2015, 1(2), 144-150.
- Лолейт С.И. Разработка экологически чистых технологий комплексного извлечения благородных и цветных металлов из электронного лома: Дис. …д-ра техн. наук. Москва, 2009, 234 с.
- Pincha Torkittikul, Thanongsak Nochaiya, Watcharapong Wongkeo, Arnon Chaipanich Utilization of coal bottom ash to improve thermal insulation of construction material, Journal of material cycles and waste management, 2017, 19(1), 305-317.
- Krishna Murari, Rafat Siddique, K.K. Jain Use of waste copper slag, a sustainable material, Journal of Material Cycles and Waste Management, 2015, 17(1), 13-26.
- Christoph Nobel, Uwe Hofmann, Fritz Klocke, Drazen Veselovac Experimental investigation of chip formation, flow, and breakage in free orthogonal cutting of copper-zinc alloys, The International Journal of Advanced Manufacturing Technology, 2016, 84(5), 1127-1140.
- Электротехника: необходимость переработки электронного лома . -Режим доступа: http://vtorothodi.ru/pererabotka/pererabotka-elektronnogo-loma
- Ходасевич Г.Б. Планирование эксперимента : Режим доступа: http://pds.sut.ru/electronic_manuals/pe
- Подчайнова В.Н., Симонова Л.Н. Медь. М.: Наука, 1990. 279 с.
- Живописцев В.П., Селезнева Е.А. Аналитическая химия цинка. М.: Наука, 2007. 305 c.


