Кинетика твердофазного синтеза феррита висмута со структурой силленита
Автор: Ендржеевская-шурыгина В.Ю., Жереб В.П., Бабицкий Н.А.
Журнал: Журнал Сибирского федерального университета. Серия: Техника и технологии @technologies-sfu
Статья в выпуске: 6 т.5, 2012 года.
Бесплатный доступ
В статье исследовано твердофазное взаимодействие смеси оксида висмута и оксида железа (III) состава 25 : 1в изотермических условиях в интервале температуры (923-1043) К. С помощью дифференциально-термического, рентгенофазного анализов и растровой электронной микроскопии изучена кинетика образования феррита висмута с кристаллической структурой силленита при различных значениях парциального давления кислорода.
Твердофазное взаимодействие, силленит, феррит висмута, оксид висмута (iii), оксид железа (iii)
Короткий адрес: https://sciup.org/146114696
IDR: 146114696 | УДК: 669.046:542.943.4
Текст научной статьи Кинетика твердофазного синтеза феррита висмута со структурой силленита
Сложные кислородные соединения висмута с кристаллической структурой силленита (КСС), относящейся к кубической сингонии, нецентросимметрическому классу с пространственной группой I23, обладают разнообразными и значительными по величине физическими эффектами – пьезоэлектрическим, электро- и магнитооптическим, что в сочетании с фотопроводимостью и фоторефракцией [1] позволяет использовать их в различных акусто- и оптоэлектронных устройствах обнаружения и обработки информации и управления лазерным излучением, например, для совершенствования лазерных навигационных систем [2].
Преимуществом феррита висмута с КСС по сравнению с изоструктурными фазами другого состава является возможность управления перечисленными выше свойствами с помощью магнитного поля. Однако, инконгруэнтный характер плавления этого феррита висмута [3] усложняет получение его монокристаллов и существенно ограничивает их применение, расширяя возможности использования в виде керамики. Поэтому актуальной задачей является исследование твердофазного синтеза феррита висмута с КСС как перспективного пьезоэлектрического материала. Особенности взаимодействия исходных оксидов в системе Bi2O3-Fe2O3 имеют важное значение также в связи с огромным интересом к другому соединению этой си
стемы – BiFeO3 – одному из самых перспективных материалов для спинтроники [4], высокотемпературный твердофазный синтез которого осложнен появлением промежуточной фазы с КСС [5].
Кинетические закономерности твердофазного синтеза оксидных соединений во многом определяются природой исходных компонентов. Особенно это характерно для оксида висмута (III), составляющего основную массу исходных смесей при твердофазном синтезе феррита висмута с КСС. Как показал высокотемпературный рентгенофазовый анализ (ВРФА), при нагревании оксида висмута (III) выше 1003 К происходит полиморфное превращение α-Bi 2 O 3 в δ-Bi2O3. На последовательность фазовых превращений при охлаждении δ-Bi2O3 оказывают влияние температура, при которой она находилась, скорость охлаждения, природа и концентрация примесей. При охлаждении от 1023 К со скоростью 0,3 – 1,0 К/с реализуется переход по схеме δ-Bi 2 O 3 → α-Bi 2 O 3 . Если температура понижается от 1073 К, то появляется промежуточная ме-тастабильная модификация β-Bi2O3 и превращение происходит по стандартному пути: δ-Bi2O3 → β-Bi 2 O 3 → α-Bi 2 O 3 . При охлаждении не полностью прореагировавшей смеси состава соединения с КСС 25Bi2O3 : Fe2O3, наряду с вышеприведенными схемами полиморфных превращений Bi 2 O 3 , зафиксированы переходы δ-Bi 2 O 3 → γ-Bi 2 O 3 → α-Bi 2 O 3 , δ-Bi 2 O 3 → γ-Bi 2 O 3 или δ-Bi 2 O 3 → γ-Bi2O3+ α-Bi2O3. Как показано в [6], определенную роль при этом играет скорость охлаждения: при скоростях 0,5 – 8,5 К/с в смесях наблюдается γ-Bi 2 O 3 , как переходящая в α-Bi 2 O 3 , так и сохраняющаяся до комнатной температуре (табл. 1).
Одновременное присутствие в реакционной смеси метастабильной модификации γ-Bi 2 O 3 и изоструктурного ей феррита висмута Bi25FeO39 связано с влиянием образовавшейся фазы с КСС на последовательность полиморфных превращений Bi 2 O 3 в согласии с принципом ориентационного и размерного соответствия [7]. В пользу этого предположения говорит и тот факт, что после десятисуточного отжига прессованных образцов состава 25Bi 2 O 3 : Fe 2 O 3 рентгенофазовый анализ (РФА) показал наличие в них Bi25FeO39, промежуточной фазы BiFeO3 и γ – Bi2O3. В [8] (цитируется по [9, c. 210]), развиты представления о взаимодействии силовых полей поверхности исходного вещества и продукта топохимического превращения, где показано, что ориентированная кристаллизация возможна, если предельная разность параметров сопрягающихся решеток не превышает 18 %. В случае для Bi25FeO39 и γ – Bi2O3 эта величина колеблется от 0,5 до 0,8 %.
Кинетику твердофазного синтеза феррита висмута с КСС, скорость его образования при взаимодействии оксидов висмута и железа в стехиометрической смеси 25Bi2O3 : Fe2 O3 исследовали при температурах 923-1043 К с изотермической выдержкой в течение 300-25,92 ∙ 104 с. Согласно электронно-микроскопическому анализу в стехиометрической смеси преобладают частицы оксидов висмута и железа размером 1,6 ∙ 10-4 м. По мере возрастания температуры твердофазного синтеза или времени отжига при постоянной температуре, как показал количественный РФА, прослеживается тенденция увеличения содержания Bi 25 FeO 39 и уменьшения свободного оксида висмута. Это подтверждается и дифференциальным термическим анализом (ДТА). На термограммах четко фиксируется уменьшение теплового эффекта полиморфного превращения Bi2О3, Т=1003 К (рис. 1).
В смеси 25Bi 2 О 3 : Fe 2 O 3 , как показал ДТА, происходит образование не только Bi 25 FeO 39 , но и BiFeO3 (экзотермический эффект реакции при I0I9 ± 3 К, рис. 1). Одна из причин искажения формы кривых α → δ перехода Bi 2 О 3 и указанного характера плавления смеси обусловлена при- – 697 –
Таблица 1. Фазовый состав стехиометрической смеси 25Bi2O3: Fe2O3 в процессе нагревания и охлаждения по данным высокотемпературного рентгенофазового анализа
|
Условия отжига |
Фазовый состав стехиометрической смеси во время отжига |
Фазовый переход |
ΔT, К |
||||||
|
Синтез смеси |
Охлаждение смеси |
С |
α |
δ |
γ |
||||
|
Т,К |
τ∙10-3,с |
V,К/с |
T, К |
||||||
|
933 |
1,2 |
+ |
+ |
н.о. |
н.о. |
- |
- |
||
|
973 |
2,16 |
+ |
+ |
н.о. |
н.о. |
- |
— - |
||
|
1,7 |
293 |
+ |
+ |
н.о. |
н.о. |
- |
- |
||
|
1043 |
9,6 |
+ |
н.о. |
+ |
н.о. |
δ → α |
92 |
||
|
0,3 |
0,3 |
913 |
+ |
н.о. |
+ |
н.о. |
|||
|
0,3 |
0,2 |
911 |
+ |
н.о. |
+ |
н.о. |
|||
|
0,6 |
0,2 |
911 |
+ |
н.о. |
+ |
н.о. |
|||
|
1,5 |
0,2 |
911 |
+ |
+ |
н.о. |
н.о. |
|||
|
1,7 |
293 |
+ |
+ |
н.о. |
н.о. |
||||
|
1043 |
9,0 |
+ |
н.о. |
+ |
н.о. |
δ → α+ γ |
|||
|
3,3 |
293 |
+ |
+ |
н.о. |
+ |
||||
Примечание: С - Bi25FeO39, а - a-Bi2O3, 5 - 5-Bi2O3, у - Y-Bi2O3
сутствием в ней BiFeО3, у которого, согласно данным [10], при 643, 1013, 1098 К наблюдаются фазовые превращения.
В образцах уже при температуре отжига 923 К появляется феррит висмута с КСС, содержание которого при данной температуре достигает 40 %. Кроме того, везде зафиксирован свободный оксид висмута, находящийся только в а-модификации, если отжиг проведен ниже температуры полиморфного превращения оксида висмута (1003 К), и в α-, γ форма
По результатам количественного РФА построены кинетические кривые Св , д5реОзд = f ( т отж ), показывающие, что в первый момент времени скорость взаимодействия оксидов максимальна, а затем она резко снижается и с увеличением времени синтеза изменяется мало (рис. 2).
Характер кривых для Bi2O3 косвенно подтверждает замедленность процесса образования Bi25FeO39: концентрация оксида висмута за один час отжига, например при 983 К, уменьшилась на 62,6 %, а за последующие двое суток всего на 7 %. Полученные экспериментальные данные проанализированы с помощью диффузионно-кинетических уравнений Яндера (1), Гинстлинга Броунштейна (2), Дюнвальд Вагнера (3):
Fя(а) = (1 - V1 — а)2(1)
FГБ(a) = 1-|• а-(1- а)2/3 = КГБ •т(2)
Рцв(а) = ln п2 (1_а) = КДВ • Т .
Линейность зависимостей F (α) = f (τ) предполагает диффузионный характер процесса (рис. 3).
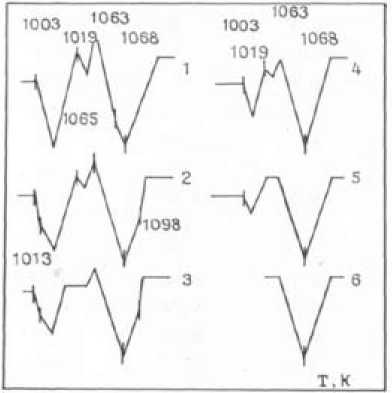
Рис. 1. Схемы дифференциальных кривых нагрева образцов 25Bi 2 O 3 : Fe 2 O 3 ; 1 – неотожженная смесь; 2 – 923 К, 600 с; 3 – 923 К, 12,96 ⋅ 104c; 4 – 1043 К, 300 с; 5 – 1043 К, 17,28∙104 с; 6 – 1043 К, 90,0∙104 с
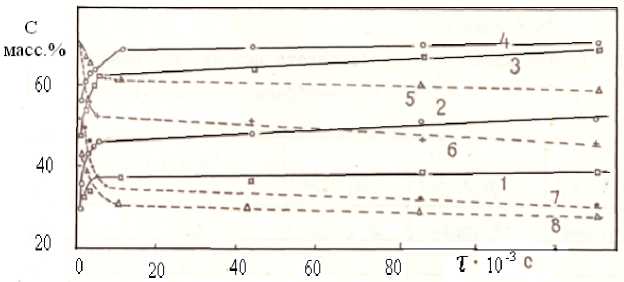
Рис. 2. Кинетика синтеза стехиометрической смеси 25 Bi2 O3 : Fe2O3; 1-4 – Bi25FeO39; 5-8 – α –Bi 2 O 3; T – 1,5 – 923; 2,6 – 953; 3,7 – 1013; 4,8 – 1043 К
Если сравнить данные количественного РФА по выходу Bi25FeO39 при 953 (47 %) и 1013 (63 %), 1043 (64 %) К за 1 ч, то разница составляет порядка 16 %, что связано, надо полагать, в первую очередь с полиморфным превращением оксида висмута (1003 К). При твердофазном синтезе Bi 25 FeO 39 , как и при синтезе Bi 12 ЭO 20 (Э – Ti, Si, Ge) [11, 12], зафиксировано влияние полиморфного перехода Bi 2 O 3 на энергию активации реакции его образования: после кристаллографического превращения оксида висмута, повышающего его реакционную способность, энергия активации с 200 кДж/моль понижается до 44 кДж/моль, т.е. уменьшается в 4 раза, а энергия активации диффузии с 250 до 40 кДж/моль (рис. 3). Это явление (эффект Хедвалла) объясняется повышенной реакционной способностью твердых тел за счет кристаллографических превращений [9]. При наличии вышеприведенных результатов трудно согласиться с авторами [13, 14], что оптимальной температурой синтеза ферритов является ~ 720 °С.
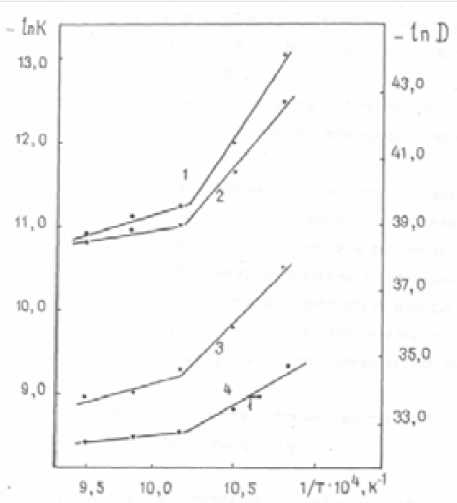
Рис. 3. Температурная зависимость условных констант скорости реакции образования Bi 25 FeO 39 (1-3) и коэффициента диффузии (4): 1 – F ГБ (α); 2 – F Я (α); 3 – F ДВ (α)
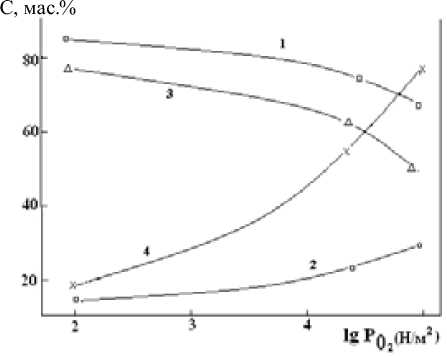
Рис. 4. Влияние парциального давления кислорода на образование феррита висмута с КСС в стехиометрической смеси 25 Bi 2 O 3 : Fe 2 O 3 : 1, 3 – Bi 25 FeO 39 , 2, 4 – α- Bi 2 O 3 ; 1, 2 – 1063 К, 7,3∙104 с; 3,4 – 1063 К, 3,6∙104 с
Повысить выход феррита висмута с КСС в 1,7 раза, а содержание BiFeO 3 понизить удалось путем использования для его синтеза активированного оксида висмута. Активирование Bi 2 O 3 осуществлено его отжигом в течение 4 часов при давлении воздуха , равном 3.104 Па и температуре 873 К [6]. Отжиг смеси 25 Bi 2 O 3 :Fe 2 O 3 при различных парциальных давлениях кислорода привел к аналогичному результату. На рис. 4 показано влияние парциального давления кислорода на выход феррита висмута с КСС.
Учитывая близость ионных радиусов Bi3+ (r = 0,120 нм) и O2- (r = 0,136 нм), можно предположить, что ионы висмута движутся в Fe 2 O 3 , являющемся типичной фазой внедрения [15], по анионным вакансиям. Их концентрация, согласно квазихимической реакции – 700 –
^Fe2 03 = ^Fe3+ + 4e + 02, уменьшается с увеличением парциального давления кисло рода. В данных условиях максимальный выход Bi25FeO39 достигается при давлении кислорода, равном 102 Па.
Заключение
Исследование кинетики твердофазного синтеза феррита висмута с КСС позволило установить следующее: процесс синтеза подчиняется параболическому закону кинетических уравнений, что указывает на его диффузионный характер; существенное влияние на кинетику синтеза Bi 25 FeO 39 оказывают дефекты по кислороду Fe 2 O 3 . Ионы висмута в оксиде железа перемещаются по анионным вакансиям, а кислород – по межкристаллитному пространству. Интенсификация твердофазного синтеза феррита висмута с КСС возможна при отжиге стехиометрической смеси не ниже температуры полиморфного превращения оксида висмута α – Bi2O3 → δ – Bi2O3 и парциальном давлении кислорода 102 Па.


