Кинетика выщелачивания молибдата кальция раствором карбоната натрия
Автор: Алешин Дмитрий Сергеевич, Крашенинин Алексей Геннадьевич, Гаврилов Алексей Сергеевич, Танутров Игорь Николаевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Металлургия чёрных, цветных и редких металлов
Статья в выпуске: 4 т.21, 2021 года.
Бесплатный доступ
Молибдат кальция CaMoO4 (повеллит) является главным продуктом при окислительном обжиге сульфидных молибденовых концентратов и молибденового сырья с кальцийсодержащими добавками. Далее огарок перерабатывают гидрометаллургическим способом. Одним из основных способов извлечения молибдена из огарка является выщелачивание раствором карбоната натрия. С целью определения оптимальных параметров извлечения Мо необходимо исследовать кинетику выщелачивания CaMoO4 водным раствором Na2CO3, определить зависимости скорости процесса извлечения молибдена в раствор от основных технологических параметров: температуры, концентрации реагентов, установить лимитирующую стадию процесса. В качестве исходных материалов применяли СаМоО4 и Na2CO3 квалификации ХЧ. Растворение СаМоО4 в Na2CO3 изучали в пределах концентрации соды СNa2CO3 = 100, 150, 200, 250, 300 г/дм3, в температурном интервале от 20 до 90 °С, отношение Т : Ж = 1 : 2, 1 : 4, 1 : 6, 1 : 8, 1 : 10, продолжительностью от 30 до 300 мин. Изучена зависимость скорости выщелачивания CaMoO4 от интенсивности перемешивания. Определены кажущийся порядок реакции в интервале концентрации Na2CO3 = 100…250 г/дм3 и кажущаяся энергия активации в интервале температур от 60 до 90 °С. Установлено, что оптимальными параметрами выщелачивания СаМоО4 является: Т : Ж = 1 : 6, Т = 90 °С, СNa2CO3 = 200…250 г/дм3, интенсивности перемешивания более 500 мин-1, при данных параметрах процесс протекает в кинетическом режиме. Показано, что при концентрации Na2CO3 более 250 г/дм3 процесс протекает с образованием карбонатов натрия-кальция, в этом случае лимитирующей стадией процесса является внутренняя диффузия. Также формирование карбонатов натрия-кальция приводит к увеличению расходу Na2CO3.
Молибден, кинетика выщелачивания, молибдат кальция, карбонат натрия, энергия активации
Короткий адрес: https://sciup.org/147236539
IDR: 147236539 | УДК: 669.283 | DOI: 10.14529/met210402
Текст научной статьи Кинетика выщелачивания молибдата кальция раствором карбоната натрия
Молибдат кальция CaMoO4 (повеллит) является одним из основных молибденсодержащих минералов. Также он является важным промежуточным звеном в некоторых гидрометаллургических и пирометаллургических технологиях переработки молибденовых концентратов. Авторами работ [1–6] были предложены технологии окислительного обжига молибденового сырья в присутствии соединений кальция в интервале температур 500–700 °С с образованием молибдата кальция, что позволяет значительно снизить выброс сернистого ангидрида в атмосферу при окислительном обжиге сульфидных молибденовых концентратов.
В Институте металлургии УрО РАН продолжаются исследования по поиску экологи- чески чистой технологии производства молибдена и рения из сульфидных концентратов путем обжига концентратов с кальцийсодержащей добавкой и последующей гидрометаллургической переработкой огарка [7, 8].
Целью работы является исследование кинетики выщелачивания CaMoO 4 водным раствором Na2CO3, определение зависимости скорости процесса извлечения молибдена в раствор от основных технологических параметров: температуры, концентрации реагентов, лимитирующей стадии процесса.
Оборудование и методы исследования
В рамках работы использовали синтезированный СаМоО4 и Na2CO3 квалификации ХЧ. Выщелачивание молибдата кальция в со- довом растворе проводили в термобане, точность поддержания температуры ±0,1 °С, в комбинации с перемешивающим устройством ПЭ-8100. Для фильтрации пульпы использовали вакуумный нутч-фильтр. Процесс проходил следующим образом: в сосуд объемом 400 мл с раствором Na2CO3, нагретым до заданной температуры, при постоянном перемешивании вводили навеску СаМоО4. Отбор проб для анализа раствора проводили каждые 30 мин. Полученный после выщелачивания кек сушили в сушильном шкафу (Nabertherm P330) при температуре 150–200 °С. Степень перехода молибдена из молибдата кальция в раствор определяли по сопоставлению результатов химического анализа раствора и кека. Анализ растворов проводили на атомно-абсорбционном спектрофотометре. Кек подвергался рентгенофазовому анализу.
Экспериментальная часть
Растворение СаМоО 4 в Na 2 CO 3 изучали в пределах концентрации соды С Na CO = 100, 150, 200, 250, 300 г/дм3 в температурном интервале от 20 до 90 °С, отношение Т : Ж = 1 : 2, 1 :4, 1 : 6, 1 : 8, 1 : 10, продолжительность процесса составляла от 30 до 300 мин.
Взаимодействие СаМоО 4 с Na 2 CO 3 протекает согласно уравнению
CaMoO 4(т) + Na 2 CO 3(р) →
→ NaMoO4(р) + CaCO3(т). (1)
Известно, что кинетика взаимодействия такого типа состоит из нескольких этапов: перенос реагента из объема раствора к поверхности твердой фазы через пограничный слой жидкости; диффузия реагента через слой твердого продукта (слой СаСО3 на частице СаМоО4); химическое взаимодействие на поверхности СаМоО4 и перенос продукта ( МоО24- ) в объем раствора.
Результаты изучения степени выщелачивания молибдена из молибдата кальция при Т = 90°С, С Na CO = 200 г/дм3 от продолжительности при различных скоростях вращения мешалки представлены на рис. 1. Обороты импеллера перемешивающего устройства варьировали от 3,3 до 10 с–1. После того как экспериментально установили и построили график зависимости степени выщелачивания молибдена от продолжительности при различных скоростях вращения мешалки, определяли начальные скорости выщелачивания и строили зависимости d α/ d τ от корня квадратного от оборотов мешалки ω [9].
Начальный прямолинейный участок кривой при оборотах от 3,3 до 5 с–1 соответствует внешнедиффузионному режиму, затем идет область переходного режима, а при увеличении числа оборотов с 8,3–1 (500 мин–1) начальная скорость выщелачивания становится постоянной, процесс переходит в кинетическую область. Из чего следует, что, оптимальным параметром скорости вращения перемешивающего устройства предпочтительно выбрать 8,3 с–1 (500 мин–1), так как при данном значении процесс проходит в устойчивый кинетический режим. Дальнейшие исследования проводились при данном параметре.
Влияние отношения твердого к жидкому при выщелачивании молибдата кальция в водном растворе кальцинированной соды проводили при концентрации С Na CO = 150 г/дм3,
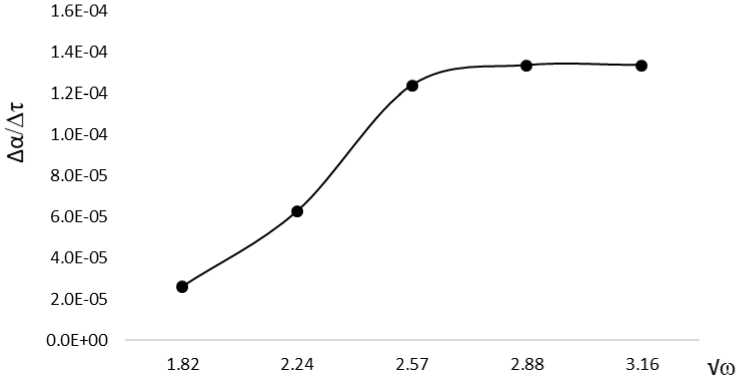
Рис. 1. Зависимость скорости выщелачивания от корня квадратного оборотов мешалки
Металлургия чёрных, цветных и редких металлов
Т = 90 °С, с постоянным перемешиванием n = 8,3 с–1. Отношение Т : Ж варьировали от 1 : 2 до 1 : 10. Результаты приведены на рис. 2.
В результате эксперимента установили, что соотношения Т : Ж = 1 : 4 не достаточно, максимальное извлечение молибдена в раствор наблюдалось при соотношение Т : Ж = 1 : 6, при данном соотношение в раствор перешло 79,9 % Мо. Также в рамках эксперимента было установлено, что оптимальной продолжительностью выщелачивания является 120–150 мин. Дальнейшее увеличение продолжительности не приводит к значительному увеличению перехода молибдена в раствор, а даже наоборот после 150-й минуты наблюдается снижение концентрации молибдена в растворе, это связано с образованием соединения Na2MoO4·2H2O, которое переходит в осадок, аналогичный процесс наблюдали авторы работы [10, 11], также при увеличении соотношения Т : Ж свыше 1 : 6 возможно интенсивное выделение представленной фазы.
Исследования по влиянию исходной концентрации Na 2 CO 3 на степень выщелачивания СaMoO 4 при следующих параметрах: Т = 90 °С, Т : Ж = 1: 6, τ = 120 мин, С Na CO = 100, 150, 200, 250, 300 г/дм3. Результаты представлены на рис. 3.
С повышением концентрации Na 2 CO 3 в растворе от 100 до 200 г/дм3 степень перехода молибдена в раствор увеличивается, но дальнейший рост концентрации соды в растворе
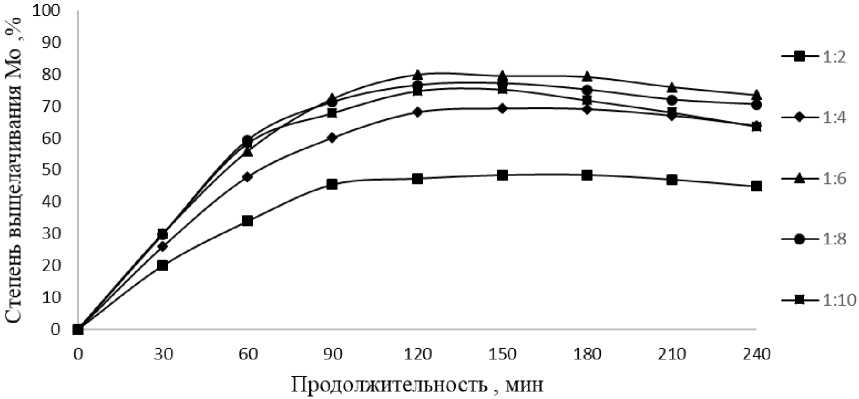
Рис. 2. Зависимость степени выщелачивания молибдена от соотношения Т : Ж
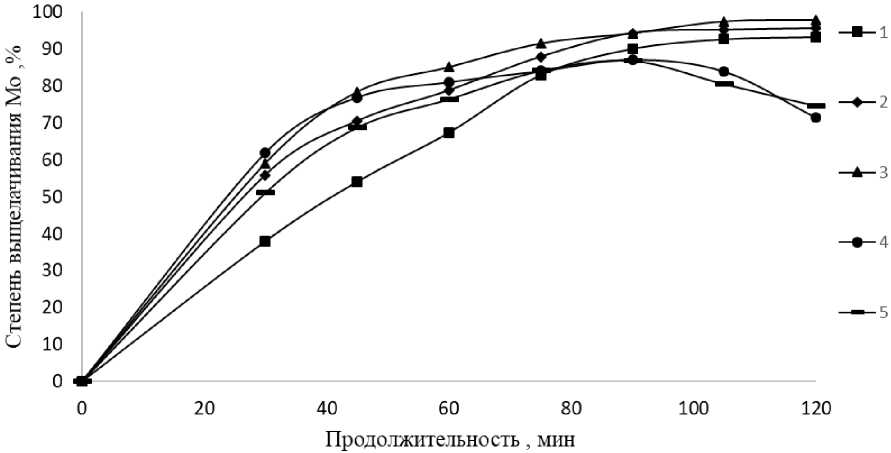
Рис. 3. Зависимость извлечения молибдена в раствор от продолжительности выщелачивания при СNa CO , г/дм3: 1 – 100, 2 – 150, 3 – 200, 4 – 250, 5 – 300
с 250 до 300 г/дм3 не приводит к изменению интенсификации процесса. Наилучшие показатели степени перехода молибдена в раствор в количестве 97,9 отн. % достигнуты при концентрации Na 2 CO 3 в растворе 200 г/дм3. В рамках этого эксперимента установлено, что при увеличение концентрации соды в выщелачивающем растворе с 250 до 300 г/дм3 снижается степень растворения молибдена. Это возможно из-за формирования двойных карбонатов натрия-кальция в виде безводной соли Na 2 Ca(CO 3 ) 2 или формирования кристаллогидратов с переменным числом молекул Na 2 Ca(CO 3 ) 2 ·2H 2 O [12, 13]. Результаты рентгенофазового анализа кека представлены на рис. 4.
Согласно полученным данным, в осадке содержится CaMoO4, две модификации СаСО3 – ватерит и кальцит, также присутствует безводная соль Na2Ca(CO3)2. Это позволяет сделать вывод, что формирование кальцита происходит через образование его менее устойчивой модификации ватерита. Возможно, безводная соль получается через взаимодействие ватерита с карбонатом натрия. Полученные результаты не противоречат литературным данным [14].
На рис. 5 представлены данные в координатах lg v – lg C , где скорость реакции v рассчитана с учетом линейности участков как отношение Δα/Δτ (α – степень растворения, доли единицы; τ – время, мин).
Кажущийся порядок процесса по реагенту n , рассчитанный как угловой коэффициент прямой в координатах lg v – lg C , составляет 0,49 ± 0,02, это означает, что в интервале кон-
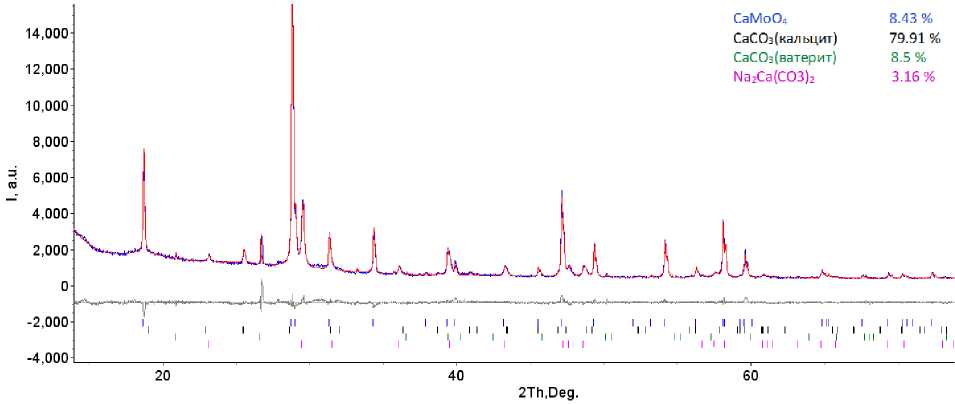
Рис. 4. Рентгенограмма остатка после выщелачивания при С = 300 г/дм3,
Т = 90 °С, Т : Ж = 1 : 6, т = 120 мин на дифрактометре D8 ADVANCE
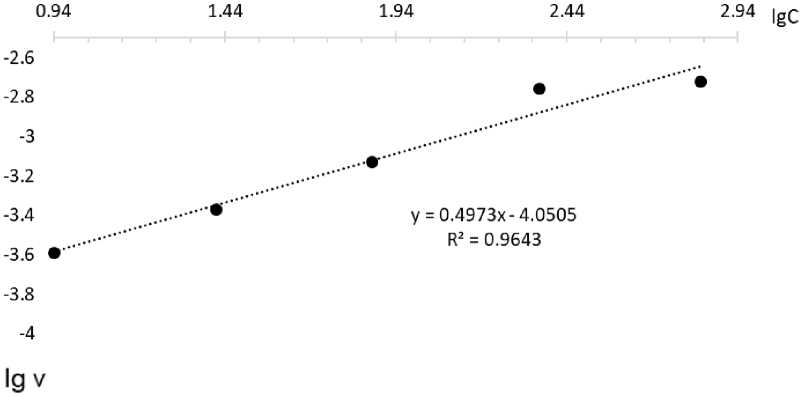
Рис. 5. Зависимость скорости выщелачивания СаМоО 4 от исходной концентрации Na 2 CO 3 , Т = 90 °С
Металлургия чёрных, цветных и редких металлов центраций 100–250 г/дм3 процесс протекает в кинетической области. Константа скорости в этом концентрационном интервале Na2CO3 при температуре 90 °С равна 4,1·10–2 моль/с.
Полученные результаты позволяют предположить, что в системе с ростом концентрации соды выше 250 г/дм3 растворение СаМоО4 сопровождается взаимодействием получаемого СаСО 3 (ватерита) с содой по уравнению
CaCO 3 + 2Na + + CO 2- = Na 2 Ca(CO 3 ) 2 (2) с образованием плотной оболочки двойных карбонатов. В этом случае лимитирующей стадией процесса будет внутренняя диффузия молибдат-иона от фронта реакции в раствор через твердую оболочку из СаСО 3 и двойной соли [15].
Влияние температуры на скорость процесса изучали в интервале температур 60–90 °С, при концентрации Na 2 CO 3 = 200 г/дм3, Т : Ж = = 1 : 6, τ = 120 мин. На основании данных, полученных авторами работы [10], исследования при температуре менее 60 °С проводить не целесообразно. Установлено, что скорость растворения молибдата кальция заметно увеличивается с ростом температуры, наибольшие значения её достигается при температуре 90 °С (рис. 6).
В интервалах температур от 80 до 90 °С при достижение степени выщелачивания молибдата кальция более 50 % скорость уменьшается, что указывает на рост внутридиф-фузионного сопротивления. Возможно, это связано с тем, что при температурах более
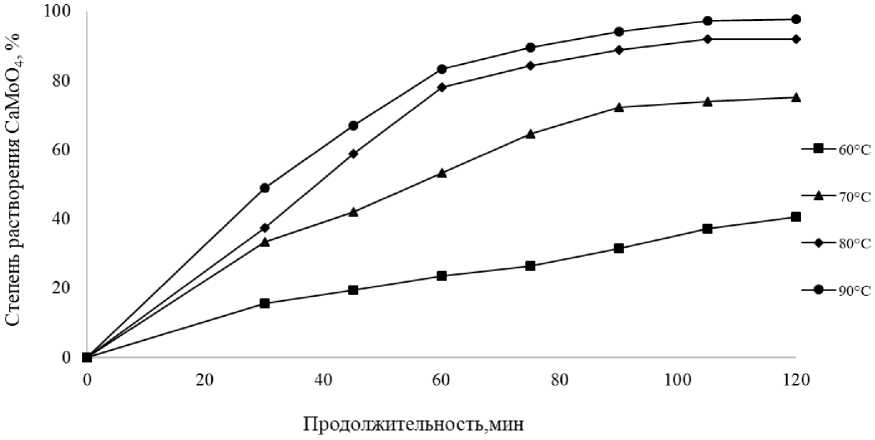
Рис. 6. Зависимость степени выщелачивания СаМоО 4 от температуры
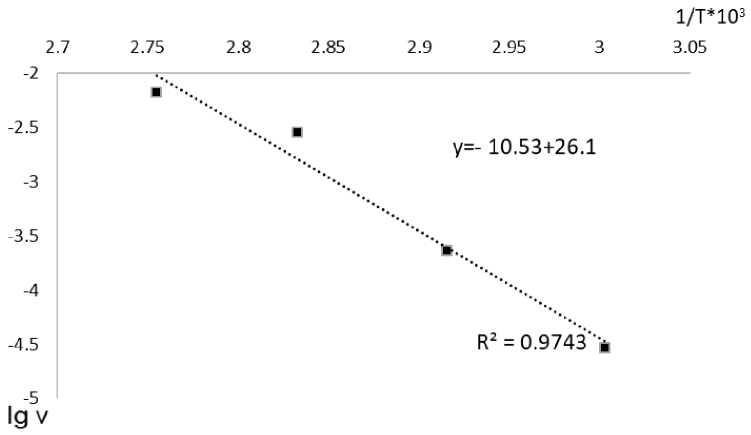
Рис. 7. Определение энергии активации по зависимости скорости реакции от температуры
80 °С в состав твердой оболочки продуктов входит двойной карбонат натрия-кальция большей плотности, что объясняет падение скорости выщелачивания молибдена при достижении степени выщелачивания более 50 %.
Энергию активации определяли методом начальных скоростей. Этот метод основан на определение начальных скоростей реакции при разных температурах, но с фиксированными начальными концентрациями реагентов.
На рис. 7 данные представлены в координатах lg v – 1/ Т ·103, где скорость реакции v рассчитана с учетом линейности участков как отношение Δα/Δτ (α – степень растворения, доли единицы; τ – время, мин). Кажущаяся энергия активации, рассчитанная как угловой коэффициент прямой в выбранных координатах, составляет 87,5 ± 2 кДж/моль.
Вывод
Изучена кинетика выщелачивания молибдата кальция в растворах карбоната натрия. Установлено, что скорость растворения
СаМоО 4 зависит от интенсивности перемешивания, оптимальная скорость мешалки более 400 мин–1. Скорость выщелачивания СаМоО4 в водном растворе карбоната натрия при концентрации 100–250 г/дм3 зависит от концентрации реагента. Кажущейся порядок по реагенту составляет 0,49 ± 0,02, величина кажущейся энергии активации равна 87,5 ± 2 кДж/моль. При интенсивном перемешивание (более 400 мин–1) и постоянной температуре 90 °С в указанном интервале концентраций соды процесс выщелачивания протекает в кинетическом режиме. Увеличение концентрации Na2CO3 приводит к образованию двойных карбонатов и к дополнительному расходу соды. Лимитирующей стадией процесса может являться внутренняя диффузия молибдат-иона через плотною оболочку продуктов.
Работа выполнена по государственному заданию ИМЕТ УрО РАН в рамках программы фундаментальных исследований государственных академий № госрегистрации: 0396-2019-0005.
Список литературы Кинетика выщелачивания молибдата кальция раствором карбоната натрия
- Зеликман, А.Н. Металлургия тугоплавких редких металлов / А.Н. Зеликман. – М.: Металлургия, 1986. – 440 с.
- Lasheen, T.A. Molybdenum Metallurgy Review: hydrometallurgical routes to recovery of molybdenum from ores and mineral raw materials / T.A. Lasheen, M.E. El-Ahmady, H.B. Hassib // Mineral Processing and Extractive Metallurgy Review. – 2015. – Vol. 36, no. 3. – P. 145–173. DOI: 10.1080/08827508.2013.868347
- Extraction of molybdenum from high-impurity ferromolybdenum by roasting with Na2CO3 and CaO and leaching with water / Lihua Shi, Xue-Wen Wang, Ming-Yu Wang et al. // Hydrometallurgy. – 2011. – Vol. 108, iss. 3-4. – P. 214–219. DOI: 10.1016/j.hydromet.2011.04.009
- A Novel Self-Heated Roasting Technology for Molybdenum Concentrate / Wang Lianyong, Wen-qiang Sun, Zhang Jingfan, Cai Jiuju // Rare Metal Materials and Engineering. – 2015. – Vol. 44 (11). – P. 2618–2622. DOI: 10.1016/S1875-5372(16)60005-X
- Wang, M. A novel technology of molybdenum extraction from low grade Ni-Mo ore / M. Wang, X. Wang, W. Liu // Hydrometallurgy. – 2009. – Vol. 97 (1-2). – P. 126–130. DOI: 10.1016/j.hydromet.2008.12.004
- Обжиг молибденового концентрата с добавкой Са(ОН)2 / Д.С. Алешин, А.Г. Крашенинин, Д.С. Реутов, И.Н. Танутров // Вестник Иркутского государственного технического университета. – 2020. – № 4. – С. 876–885. DOI: 10.21285/1814-3520-2020-4-876-886
- Харин, Е.И. Разработка экологически чистой комплексной технологии переработки молибденового концентрата Южно-Шамейского месторождения / Е.И. Харин, Б.Д. Халезов, Е.А. Зеленин // Известия высших учебных заведений. Горный журнал. – 2015. – № 5. – С. 129–134.
- Поиск экологически чистой технологии переработки молибденовых концентратов / Н.А. Ватолин, Б.Д. Халезов, Е.И. Харин, Е.А. Зеленин // Химическая технология. – 2012. – Т. 13, № 4. – С. 229–232.
- Вольдман, Г.М. Теория гидрометаллургических процессов / Г.М. Вольдман, А.Н. Зеликман. – М.: Интермет Инжиниринг, 2003. – 464 с.
- Рейнгольд, Б.М. О взаимодействии молибдатов кальция меди и железа с раствором карбоната натрия / Б.М. Рейнгольд // Добыча и обработка руд редких, цветных и благородных металлов: сб. тр. Иргиредмета. – 1965. – Вып. 13. – С. 398–406.
- Rodriguez-Blanco, J.D. The kinetics and mechanisms of amorphous calcium carbonate crystallization to calcite, viavaterite / J.D. Rodriguez-Blanco, S. Shaw, L.G. Benning // Nanoscale. – 2011. – No. 3. – P. 265–271. DOI: 10.1039/c0nr00589d
- Киндряков, П.С. Равновесие системы CaMoO4 + Na2CO3 ↔ Na2MoO4 + CaCO3 и некоторых других систем / П.С. Киндряков // Редкие металлы. – 1934. – № 4. – С. 48–51.
- Зеликман, А.Н. Исследование реакций взаимодействия молибдатов кальция, меди и железа / А.Н. Зеликман, Л.В. Беляевская // Журнал прикладной химии. – 1956. – № 1. – С. 11–17.
- Chang, R. Calcium Carbonate Precipitation for CO2 Storage and Utilization: A Review of the Carbonate Crystallization and Polymorphism / R. Chang, S. Kim, S. Lee // Frontiers in Energy Re-search. – 2017. – Vol. 5. – P. 1–12. DOI: 10.3389/fenrg.2017.00017
- Соколова, Ю.В. Исследование кинетики выщелачивания молибдата кальция растворами карбоната натрия / Ю.В. Соколова, Е.В. Богатырева // Цветные металлы. – 2021. – № 1. – С. 40–46. DOI: 10.17580/tms.2021.01.04


