Кишечное пищеварение и биохимия крови у кур-несушек (Gallus gallus L.) при введении в рационы микродобавки хрома
Автор: Фисинин В.И., Вертипрахов В.Г., Грозина А.А., Кислова И.В., Кощеева М.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ультрадисперсные кормовые добавки
Статья в выпуске: 4 т.54, 2019 года.
Бесплатный доступ
Хром относится к биогенным элементам, которые необходимы для нормального развития и функционирования организма. Он регулирует синтез жиров, углеводный обмен и содержание глюкозы в крови. Известно о положительном влиянии добавок хрома при его использовании в кормлении молодняка кур. Данные о влиянии микродобавок хрома на процессы пищеварения в научной литературе малочисленны, а на животных с хронической фистулой кишечника отсутствуют. В настоящей работе на курах-несушках с дуоденальной фистулой впервые показано, что при введении в рацион микродобавки хрома в пищеварительном тракте кур изменяется активность ферментов, которые по-разному реагируют на присутствие тяжелого металла в неодинаковых по ингредиентному составу кормах. При этом также изменяются биохимические показатели крови: содержание амилазы, трипсина, глюкозы, триглицеридов, общего белка, мочевой кислоты, щелочной фосфатазы. Целью работы было изучение влияния микродоз (100 мкг/кг корма) добавки Cr2O3 на пищеварение и биохимию крови у кур-несушек, получающих разные по ингредиентному составу корма...
Куры-несушки, дуоденальное содержимое, активность пищеварительных ферментов, пищеварительные ферменты крови, оксид хрома (iii)
Короткий адрес: https://sciup.org/142222197
IDR: 142222197 | УДК: 636.52/.58:591.1:636.085.12:546.763 | DOI: 10.15389/agrobiology.2019.4.810rus
Текст научной статьи Кишечное пищеварение и биохимия крови у кур-несушек (Gallus gallus L.) при введении в рационы микродобавки хрома
Хром относится к биогенным элементам, которые содержатся в тканях растений и животных и необходимы для нормального развития и функционирования организма. Его важнейшая биологическая роль состоит в регуляции синтеза жиров, углеводного обмена и содержания глюкозы в крови. Хром входит в состав низкомолекулярного органического комплекса — фактора толерантности к глюкозе, обеспечивающего ее нормальное содержание в крови. Он действует как регулятор количества сахара в крови (1, 2), обеспечивая нормальную активность инсулина. Хром вовлечен в регуляцию обмена холестерина (входит в состав трипсина) и служит активатором некоторых ферментов, участвуя в поддержании нормальной работы сердечной мышцы и функционирования кровеносных сосудов. Также хром способствует выведению из организма токсинов, солей тяжелых металлов, радионуклидов (3).
Биологическая активность хрома объясняется главным образом способностью ионов Сr3+ образовывать комплексные соединения. Ионы Cr3+ участвуют в стабилизации структуры нуклеиновых кислот. Хром оказывает действие на процессы кроветворения и обладает способностью активировать трипсин, поскольку входит в состав кристаллического трипсина в виде лабильного соединения, способного отщеплять ионы хрома (4). Хром проникает через кишечную стенку, причем скорость его всасывания возрастает в зависимости от концентрации, при уменьшении размеров частиц и наличии пищеварительных агентов (витамины, фитаты, аминокислоты) (5, 6).
Известно о положительном влиянии хромовых добавок при кормлении молодняка кур (7, 8). Показано (9, 10), что введение в рацион цыплят-бройлеров наночастиц хрома в дозировках 100-200 мкг/кг стимулирует обмен химических элементов. Существует противоположное мнение (1114) о том, что хром может оказывать отрицательное воздействие на организм. Поскольку реакция на определенное количество тяжелого металла разная, при введении в рацион хрома в дозировках 100 мкг/кг происходит как стимуляция, так и торможение некоторых процессов, которые напрямую зависят от его количества в корме.
В настоящей работе на курах-несушках с дуоденальной фистулой впервые показано, что при введении в рацион микродобавки хрома в пищеварительном тракте кур изменяется активность ферментов, которые по-разному реагируют на присутствие тяжелого металла в неодинаковых по ингредиентному составу кормах. При этом также изменяются биохимические показатели крови: содержание амилазы, трипсина, глюкозы, триглицеридов, общего белка, мочевой кислоты, щелочной фосфатазы.
Целью работы было изучение влияния добавки Cr2O3 на пищеварение и биохимию крови кур-несушек при ее вводе в разные по ингредиентному составу корма в микродозах (100 мкг/кг корма).
Методика. Опыты выполняли на 10 курах-несушках (Gallus gallus L.) кросса Hisex White 10-12-месячного возраста (ФНЦ Всероссийский научно-исследовательский и технологический институт птицеводства РАН, 2018 год). Все манипуляции проводили в соответствии с требованиями Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ETS ¹ 123, Страсбург, 1986; . Для получения содержимого 12-перстной кишки птицу оперировали, вживляя канюлю в 12-перстную кишку напротив места впадения панкреатических и желчных протоков. Хирургические операции выполняли с применением седативных и обезболивающих средств. Курицу фиксировали в левом боковом положении в специальном станке.
Разрез делали с правой стороны от последнего ребра по краю бокового отростка грудной кости на 4-5 см. Извлекали 12-перстную кишку, находили место впадения протоков в 12-перстную кишку и напротив него накладывали кисетный шов длиной 0,5-0,6 см. Внутри кисетного шва делали разрез, вставляли канюлю и затягивали кисетный шов. Тщательно обрабатывали участок вокруг вживленной канюли, при необходимости накладывали дополнительный кисетный шов. Кишечник погружали вглубь грудобрюшной полости и зашивали операционную рану узловатыми швами, захватывая все слои. После операции птица в течение 16-18 ч имела доступ к воде, но корм не получала. Через 5-7 сут после хирургической операции, когда здоровье птицы полностью восстанавливалось, приступали к физиологическим опытам.
Физиологический опыт выполняли методом групп-периодов (в каждой группе по 5 гол.), сформированных по принципу аналогов. Опыт включал два периода (по 7-10 сут каждый): в контрольный птица не получала добавку, в опытный к основному рациону добавляли ультрадисперсный препарат Cr 2 O 3 ( ООО «Платина», Россия; метод получения — плазмохимический синтез, d = 91 нм, удельная поверхность — 9 м2/г, Z-потенциал — 93±0,52 мВ, содержание Cr2O3 — 99,8 %) в дозе 100 мкг/кг. В первой серии опытов в состав основного рациона был включен соевый, во второй — подсолнечный жмых. Для получения достоверных результатов на каждой курице проводили не менее трех опытов по пищеварению в каждый учетный период.
Корм готовили в соответствии с зоотехническими нормами. Птица получала комбикорм по 30 г/гол. утром натощак, остальную часть скармливали в течение дня. Через 1 ч после кормления выполняли сбор дуоденального химуса (5 мл), образцы сразу центрифугировали (5 мин при 5000 об/мин) и разводили охлажденным раствором Рингера (1:10).
Активность амилазы в химусе устанавливали по гидролизу крахмала (15) с использованием фотометра КФК-3 («Загорский оптико-механический завод», Россия) при λ = 670 нм и выражали в миллиграммах расщепленного крахмала на 1 мл химуса в течение 1 мин. Липолитическую активность измеряли на полуавтоматическом биохимическом анализаторе BS-3000P с проточной кюветой («SINNOWA Medical Science & Technology Co., Ltd», Китай) с использованием набора реактивов для липазы (ООО «ДИАКОН-ВЕТ», Россия). Активность протеаз определяли по расщеплению казеина по Гаммерстену («EMD Millipore Corp., Billerica», США) с колориметрическим контролем на КФК-3 при λ = 450 нм (16).
Условия содержания и кормления кур в период экспериментов соответствовали нормам ВНИТИП (Руководство по оптимизации рецептов комбикормов для сельскохозяйственной птицы. Сергиев Посад, 2014). Корма были приготовлены на основе пшеницы и ячменя. Корм ¹ 1 содержал 812
19,4 % соевого жмыха, корм ¹ 2 — 21,4 % подсолнечного жмыха. Количество обменной энергии в кормах было одинаковым (265 ккал/100 г). Корм на основе подсолнечного жмыха содержал на 2,11 % больше сырой клетчатки и на 1,07 % — сырого жира.
Для статистической обработки результатов использовали программное обеспечение JMP Trial 14.1.0 («SAS», США) , с помощью которого рассчитывали среднее значение (M), стандартную ошибку среднего (±SEM) и корреляцию (r), определяли достоверность различий по t-критерию Стьюдента. Различия считали статистически значимыми при p < 0,05.
Результаты. Известно, что панкреатические ферменты адаптируются к качеству поступающего в организм корма (18). В наших опытах при замене в рационе кур-несушек соевого жмыха на подсолнечный наблюдалось изменение активности пищеварительных ферментов в дуоденальном химусе (табл. 1).
1. Активность пищеварительных ферментов в дуоденальном содержимом у кур-несушек ( Gallus gallus L.) кросса Hisex White при введении в рацион наночастиц оксида хрома Cr2O3 на фоне различных по ингредиентному составу кормов ( M ±SEM, n = 5)
|
Показатель |
Корм ¹ 1 |
Корм ¹ 2 |
||
|
контроль |
опыт |
контроль |
опыт |
|
|
Амилаза, мг•мл - 1•мин - 1 |
1426±144,8 |
1086±70,0 |
666±147,6 |
1747±187,3* |
|
Липаза, Ед/л |
3231±484,0 |
1762±187,6* |
2669±144,5 |
4573±644,5* |
|
Протеазы, мг•мл - 1•мин - 1 |
66±6,0 |
65±3,6 |
65±4,3 |
80±8,0* |
П р и м е ч а н и е. Описание групп и кормов см. в разделе «Методика».
* Различия с соответствующим контролем статистически значимы при р < 0,05.
Активность амилазы при замене в рационе соевого жмыха на подсолнечный уменьшалась на 53,3 % (р < 0,05). При этом активность липазы и общих протеаз оставалась без изменений. Микродобавка хрома, введенная в рацион на фоне соевого жмыха, уменьшала активность амилазы на 24,0 %, липазы — на 45,5 % (р < 0,05) по сравнению с контролем (корм ¹ 1). Добавка к корму хрома на фоне подсолнечного жмыха (корм ¹ 2) приводила к повышению активность амилазы на 162,3 % (р < 0,05), липазы — на 71,4 % (р < 0,05), протеаз — на 23,1 % (р < 0,05). Следовательно, микродобавка хрома на фоне низкой ферментативной активности в кишечнике выступала стимулятором секреторной функции поджелудочной железы, а на фоне высокой — ингибировала активность липазы.
Адаптация пищеварительных ферментов к ингредиентам корма и микроэлементам отражалась на переваримости питательных веществ (табл. 2).
2. Переваримость питательных веществ у кур-несушек ( Gallus gallus L.) кросса Hisex White при введении в рацион наночастиц оксида хрома Cr2O3 на фоне различных по ингредиентному составу кормов ( M ±SEM, n = 5)
|
Переваримость, % |
Корм ¹ 1 |
Корм ¹ 2 |
||
|
контроль |
опыт |
контроль |
опыт |
|
|
Протеин |
91,5±0,25 |
92,1±0,46 |
89,9±0,33* |
90,7±0,25 |
|
Клетчатка |
33,3±2,40 |
31,6±2,04 |
20,9±2,10* |
23,1±1,78 |
|
Жир |
91,2±0,38 |
90,4±0,34 |
93,4±3,10 |
91,3±0,47 |
П р и м е ч а н и е. Описание групп и кормов см. в разделе «Методика».
* Различия между контролями статистически значимы при р < 0,05.
Переваримость протеина при замене соевого жмыха на подсолнечный (контрольные периоды) снижалась на 1,5 % (р < 0,05). Количество лизина, выделяемого с пометом птицы в контроле (корм ¹ 2), превышало аналогичный показатель для корма ¹ 1 на 25,0 % (р < 0,05), содержание метионина в контрольные периоды существенно не изменялось и составля- ло 0,001±0,0002 г. Сырая клетчатка в корме, содержащем соевый жмых, переваривалась на 12,4 % лучше (р < 0,05) по сравнению с подсолнечным. Следовательно, на фоне более высокой активности пищеварительных ферментов переваримость протеина и клетчатки для соевого жмыха была выше, чем для подсолнечного. Введение в рацион наночастиц хрома не оказывало существенного влияния на переваримость питательных веществ при использовании разных белковых ингредиентов в корме.
3. Биохимические показатели плазмы крови у кур-несушек ( Gallus gallus L.) кросса Hisex White при введении в рацион наночастиц оксида хрома Cr2O3 на фоне различных по ингредиентному составу кормов ( M ±SEM, n = 5)
|
Показатель |
Корм |
¹ 1 |
Корм |
¹ 2 |
|
контроль |
опыт |
контроль |
опыт |
|
|
Амилаза, Ед/л |
288±18,8 |
397±32,7* |
271±25,0 |
407±35,2* |
|
Липаза, Ед/л |
58±2,8 |
62±7,5 |
61±3,0 |
63±0,2 |
|
Трипсин, Ед/л |
202±43,7 |
154±16,8 |
95±37,9 |
135±53,6 |
|
Глюкоза, ммоль/л |
11,3±0,40 |
8,3±0,51* |
12,0±0,33 |
9,9±0,42* |
|
Щелочная фосфатаза, Ед/л |
1155±161,3 |
853±97,3 |
1293±68,8 |
1635±185,6 |
|
Общий белок, г/л |
41,9±1,91 |
33,0±1,12* |
42,4±1,71 |
38,7±2,30 |
|
Триглицериды, ммоль/л |
1,8±0,30 |
1,4±0,21 |
3,6±0,40 |
4,3±0,40 |
|
Мочевая кислота, ммоль/л |
245±34,7 |
182±19,1 |
233±21,1 |
180±16,2 |
|
Аланинаминотрансфераза, Ед/л |
7,7±0,91 |
5,4±0,53* |
7,9±0,54 |
7,5±0,91 |
|
Аспартатаминотрансфераза, Ед/л |
197,2±8,81 |
118,3±16,63* |
211,2±6,65 |
190,2±11,21 |
П р и м еч а ни е. Описание групп и кормов см. в разделе «Методика».
* Различия с соответствующим контролем статистически значимы при р < 0,05.
Полученные нами ранее данные свидетельствуют об изменении активности пищеварительных ферментов в плазме крови у мясных кур при включении в рацион различных биопрепаратов (19). В этом опытах биохимические показатели крови у птицы не имели существенных различий при использовании неодинаковых по ингредиентному составу кормов. Исключением были триглицериды, количество которых оказалось в 2 раза выше в варианте с кормом ¹ 2 по сравнению с кормом ¹ 1 (табл. 3), что указывает на лучшее усвоение жира при одинаковой активности липазы в дуоденальном содержимом. При добавлении хрома на фоне соевой белковой добавки наблюдалось увеличение активности амилазы в плазме крови на 37,8 % (р < 0,05), остальные показатели имели тенденцию к снижению по сравнению с контролем: по трипсину — на 23,8 % (р < 0,05), глюкозе — на 26,3 % (р < 0,05), щелочной фосфатазе — на 26,1 % (р < 0,05), общему белку — на 21,4 % (р < 0,05), триглицеридам — на 22,2 % (р < 0,05), мочевой кислоте — на 25,7 % (р < 0,05), аланинаминотрансферазе (АлАТ) — на 29,9 % (р < 0,05), аспартатаминотрансферазе (АсАТ) — на 40,1 % (р < 0,05). При использовании микродобавки хрома на фоне рациона с подсолнечным жмыхом активность амилазы увеличивалась на 50,1 % при одновременном снижении глюкозы на 17,2 % (р < 0,05).
Мы установили зависимость между активностью амилазы в дуоденальном химусе и содержанием глюкозы: чем выше активность фермента, тем меньше глюкозы содержалось в крови (рис. 1). Если корреляция в контроле не была достоверной, то в опыте коэффициент корреляции между активностью амилазы в дуоденальном химусе и содержанием глюкозы в крови оставался устойчиво отрицательным: в варианте с кормом ¹ 1 r = - 0,72 (р < 0,05), с кормом ¹ 2 — r = - 0,45. Это позволяет заключить, что хром существенно влияет на углеводный обмен благодаря лучшему использованию глюкозы организмом. Известно, что хром регулирует гомеостаз глюкозы, активируя рецепторы инсулина, тем самым усиливая передачу сигнала и увеличивая чувствительность к инсулину (20-22).
Триглицериды — это сложные эфиры, которые служат основными составляющими жира у всех живых организмов. Попадая в кишечник вме-814
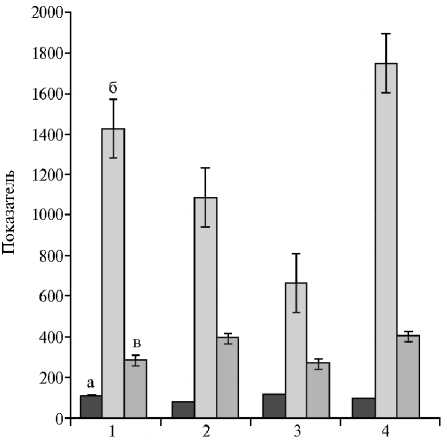
Рис. 1. Содержание глюкозы (ммоль/л) (а) и активность амилазы в плазме крови (Ед/л) (в), активность амилазы и дуоденальном содержимом (мг•мл - 1 •мин - 1 ) (б) у кур-несушек ( Gallus gallus L.) кросса Hisex White при введении в рацион наночастиц оксида хрома Cr 2 O 3 на фоне различных по ингредиентному составу кормов: 1 — контроль (корм ¹ 1), 2 — опыт (корм ¹ 1), 3 — контроль (корм ¹ 2), 4 — опыт (корм ¹ 2). Описание групп и кормов см. в разделе «Методика». Показатели содержания глюкозы увеличены в 10 раз.
сте с пищей, триглицериды подвергаются расщеплению липазой желудочного сока и поджелудочной железы на глицерин и жирные кислоты (23), однако вопросы жирового обмена в организме птицы до конца не изучены (24). По нашим данным, при увеличении активности липазы в химусе повышалось количество триглицеридов в плазме крови (рис. 2).
Величина липазно-жирового соотношения в плазме крови при использовании в рационе кур-несушек корма с соевой добавкой почти в 2 раза превышала показатели контроля с добавкой подсолнечного жмыха. Прямая зависимость наблюдалась между активностью липазы в дуоденальном химусе и триглицеридами, то есть чем лучше проходил гидролиз жиров в кишечнике, тем больше липидов поступало в кровь (коэффициент корреляции r колебался от 0,42 до 0,63; р < 0,05). Микродобавка хрома усиливала эти процессы, улучшая усвоение жиров организмом.
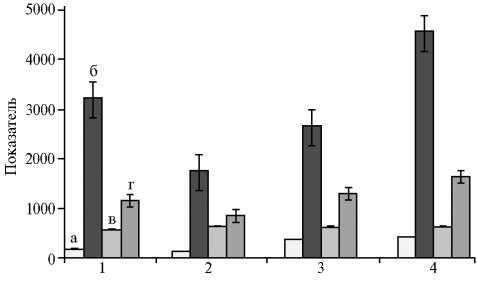
Рис. 2. Содержание триглицеридов (ммоль/л) (а) , активность липазы (Ед/л) (в) и щелочной фосфатазы (Ед/л) (г) в плазме крови, активность липазы в дуоденальном содержимом (Ед/л) (б) у кур-несушек ( Gallus gallus L.) кросса Hisex White при введении в рацион наночастиц оксида хрома Cr2O3 на фоне различных по ингредиентному составу кормов: 1 — контроль (корм ¹ 1), 2 — опыт (корм ¹ 1), 3 — контроль (корм ¹ 2), 4 — опыт (корм ¹ 2). Описание групп и кормов см. в разделе «Методика». Показатели содержания триглицеридов увеличены в 100 раз, липазы в крови — в 10 раз.
Активность щелочной фосфатазы, которая секретируется в печени, зависит от содержания липазы в дуоденальном химусе (25). Мы обнаружили зависимость между активностью липазы в дуоденальном содержимом и активностью щелочной фосфатазы в плазме крови (см. рис. 2). Обратная связь между этими по- казателями в некоторых случаях оказалась сильной (значение r = -0,90, р < 0,05).
Общий белок в плазме крови — это относительно стабильный показатель у здоровых животных, его колебания могут быть связаны с низким содержанием протеина в корме или с заболеванием. Белки крови в основном представлены альбуминами, которые обеспечивают поддержание онкотического давления крови. В нашем опыте уменьшение содержания общего белка в пределах физиологической нормы было связано с введением в корм микродобавки хрома (рис. 3). Одновременно с этим изменялось количество мочевой кислоты в крови и активность АлАТ, что указывает на нормализацию функции печени и поджелудочной железы (26).
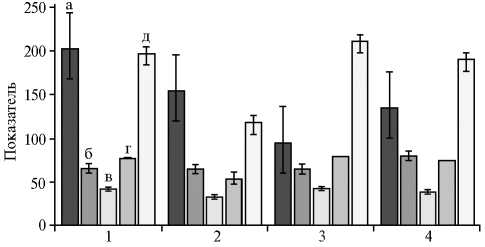
Рис. 3. Активность трипсина (Ед/л) (а) , содержание общего белка (г/л) (в) , активность аланинаминотрансферазы (Ед/л) (г) , аспартатаминотрансферазы (Ед/л) (д) в крови и активность протеаз (мг•мл - 1 •мин - 1 ) (б) в дуоденальном содержимом у кур-несушек ( Gallus gallus L.) кросса Hisex White при введении в рацион наночастиц оксида хрома Cr 2 O 3 на фоне различных по ингредиентному составу кормов: 1 — контроль (корм ¹ 1), 2 — опыт (корм ¹ 1), 3 — контроль (корм ¹ 2), 4 — опыт (корм ¹ 2). Описание групп и кормов см. в разделе «Методика». Показатели содержания аланинаминотрансферазы увеличены в 10 раз.
Анализ содержания ферментов в крови широко используется в медицине для оценки состояния сердца и печени. Фернандо Де Ритис (Fernando De Ritis) в 1957 году установил, что важное значение имеет не только собственно активность АлАТ и АсАТ в сыворотке крови, но и их соотношение (коэффициент де Ритиса). Колебания этого показателя у человека находятся в диапазоне от 1 до 2. У подопытных кур его значение было чрезвычайно высоким — 21,8-26,7. Возможно, следует отказаться от расчета коэффициента де Ритиса для кур, но отметим, что выполненный нами корреляционный анализ показал прямую и достаточно устойчивую связь между АсАТ и АлАТ, для которой величина r достигала 0,98 (р < 0,05). При добавлении наночастиц оксида хрома коэффициент де Ритиса незначительно снижался в опытных группах по сравнению с контролем. В отличие от тканевых, панкреатические ферменты гидролизуют белки, жиры и углеводы в желудочно-кишечном тракте до мономеров, а затем поступают в кровь, где участвуют в регуляции метаболизма. Из литературы известно (27), что существует прямая зависимость между активностью трипсина в крови и количеством глюкозы: чем больше трипсина в крови, тем выше содержание глюкозы. Эта закономерность была подтверждена нами в исследованиях на птице в постпрандиальный период (28).
Наши экспериментальные данные также согласуются с результатами исследований (1, 2), в которых показано, что хром регулирует гомеостаз глюкозы в крови, активируя рецепторы инсулина и тем самым, как уже отмечалось, модулирует сигнальную трансдукцию и повышает чувствительность к инсулину (29, 30). Что касается липидного обмена, то мы, в отличие от А.А. Оганяна с соавт. (3), не обнаружили достоверного влияния микродобавки хрома на концентрацию триглицеридов в крови. Однако нами установлено, что микродобавка хрома при низкой ферментативной активности в кишечнике выступает стимулятором активности дуоденальных ферментов, а при высокой — ингибирует активность липазы. Следовательно, есть основания полагать, что при низкой ферментативной активности добавка хрома оказывает положительное влияние на липидный обмен. В белковом обмене при добавлении в корм Cr 2 O 3 мы отмечали некоторые изменения: общий белок снижался в пределах физиологической нормы (на 24,1 %) при содержании кур на рационе с добавкой соевого жмыха, активность протеаз увеличивалась на 23,1 % при использовании в рацион подсолнечного жмыха, но при этом переваримость сырого протеина существенно не изменялась.
В опытах на крысах (31) сравнительный анализ использования раз- ных форм хрома в рационе показал, что активность амилазы в поджелудочной железе увеличивается при дозе наночастиц оксида хрома 300 мкг/кг. Включение пиколината хрома (CrРic) в аналогичной дозировке в корм крыс стимулирует активность липазы и протеазы. Увеличенная доза (500 мкг/кг) CrCl3 и CrРic уменьшает активность липазы в 12-перстной кишке и снижает активность амилазы и липазы в плазме крови, что свидетельствует о депрессирующем влиянии высоких доз хрома на энтеропанкреатическую циркуляцию пищеварительных ферментов и нарушении обмена Mg и Fe в крови. Количество триглицеридов снижается при максимальных дозах хрома в форме хлорида и пиколината, что подтверждает их участие в липидном обмене. Кроме того, на крысах установлено значительное увеличение частоты повреждений ДНК в лейкоцитах периферической крови и печени после воздействия оксида хрома в дозах 300 и 1000 мг/кг (32).
Результаты, полученные нами на курах, согласуются с описанием действия оксида хрома в форме наночастиц на крыс. Преимущество наших экспериментов состоит в том, что мы впервые изучили влияние оксида хрома в опытах in vivo на канюлированных курах на фоне разных белковых добавок.
Таким образом, у кур-несушек кросса Hisex White микродобавка хрома на фоне разных белковых компонентов рациона оказывает неоднозначное действие. В опытный период, независимо от рациона, при введении добавки оксида хрома отмечается повышение активности амилазы в крови на 37,8-50,2 % (р < 0,05), при этом содержание глюкозы в базальный период снижается на 26,6-17,5 % (р < 0,05), что свидетельствует об улучшении усвоения глюкозы. Установлена связь между активностью амилазы в дуоденальном содержимом и количеством глюкозы в крови: коэффициенты корреляции в опытный период на разных рационах — - 0,72 (р < 0,05) и - 0,45. При содержании птицы на пшеничном рационе с добавкой соевого жмыха введение оксида хрома способствует снижению активности липазы в содержимом кишечника, при этом биохимические показатели крови кур-несушек уменьшаются на 22-40 % (р < 0,05) в пределах физиологической нормы. Введение оксида хрома на фоне подсолнечного жмыха способствует повышению активности амилазы, липазы и протеаз в дуоденуме, что связано, по-видимому, с содержанием антипита-тельных веществ в подсолнечном жмыхе. Это указывает на роль базового рациона в действии оксида хрома на организм птицы.
Список литературы Кишечное пищеварение и биохимия крови у кур-несушек (Gallus gallus L.) при введении в рационы микродобавки хрома
- Kargar S., Mousavi F., Karimi-Dehkordi S., Ghaffari M.H. Growth performance, feeding behavior, health status, and blood metabolites of environmentally heat-loaded Holstein dairy calves fed diets supplemented with chromium. Journal of Dairy Science, 2018, 101(11): 9876-9887 ( ). DOI: 10.3168/jds.2017-14154
- Юдина Т.А., Серяков И.С. Результаты использования различных дозировок хрома на воспроизводительные способности и некоторые гематологические показатели свиноматок. Животноводство и ветеринарная медицина, 2013, 2: 9-14.
- Оганян А.А., Неелова О.В. Биологическая роль хрома, применение дихромата калия в фармацевтическом анализе. Успехи современного естествознания, 2011, 8: 227-229.
- Wang M.Q., Xu Z.R., Zha L.Y., Lindemann M.D. Effects of chromium nanocomposite supplementation on blood metabolites, endocrine parameters and immune traits in finishing pigs. Animal Feed Science and Technology, 2007, 139(1-2): 69-80 ( ). DOI: 10.1016/j.anifeedsci.2006.12.004
- Wei X., Hu L.L., Chen M.L., Yang T., Wang J.H. Analysis of the distribution pattern of chromium species in single cells. Anal. Chem., 2016, 88(24): 12437-12444 ( ). DOI: 10.1021/acs.analchem.6b03810
- Кононский А.И. Биохимия животных. М., 1992.
- Простокишин А.С., Бабухадия К.Р., Нимаева В.Ц., Красновский К.А., Горная Э.Н. Влияние скармливания хрома молодняку кур на рост и обмен веществ. Зоотехния, 2014, 4: 16-17.
- Губайдулина И.З., Гавриш И.А., Маркова И.В., Мустафина А.С. Воздействие ультрадисперсных частиц хрома различной дозировки на элементарный статус цыплят-бройлеров. Известия Оренбургского государственного аграрного университета, 2018, 6: 263-265.
- Tahami Z., Hosseini S.M., Bashtani M. Effect of organic acids supplementation on some gastrointestinal tract characteristics and small intestine morphology of broiler chickens. Animal Production Research, 2014, 3(3): Pe1-Pe9.
- Anderson R.A. Chromium and insulin resistance. Nutrition Research Reviews, 2003, 16(2): 267-275 ( ).
- DOI: 10.1079/NRR200366
- Saeed A.A., Sandhu M.A., Khilji M.S., Yousaf M.S., Rehman H.U., Tanvir Z.I., Ahmad T. Effects of dietary chromium supplementation on muscle and bone mineral interaction in broiler chicken. Journal of Trace Elements in Medicine and Biology, 2017, 42: 25-29 ( ).
- DOI: 10.1016/j.jtemb.2017.03.007
- Piotrowska A., Pilch W., Tota L., Nowak G. Biological significance of chromium III for the human organism. Medycyna Pracy, 2018, 69(2): 211-223 ( ).
- DOI: 10.13075/mp.5893.00625
- Rao S.V., Prakash B., Raju M.V., Panda A.K., Kumari R.K., Reddy E.P. Effect of supplementing organic forms of zinc, selenium and chromium on performance, anti-oxidant and immune responses in broiler chicken reared in tropical summer. Biological Trace Element Research, 2016, 172(2): 511-520 ( ).
- DOI: 10.1007/s12011-015-0587-x
- White P.E., Vincent J.B. Systematic review of the effects of chromium(III) on chickens. Biological Trace Element Research, 2019, 188(1): 99-126 ( ).
- DOI: 10.1007/s12011-018-1575-8
- Мерина-Глузкина В.М. Сравнительная оценка сахарифицирующего и декстринирующего методов при определении активности амилазы крови здоровых и больных острым панкреатитом. Лабораторное дело, 1965, 3: 142-146.
- Батоев Ц.Ж. Фотометрическое определение активности протеолитических ферментов в поджелудочной железе, соке по уменьшению концентрации казеина. Сборник научных трудов Бурятcкого СХИ (Улан-Удэ), 1971, 25: 122-126.
- Вертипрахов В.Г., Грозина А.А. Оценка состояния поджелудочной железы методом определения активности трипсина в крови птицы. Ветеринария, 2018, 12: 51-54 ( ).
- DOI: 10.30896/0042-4846.2018.21.12.51-54
- Батоев Ц.Ж. Физиология пищеварения птиц. Улан-Удэ, 2001.
- Фисинин В.И., Егоров И.А., Вертипрахов В.Г., Грозина А.А., Ленкова Т.Н., Манукян В.А., Егорова Т.А. Активность пищеварительных ферментов в дуоденальном химусе и плазме крови у исходных линий и гибридов мясных кур при использовании биологически активных добавок в рационе. Сельскохозяйственная биология, 2017, 52(6): 1226-1233 ( ).
- DOI: 10.15389/agrobiology.2017.6.1226rus
- Liu L., Zhang S.W., Lu J., Pang X.Y., Lv J.P. Antidiabetic effect of high-chromium yeast against type 2 diabetic kk-ay mice. Journal of Food Science, 2018, 83(7): 1956-1963 ( ).
- DOI: 10.1111/1750-3841.14138
- Егоров И.А., Петросян А., Андрианова Е.Н. Био-хром™ в кормлении птицы. Птицеводство, 2011, 12: 3-5.
- Никулин В.Н., Скицко Е.Р. Повышение переваримости питательных веществ курами-несушками под действием пробиотика и минеральной добавки. Известия Оренбургского государственного аграрного университета, 2017, 3: 167-169.
- Титов В.Н., Творогова М.Г. Триглицериды крови: методы определения и диагностическое значение (обзор литературы). Клиническая лабораторная диагностика, 1992, 9-10: 5-11.
- Serr J., Suh Y., Lee K. Regulation of adipose triglyceride lipase by fasting and refeeding in avian species. Poultry Science, 2009, 88(12): 2585-2591 ( ).
- DOI: 10.3382/ps.2009-00265
- Можейко Л.А. Влияние сахарного диабета на экзокринную деятельность поджелудочной железы. Ч. 2. Журнал Гродненского государственного медицинского университета, 2016, 3: 18-23.
- Wang C., Chen Z., Pan Y., Gao X., Chen H. Anti-diabetic effects of Inonotus obliquus polysaccharides-chromium (III) complex in type 2 diabetic mice and its sub-acute toxicity evaluation in normal mice. Food and Chemical Toxicology, 2017, 108(part B): 498-509 ( ).
- DOI: 10.1016/j.fct.2017.01.007
- Tsuda Y., Iwasawa K., Yokoyama M., Yamaguchi M. Trypsin-treated β-lactoglobulin improves glucose tolerance in c57BL/6 mice by enhancing AMPK activation and glucose uptake in hepatocytes. Biological and Pharmaceutical Bulletin, 2017, 40(11): 1917-1922 ( ).
- DOI: 10.1248/bpb.b17-00437
- Фисинин В.И., Вертипрахов В.Г., Грозина А.А. Новые подходы к оценке функции пищеварения у кур. Российская сельскохозяйственная наука, 2018, 1: 49-53.
- Turgut M., Cinar V., Pala R., Tuzcu M., Orhan C., Telceken H., Sahin N., Deeh P.B.D., Komorowski J.R., Sahin K. Biotin and chromium histidinate improve glucose metabolism and proteins expression levels of IRS-1, PPAR-γ, and NF-κB in exercise-trained rats. Journal of the International Society of Sports Nutrition, 2018, 15(1): 45 ( ).
- DOI: 10.1186/s12970-018-0249-4
- Ngala R.A., Awe M.A., Nsiah P. The effects of plasma chromium on lipid profile, glucose metabolism and cardiovascular risk in type 2 diabetes mellitus. A case - control study. PLoS ONE, 2018, 13(7): e019797 ( ).
- DOI: 10.1371/journal.pone.0197977
- Лебедев С.В., Гавриш И.А., Губайдуллина И.З. Морфо-биохимические показатели и активность пищеварительных ферментов у крыс линии Wistar под влиянием различных источников хрома. Сельскохозяйственная биология, 2019, 54(2): 304-315 ( ).
- DOI: 10.15389/agrobiology.2019.2.304rus
- Singh S.P., Chinde S., Kamal S.S., Rahman M.F., Mahboob M., Grover P. Genotoxic effects of chromium oxide nanoparticles and microparticles in Wistar rats after 28 days of repeated oral exposure. Environmental Science and Pollution Research, 2016, 23(4): 3914-3924 ( ).
- DOI: 10.1007/s11356-015-5622-0


