Кислотно-основные свойства поверхности оксидных материалов
Автор: Рязанов М.А.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Химические науки
Статья в выпуске: 2 (6), 2011 года.
Бесплатный доступ
Составлена и решена система уравнений, соответствующая 4рК модели ки- слотно-основных свойств поверхности оксидных материалов. Показано, что при уменьшении концентрации фонового электролита точка нулевого заряда протонов этой поверхности сдвигается в сторону более низких значений рН в случае специфической адсорбции катионов и в сторону более высоких рН в случае специфической адсорбции анионов. Представлено обоснование метода рК-спектроскопии. На основе полученных данных построен рК-спектр, соот- ветствующий данной модели; он состоит из двух полос, положение которых зависит от концентрации фонового электролита.
Адсорбция, адсорбенты, катализ, кислотно-основные свойства, 4рк-модель, анатаз, рк-спектры, рк-спектроскопия
Короткий адрес: https://sciup.org/14992449
IDR: 14992449 | УДК: 541.18.537
Текст научной статьи Кислотно-основные свойства поверхности оксидных материалов
Кислотно-основные свойства различных материалов давно и интенсивно изучаются, главным образом, в связи с их адсорбционными и каталитическими свойствами [1 – 4].
В частности, кислотно-основной характер активных центров на поверхности оксидных минералов во многом определяет их поведение в природной среде, взаимодействие с поровым раствором, является причиной образования геохимических барьеров и существенно связан с комплемен-тарностью поверхности в отношении к простейшим биомолекулам в концепции генобиоза [5].
Наиболее распространенным методом изучения кислотно-основных свойств (в рамках концепции Бренстеда) оксидных материалов является потенциометрическое титрование их суспензий в водной среде. Использование неводных растворителей перспективно в отношении изучения кислотноосновных свойств в рамках концепции Льюиса. Обычно титрование проводится из кислой области в щелочную (и наоборот) добавлением к суспензии, содержащей известную концентрацию свободной сильной кислоты cHA , последовательных порций сильной щелочи с концентрацией c и измере-
BOH
нием при этом рН раствора.
Кислотно-основные свойства изучаемого материала удобно охарактеризовать соответствующим рК-спектром [2, 3], представляющим собой гистограмму, площадь отдельных полос которой равна вероятности того, что характеризующая данный кислотно-основной центр величина рK i лежит в интервале между pK i и pK i + A pK. Расчет рК-спектров проводится на основании экспериментальной кривой титрования, выражающей зависимость Гиббсо-вой адсорбции ионов водорода на изучаемой поверхности от рН раствора (в расчете на 1 г изучаемого образца):
c u д V o — c roh V — [H ] " ( V o + V ) i \
Г н (pH) = HA 0 —BOH--------- 0----, ммоль/г. (1)
m
Здесь V0 – объем суспензии, взятой для титрования, концентрация одноосновной сильной кислоты в которой равна cHA , V – объем добавлен- ной щелочи с концентрацией cBOH , m – масса твердой фазы суспензии (г) во взятом образце. Концентрация ионов водорода в уравнении (1) рассчитывается из рН раствора по уравнению [H + ] = 10 - pH.
Интерпретация кислотно-основных свойств оксидных материалов обычно проводится в рамках концепции Дэвиса – Джеймса – Лекки [1] на основе так называемых 2рК и 4рК- моделей.
В 2рК-модели предполагается, что заряд по- верхности появляется в результате ионизации поверхностных амфотерных групп ─SOH по следующим реакциям и описывается соответствующими им уравнениями закона действующих масс:
+ + [-SOH] • [H + ]
-SOH 2+ ^ -SOH + H+ ( K ), K =
1 1 [-SOH + ]
+ [-SO-] • [H + ]
-SOH ^ -SO- + H+ ( K ,). K, = .
2 2 [-SOH]
Здесь индекс ─S используется для обозначения поверхности изучаемого образца. Константы равновесия K 1 и K2 характеризуют силу рассматриваемых кислотно-основных центров и постоянны при проведении эксперимента в условиях постоянной концентрации фонового электролита.
В кислой области (рН<=6) наблюдается равновесие (2), а в щелочной (рН>=9) – равновесие (3).
В тех случаях, когда константы K 1 и K 2
оказываются зависящими от концентрации фонового электролита, вместо модели 2рК используется модель 4рК. 2рК-модель – частный случай 4рК-модели, которая допускает возможность частичной нейтрализации поверхностного заряда ионами индифферентного электролита (например, NaCl), т.е. образованием на поверхности ионных пар:
+ + [SOH] • [H + ] • [Cl-]
SOH%Cl< > SOH+H + +Cl( K. ), K, =
3 3 [SOH + Cl-]
SOH+Na + ^ SO Na + +H + ( K 4 ), K 4 =
[SO-Na + ] • [H + ] [SOH] • [Na + ] .
Очевидно, большие значения констант K 3 и
K 4 соответствуют специфической адсорбции катионов, а малые значения – специфической адсорбции анионов.
Вообще говоря, зависимость констант K 1 и
K 2 от концентрации фонового электролита можно объяснить не только образованием ионных пар по реакциям (4) и (5), но и изменением коэффициентов активности реагирующих ионов, как это обычно делается при изучении комплексообразования в растворах.
Решая теперь систему уравнений законов действующих масс для равновесий (2), (3), (4), (5) и уравнений, выражающих условие электронейтральности раствора:
[SOH 2 +] + [H+] + [Na+] – [SO-] – [Cl-] = 0, условие баланса ионов Na+ и Cl- в системе (считая, что в качестве фонового электролита используется NaCl):
[NaCl] = [Na+] + [SONa], и
[NaCl] + [HCl] = [Cl-] + [SOH 2 Cl], получаем следующее уравнение для расчета величины F H(pH) :
c - [H ]
Гн (pH) = -HC =
H B
( K 3 / K 1 + [NaCl]) [H + ]2 - K 3 K 4[NaCl]- K 2 K 3
( K 3 / K 1 + [NaCl]) [H + ]2 + K 3 [H + ] + K 3 K 4[NaCl}^ K 2 K 3
При решении предполагалось, что [NaCl] = [Na+] = [Cl-], что справедливо при достаточно малых количествах твердой фазы и сравнительно высоких концентрациях фонового электролита. На рис. 1 представлен график зависимости ^(pH) для случая, когда рК 1 = 3.2, рК 2 = 8.7, рК 3 = 4.0, рК 4 = 7.0 (анатаз [6]) и при различных концентрациях NaCl. C ростом концентрации фонового электролита кривая в данном случае смещается в сторону более меньших значений рН в области положительных величин r H(pH) и в сторону более высоких значений рН в области отрицательных значений ^(pH) .
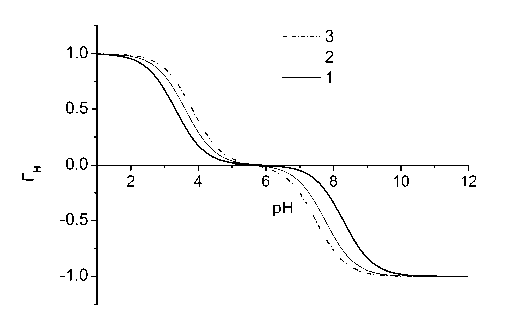
Рис. 1. Зависимость ^(pH) при различных концентрациях фонового электролита: 1 – 0.05 М, 2 – 0.25 М, 3 – 0.5 М NaCl.
Полученная зависимость ^(pH) может быть использована для построения соответствующего рК-спектра. Полная адсорбция ионов водорода на поверхности изучаемого сорбента, очевидно, равна:
N_ N_ I r H ( pH ) +Г 0 = 5r H i = ^r i pH-pK. ■ (7)
i i 1 + wp p 1
Суммирование в уравнении (7) проводится по всем ионам водорода или числу кислотно-основных центров N , находящихся на поверхности данного образца. Г , - полная обменная емкость i - го кислотно-основного центра, pK i – показатель константы диссоциации этого центра (отрицательный десятичный логарифм константы диссоциации). Г 0 — количество адсорбированных ионов водорода на изучаемой поверхности, не зависящее от рН раствора и соответствующее точке нулевого заряда протонов этой поверхности. Эту величину можно рассматривать как количество «не титруемых» в условиях проведения эксперимента ионов водорода, например, ионы водорода, входящие в состав OH-групп на поверхности изучаемого адсорбента, когда pK , ^- го . Величины Г н ( pH ) и Г ) могут быть как положительными, так и отрицательными в зависимости от положения разделяющей поверхности, которая обычно соответствует поверхности образца.
Сложность решения уравнения (7) относительно величин Г, обусловлена тем, что общее число N кислотно-основных центров заранее неизвестно.
Таким образом, каждое уравнение системы (7) линейно зависит от Г ) и N величин r i , а также нелинейно от N величин pK i . Общее число неизвестных равно 2 N +1. Для решения такой системы уравнений следует составить по меньшей мере 2 N +1 уравнений, что возможно, если экспериментальную кривую титрования аппроксимировать каким-либо сглаживающим сплайном и использовать этот сплайн для расчета величин Г н ( pH ) при заданных значениях рН. Очевидно, стандартный метод наименьших квадратов в данном случае не подходит, тем более, что заранее известно, что величины Г, положительны.
Поскольку величины Г i являются однозначными функциями дискретного множества величин pK i , уравнение (7) можно переписать в виде: rH ( pH ) = -r0 + N HpK ’- 5 ( pK - pK i )-- - pK .
I = 1 -го 1 + 10p p
Здесь d ( pK - pK i ) - дельта-функция. Число уравнений вида (8) равно числу величин Г н ( pH ) , соответствующих дискретным значениям рН и определяемых с помощью выше упомянутого сплайна.
Если значения величин pKi лежат в интер- вале pKmin < pKi < pKmax, то уравнение (8) можно представить в виде:
Гн^-Г )
N pKmax
+ Z j r(pK)- 5(pK-pp)-i=1pK ■ min dpK i+iopH"pK.
Разбивая область интегрирования на интервалы шириной ApK, представим каждый интеграл уравнения (9) в виде суммы: pKmax
HK)* - pK, )- »pK = pKmin 1 + 10 , (10)
l pK y +A pK
= Z j г( pK ) -6 ( pK - pK , ) . > pK
J = 0 pK ,. 1 + 10
где l = ( pKmax - pKmin ) / A pK-1 - равно числу интервалов шириной A pK . В результате уравнение (10) принимает вид:
Г ( pH ) = -f 0 +
Nl
+ z z i = 1 j = 0
= -Г0 + lN
+z z j=0 i=1
pK j +A pK
J r ( pK ) .S ( pK - pK , ) . —L pK j
PK j +A pK J V
J* ) -8( pK - pK , ) - 1 + 1" pH - pK .
pK j
Выполняя интегрирование и суммирование по i в последнем уравнении, получаем:
Г н ( pH ) = -Г 0 + z aj , J =0 J
где а равно либо 0, либо Г ,-- H - p ,
1 + 10p p i если pKi попадает в интервал pKmin + jApK < "K < pKmin + (j + 1)apK - в ре-mn mn зультате чего pKi можно аппроксимировать вели- чиной pK j = pKmin + jApK , положив
{Г, | i = 1...N} ■ {Гj | j = 0.J}. Окончательно урав- нение (11) принимает вид:
l 1
гн ( pH ) = г, - ( - 1 ) +У г, ----———,
H\r / 0 \ j 1 + 10"H -(pKmin+ jApK) , где
г , =1
; > 0 , если
_pKmin + jApK < "Ki < pKmin + (j + 1)ApK.
Таким образом, нахождение набора чисел
{ Г j\ j = 0.. l } , включающего набор чисел
{Г, | i = 1...N}, можно выполнить обычным методом наименьших квадратов с ограничением на положительные значения корней (алгоритм NNLS [7]), если предполагается, что Г, и Г0 > 0, на основе экспе- риментальной зависимости Гн (pH). Неопределенность найденных таким образом величин pKi характеризуется шагом ApK изменения pK и может быть снижена уменьшением этого шага и, соответственно, возрастанием числа членов l суммы по j в уравнении (12), если экспериментальную зависимость Гн (pH) интерполировать соответствующим сплайном. Величину ApK можно рассматривать как доверительный интервал для найденной таким образом величины pKi . Данная задача относится к числу некорректных задач [8], и при ее решении необходимо принимать во внимание погрешность экспериментальных данных.
Результаты решения задачи удобно представлять в виде гистограммы зависимости чисел l qj =Гj £ Г от соответствующих им величин J Л i=0
pK j . Число полос на такой гистограмме будет равно числу индивидуальных равновесий, описывающих изучаемую диаграмму состав – свойство. Сама гистограмма может быть названа рК-спектром изучаемой системы. Надежный рК-спектр, очевидно, может быть получен лишь при минимально возможной погрешности экспериментальных данных. В данном случае возникает своеобразный принцип неопределенности , согласно которому неопределенность рК-спектра является следствием неопределенности ошибки эксперимента.
На рис. 2 представлен рK-спектр (для A pK=0.1), построенный по данным рис. 1, из которого видно, что найденные этим методом величины рК i близки к заданным при построении рис. 1. По оси ординат здесь отложена относительная мольная доля соответствующего кислотно-основного центра от общего их числа ( q ).
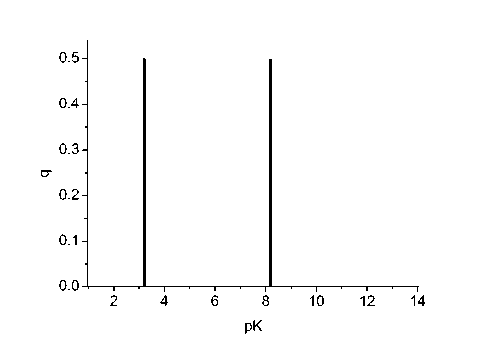
Рис. 2. рК-спектр анатаза при [NaCl]=0.
Уравнение (6) перепишем в виде:
Г H(pH) =
[H + ]2 - K‘K 2
[H + ]2 + K ‘ [H + ] + K 1 K 2
в котором штрихованные константы соответствуют величинам рК i , получаемым при использовании фонового электролита:
K 1 =
K 1 • K 3 _
K 3 + K 1[NaCl] ’
и
K 2 = K 4[NaCl] + K 2 .
При этом K1 и K 2 соответствуют, очевидно, предельным значениям штрихованных констант при нулевой концентрации фонового электролита. Если константы K1 и K2 найдены в условиях очень низкой (практически нулевой) концентрации фонового электролита, то уравнения (14) и (15) позволяют определить константы K3 и K4 при условии, что штрихованные константы определены из рК-спектров, соответствующих заданной концентрации фонового электролита.
Из полученных уравнений следует, что при увеличении концентрации фонового электролита полоса, соответствующая величине pK, должна сдвигаться в сторону более высоких значений, а полоса, соответствующая величине pK^, в сторону более низких значений. Положение точки нулевого заряда протонов pznpc (Гн (pH) = 0) определяется выражением:
pznpc = I (pK 1 + pK^) =
^(pK1 + pK2) - ^g
K 3( K 2 + K 4[NaCl]) ’ K 2( K 3 + K 1[NaCl])
и в пределе очень большой концентрации фоново- го электролита стремится к величине
2"(pKg + pK4). При специфической адсорбции катионов фона на изучаемой поверхности точка нулевого зарядов протонов сдвигается в область более низких значений рН, а при специфической адсорбции анионов – в сторону более высоких значений рН. При достаточно высоком сродстве поверхности к присутствующим в растворе катионам можно ожидать, что величина Гн (pH) во всей изучаемой области рН окажется отрицательной.
Список литературы Кислотно-основные свойства поверхности оксидных материалов
- Davis J.A., James R.O., Leckie J.O.//J. Colloid and Interface Sci. 1978. Vol. 61. No. 3. P. 480.
- Рязанов М.А., Дудкин Б.Н.//Коллоид. журн. 2003. Т. 65. № 6. С. 831.
- Ryazanov M.A., Dudkin B.N. Rus. Journal of Phys. Chem. A. 2009. Vol. 83. No. 13. P. 2318.
- Танабе К. Твердые кислоты и основания. М.: Мир, 1973.
- Юшкин Н.П. Минеральный мир и биосфера: минеральный организмобиоз, биоминеральные взаимодействия, коэволюция//Матер. IV Международного семинара «Минералогия и жизнь: Происхождение биосферы и коэволюция минерального и биологического миров». Сыктывкар. Геопринт, 2007. С. 5.
- Huertas F.J., Chou Lei, Wollast R.//Geochim. et Cosmochim. Acta. 1998. Vol. 62. Nо. 3. P. 417.
- Лоусон Ч., Хенсон Д. Численное решение задач метода наименьших квадратов. М.: Наука, 1986. 230 с.
- Тихонов А.Н., Гончарский А.В., Степанов В.В., Ягола А.Г. Численные методы решения некорректных задач. М.: Наука, 1990. 230 с.


