Кластер miR-17-92 и miR-203А как предикторы течения хронического миелолейкоза
Автор: Перепечаева М.Л., Горева О.Б., Лямкина А.С., Поспелова Т.И., Гришанова А.Ю.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 т.24, 2025 года.
Бесплатный доступ
Введение. В терапии хронического миелолейкоза (ХМЛ) в настоящее время повсеместно применяются ингибиторы тирозинкиназ, и прогрессирование заболевания часто связано с развитием резистентности к ним. Существует потребность в дополнительных инструментах контроля терапии, и таковыми могут стать уровни экспрессии определенных микроРНК (miR). Цель исследования – оценка уровня экспрессии miR-203а и miR-17-92 в костном мозге и субстратах периферической крови – лимфоцитах, плазме и внеклеточных везикулах у пациентов с ХМЛ с разными характеристиками патологического процесса и врачебного вмешательства. Материал и методы. Образцы крови и костного мозга 56 пациентов с диагнозом ХМЛ были взяты из Городского гематологического центра Государственного бюджетного учреждения здравоохранения Новосибирской области «Городская клиническая больница № 2» с 2016 по 2017 гг. Уровень экспрессии miR оценивали методом ОТ-ПЦР в реальном времени по принципу taqMan. Результаты. В костном мозге и лимфоцитах крови уровень экспрессии miR-17, miR-18а и miR-20a оказался выше у пациентов в фазе акселерации (ФА) по сравнению с хронической фазой (ХФ), а также у больных с неблагоприятным прогнозом. Уровень экспрессии miR-19a и miR-19b в плазме был выше у пациентов с ХФ по сравнению с бластным кризом (БК) и у пациентов с благоприятным прогнозом. Уровень экспрессии miR-19а был выше у пациентов с благоприятным прогнозом в микровезикулах, а уровень экспрессии miR-203 был выше у пациентов с благоприятным прогнозом в микровезикулах и плазме крови. Также экспрессия miR-203 оказалась существенно выше в микровезикулах у пациентов, достигших большого молекулярного ответа (БМО). Заключение. Наиболее перспективными в плане возможного практического применения представляются miR-17, miR-18а и miR-20a в костном мозге и лимфоцитах, miR-19a и miR-19b в плазме крови, а также miR-203 в плазме крови и в микровезикулах.
ХМЛ, miR-203а, miR-17-92, внеклеточные везикулы, лимфоциты, периферическая кровь, костный мозг, фазы ХМЛ, прогноз ХМЛ
Короткий адрес: https://sciup.org/140312273
IDR: 140312273 | УДК: 616.155.392.8-08 | DOI: 10.21294/1814-4861-2025-24-4-66-81
Текст научной статьи Кластер miR-17-92 и miR-203А как предикторы течения хронического миелолейкоза
Хронический миелоидный лейкоз (ХМЛ), по международной классификации – сhronic myeloid leukemia [1], представляет собой клональный миелопролиферативный процесс, развивающийся в результате злокачественной трансформации ранних гемопоэтических стволовых клеток, в основе которой лежит хромосомная мутация t(9;22) (q34;q11) (так называемая филадельфийская (Ph) хромосома). В результате данной транслокации формируется химерный ген BCR::ABL1 [2, 3]. Белковый продукт гена BCR::ABL1 – тирозин-киназа с аномально повышенной активностью, регулирует сигналы, ответственные за клеточный рост, активацию, дифференцировку, адгезию и апоптоз [2, 3].
В развитии ХМЛ выделяют 3 фазы, первую (начальную) из которых называют хронической (ХФ), затем следует фаза акселерации (ФА) – более продвинутый этап развития патологического процесса, начало прогрессирования заболевания. Бластный криз (БК) является последней и самой агрессивной стадией ХМЛ, а начало болезни с БК – неблагопри- ятный прогностический признак. На этой стадии медианная продолжительность жизни пациента составляет 6–12 мес [2, 3].
После появления таргетных ингибиторов тиро-зинкиназы (ИТК), таких как иматиниб, дазатиниб, нилотиниб, бозутиниб, понатиниб и асциминиб, частота прогрессирования заболевания в позднюю фазу снизилась, и сейчас 10-летняя выживаемость при ХМЛ составляет 80–90 % [4]. При постоянном приеме ИТК опухолевый клон подвергается редукции, риск прогрессирования заболевания снижается. Основной целью терапии является достижение большого молекулярного ответа – благоприятного фактора длительной выживаемости [2].
При терапии ИТК основной проблемой является развитие резистентности к терапии, обусловленной, в первую очередь, появлением дополнительных хромосомных аберраций гена BCR::ABL1. В этом случае заболевание прогрессирует и переходит из моноклоновой фазы (ХФ) в поликлоновую (ФА и БК) [4]. Для улучшения результатов общей и бес-событийной выживаемости при ХМЛ рекомендуется регулярный контроль эффективности терапии и переход больного на следующую линию ИТК в случае появления неблагоприятных признаков резистентности к терапии и прогрессирования гемобластоза. Контроль терапии в настоящее время осуществляют путем проведения общего развернутого анализа крови, цитологического и цитогенетического исследования мазка костного мозга, молекулярно-цитогенетического исследования методом FISH, исследования экспрессии BCR::ABL1 (соотношение BCR-ABL1/ABL1) [2].
микроРНК (miR) – класс небольших некодирующих РНК, которые играют важную роль в регуляции экспрессии генов и широкого спектра биологических процессов, включая канцерогенез и метастазирование, активно участвуют в патогенезе злокачественных новообразований человека [5]. мiR посттранскрипционно регулируют работу генов, взаимодействуя с определенными мРНК, включая их деградацию и репрессию трансляции [5].
За последние годы достигнут серьезный прогресс в определении функций различных miR, для которых идентифицируются «рабочие» молекулярные мишени в случае разных заболеваний, в разных типах тканей и т.п. Одной из проблем является множественность мишеней, управляемых каждой miR, что часто дает неоднозначную картину. Однако считается, что miR могут быть надежным диагностическим инструментом, в достаточной степени отвечая таким критериям биомаркеров, как доступность, специфичность и чувствительность. Важную роль в малоинвазивной диагностике отводят циркулирующим miR, которые выделяются в кровь и другие биологические жидкости из патологического очага [6].
При необходимости регулярного мониторинга течения заболевания либо ответа на терапию, как при ХМЛ, профилирование экспрессии miR может стать ценным диагностическим маркером, наряду с цитогенетическим исследованием и молекулярногенетическим исследованием, либо войти в комплекс диагностических инструментов при ведении пациентов с ХМЛ. miR достаточно стабильны в жидкостях организма, и их уровень экспрессии может быть измерен с помощью ОТ-ПЦР [7], и, таким образом, miR могут иметь хороший потенциал в качестве биомаркера течения и ответа на лечение при ХМЛ.
Кластер miR-17-92 расположен в геноме человека на хромосоме 13 и включает miR-17, miR-18a, miR-19a, miR-19b, miR-20a и miR-92a [8]. Кластер miR-17-92 регулирует множество генов-мишеней и многие клеточные процессы. Гены кластера miR-17-92 играют роль онкогена либо опухолевого супрессора в зависимости от типа ткани и клеточного контекста [8–10]. Этот кластер отсутствует при раке яичников, молочной железы и кожи [9], но активирован при лимфомах человека и описан как распространенный сайт вставки ретровирусов [9]. Сообщалось, что miR-17-92 воздействует на ряд генов-супрессоров опухолей, способствуя развитию опухоли [11]. Среди генов-мишеней miR-17-92 – антиапоптотические факторы: MCL1, BCL2 и BCL2L10; проапоптотические факторы: BID, BCL2L1 и каспаза 8; регуляторы клеточного цикла: E2F1, белок ретинобластомы RB1, мутантный при атаксии-телеангиэктазии белок ATM, CCND1, трансформирующий фактор роста бета TGFβ; супрессор опухоли фосфатаза PTEN и ряд других [12–14].
мiR-17-92 играют патогенную роль в развитии различных лейкозов. Они регулируются химерной тирозинкиназой BCR::FGFR1, усиливая пролиферацию клеток, подавление апоптоза и развитие агрессивных гемобластозов, связанных с аномалиями FGFR1 (В-клеточный острый лифобласт-ный лейкоз, острый миелоидный лейкоз, Т- или В-клеточные лимфомы) [15]. miR-17-92 способствуют пролиферации и выживанию клеток, влияя на CDKN1A и PTEN при гемобластозах. Обратная корреляция уровней экспрессии наблюдается между miR-17-92 и CDKN1A и PTEN у пациентов с хроническим лимфолейкозом [15]. Кластер miR-17-92 является онкогеном, ассоциированным с ХМЛ. Экспрессия кластера miR-17-92 повышена в лейкемических CD34 + клетках ХМЛ [11]. Члены кластера miR-17-92 действуют как опухолевые промоторы BCR::ABL1 через фактор транскрипции c-myc [11, 16, 17]. BCR::ABL1 индуцирует экспрессию гена c-MYC , который необходим для трансформации BCR::ABL1 при ХМЛ [18].
С использованием мышиной модели трансплантации опухолевых гемопоэтических стволовых клеток BCR::ABL1- позитивных показано, что miR-17-92 способствует развитию ХМЛ путем ингибирования белка A20 и активации ядерного фактора-кВ (NF-кВ) [17]. Активация NF-кВ характерна для большинства злокачественных новообразований и играет важную роль в развитии ХМЛ [19]. А20 действует как супрессор опухоли, способствуя усилению апоптоза и остановке роста клеток в лейкемических CD34 + клетках ХМЛ, а его ингибирование способствует пролиферации и выживанию клеток опухолевого клона [19].
Сообщалось, что несколько членов кластера miR-17-92, особенно miR-17 и miR-20, участвуют в регуляции клеточного цикла, но действуют ли они как активаторы или ингибиторы, зависит от клеточного контекста [10]. Показано, что miR-92a1-5p способствует прогрессированию ХМЛ, подавляя экспрессию и активность белка MLKL, участвуя в посттранскрипционной регуляции ключевых генов некроптоза (программируемой некротической гибели клетки, сопровождаемой активацией взаимодействующей с рецептором протеинкиназы-3) [16].
мiR-203 расположена на хромосоме 14q32.33 и впервые была выявлена как участвующая в гомеостазе кожи и врожденного иммунитета;
аберрантная экспрессия miR-203 связана с прогрессированием иммунных нарушений, нейродегенерацией и раком [20, 21]. miR-203 играет важную роль в росте, миграции и инвазии опухолевых клеток, способствует аномальной пролиферации, инвазии и метастазированию [22]. Мишени miR-203 участвуют в путях апоптоза, воздействуя на Bcl-2-подобный белок 2 (Bcl2l2), диацилглицерол-киназу бета (Dgkb), митоген-активируемую киназу 10 (Mapk10), визининоподобный белок 1 (Vsnl1); в NF-κB-зависимых воспалительных путях – на IL-24 и IL-8, адапторный белок MyD88, белок SOCS3 [20]. Показано, что miR-203 может быть как онкогеном, так и супрессором опухоли даже в пределах одного типа злокачественных новообразований. Например, снижение экспрессии miR-203 усиливает рост и метастазирование карциномы почек за счет сверхэкспрессии FGF2 [23], но при той же карциноме почек miR-203 может играть роль супрессора опухоли, действуя как блокатор сигнального пути PI3K/AKT, ингибируя CAV1 и подавляя эпителиально-мезенхимальный переход, миграцию и инвазию раковых клеток [24].
При ХМЛ miR-203а является антионкогеном. Подавление экспрессии miR-203а коррелирует с появлением опухолевого клона и прогрессированием ХМЛ [25], Экспрессия miR-203а обладает противоопухолевым действием: улучшает чувствительность человеческих клеток ХМЛ K562 к химиотерапевтическим препаратам [26]. Сообщается, что транскрипционный фактор EGR1 положительно регулирует экспрессию miR-203a, генами-мишенями которой являются проонко-генные белок опухоли Вильмса 1 ( WT1 ), BMI1 и белок-ингибитор апоптоза XIAP [27]. И, таким образом, EGR1, положительно влияя на экспрессию miR-203a, ослабляет ингибирующее действие miR-203a на трансляцию генов-мишеней ( WT1, BMI1 и XIAP ) и влияет на пролиферацию клеток K562 [27].
В BCR::ABL1 -положительных клеточных линиях ХМЛ происходит подавление экспрессии miR-203 по различным генетическим и эпигенетическим механизмам, таким как гиперметилирование промотора miR-203 [28]. Иматиниб вызывает деметилирование промоторной области miR-203, что приводит к подавлению экспрессии BCR::ABL1 , в результате снижается пролиферация опухолевых клеток [25]. Повышение экспрессии miR-203 в клетках BaF3-BCR::ABL1 с устойчивой к иматинибу мутацией T315I ингибирует рост опухоли и повышает чувствительность к имати-нибу [29].
Целью исследования явилось выявление возможных закономерностей различий уровня активности гена miR-203а, в основном известной как антионкогенная miR и miRs, принадлежащих к кластеру miR-17-92: miR-17, miR-18a, miR-19a, miR-19b, miR-20a, и miR-92a, являющихся при
ХМЛ проонкогенными miR, в субстратах крови и костном мозге у пациентов с ХМЛ в зависимости от фазы и прогноза заболевания и ответа на лечение, ряда клинических и лабораторных показателей. Вовлеченность miR-203а и miR-17-92 в патогенез ХМЛ в целом известна, но информации о связи изменений уровня их экспрессии и динамики патологического процесса недостаточно.
Материал и методы
В работе использовали образцы клинического материала (периферическая кровь и костный мозг) 56 пациентов, которые проходили лечение в отделении гематологии Государственного бюджетного учреждения здравоохранения Новосибирской области «Городская клиническая больница № 2» с 2016 по 2017 г. Всем пациентам был поставлен диагноз ХМЛ. Диагностика ХМЛ и показания к началу терапии определялись в соответствии с международными критериями ELN 2013 г. и Российскими клиническими рекомендациями по диагностике и лечению хронического миелолейкоза [30–32]. Среди больных было 40 женщин (средний возраст – 54 ± 15 лет) и 16 мужчин (средний возраст – 53 ± 15 лет). У большинства пациентов (n=50) наблюдалась хроническая фаза заболевания (ХФ), у 3 – фаза акселерации (ФА) и у 3 больных – фаза бластного криза (БК).
Прогноз ХМЛ определялся, исходя из группы риска, определенной согласно международным индексам прогноза Sokal (прогноз прогрессирования в ФА и БК) либо EUTOS (прогноз достижения полного цитогенетического ответа (ПЦО) к 18 мес терапии иматинибом) [33]. Также прогноз определялся как неблагоприятный при наличии ФА либо БК. Среди пациентов было 33 человека с благоприятным прогнозом, 15 – с промежуточным, 8 – с неблагоприятным прогнозом. У 47 пациентов на момент забора биоматериала показатели гемограммы и миелограммы были в норме, клинические проявления заболевания отсутствовали. У двоих отмечалась анемия, из них у одного – панцитопения и низкая клеточность по результату миелограммы. У 7 пациентов наблюдался лейкоцитоз, сдвиг лейкоцитарной формулы, гиперклеточность костного мозга за счет клеток миелоидного ряда, при этом у 2 из 7 больных дополнительно наблюдался бластоз в костном мозге более 20 %. Сопутствующей патологии у 18 пациентов не отмечено, у остальных самым распространенным сопутствующим заболеванием была артериальная гипертония (n=26), а также другая патология сердечно-сосудистой системы (n=11) и желудочно-кишечного тракта (n=12).
Пациенты получали ингибиторы тирозинкина-зы (ИТК): иматиниб (n=47), дазатиниб (n=5) или нилотиниб (n=1), первичные больные в ХФ (n=3) получали химиотерапию (гидроксикарбамид). У 31 пациента достигнут большой молекулярный
Таблица/table
Последовательности олигонуклеотидов для проведения ОТ-ПЦР
Oligonucleotide sequences for reverse-transcription PCR
|
miR |
Тип/Type |
Последовательность/Sequence (5’→3’) |
|
miR-203a-3p |
Адаптер/Adapter Прямой/Forward Зонд/Probe |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCTAGTGGT GCCGCGTGAAATGTTTAGG [FAM]TTCGCACTGGATACGACCTAGTGGT[BHQ-1] |
|
miR-17-5p |
Адаптер/Adapter Прямой/Forward Зонд/Probe |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCTACCTGC GCCGCCAAAGTGCTTACAGT [FAM]TTCGCACTGGATACGACCTACCTGC[BHQ1] |
|
miR-18a-5p |
Адаптер/Adapter Прямой/Forward Зонд/Probe |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCTATCTGC GCCGCTAAGGTGCATCTAGT [FAM]TTCGCACTGGATACGACCTATCTGC[BHQ1] |
|
miR-19a-5p |
Адаптер/Adapter Прямой/Forward Зонд/Probe |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTTGTAGTGC GCCGCAGTTTTGCATAGTT [FAM]TTCGCACTGGATACGACTGTAGTGC[BHQ1] |
|
miR-19b1-3p |
Адаптер/Adapter Прямой/Forward Зонд/Probe |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTTCACTTTT GCCGCTGTGCAAATCCATGC [FAM]TTCGCACTGGATACGACTCACTTTT[BHQ1] |
|
miR-20a-5p |
Адаптер/Adapter Прямой/Forward Зонд/Probe |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCTACCTGC GCCGCTAAAGTGCTTATAGT [FAM]TTCGCACTGGATACGACCTACCTGC[BHQ1] |
|
miR-92a1-5p |
Адаптер/Adapter Прямой/Forward Зонд/Probe |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTAGCATTGC GCCGCAGGTTGGGATCGGTT [FAM]TTCGCACTGGATACGACAGCATTGC[BHQ1] |
|
RNU6-1 |
Адаптер/Adapter Прямой/Forward Зонд/Probe |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGGCCATGC GCCGCATACAGAGAAGATTA [FAM]TTCGCACTGGATACGACGGCCATGC[BHQ1] |
|
Обратный (общий)/Reverse (common) |
AGTGCAGGGTCCGAGGTA |
Примечание: таблица составлена авторами.
Note: created by the authors.
ответ (БМО, снижение экспрессии BCR::ABL1 ниже уровня 0,1 %); у 7 пациентов – полный цитогенетический ответ (ПЦО, характеризующийся отсутствием Ph-хромосомы при стандартном цитогенетическом исследовании). У 9 больных получен клинико-гематологический ответ (КГО, отсутствие лишь клинических симптомов и изменений в гемограмме). У 9 пациентов не получено ответа на терапию.
Забор материала, выделение мононуклеаров костного мозга, лимфоцитов крови, плазмы крови и микровезикул из плазмы крови производили аналогично нашему предыдущему исследованию [34]. Выделение суммарной РНК, постановку реакции обратной транскрипции и оценку экспрессии генов также проводили аналогично исследованию [34]. Последовательности олигонуклеотидов представлены в таблице. В качестве эталонного гена использовали малую ядерную РНК U6. Последовательности микроРНК взяты из miRBase , последовательность малой ядер- ной РНК U6 – из базы данных Nucleotide . ПЦР в реальном времени по принципу TaqMan проводили на оборудовании iCycler CFX96 real-time PCR detection system (BioRad Laboratories, USA) аналогично исследованию [34]. Каждый образец амплифицировали трижды. Для оценки экспрессии применялся показатель ΔCT [35].
Статистическую обработку результатов проводили с использованием программного пакета STATISTICA software и MS Excel. Характер распределения данных определяли с помощью критерия Колмогорова–Смирнова с поправкой Лиллифорса. Для оценки значимости различий групп использовали непараметрический критерий Краскела–Уоллиса с последующим попарным сравнением с помощью критерия Манна–Уитни либо только критерий Манна–Уитни. При демонстрации результатов в виде X ± m показатель вариабельности m представлен как среднеквадратичное отклонение. Значения уровня экспрессии
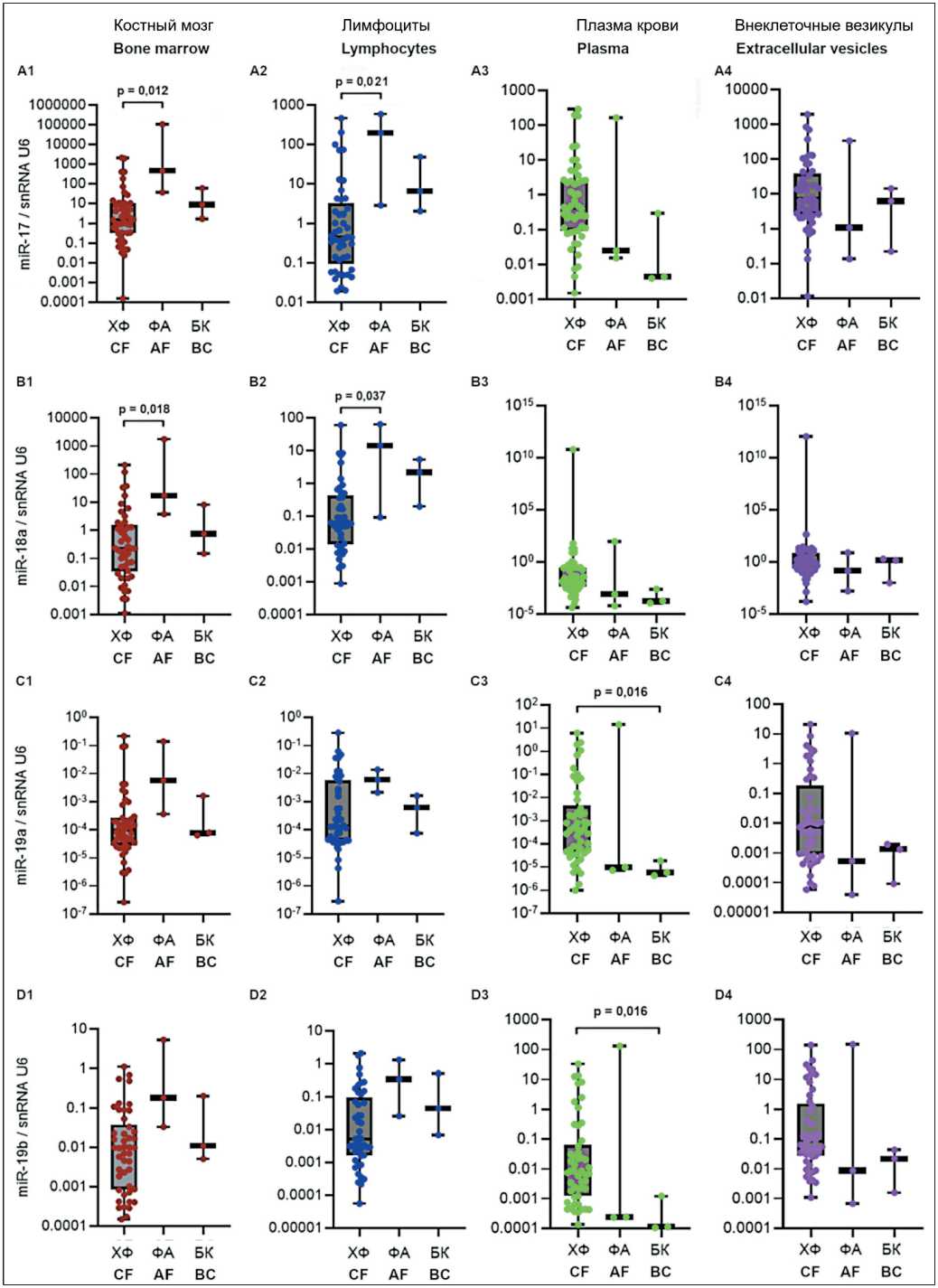
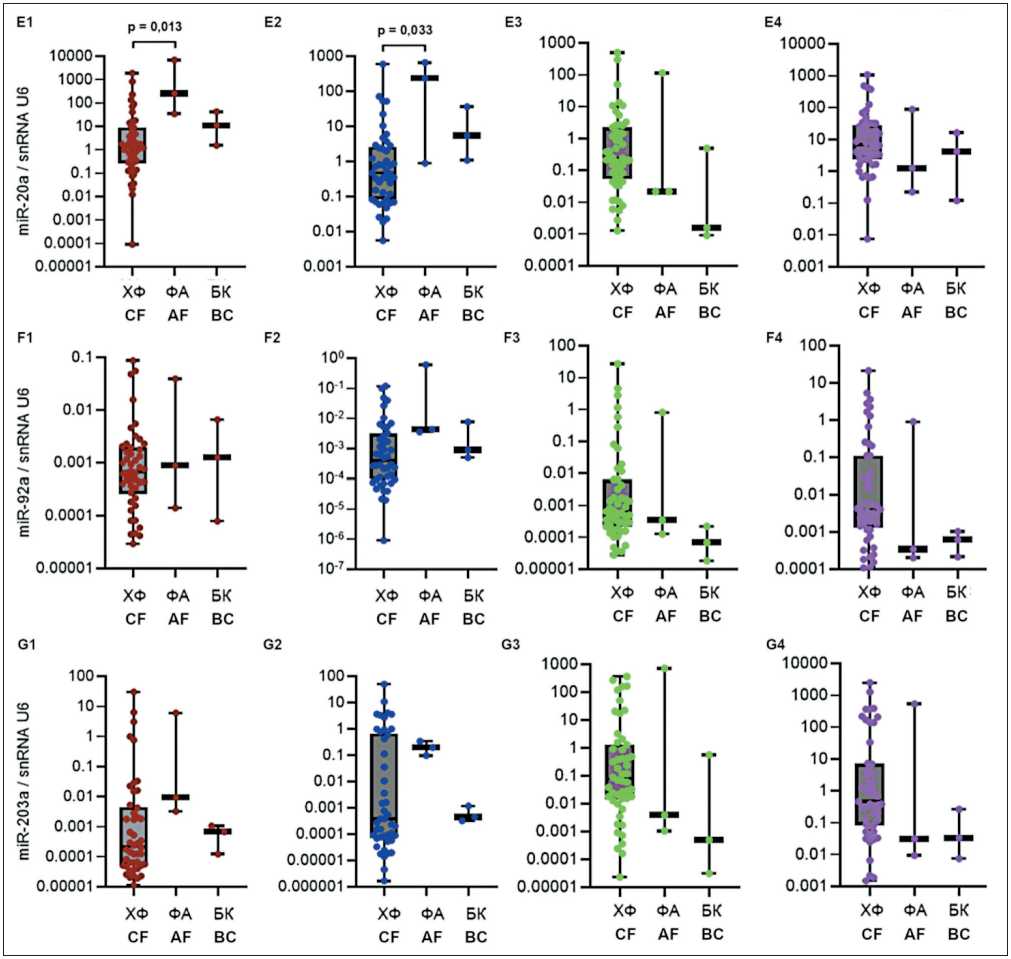
Рис. 1. Уровень экспрессии miR-17-92 (А-F) и miR-203а (G) в костном мозге и лимфоцитах периферической крови у пациентов с различными фазами заболевания. Данные представлены в виде медианы и 25–75 процентилей, минимального и максимального значений относительного уровня экспрессии. Хроническая фаза (ХФ) – n=45–50, фаза акселерации (ФA) – n=3, бластный криз (БК) – n=3; рисунок выполнен авторами
Fig. 1. Expression levels of miR-17-92 (А-F) and miR-203а (G) in bone marrow and peripheral blood lymphocytes in groups of patients having different phases of the disease. The data are presented as a median with 25–75th percentiles and minimal and maximal relative expression levels. Chronic phase (CF): n=45–50, acceleration phase (AF): n=3, and blast crisis (BC): n=3; created by the authors
miR-17-92 и miR-203 представлены как медиана и 1 и 3 квартили (Me (Q1; Q3)).
Результаты
Нами проанализированы уровни экспрессии miR-17-92 (miR-17, miR-18a, miR-19a, miR-19b, miR-20a и miR-92a) и miR-203а в плазме, лейкоцитах и микровезикулах крови и костном мозге у пациентов с ХМЛ в различных фазах заболевания и с разным прогнозом течения заболевания, ответом на терапию, нормальной или патологической миелограммой и ОАК, наличием клинической симптоматики и сопутствующих заболеваний. Дизайн исследования не предусматривал сравнение со здоровым контролем.
Исследована возможная связь уровня экспрессии miR-17-92 и miR-203а с разными фазами ХМЛ. На рис. 1 представлены значения относительного уровня экспрессии кластера miR-17-92: miR-17, miR-18a, miR-19a, miR-19b, miR-20a и miR-92a и miR-203а в костном мозге, лимфоцитах, плазме крови и внеклеточных везикулах у пациентов с
Плазма
Костный мозг
Bone marrow
Plasma р = 0,002
р = 0,033
А1
р = 0,015
р =0.002
1000-.
1000-1
100-
100-
1000000-1 100000-
“ 10000- f 1000-
Лимфоциты
Lymphocytes
Внеклеточные везикулы
Extracellular vesicles
Е
В1
В2
р = 0,028
р = 0,006
10000-1
Благ. Пром. Небл.
Fav. Int. Unfav.
0.01
0.001
0.0001-
р = 0,014
0.00001 -I----1------1------1----
Благ. Пром. Небл.
Fav. Int. Unfav.
0.001-
Е
0.0001
0.0001
0.I
Благ. Пром. Небл.
Fav. Int. Unfav.
Благ. Пром. Небл.
Fav. Int. Unfav.
0.0001
Благ. Пром. Небл.
Fav. Int. Unfav.
0.00001
Благ. Пром. Небл.
Fav. Int. Unfav.
Благ. Пром. Небл.
Fav. Int. Unfav.
Благ. Пром. Небл.
Fav. Int. Unfav.
Благ. Пром. Небл.
Fav. Int. Unfav.
р =0,002
1000-
0.0001
Пром. Небл.
Int. Unfav.
Благ. Пром. Небл.
Fav. Int. Unfav.
р = 0,01
р = 0,007
р = 0,023
Благ. Пром. Небл.
Fav. Int. Unfav.
Благ. Пром. Небл.
Fav. Int. Unfav.
Благ. Пром. Небл.
Fav. Int. Unfav.
р = 0,034 р = 0,001
р = 0,012
Пром. Небл.
Int. Unfav.
Пром. Небл.
Int. Unfav.
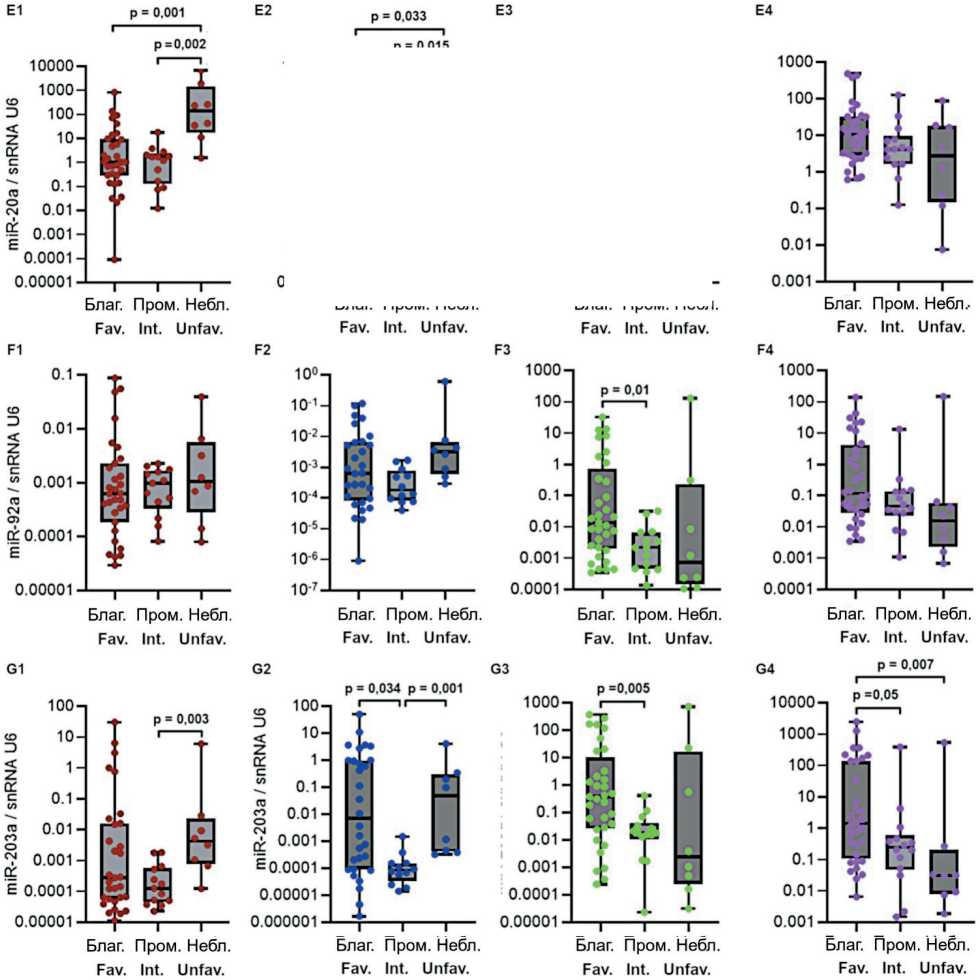
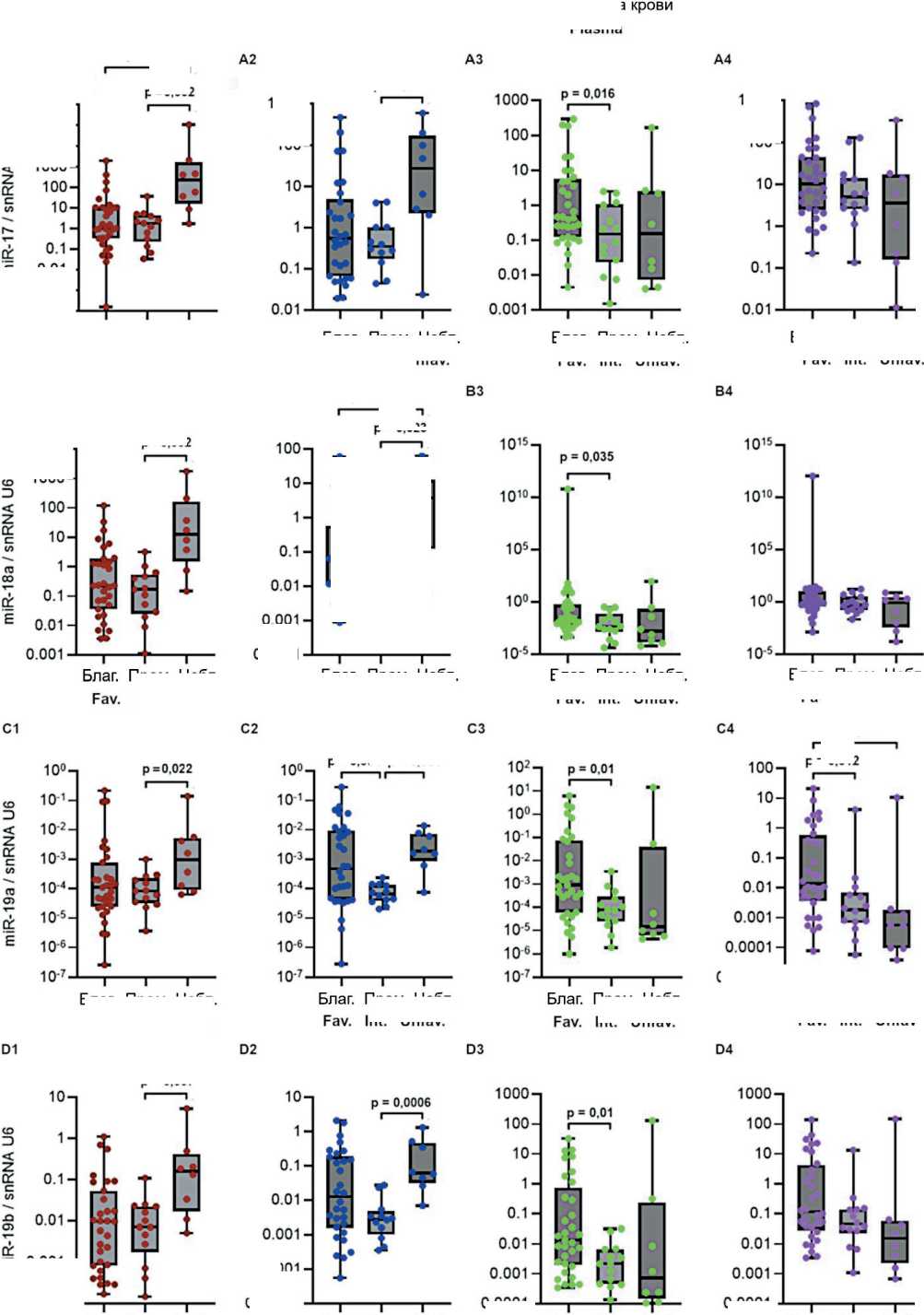
Рис. 2. Уровень экспрессии miR-17-92 (А-F) и miR-203а (G) в костном мозге и лимфоцитах периферической крови в группах пациентов с различным прогнозом заболевания. Данные представлены в виде медианы и 25–75 процентилей, минимального и максимального значений относительного уровня экспрессии. Благоприятный прогноз (благ.) – n=27–33, промежуточный прогноз (пром.) – n=12–15, неблагоприятный прогноз (небл.) – n=8; рисунок выполнен авторами
Fig. 2. Expression levels of miR-17-92 (A-F) and miR-203a (G) in bone marrow and peripheral blood lymphocytes in groups of patients having different prognoses of CML. The data are presented as a median with 25–75th percentiles and minimal and maximal relative expression levels. Favorable prognosis (fav.): n=27–33, intermediate prognosis (int.): n=12–15, and unfavorable prognosis (unfav.): n=8; created by the authors
разной фазой заболевания. Оценка показала значимые различия для экспрессии miR-17 – в костном мозге (p=0,022), в лимфоцитах (p=0,016); для miR-18а – в костном мозге (p=0,046), в лимфоцитах (p=0,022); для miR-20a – в костном мозге (p=0,02), в лимфоцитах (p=0,025). Также выявлены значимые различия для экспрессии miR-19а (p=0,048) и miR-19b (p=0,04) в плазме крови.
Далее проведено попарное сравнение между группами пациентов с ХМЛ, разделенными на основании наблюдаемой фазы заболевания. Оценка показала достоверность различий уровня экспрессии miR-17 (рис. 1А1, 1A2), miR-18а (рис. 1B1, 1B2) и miR-20a (рис. 1E1, 1E2) между группами ХФ и ФА в костном мозге и лимфоцитах крови. Уровень miR в ФА был выше, чем в ХФ, и при БК имел тенденцию к снижению, не доходя до уровня ХФ. Также попарное сравнение показало достоверность различий уровня экспрессии miR-19а (рис.1С3) и miR-19b (рис.1D3) между группами ХФ и БК в плазме крови. Уровень miR-19а и miR-19b при БК был ниже, чем в ХФ.
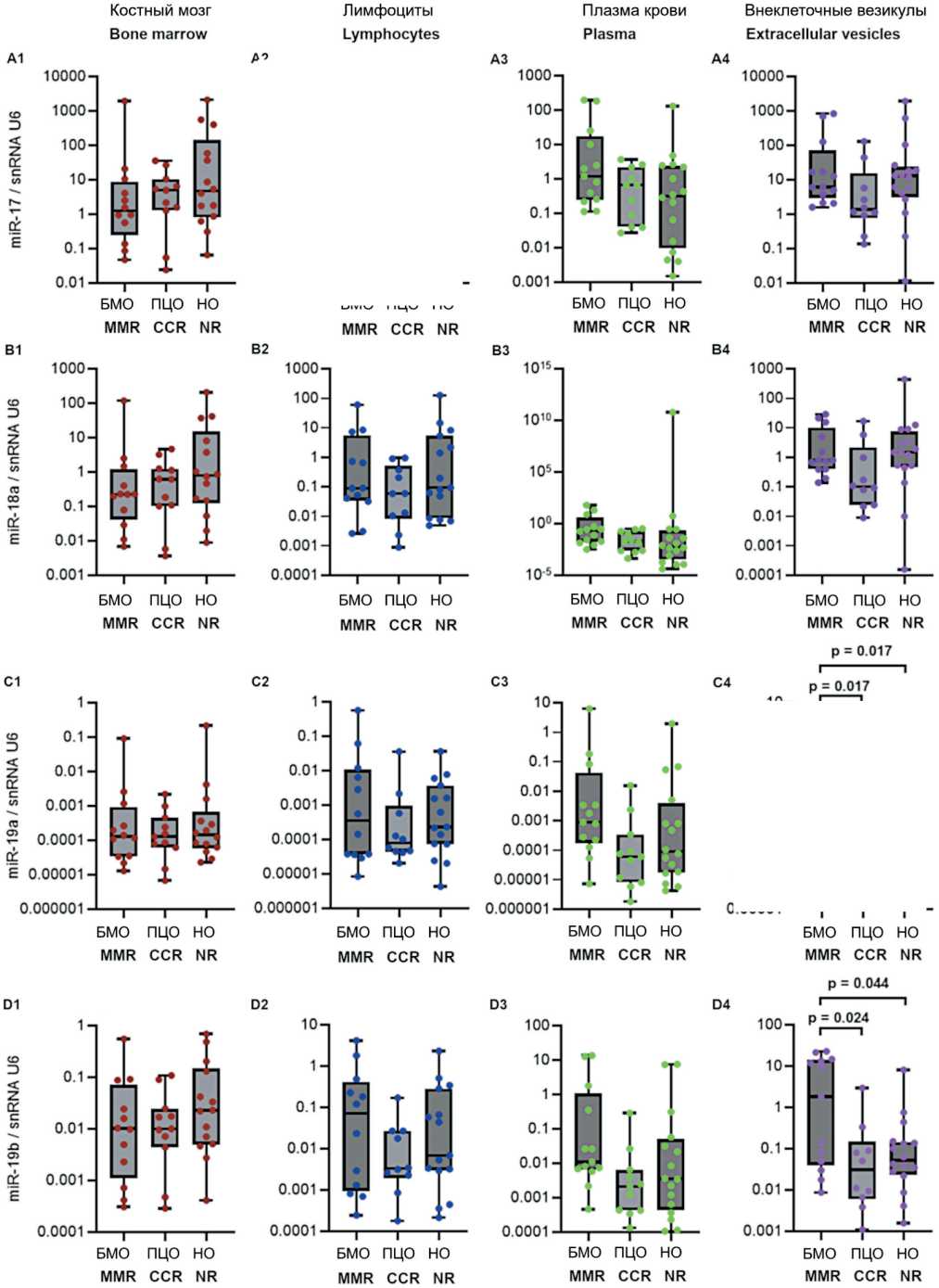
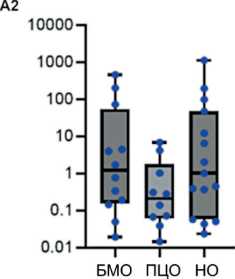
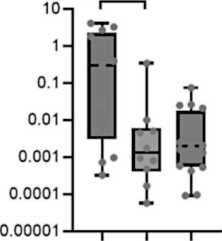
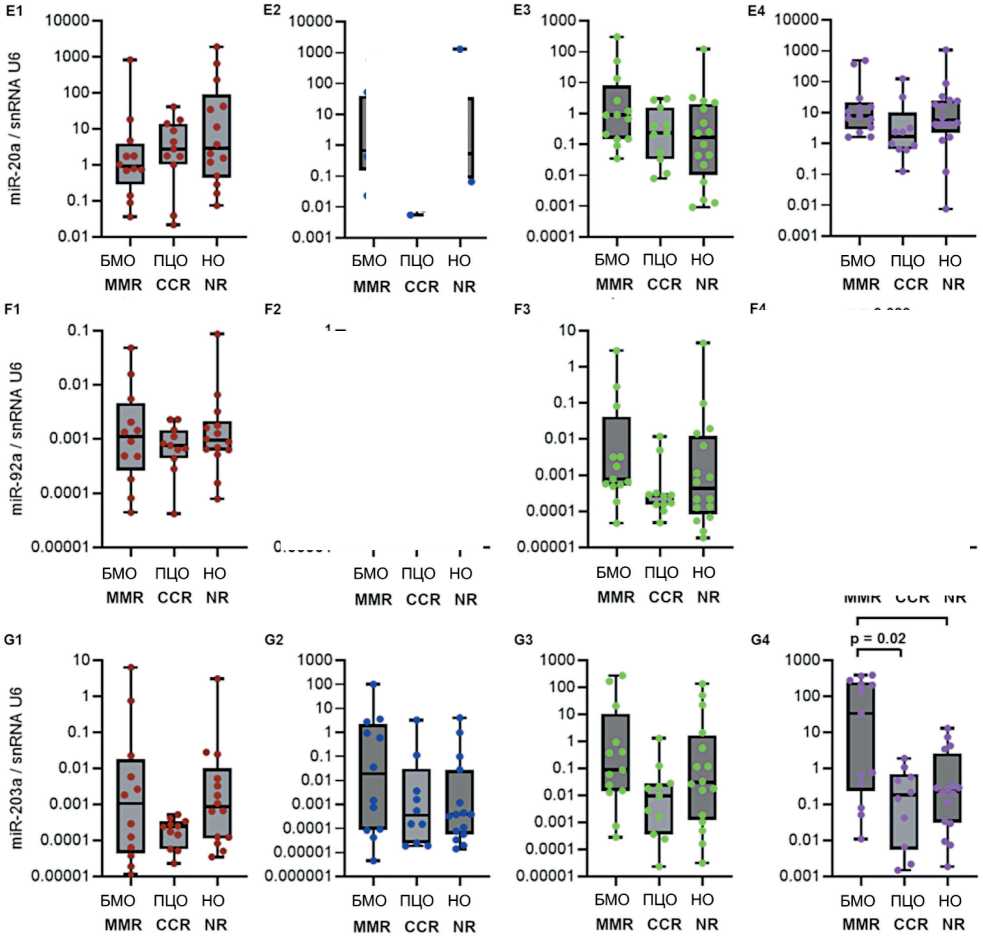
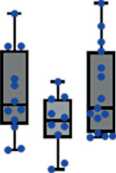
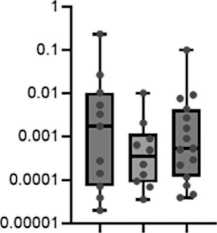
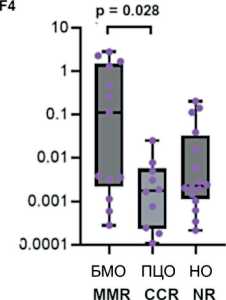
Рис. 3. Уровень экспрессии miR-17-92 (А-F) и miR-203а (G) в костном мозге и лимфоцитах периферической крови в группах пациентов с разным ответом на терапию. Данные представлены в виде медианы и 25–75 процентилей, минимального и максимального значений относительного уровня экспрессии. Большой молекулярный ответ (MMR) – n=12–13, полный цитогенетический ответ (CCR) – n=10–11, нет ответа – n=14–16; рисунок выполнен авторами
Fig. 3. Expression levels of miR-17-92 (A-F) and miR-203a (G) in bone marrow and peripheral blood lymphocytes from groups of patients with different responses to treatment. The data are given as a median with 25–75th percentiles and minimal and maximal relative expression levels. Major molecular response (MMR): n=12–13, complete cytogenetic response (CCR): n=10–11, and no response (NR) to treatment: n=14–16; created by the authors
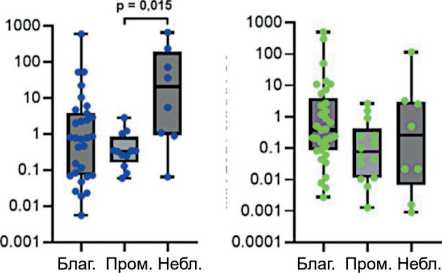
Исследована возможная связь уровня экспрессии miR-17-92 и miR-203а с прогнозом ХМЛ. На рис. 2 представлены значения уровня экспрессии miR-17-92 и miR-92a и miR-203а в костном мозге, лимфоцитах, плазме крови и внеклеточных везикулах у пациентов с разным прогнозом заболевания. Показаны значимые различия для экспрессии miR-17 – в костном мозге (p=0,0028), в лимфоцитах (p=0,041), в плазме крови (p=0,04); для miR-18а – в костном мозге (p=0,0049), в лимфоцитах (p=0,049), в плазме крови (p=0,048); для miR-19a – в костном мозге (p=0,086), в лимфоцитах (p=0,014), в плаз- ме крови (p=0,017), во внеклеточных везикулах (p=0,005); для miR-19b – в костном мозге (p=0,017), в лимфоцитах (p=0,009), в плазме крови (p=0,019); для miR-20a – в костном мозге (p=0,002), в лимфоцитах (p=0,034); для miR-92а – в плазме крови (p=0,007), во внеклеточных везикулах (p=0,081); для miR-203 – в костном мозге (p=0,04), в лимфоцитах (p=0,004), в плазме крови (p=0,018), во внеклеточных везикулах (p=0,008).
Далее проведено попарное сравнение между группами пациентов с ХМЛ, разделенными на основании прогноза заболевания. В костном мозге выявлены значимые различия уровня экспрессии miR-17, miR-18а, miR-19b и miR-20a между группами с благоприятным и неблагоприятным прогнозом (рис. 2А1, 2B1, 2D1, 2E1), а также уровня экспрессии miR-17, miR-18а, miR-19а, miR-19b, miR-20a и miR-203а между группами с промежуточным и неблагоприятным прогнозом (рис. 2А1, 2B1, 2C1, 2D1, 2E1, 2G1).
В лимфоцитах оценка показала значимость различий уровня экспрессии miR-17, miR-18а и miR-20a между группами с благоприятным и неблагоприятным прогнозом (рис. 2A2, 2B2, 2E2), уровня экспрессии miR-17, miR-18а, miR-19а, miR-19b, miR-20a, miR-203а – между группами с промежуточным и неблагоприятным прогнозом (рис. 2A2, 2B2, 2C2, 2D2, 2E2, 2G2) и уровня экспрессии miR-19а и miR-203а (рис. 2C2, 2G2) – между группами с благоприятным и промежуточным прогнозом.
Попарное сравнение выявило значимые различия в плазме крови уровня экспрессии miR-17, miR-18а, miR-19a, miR-19b, miR-92a и miR-203а между группами с благоприятным и нейтральным прогнозом (рис. 2A3, 2B3, 2C3, 2D3, 2F3, 3G3). Во внеклеточных везикулах оценка выявила значимые отличия уровня экспрессии miR-19а и miR-203а в группах с благоприятным прогнозом от групп с нейтральным и неблагоприятным прогнозом (рис. 2C4, 2G4) – уровень miR при благоприятном прогнозе был выше.
Исследована возможная связь уровня экспрессии miR-17-92 и miR-203а с ответом на терапию ХМЛ. На рис. 3 представлены значения уровня экспрессии miR-17-92 и miR-92a и miR-203а в костном мозге, лимфоцитах, плазме крови и внеклеточных везикулах у пациентов с разным ответом на терапию ХМЛ. Выявлены значимые различия для экспрессии miR-19a (p=0,018), miR-19b (p=0,034), miR-92а (p=0,04) и miR-203 (p=0,017) во внеклеточных везикулах. Далее проведено попарное сравнение между группами пациентов с ХМЛ, разделенных на основании достигнутого ответа на терапию. Во внеклеточных везикулах выявлены значимые различия уровня экспрессии miR-19а, miR-19b, miR-92a и miR-203а между группами большого молекулярного ответа (БМО, MMR) и полного цитогенетического ответа (ПЦО, CCR) (рис. 3С4, 3D4, 3F4, 3G4), а также уровня экспрессии miR-19а, miR-19b и miR-203а между группами с БМО (MMR) и отсутствием ответа на терапию (рис. 3С4, 3D4, 3G4). Уровень экспрессии miR-19а, miR-19b, miR-92a и miR-203а был более высоким в группе БМО (MMR) по сравнению с ПЦО (CCR) и группой с отсутствием ответа на терапию.
Обсуждение
Полученные результаты показали, что уровень экспрессии miR-17-92 и miR-203а связан с фазой ХМЛ – характеристикой, определяющей стадию заболевания, и прогнозом ХМЛ. В костном мозге и лимфоцитах крови уровень экспрессии членов кластера miR-17-92 – miR-17, miR-18а и miR-20a оказывается выше у пациентов в ФА по сравнению с ХФ, а также выше при неблагоприятном прогнозе по сравнению с благоприятным и промежуточным прогнозом. Теоретически увеличение уровня экспрессии этих miR может быть маркером начала прогрессирования патологического процесса, перехода к ФА и ухудшения прогноза.
Уровень экспрессии miR-19a и miR-19b в плазме оказывается выше у пациентов с ХФ по сравнению с БК и (среди других miR), выше у пациентов с благоприятным прогнозом по сравнению с промежуточным. Уровень экспрессии miR-19а также выше во внутриклеточных везикулах у пациентов с благоприятным прогнозом по сравнению с промежуточным и неблагоприятным. Возможно, снижение уровня экспрессии этих miR в плазме и внутриклеточных везикулах может быть маркером прогрессирования заболевания и ухудшения прогноза.
Уровень экспрессии miR-203 был достоверно повышен у пациентов с благоприятным прогнозом по сравнению с больными с промежуточным прогнозом в плазме крови и в микровезикулах. Также экспрессия miR-203 оказалась существенной в микровезикулах у пациентов, достигших БМО, по сравнению с больными, у которых удалось получить только ПЦО или вообще не получен ответ на терапию.
Наблюдаемые тенденции прослеживаются и для тех miR, для которых значимых различий не выявлено. Возможно, тенденции станут достоверными закономерностями при увеличении размера выборки.
Согласно нашим данным, увеличение уровня экспрессии miR-17, miR-18а и miR-20a в лимфоцитах и костном мозге происходит в ФА. В литературе сообщалось, что в лейкемических CD34 + клетках при ХМЛ в ХФ, в отличие от фазы БК, повышена экспрессия кластера miR-17-92 по сравнению с нормальными CD34 + клетками. Уровень miR в ФА не исследовался [12].
miR-17, miR-18а и miR-20a имеют между собой структурное сходство, так что возможно ингибировать биосинтез всех трех единственным синтетическим соединением [36]. Возможно, и при прогрессировании ХМЛ на активацию этих трех miR влияет некая единственная молекула, уровень которой повышается при прогрессировании. Известно, что экспрессия кластера miR-17-92 повышена и связана с плохим прогнозом при остром миелоидном лейкозе [14], но относительно ХМЛ в литературе нет данных о прямой связи уровня miR-17-92 с прогнозом заболевания. Более высокий уровень miR-19а и miR-203а в лимфоцитах при неблагоприятном (у пациентов с высоким риском) и благоприятном (у пациентов с низким риском) прогнозе по сравнению с промежуточным (у пациентов с промежуточным риском) может отражать динамические процессы в опухоли.
Что касается miR-19a и miR-19b, одной из их прямых мишеней является фосфатаза PTEN. miR-19a и miR-19b ингибируют экспрессию PTEN путем связывания с 3’-UTR мРНК PTEN и активации передачи сигналов AKT/p-AKT [37]. PTEN является геном-супрессором опухоли при ХМЛ, индуцируя остановку клеточного цикла лейкозных клеток [38]. Наши результаты о снижении уровня экспрессии miR-19a и miR-19b в плазме крови и при БК по сравнению с ХФ и при неблагоприятном прогнозе по сравнению с благоприятным, а также у больных без ответа на терапию по сравнению с больными, достигшими ПЦО и БМО, в микровезикулах в некоторой степени противоречат этим данным.
miR-203 достаточно широко изучена. Известно, что она регулирует уровни ABL1 и BCR::ABL1 и ингибирует пролиферацию клеток. Установлено, что избыточная экспрессия miR-203 снижает уровни слитых белков ABL1 и BCR::ABL1 ABL1-зависимым образом. Исследования показали, что miR-203 может служить новой мишенью для лечения ХМЛ. Има-тиниб провоцирует деметилирование промоторной области miR-203, что приводит к низкой экспрессии целевых генов BCR::ABL1 и потере пролиферации лейкозных клеток. miR-203 может контролировать уровни ABL1 у различных организмов. Далее высказано предположение, что miR-203 действует как супрессор опухоли, целью которого являются киназы как BCR::ABL1, так и ABL1, которая эпигенетически подавляется в клеточных линиях Ph-положительного лейкоза человека [39].


