Кластеризация белковых молекул в водно-солевых растворах лизоцима
Автор: Рожков Сергей Павлович, Горюнов Андрей Сергеевич
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 4 (125), 2012 года.
Бесплатный доступ
Методом электронного парамагнитного резонанса показано, что среднее расстояние между спин-мечеными молекулами лизоцима (35 мг/мл) немонотонно и обратимо изменяется в зависимости от концентраций NaCl в диапазоне от 0 до 3 моль/л параллельно с изменениями гетерогенности раствора. Полученные результаты интерпретируются на основе представления о непрерывных закритических фазовых переходах и формировании различных типов белковых кластеров.
Дипольное взаимодействие спин-меток, кластеры белка, фазовая диаграмма
Короткий адрес: https://sciup.org/14750147
IDR: 14750147 | УДК: 577.322
Текст научной статьи Кластеризация белковых молекул в водно-солевых растворах лизоцима
В последние годы в связи с развитием прецизионных структурных методов исследования сложных микрогетерогенных биологических дисперсий все большее внимание уделяется проблеме возникновения в растворах глобулярных белков надмолекулярных структур – белковых кластеров различного типа. К ним относятся перманентные кластеры белковых макромолекул – олигомеры [31], динамические [25] и мезоскопические кластеры размерами в десятки и сотни нанометров [15], [24], [33], кинетические агрегаты размером в сотни и более нанометров [12], а также плотные жидкие фазы микроскопических размеров с концентрацией белка, на порядок большей, чем средняя по объему [10], [14], [20], зародыши кристаллической фазы, микрокристаллы и, наконец, гель [12]. Изучение таких белковых образований необходимо для решения ряда важных проблем биотехнологии, биологии и медицины, в числе которых кристаллизация белка [21], патогенез заболеваний, связанных с конденсацией белка [18], устойчивость белковых препаратов медицинского назначения [8], [23], регуляция осмотического гомеостаза висцеральных жидкостей [6], [7].
Ярким примером конденсации белка в водной среде является кристаллизации лизоцима в присутствии NaCl. Водно-солевые растворы этого белка подробно изучались разнообразными методами, в том числе с помощью теоретических моделей, с целью выяснить механизмы зародышеобразования и роста кристаллов [10], [12], [14], [20], [31]. При этом были построены фазовые диаграммы растворимости и разработаны экспериментальные и теоретические подходы, позволяющие установить соответствие между разными типами белковых ассоциатов в растворе и участками фазовой диаграммы, где они воз- никают. Это способствовало значительно более глубокому пониманию явления фазового перехода типа жидкость – жидкость и перманентных белковых кластеров размером до 10 нм [31].
Однако результаты, полученные разными методами, не позволяют дать однозначный ответ на самый общий вопрос о том, чем же являются обнаруженные концентрационные неоднородности [17], [22], [24], [31], [33]. Ряд авторов считают их статическими (перманентными, равновесными) кластерами [13], [31]. В то же время другие исследователи считают их динамическими [26], [30]. Поэтому актуальность привлечения дополнительных экспериментальных физических методов исследования концентрационных неоднородностей в белковых растворах, а также дальнейшего анализа данных, получаемых с помощью этих методов, на основе фазовых диаграмм сохраняется, несмотря на прогресс в решении ряда методических проблем, возникающих при изучении явлений кластеризации белков [32].
Уширение линий спектра ЭПР, обусловленное диполь-дипольным взаимодействием спин-меток, связанных с молекулой белка, нередко используют для оценки расстояния между парамагнитными центрами [2], [4], [18], [19]. Уширение можно зарегистрировать в спектрах ЭПР застеклованных матриц белков, если расстояние между парамагнитными центрами не превышает 6–8 нм [2]. Поскольку среднее расстояние между молекулами белка в плотной фазе (или в кластере) составляет 0,6–1 нм [24], то образование кластеров должно приводить к уширению спектров ЭПР спиновых меток. В настоящей работе ставилась задача зарегистрировать надмолекулярные формирования – от белковых кластеров до геля – путем оценки относительных изменений среднего расстояния между макромолекулами методом ЭПР спин-метки. Важной
задачей также было обсуждение полученных результатов на основе представления о разных типах белковых кластеров, возникающих в за-критической области фазовой диаграммы тройной системы вода – белок – соль.
МЕТОДЫ И МАТЕРИАЛЫ
Конъюгацию спиновой метки 4-(2-io-doacetamido)-2,2,6,6-tetramethylpiperidine 1-oxyl (Takeda Chemical Industries) с лизоцимом из белка куриных яиц (Sigma) проводили, следуя методике Лихтенштейна и др. [5]. При этом происходит избирательная модификация остатка аминокислоты гистидина-15 молекулы лизоцима (коэффициент посадки – 0,8) [5]. Для получения растворов с различной ионной силой в исходный раствор белка, приготовленного на основе 0,01 М фосфатного буфера, рН 6,4, добавлялись разные количества NaCl. Конечная концентрация белка в образцах составляла 35 мг/мл. Спектры ЭПР регистрировались с помощью радиоспектрометра Bruker EMX 6/1 (модуляция 100 кГц, амплитуда 1 Гс). Перед снятием спектров образцы выдерживали 6–8 часов при 20 °C для формирования возможной структурной организации раствора. При температуре 20 °C оценивали времена корреляции τ с вращения метки, связанной с белком, для разных концентраций соли на основе модели быстрого вращения радикала [4], используя отношение амплитуд низкопольной и центральной линии спектра, а также ширину центральной линии.
Уширение линий спектра ЭПР, обусловленное диполь-дипольным взаимодействием спиновых меток, исследовалось в замороженных (77 К) растворах спин-меченого белка. Температура 77 К в образце устанавливалась после мгновенного помещения кюветы в наполненный жидким азотом сосуд дьюара резонатора. Показано [34], что концентрационные неоднородности в растворах макромолекул сохраняются при мгновенном замораживании, поскольку лимитирующим фактором их сохранения является трансляционная диффузия молекул, сопряженная с преодолением достаточно больших потенциальных барьеров.
Амплитуду крайних компонент спектра d1 и центральной компоненты d и их отношение определяли для образцов с разным содержанием соли при 77 К в зависимости от СВЧ-мощности. Параметр d1/d, чувствительный к диполь-дипольному взаимодействию нитроксильных радикалов, может быть использован при концентрациях нитроксильных радикалов более 7 х 10-3 М для характеристики изменений среднего расстояния между спин-метками [4] и, соответственно, между спин-мечеными молекулами белков в условиях одного центра посадки спин-метки на белке. При понижении концентрации нитроксильных радикалов параметр d1/d стано- вится слабо чувствителен к расстоянию между ними [2], поэтому при концентрации радикалов менее 7 х 10-3 М для оценки их взаимодействия может быть использована форма кривой насыщения СВЧ-сигнала [4].
РЕЗУЛЬТАТЫ
Зависимости амплитуды центральной линии спектра ЭПР спин-меченого лизоцима от мощности СВЧ поля, представленные на рис. 1 для разных концентраций NaCl при 77, позволяют разбить рассматриваемый диапазон концентрации соли m3 (М/л) на три части по характеру насыщения сигнала: (1) 0 < m3< 0,15 М/л; (2) 0,3 М/л < m3< 1,5 М/л; (3) m3 > 1,5 М/л. При малых концентрациях соли (1) кривая насыщения менее пологая, чем в контроле (растворе белка без NaCl), при средних концентрациях (2) – более пологая, чем в контроле, в условиях высаливания (3) – снова менее пологая. Более пологие кривые насыщения отвечают и более близкому расположению спиновых меток [4]. Это позволяет использовать форму кривой насыщения для контроля изменений среднего расстояния взаимодействия между спиновыми метками l . Следовательно, можно полагать, что в 1-й части диапазона концентрации соли среднее расстояние l между спин-метками больше, чем в контроле, во 2-й – меньше, в 3-й – снова больше.
Увеличение СВЧ-мощности приводит к изменению параметров сигнала ЭПР и позволяет выявить различия между величинами d1/d для растворов спин-меченого лизоцима с разной концентрацией соли при 77 К. Если в условиях без насыщения (0,63 мВт) зависимость d1/d от концентрации соли проявляется слабо, то в условиях умеренного насыщения (12,4 мВт) зависимость становится более выраженной (рис. 2). Поскольку d1/d ~ l -1, то данные, представленные на рис. 1 и 2, указывают, что с ростом концентрации соли до 0,15 М среднее расстояние l между связанными с белком спиновыми метками увеличивается, затем уменьшается и вновь возрастает по достижении концентрации NaCl 3 М, которая является высаливающей.
Эти результаты, а также тот факт, что при общей концентрации спин-меток (и спин-мече-ного белка) 2,5 х 10-3 М параметр d 1 /d сохраняет чувствительность к изменению условий и СВЧ-мощности, свидетельствуют о том, что в растворе лизоцима образуются концентрационные неоднородности, в составе которых локальная концентрация превышает 7 х 10-3 М.
Образование вязкого белого геля в условиях высаливания лизоцима – известный эффект [12], [20], который наблюдали и мы еще до погружения образца в жидкий азот. Образец белка при добавлении 3 М NaCl мгновенно превращался в гель и оставался в состоянии геля белого цвета в течение 4 суток при 20 °С. Образцы белка,
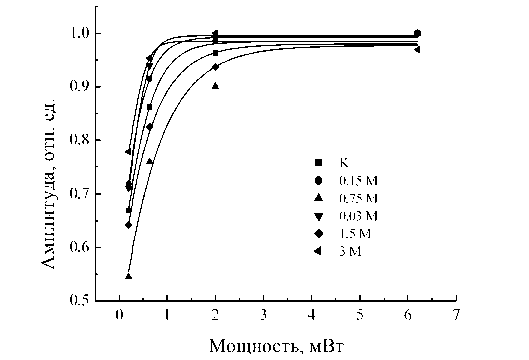
Рис. 1. Нормированные значения амплитуд центральной компоненты спектра ЭПР спин-меченого лизоцима в зависимости от насыщающей СВЧ-мощности при разных концентрациях NaCl в растворе белка
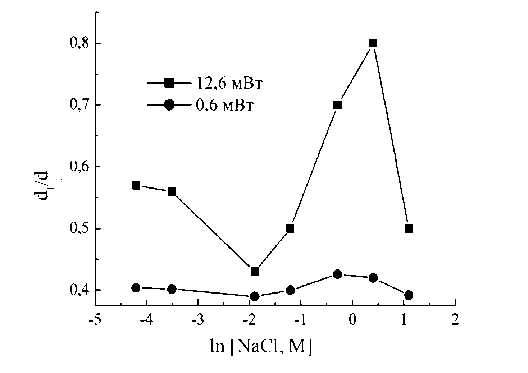
Рис. 2. Зависимость параметра d1/d от концентрации NaCl (М) как ln(NaCl) при значении СВЧ-мощности 12,6 мВт – (1) и 0,6 мВт – (2). Размер символа соответствует стандартной погрешности содержавшие менее 0,3 М NaCl, сохраняли прозрачность. В изначально прозрачных образцах, содержавших от 0,3 до 1,5 М NaCl, через 4 суток наблюдалась выраженная опалесценция, которая была тем более заметна, чем выше исходная концентрация NaCl. Постепенное уменьшение расстояния между молекулами белка в диапазоне 0,3–1,5 М NaCl, выявляемое на основе анализа спектров ЭПР спин-меченого лизоцима, можно связать с проявлением сильного взаимодействия белок – белок, которое, как предполагается, в этих условиях может приводить к формированию различных агрегатов, кластеров плотной фазы и даже зародышей кристаллической фазы [12], [14], [20]. Однако поскольку зародыши новой фазы обычно появляются лишь через несколько суток, следует предположить, что обнаруженное по спектрам ЭПР через 6–8 часов уменьшение расстояния в диапазоне 0,3– 0,8 М NaCl, поначалу не сопровождающееся визуально наблюдаемой опалесценцией, обусловлено формированием белковых кластеров и/или агрегатов вследствие потери системой термодинамической устойчивости.
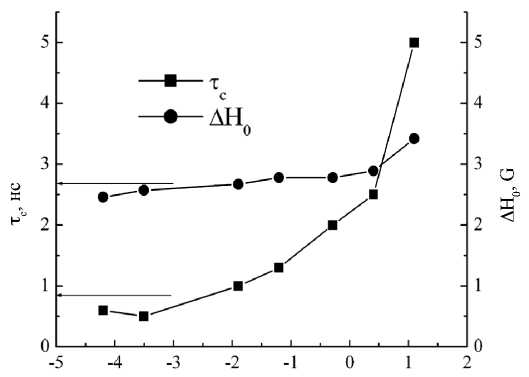
На рис. 3 эффективное время корреляции вращения спиновой метки, определяющееся отношением амплитуд линий спектра ЭПР [4], представлено в зависимости от концентрации соли при 20 °С. Как время корреляции, так и ширина центральной линии спектра монотонно возрастают во всем рассматриваемом диапазоне солей. Однако в растворе без соли время корреляции (горизонтальная линия на рис. 3) больше, чем в низкосолевых растворах. Поскольку в спектрах ЭПР в первую очередь проявляется наиболее быстрый тип подвижности спиновой метки, эти изменения времени корреляции отражают изменения микровязкости белковой глобулы в области локализации метки.
ln [NaCl, M]
Рис. 3. Зависимости изменения времени корреляции ( τ с) спин-метки, связанной с молекулой лизоцима, и ширины центральной компоненты ( Δ H0) спектра ЭПР спин-метки от концентрации NaCl. Горизонтальными отрезками показаны уровни τ с и Δ H0 в растворе белка без соли.
Размер символа соответствует стандартной погрешности
Первые две точки обеих зависимостей рис. 3 лежат ниже уровня значений, соответствующих раствору белка без соли (пунктир). Благодаря этому можно сделать вывод, что при концентрациях менее 0,05 М NaCl имеет место некоторое снижение микровязкости в области спин-метки, которое может быть связано с разрыхлением структуры белковой глобулы в этих условиях. Однако в дальнейшем значения обоих параметров возрастают и превышают уровень бессолевого раствора, что указывает на постепенную солью индуцируемую стабилизацию структуры белка в области спин-метки. Весьма вероятно, эти изменения сопряжены в том числе с усилением взаимодействия между молекулами белка при образовании высокосолевых мезоскопических кластеров, а впоследствии и при формировании зародышей кристаллической фазы.
Вблизи верхней границы рассматриваемого диапазона – при 3 М NaCl в условиях высали- вания при 20 °С в спектре ЭПР спин-меченого лизоцима – появляется широкая линия, и время корреляции существенно увеличивается. Это может указывать на сильное увеличение вязкости в системе, поскольку аналогичная линия наблюдается, например, в растворе 35 % сахарозы [3]. Однако среднее расстояние между спиновыми метками и молекулами белка при этом не уменьшается, как можно было бы ожидать, а остается на том же уровне, что и при физиологических концентрациях соли (рис. 2). Это говорит об отсутствии кристаллической фазы в геле и о том, что гель является целлюлярной, достаточно рыхлой структурой.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 4 представлена фазовая диаграмма раствора лизоцима, которая наряду с линиями бинодалей (1–3), полученными ранее экспериментально для фиксированных концентраций соли [20], содержит предлагаемую нами линию бинодали для концентрации 3 М NaCl (кривая 4). С увеличением концентрации соли критическая точка бинодали и спинодали (рис. 4) смещается все выше по оси температур, и область, ранее являвшаяся однофазной, оказывается на границе бинодали. При этом происходит фазовый переход типа жидкость – жидкость, связанный с образованием плотной и разбавленной фаз [20]. Соответственно, в растворах лизоцима при малых концентрациях NaCl бинодаль окажется в области низких температур, а с ростом концентрации соли до 1,5 М при содержании белка 35 мг/мл она сдвинется к 20 °С. При дальнейшем повышении концентрации соли до 3 М NaCl в результате быстрого кинетического процесса спинодального распада [14] вместо концентрированной, но прозрачной фазы (или микрокапель плотной фазы) образуется вязкий гель (см. рис. 1 в работе [12]).
Обычно в присутствии высоких концентраций солей раствор белка теряет термодинамическую устойчивость. Переход в устойчивое состояние может приводить к образованию зародышей кристаллической фазы или вязкого геля, установление равновесия в котором требует значительного времени. Образование вязкого геля белого цвета сопровождается сильной иммобилизацией спиновой метки относительно белка, которая приводит к появлению второй (широкой) линии в спектре ЭПР и к резкому возрастанию времени корреляции (рис. 3). Однако сохраняющееся сравнительно большое расстояние между молекулами белка (рис. 1 и 2) позволяет предположить, что пространственная сетка геля при этом формируется в виде ячеистой фрактальной структуры из белковых кластеров за счет межмолекулярных взаимодействий различной природы [14]. Возможно, часть кластеров появляется в результате некоторого разворачивания структуры белковой молекулы.
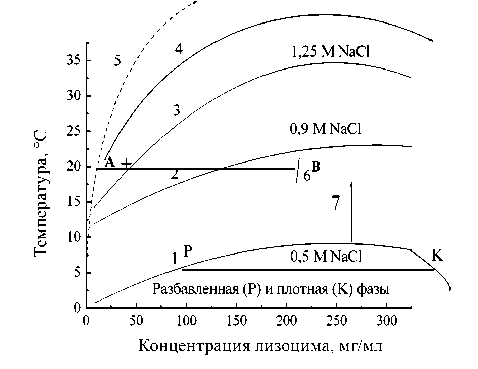
Рис. 4. Схематическая фазовая диаграмма раствора лизоцима: 1–3 – экспериментальные бинодали как линии равновесия фаз при соответствующей концентрации NaCl согласно [20]; 4 – предполагаемое положение бинодали при концентрации соли 3 М NaCl; 5 – линия растворимости белка при 0,5 М NaCl согласно [20]; 6 – предполагаемая линия гелеобразования при 3М NaCl. А и В – концентрация белка в разбавленной фазе и в геле соответственно;
7 – предполагаемая квазиспинодаль для кривой 1. Критической точке соответствует около 270 мг/мл белка.
Состояние исследуемого раствора лизоцима на фазовой диаграмме показано крестиком
В области физиологических концентраций соли фазовое разделение в наших экспериментах не обнаруживается. Следовательно, экспериментальная точка, соответствующая 20 ºС и 35 мг/мл лизоцима, располагается выше линии бинодали. При этом изменения концентрации соли во всем диапазоне ее низких значений, включая физиологические, заметно сказываются на диполь-ди-польном взаимодействии между спин-метками и, таким образом, на среднем расстоянии между молекулами белка. Это, вероятно, связано с существованием концентрационных неоднородностей. Они обнаруживаются и другими методами: светорассеяния, МУРР и МУНР – также в заведомо однофазной области – в окрестности линии растворимости, то есть выше и линии би-нодали, и температуры критической точки [24], [31], и интерпретируются как белковые кластеры. Мы предполагаем, что добавление NaCl вызывает постепенное замещение одних кластеров (1-го типа с размерами до 10 нм), которые доминируют в растворах без соли [31], другими кластерами (2-го типа с размерами около 100 нм), появляющимися при добавлении солей [24].
Данные рис. 3 позволяют предположить, что такой переход от одних кластеров к другим должен сопровождаться постепенным переходом белковой глобулы к более рыхлой структуре с повышенной гибкостью. Это может быть обусловлено тем, что по мере роста концентрации NaCl взаимодействие ионов Cl- с центрами сорбции белковой глобулы усиливается, а в связи с этим увеличивается осмотическое давление в водно-белковой матрице, способствующее ее разрыхлению из-за снижения удельной поверхностной энергии. Считается, что анионы хлора, помимо участия в экранировке положительно заряженных групп, также активно сорбируются специфическими неполярными участками молекул лизоцима и других белков благодаря устройству своей электронной оболочки и способности к поляризации [11]. Число таких адсорбированных анионов хлора может достигать десятка [27]. Однако при больших концентрациях соли, когда центры адсорбции насыщены, увеличение концентрации солей ведет к росту удельной поверхностной энергии вследствие эффектов предпочтительной гидратации [9].
Зависимость критической температуры системы вода – белок – соль от критического состава – соотношения молярных концентраций белка m2 и соли m3(X = (m2/m3)кр) (рис. 5) показывает, что и в области закритических состояний могут возникать условия для фазового перехода типа жидкость – жидкость [28], [29], который реализуется как флуктуационное мезофазное состояние. Это означает, что максимальные флуктуации концентрации будут иметь место в области квазиспинодали фазовой диаграммы в закритической области, то есть там, где и обнаруживаются экспериментально метастабильные мезоскопические кластеры белков [24].
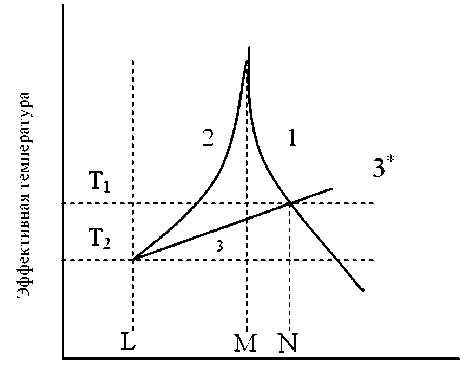
X = (m2/m3)кр
Рис. 5. Линии критических точек, устанавливающих соответствие критического состава X = (m2/m3)кр и эффективной температуры Т. Кривые 1 и 2 построены для концентраций соли, при которых производная от коэффициента активности соли по концентрации отрицательна и положительна соответственно.
При (m2/m3) > N квазиспинодаль (кривая 3*) выходит в закритическую область фазовой диаграммы.
При (m2/m3) < N кривая 3 может характеризовать положение линии бинодали [29]. Температуре T2 соответствует тройная точка, где (m2/m3) = L = 2/ ν и ν – число адсорбированных на белке анионов электролита
В соответствии с закономерностями термодинамики непрерывных фазовых переходов в закритической области система в целом является однородной, но при этом она постепенно теряет свойства двухфазной системы [1]. Эта трансформация может занимать значительную область фазовой диаграммы вдоль квазиспи-нодали и представлять собой область закрити-ческих фазовых переходов, захватывая линию растворимости. В этом случае флуктуирующая смесь кластеров белка является остаточным явлением низкотемпературного двухфазного состояния системы и представляет собой особое макроскопически однородное мезофазное состояние.
С другой стороны, если есть квазиспинодаль, то, вероятно, существует и квазибинодаль [1], то есть возможны такие условия, при которых во внешне однородных растворах будут существовать метастабильные белковые кластеры. Можно предположить, что кластеры – олигомеры лизоцима размерами до 10 нм являются гелеподобными квазичастицами [24], а мезоскопические кластеры – частью фрактальных агрегатов гелевой фазы. Поскольку гель образуется мгновенно после добавления избытка соли, естественно предположить, что еще до момента гелеобразования в растворе уже существует некоторая динамическая структура, имеющая отношение к мезоскопической кластерной организации. В области квазиспинодали в некотором диапазоне температур кластеры двух типов могут существовать одновременно, хотя и не находиться при этом в равновесии.
ЗАКЛЮЧЕНИЕ
Таким образом, наблюдаемые методом спиновой метки при комнатных температурах солью индуцированные изменения среднего расстояния между молекулами лизоцима в области физиологических концентраций NaCl, сопровождаемые увеличением гибкости молекул белка, могут быть обусловлены прохождением системы вода – белок – электролит области квазиспино-дали ее фазовой диаграммы. В этом состоянии пониженной термодинамической устойчивости система при макроскопической однородности будет представлять собой особое мезофазное состояние – смесь флуктуационных кластеров обеих граничных фаз – золя и геля. При концентрациях соли выше физиологических в растворе белка развивается термодинамическая неустойчивость, приводящая к формированию различных неустойчивых надмолекулярных структур типа фрактальных кластеров белка и зародышей кристаллической фазы. В области «высаливающих» концентраций соли имеет место фазовый переход золь – гель, приводящий систему к термодинамически устойчивому состоянию геля.
Список литературы Кластеризация белковых молекул в водно-солевых растворах лизоцима
- Базаров И. П. Термодинамика. М.: Высш. шк., 1983. 344 с.
- Вассерман А. М., Коварский А. Л. Спиновые метки и зонды в физикохимии полимеров. М.: Наука, 1986. 246 с.
- Кяйвяряйнен А. И., Рожков С. П. Сравнительный анализ времен корреляции молекул лизоцима и лизоцима в комплексе с ингибитором в области физиологических температур методом спиновой метки//Биофизика. 1987. Т. 32. № 1. С. 22-25.
- Лихтенштейн Г. И. Метод спиновых меток в молекулярной биологии. М.: Наука, 1974. 256 с.
- Лихтенштейн Г. И., Ахмедов Ю. Д., Иванов Л. В., Криницкая Л. А., Коханов Ю. В. Изучение молекул лизоцима методом спиновых меток//Молекулярная биология. 1974. T. 8. № 1. C. 48-57.
- Рожков С. П. Трехкомпонентная система вода-биополимер-ионы как модель молекулярных механизмов осмотического гомеостаза//Биофизика. 2001. Т. 46. № 1. С. 53-59.
- Рожков С. П. Критические явления, фазовые равновесия и структурно-температурный оптимум гомеостаза в модельной системе вода-биополимер-электролит//Биофизика. 2005. Т. 50. № 2. С. 115-122.
- Семенченко В. К. Избранные главы теоретической физики. М.: Просвещение, 1966. 396 с.
- Ahrer K., Buchacer A., Iberer G., Jungbauer A. Thermodynamic stability and formation of aggregates of human immunoglobulin G characterized by differential scanning alorimetry and dynamic light scattering//J. Biochem. Biophys. Methods. 2006. Vol. 66. № 1-3. P. 73-86.
- Arakawa T., Timasheff S. N. Mechanism of protein salting in and salting out by divalent salts: balance between hydration and salt binding//Biochemistry. 1984. Vol. 23. № 25. P. 5912-5923.
- Asherie N. Protein crystallization and phase diagrams//Methods. 2004. Vol. 34. № 3. P 266-272.
- Bostrom M., Williams D. R. M., Ninham B. W. Specific ion effects: why the properties of lysozyme in salt solutions follow a Hofmeister series//Biophys. J. 2003. Vol. 85. № 2. P. 686-694.
- Dumetz A. C., Chockla A. M., Kaler E. W., Lenhoff A. M. Protein phase behavior in aqueous solutions: crystallization, liquid-liquid phase separation, gels, and aggregates//Biophys. J. 2008. Vol. 94. № 2. P. 570-583.
- Fukasawa T., Sato T. Versatile application of indirect Fourier transformation to structure factor analysis: from X-ray diffraction of molecular liquids to small angle scattering of protein solutions//Phys. Chem. Chem. Phys. 2011. Vol. 13. № 8. P. 3187-3196.
- Georgalis Y., Umbach P., Soumpasis D. M., Saenger W. Dynamic and microstructure formation during nucleation of lysozyme solutions//J. Am. Chem. Soc. 1998. Vol. 120. № 22. P. 5539-5548.
- Glico O., Pan W., Katsonis P., Neumaier N., Galkin O., Weinkauf S., Vekilov P. G. Metastable liquid clusters in super and undersaturated protein solutions//J. Phys. Chem. B. 2007. Vol. 111. № 12. P. 3106-3114.
- Hill S. E., Robinson J., Matthews G., Musсhol M. Amyloid protofibrils of lysozyme nucleate and grow via oligomer fusion//Biophys. J. 2009. Vol. 96. № 9. P. 3781-3790.
- Igarashi K., Azuma M., Kato J., Ooshima H. The initial stage of crystallization of lysozyme: a differential scanning calorimetric (DSC) study//J. Cryst. Growth. 1999. Vol. 204. № 1-2. P. 191-200.
- Ionita P., Caragheorgheopol A., Gilbert B. C., Chechik V. Dipole-dipole interactions in spin-labeled Au nanoparticles as a measure of interspin distances//J. Phys. Chem. B. 2005. Vol. 109. № 9. P. 3734-3742.
- Mevorat-Kaplan K., Veiner L., Sheves M. Spin-labeling of Natronomonas pharaonis halorodopsin: Probing the cysteine residues environment//J. Phys. Chem. B. 2006. Vol. 110. № 17. P. 8825-8831.
- Muschol M., Rozenberger F. Liquid-liquid phase separation in supersaturated lysozyme solutions and associated precipitate formation/crystallization//J. Chem. Phys. 1997. Vol. 107. № 6. P. 1953-1962.
- Nanev C. N. On slow protein crystal nucleation: cluster-cluster aggregation on diffusional encounters//Cryst. Res. Technol. 2009. Vol. 44. № 1. P. 7-12.
- Niimura N., Minezaki Y., Ataka M., Katsura T. Aggregation in supersaturated lysozyme solution studied by time-resolved small angle neutron scattering//J. Cryst. Growth. 1995. Vol. 154. № 1-2. P. 136-144.
- Nishi H., Miyajima M., Nakagami H., Noda M., Uchiyama S., Fukui K. Phase separation of an IgG1 antibody solution under a low ionic strength condition//Pharm. Res. 2010. Vol. 27. № 7. P. 1348-1360.
- Pan W., Vekilov P. G., Lubchenko V. Anomalous mesoscopic phases in protein solutions//J. Phys. Chem. B. 2010. Vol. 114. № 22. P. 7620-7630.
- Piazza R. Protein interacton and association: an open challenge for colloid science//Curr. Opin. Colloid Interface Sci. 2004. Vol. 8. № 6. P 515-522.
- Porcar L., Falus P., Chen W.-R., Faraone A., Fratini E., Hong K., Baglioni P., Liu Y. Formation of the dynamic clusters in concentrated lysozyme protein solutions//J. Phys. Chem. Lett. 2010. Vol. 1. № 1. P. 126-129.
- Retailleau P., Ries-Kautt M., Ducruix A. No salting in of lysozyme chloride observed at low ionic strength over a large range of pH//Biophys. J. 1997. Vol. 73. № 4. P. 2156-2163.
- Rozhkov S. P. Phase transitions and precrystallization processes in a water-protein-electrolyte system//J. Cryst. Growth. 2004. Vol. 273. № 1-2. P. 266-279.
- Rozhkov S. P., Goryunov A. S. Effects of inorganic salts on the structural heterogeneity of serum albumin solutions//Eur. Biophys. J. 2000. Vol. 28. № 8. P. 639-645.
- Rozhkov S. P., Goryunov A. S. Thermodynamic study of protein phases formation and clustering in model water-protein-salt solutions//Biophys. Chem. 2010. Vol. 151. № 1-2. P. 22-28.
- Shukla A., Mylonas E., Di Cola E., Finet S., Timmins P., Narayanan T., Svergun D. I. Absence of equilibrium cluster phase in concentrated lysozyme solutions//Proc. Natl. Acad. Sci. USA. 2008. Vol. 105. № 13. P. 50755080.
- Stradner A., Cardinaux F., Schurtenberger P. A small-angle scattering study on equilibrium clusters in lysozyme solutions//J. Phys. Chem. B. 2006. Vol. 110. № 42. P. 21222-21231.
- Trewhella J. The different views from small angles//Proc. Natl. Acad. Sci. USA. 2008. Vol. 105. № 13. P. 4967-4968.
- Vekilov P. G. Metastable mesoscopic phases in concentrated protein solutions//Ann. N. Y. Acad. Sci. 2009. Vol. 1161. № 4. P. 377-386.
- Weber S., Wolff T., von Bunau G. Molecular mobility in liquid and in frozen micellar solutions. EPR spectroscopy of nitroxide free radicals//J. Colloid Interface Sci. 1996. Vol. 184. № 1. P. 163-169.


