Клеточно-межклеточные взаимоотношения в различных отделах аорты после реконструктивных операций при коарктации у детей первого года жизни
Автор: Тодоров Сергей Сергеевич
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Врожденные пороки сердца
Статья в выпуске: 2 т.21, 2017 года.
Бесплатный доступ
Цель Оценка клеточно-межклеточных взаимоотношений в различных отделах аорты у детей первого года жиз ни после реконструктивных операций при коарктации. Методы Изучены истории болезни и протоколы вскрытий трех умерших новорожденных после оперативного лече ния коарктации аорты. Операции проводились у детей на 8, 10, 15-е сут. после рождения. В двух наблюдениях выполнялись резекция участка сужения просвета аорты, перевязка Боталлова протока, формирование прямого анастомоза аорты. В одном наблюдении использовалась закрытая баллонная дилатация аорты в месте сужения. На вскрытии изучались размеры сердца, периметр аорты в местах операций, в различных отделах аорты. Фрагменты стенок отделов аорты вырезались, фиксировались в 10% нейтрального формалина, после обычной проводки изготавливались гистологические срезы с последующей окраской их гематоксилином-эозином, пикрофуксином по Ван Гизону, на эластические волокна резорцин-фуксином, по Хочкиссу для выявления мукополисахаридов. Результаты Клеточно-межклеточные взаимоотношения в различных отделах аорты после реконструктивных операций при коарктации у детей первого года жизни имеют морфологические особенности. Морфометрическое изучение сердца и аорты показало значительное увеличение объема и массы сердца по сравнению с нормальными величинами за счет гипертрофии миокарда правого и левого желудочков сердца. Неравномерное сужение просветов аорты было наиболее выраженно в дуге и перешейке по сравнению с восходящим и грудным отделами аорты. Морфологическое исследование стенки аорты в зонах сужений показало наличие коагуляционного некроза, лизиса эластических и коллагеновых волокон с окружающей гиперплазией гладких миоцитов новообразованными тонкостенными сосудами капиллярного типа. Вне зоны коарктации наиболее значимые изменения были в стенках дуги и восходящего отдела аорты с развитием в них гипоэластоза, неравномерного накопления кислых мукополисахаридов. Выводы При коарктации аорты у детей первого года жизни наблюдается дилатация восходящего отдела с компен саторной гипертрофией сердца, в местах сужений развивается мышечно-фиброзная ткань, богатая гладкими миоцитами, новообразованными тонкостенными сосудами. Мы считаем, что риск развития рестенозов зависит от распространенности и степени выраженности пролиферативных процессов клеточных элементов аорты, что позволяет считать оправданным проведение ранних оперативных вмешательств для предотвращения необратимых деструктивных изменений.
Аорта, коарктация, хирургическое лечение, дети, морфология
Короткий адрес: https://sciup.org/142140796
IDR: 142140796 | DOI: 10.21688-1681-3472-2017-2-52-59
Текст научной статьи Клеточно-межклеточные взаимоотношения в различных отделах аорты после реконструктивных операций при коарктации у детей первого года жизни
Врожденные пороки сердца (ВПС) и сосудов у новорожденных и детей первого года жизни остаются сложной и актуальной проблемой в современной кардиологии, кардиохирургии. В структуре детской смертности врожденные пороки сердца и сосудов занимают лидирующие позиции [1–4].
Среди врожденных заболеваний сердца и сосудов детей первого года жизни особое место занимает коарктация аорты (КА), которая встречается в 5–8% всех ВПС [5–7]. Отмечено, что КА может быть изолированной, сочетаться с дефектом межжелудочковой перегородки сердца или другими врожденными пороками сердца [6].
В настоящее время разрабатываются методики хирургического лечения КА, дискутируются сроки их проведения. Среди хирургических методик при КА используют реконструкцию аорты в месте сужения с наложением анастомоза «конец-в-конец», истмоплас-тику в области левой подключичной артерии. Широкое признание кардиохирургов получил метод баллонной дилатации аорты при коарктации аорты [4].
Однако при всем многообразии используемых методик лечения КА часто возникают осложнения в виде рекоарктации (15–30%), аневризм (4–37%), илеофемо-рального тромбоза (4–6%), аллергических реакций на введение контрастных веществ [3, 4, 6].
Противоречивыми остаются вопросы, связанные со сроками проведения хирургических операций при КА. Некоторые авторы полагают, что оптимальным для операций при КА является возраст, в котором морфологические изменения носят обратимый характер, то есть в 12–15 лет, до полового созревания, на аорте достаточного размера [4]. По мнению И.И. Семенова [5], выполнение ранних операций при КА увеличивает возможность развития рекоарктации аорты. По данным других исследований, хирургические вмешательства в течение первых 4 мес. жизни детей при КА могут восстановить нормальный кровоток в аорте и способствовать улучшению эластических свойств ее стенки [8–11, 14]. На решение данных вопросов может повлиять выяснение клеточно-межклеточных взаимоотношений в стенке аорты при коарктации аорты.
Считается, что ремоделирование рестенотических, атеросклеротических поражений аорты и ее ветвей возникает при изменении фенотипа гладких миоцитов, что, в свою очередь, ведет к активации цитокинов, факторов роста клеток [12, 15]. В настоящее время ус- тановлены морфологические варианты гладких миоцитов артерий: эпителиоидные (ромбоидные) и веретеновидные [13].
Морфологические изменения, возникающие в стенке аорты после операций, малоизучены, не определена роль экстрацеллюлярного (внеклеточного) матрикса в регенерации и ремоделировании клеточно-волокнистых элементов стенок магистральных сосудов.
В этой связи целью исследования была оценка клеточно-межклеточных взаимоотношений в различных отделах аорты у детей первого года жизни после реконструктивных операций при коарктации.
Методы
Изучены истории болезни и протоколы вскрытий трех умерших новорожденных после оперативного лечения КА. Возраст детей 1–3 мес. жизни, среди них двое мальчиков, одна девочка. У всех женщин во время беременности не было выявлено признаков акушерско-гинекологической патологии. Все новорожденные родились на 39–40-й нед. беременности, были доношенными, зрелыми, массой тела от 2 800 до 3 500 г, оценкой по шкале Апгар 7–8 баллов.
Клинические проявления ВПС и сосудов обнаруживались у детей уже на 3–5-е сут. после рождения в виде появления и дальнейшего нарастания признаков прогрессирующей сердечно-сосудистой недостаточности. Во всех случаях новорожденных консультировали кардиолог, кардиохирург, после уточнения ультразвуковых признаков ВПС и аорты рекомендовано хирургическое вмешательство.
Операции при КА проводились у детей на 8, 10, 15-е сут. после рождения. В двух наблюдениях выполнялись резекция участка сужения просвета аорты, перевязка Боталлова протока, формирование прямого анастомоза аорты. В одном наблюдении использовалась закрытая баллонная дилатация аорты в месте сужения.
После оперативного лечения КА у детей отмечались явления нарастающей сердечной и дыхательной недостаточности. Смерть наступала через 1,5–2 мес. в связи с присоединением и развитием двусторонней пневмонии.
Все найденные морфологические изменения регистрировались, маркировались, проводилась морфометрия, макрофотосъемка. Полученные данные подвергались математической обработке с помощью пакета данных Statistica 6.
После фиксации в 10%-м нейтральном растворе формалина и обычной проводки гистологические срезы
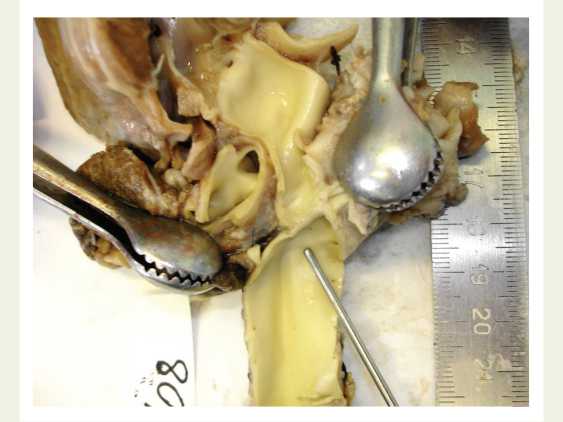
Рис. 1. Морфологические изменения различных отделов аорты после реконструктивной операции при коарктации аорты: дилатация восходящего отдела аорты, валикообразное утолщение зоны перешейка аорты
Fig. 1. Structural changes in various parts of the aorta after aortic coarctation repair: ascending aorta dilatation, rollshaped thickening of the aortic isthmus аорты, легочной артерии, сердца окрашивались гема-токсилином-эозином, пикрофуксином по Ван Гизону, Вейгерту на эластические волокна, проводилась ШИК-реакция с докраской альциановым синим для выявления кислых и нейтральных гликозаминогликанов.
Результаты
На вскрытии наибольшие морфологические изменения при КА отмечались в сердечно-сосудистой системе.
При изучении аорты в местах операций имелось грубое утолщение ее стенки, сужение просвета по типу «песочных часов». На внутренней поверхности, в интиме аорты имелся плотный белесоватый «валик», выступающий в ее просвет. Проксимальнее места сужения
Таблица 2 Морфометрическая характеристика массы сердца у детей после хирургической коррекции коарктации аорты
Легочная артерия на всем протяжении была неравномерно расширена до 2,5–2,7 см, внутренняя поверхность ее была гладкой белесоватой. В двух наблюдениях имелись признаки ВПС: гипертрофическая кардиомиопатия в одном, гипоплазия и фиброэластоз эндокарда левого желудочка сердца в другом (рис. 1).
Как следует из данных в табл. 1, средняя величина объема сердца после хирургического лечения КА превышала нормальные показатели, что указывало на ослабление деятельности сердца, наличие сердечной недостаточности.
Масса сердца у детей после оперативного лечения КА (табл. 2) в среднем превышала нормальные величины на 75% , что связано с гипертрофией миокарда. Отмечены неравномерная дилатация восходящего отдела и нерезкое сужение дуги аорты (табл. 3, 4).
Важно отметить, что средние показатели периметра перешеечной области грудного отдела аорты были резко уменьшены, что свидетельствовало о стенозе этого отдела (табл. 5).
Таким образом, сравнительное морфометрическое исследование сердца и магистральных сосудов после хирургического лечения КА выявило значительное увеличение объема и массы сердца за счет резко выраженной гипертрофии миокарда левого и правого желудоч-
|
Таблица 1 Морфометрическая характеристика объема сердца у детей после хирургической коррекции коарктации аорты |
||||||
|
Возраст СМреднее, |
Стд. ошибка, m |
25% квартиль |
Медиана , Me |
75% квартиль |
||
|
32 сут. сут. 117,50 – 6 мес. |
2,50 |
115,00 |
117,50 |
120,00 |
||
Таблица 3 Морфометрическая характеристика периметра восходящего отдела аорты у детей после хирургической коррекции коарктации аорты
|
Возраст |
Среднее, М |
Стд. ошибка, m |
25% квартиль |
Медиана, Me |
75% квартиль |
|
32 сут. – 6 мес. |
2,25 |
0,25 |
2,00 |
2,25 |
2,50 |
|
Таблица 4 Морфометрическая характеристика периметра дуги аорты у детей после хирургической коррекции коарктации аорты |
||
|
Среднее, Стд. 25% Медиана, 75% Возраст ошибка, М m , квартиль Me квартиль |
||
|
32 сут. 1,25 0,15 1,10 1,25 1,40 – 6 мес. |
||
Гистологическое исследование сердечно-сосудистой системы при КА выявило следующие особенности. В местах операций архитектоника стенки аорты была нарушена, расположение внутренней, средней, наружной оболочек плохо различимо. Гистологические изменения значительно выраженны в средней оболочке. Здесь имелись крупные гомогенные бесклеточные участки — фокусы некроза гладкомышечных клеток, коллагеновых и эластических волокон, не содержащих гликозаминогликаны в окрасках по Хочкиссу альциановым синим. Эластические волокна в этих местах были фрагментированы, имели вид «прядей волос», на большем протяжении их структура не была видна, что свидетельствовало об их деструкции (рис. 2).
Вокруг очагов некрозов имелись скопления гладких миоцитов, имеющие вид веретеновидных и эпителиоидных клеток. Среди них преобладали эпителиоидные гладкомышечные клетки, которые содержали в цитоплазме альциан-положительные вещества, то есть кислые гликозаминогликаны. Гладкие миоциты веретеновидной формы располагались в стенке хаотично, образуя причудливые структуры, между ними отмечалось скопление нейтральных гликозаминогликанов, тонких коллагеновых волокон (рис. 3).
Эпителиоидные гладкие миоциты имели более крупные размеры, содержали светлую цитоплазму, в которой отмечалось накопление кислых гликозаминогликанов; при этом данные клеточные популяции
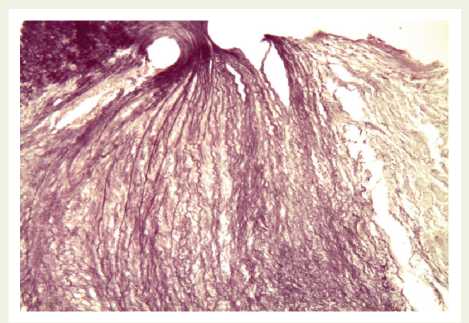
Рис. 2. В зоне операции — новообразованная мышечно-фиброзная ткань с беспорядочным расположением тонких эластических волокон, имеющих вид «прядей волос». Окрашивание по Вейгерту. Увеличение х 200
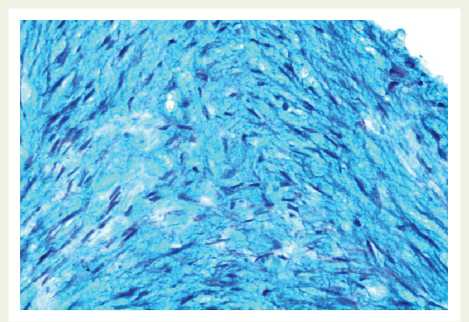
Рис. 3. В зоне операции — скопление крупных эпителиоидных и веретеновидных гладких миоцитов, инфильтрация стенки аорты кислыми мукополисахаридами. ШИК-реакция с докраской альциановым синим. Увеличение х 200
Fig. 2. Surgical site: a newly formed muscle-fibrous tissue with randomly located thin elastic fibers shaped as “hair strands”. Weigert stain. Magnification x 200
Fig. 2. Surgical site: accumulation of large epithelioid and fusiform smooth muscle cells, infiltration of the aorta wall with acid mucopolysaccharides. Periodic acid–Schiff ( PAS) reaction completed with alcian blue. Magnification x 200
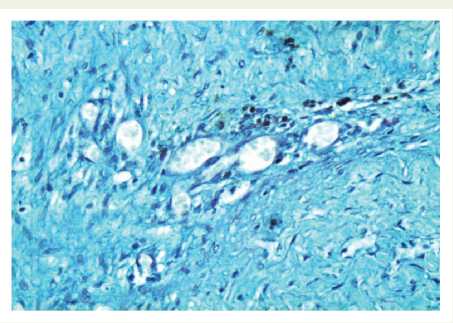
Рис. 4. В зоне операции — в средней оболочке аорты имеются новообразованные капилляры, вокруг которых видны веретеновидные, эпителиоидные гладкие миоциты единичные гемосидерофаги. ШИК-реакция с докраской альциановым синим. Увеличение х 200
Fig. 4. Surgical site: the middle coat of the aorta has newly formed capillaries surrounded by fusiform smooth muscle cells, heart failure cells. Periodic acid–Schiff ( PAS) reaction completed with alcian blue. Magnification x 200
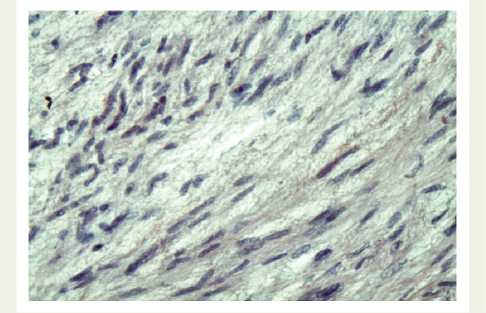
Рис. 5. В стенке грудной аорты — очаги опустошения клеток и волокон средней оболочки. Окрашивание гематоксилином-эозином. Увеличение х 200
Fig. 5. Thoracic aorta wall: loci of cell and middle coat fibers emptying. Stain with hematoxylin-eosin.
Magnification x 400
были представлены в большем количестве по сравнению с веретеновидными гладкими миоцитами.
Кроме повреждения клеточно-волокнистых структур стенки перешейка аорты обнаружены явления ангиоматоза средней и наружной оболочек с образованием тонкостенных мелких сосудов капиллярного типа. Вокруг новообразованных сосудов имелась рыхлая соединительная ткань, содержащая тонкие коллагеновые волокна, единичные гемосидерофаги, что указывало на наличие периваскулярных кровоизлияний. Количество эластических волокон в ней было резко сниженно (гипоэластоз), вплоть до полного их отсутствия (анэластоз). В наружной оболочке аорты отмечалось скопление новообразованных мелких артерий мышечного типа, капилляров, расположенных среди тонких коллагеновых волокон рыхлой соединительной ткани (рис. 4).
В наружной оболочке аорты отмечалось скопление новообразованных мелких артерий мышечного типа, капилляров, расположенных среди рыхлой соединительной ткани.
В других отделах аорты и клапанном аппарате были представлены следующие изменения. Полулунные клапаны аорты имели признаки мукоидного оте- ка, с беспорядочным содержанием эластических и коллагеновых волокон в строме.
В стенках восходящего и брюшного отделов аорты отмечались явления гипоэластоза, неравномерное истончение всех слоев.
В области дуги и проксимального отдела грудной аорты выявлялись признаки эластофиброза внутренней оболочки аорты, очаги опустошения клеток и волокон средней оболочки, нередко с образованием кистозных структур (рис. 5).
Обсуждение
Клеточно-межклеточные взаимоотношения в различных отделах аорты после оперативного лечения КА у детей первого года жизни выявили особенности дис-пластических и репаративных изменений.
Морфометрическое изучение сердца и аорты показало значительное увеличение объема и массы сердца по сравнению с нормальными величинами за счет гипертрофии миокарда правого и левого желудочков сердца. Неравномерное сужение просветов аорты было наиболее выраженно в дуге и перешейке по сравнению с ее восходящим и грудным отделами.
Важным гистологическим признаком репаративной регенерации стенки аорты при КА в местах операций является участие в этом процессе различных типов гладких миоцитов. Эти клетки, по-видимому, принимают непосредственное участие в секреции гликозаминогликанов стенки аорты, способствуют образованию мелких сосудистых элементов — капилляров, что имело место в нашем исследовании [7]. Грубых склеротических изменений стенок аорты в местах КА мы не обнаружили.
Наряду с этим, в других отделах аорты (восходящей, дуге, брюшной) и ее полулунных клапанах отмечалось уменьшение количества эластических волокон (гипоэластоз), неравномерное накопление кислых мукополисахаридов.
Структурно-функциональные изменения стенки аорты вне коарктации могут появляться во внутриутробном периоде развития плода, что согласуется с другими исследованиями [10]. В то же время морфологические изменения стенки аорты после оперативного лечения КА могут носить компенсаторно-приспособительный характер и быть связаны с гемодинамическими изменениями кровотока.
Вышеописанные морфологические изменения в различных отделах аорты при КА у детей первого года жизни указывают на то, что эта врожденная сосудистая патология, вероятнее всего, не является изолированной, а может быть проявлением дисплазии соединительной ткани. Однако данное утверждение требует дальнейшего морфологического изучения.
Выводы
Исследование не имело спонсорской поддержки.
Список литературы Клеточно-межклеточные взаимоотношения в различных отделах аорты после реконструктивных операций при коарктации у детей первого года жизни
- Бураковский В.И., Бокерия Л.А. Сердечно-сосудистая хирургия. М.: Издательство «Медицина», 1996. 768 с.
- Бокерия Л.А., Гудкова Р.Г. Сердечно-сосудистая хирургия -2014. М.: Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева, 2015. 226 с.
- Ким А.И., Бокерия Л.А., Подзолков В.П., Ильин В.Н., Туманян М.Р. Сердечно-сосудистые заболевания у новорожденных: кардиологические и хирургические проблемы. Вестник Российской академии медицинских наук. 2003;(12):77-80.
- Пурецкий М.В., Иванов А.С., Лебедева А.В. Ближайшие и отдаленные результаты баллонной дилатации коарктации аорты. Хирургия. Журнал им. Н.И. Пирогова. 2006;(10):13-6.
- Семенов И.И. Патогенетическое обоснование клиники коарктации аорты, принципов хирургического лечения и оценки его результатов: автореф. дис.. д-ра мед. наук. Новосибирск, 1997.
- Шарыкин А.С. Врожденные пороки сердца (руководство для педиатров, кардиологов, неонатологов). М.: Теремок, 2005.
- Тодоров С.С. Патоморфологические изменения аорты при врожденных заболеваниях сердечно-сосудистой системы у детей первого полугодия жизни: дис. д-ра мед. наук. Новосибирск, 2011. 227 с.
- Школьникова М.А., Осокина Г.Г., Абдулатипова И.В. Заболеваемость, смертность и структура сердечно-сосудистой патологии у детей в Российской Федерации. Российский медицинский журнал. 2003;(6):3-6.
- Fawzy M.E., Fathala A., Osman A., Badr A., Mostafa M.A., Mohamed G., Dunn B. Twenty-two years of follow-up results of balloon angioplasty for discreet native coarctation of the aorta in adolescents and adults. Am Heart J. 2008;156(5):910-7. http://dx.doi.o DOI: rg/10.1016/j.ahj.2008.06.037
- Pinzon J.L., Burrows P.E., Benson L.N., Moes C.A., Lighfoot N.E., Williams W.G., Freedom R.M. Repair of coarctation of the aorta in children: postoperative morphology. Radiology. 1991;180(1):199-203. http://dx.doi.o DOI: rg/10.1148/radiology.180.1.2052694
- Vogt M., Kuhn A., Baumgartner D., Baumgartner C., Busch R., Kostolny M., Hess J. Impaired elastic properties of the ascending aorta in newborns before and early after successful coarctation repair: proof of a systemic vascular disease of the prestenotic arteries? Circulation. 2005;111(24):3269-73. http://dx.doi. org/10.1161/CirculationAHA.104.529792
- Badimon J.J., Ortiz A.F., Meyer B., Mailhac A., Fallon J.T., Falk E., Badimon L., Chesebro J.H., Fuster V. Different response to balloon angioplasty of caroitid and coronary arteries: effects on acute platelet deposition and in thickening. Atheroscl. 1998;140(2):307-14.
- Waldo K.L., Hutson M.R., Ward C.C., Zdanowicz M., Stadt H.A., Kumiski D., Abu-Issa R., Kirby M.L. Secondary heart field contributes myocardium and smooth muscle to the arterial pole of the developing heart. Dev Biol. 2005;281(1):78-90. http://dx.doi. org/10.1016/j.ydbio.2005.02.012
- Brown J.W., Ruzmetov M., Hoyer M.H., Rodefeld M.D., Turrentine M.W. Reccurent coarctation: is surgical repair of repair coarctation of the aorta safe and effective? Ann Thorac Surg. 2009;88(6):1923-30. http://dx.doi.org/10.1016/j. athoracsur.2009.07.024
- Miano J., Long X., Fujiwara K. Serum response factor: master regulator of the actin cetosceleton and contractile apparatus. Am J Physiol Cell Phys. 2007;292(1):C70-81. http://dx.doi.org/10.1152/ajpcell.00386.2006


