Клеточные кооперации в разные сроки COVID-19 пневмонии
Автор: Тодоров Сергей Сергеевич, Тодоров Сергей сергеевич мЛ., Казьмин Андрей Сергеевич
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 3 т.20, 2023 года.
Бесплатный доступ
Цель работы: оценить степень выраженности воспалительной клеточной инфильтрации и экспрессии белков CD3, CD45, CD15, CD68 в разные сроки COVID-19 пневмонии. Материал для выполнения морфологического и иммуногистохимического исследования был получен во время выполнения вскрытий 80 умерших. Непосредственной причиной смерти больных при COVID-19 были острый респираторный дистресс-синдром (45 %), тромбоз ветвей легочной артерии (30 %), полиорганная недостаточность (25 %). Использована компьютерная морфометрия, определение коэффициента площади окрашивания с последующим статистическим анализом. Выполненное морфоиммуногистохимическое исследование легких при COVID-19 свидетельствует о существенном нарушении клеточной кооперации иммунокомпетентных клеток (CD3, CD45) с преобладанием макрофагов (CD68) в поздние сроки развития заболевания (22-40 суток). Вероятно, активация макрофального звена иммунитета может в дальнейшем инициировать развитие пневмофиброза и неоангиогенеза.
Covid-19 пневмония, клеточные кооперации, cd68+ макрофаги, сроки заболевания, ремоделирование
Короткий адрес: https://sciup.org/142238794
IDR: 142238794 | УДК: 616-091.8
Текст научной статьи Клеточные кооперации в разные сроки COVID-19 пневмонии
Новая коронавирусная инфекция, вызванная РНК-вирусом SARS-CoV-2, объявленная ВОЗ в марте 2020 г. пандемией, относится к особо опасным инфекциям с поражением легких и внутренних органов. Особое значение в патогенезе заболевания, которое носит название COVID-19, придают патологическим процессам в иммунной системе и кровеносных сосудах [1–3].
В отдельных отечественных патологоанатомических работах было показано значение различных иммуннокомпетентных клеток CD4, CD8, CD20 при
COVID-19 пневмонии [4]. По мнению авторов, преобладание CD8+ Т-лимфоцитов-супрессоров над CD4+ Т-лимфоцитами-хелперами рассматривается как признак аутоиммунного поражения, а повышенная экспрессия CD68+, CD31 в макрофагах может свидетельствовать о неблагоприятном прогнозе заболевания [5, 6].
В работе А. В. Смирнова и соавт. (2021) были выделены факторы неблагоприятного прогноза COVID-19 пневмонии: макрофагальная инфильтрация, генерализованное поражение микроциркуляторного русла с развитием тромбоэмболических осложнений, фиброз паренхимы легких, присоединение вторичной бактериальной инфекции [5]. Однако до настоящего времени работ, посвященных сравнительному изучению морфологических изменений в легких в динамике COVID-19 пневмонии, недостаточно [7–10].
ЦЕЛЬ РАБОТЫ
Оценить степень выраженности воспалительной клеточной инфильтрации и экспрессии белков CD3, CD45, CD15, CD68 в разные сроки COVID-19 пневмонии.
МЕТОДИКА ИССЛЕДОВАНИЯ
Материал для выполнения морфологического и иммуногистохимического исследования был получен во время выполнения вскрытий 80 умерших в разных стационарах Ростова-на-Дону. Участки легочной ткани (плотные, лаковые, отечные, резко полнокровные) иссекались в виде кусочков размерами не менее 2 × 2 см. Отдельно забирался материал для выполнения посмертного ПЦР-исследования с последующим обнаружением вируса SARS-CoV-2.
Среди умерших было 42 мужчины, 38 женщин, средний возраст которых составил 69 лет. Анализ историй болезни умерших пациентов с COVID-19 пневмонией выявил наличие коморбидной патологии: сахарный диабет (32,2 %), артериальная гипертензия (86,4 %), ожирение (33,4 %). Во всех наблюдениях COVID-19 пневмония была основным заболеванием в клиническом и патологоанатомическом диагнозах.
В зависимости от длительности развития заболевания, с учетом клинических данных COVID-19
пневмонии, нами были выделены хронологические группы: 1) 0–14 суток; 2) 15–21 суток; 3) 22–40 суток. Была использована компьютерная программа ImageJ (US National Institutes of Health, США) морфометрии, определение коэффициента площади окрашивания (КПО) (Славинский А. А., 2020) с последующим статистическим анализом.
Микроскопия и фотографирование полученных гистологических препаратов осуществлялась с помощью микроскопа Leica 1000DM c пакетом программного обеспечения (Германия).
Статистическую обработку полученных результатов осуществляли на персональном компьютере с применением статистических инструментов программы MedCalc Statistical Software version 19.1.3. Значения всех выборок подвергли проверке на характер распределения с помощью W-критерия Шапиро – Уилка. Поскольку распределение отличалось от нормального, для характеристики вариационных рядов использовали медиану, первый и третий квартили (Me [Q1; Q3]). Достоверность различия выборочных значений оценивали с помощью критерия Манна – Уитни. Нулевую гипотезу отвергали при пороговом значении p < 0,05.
Иммуногистохимическое исследование сосудов легких при COVID-19 пневмонии проводилось с использованием антител к CD3, CD45, CD15, CD68 (табл. 1).
Непосредственной причиной смерти больных при COVID-19 были острый респираторный дистресс-синдром (45 %), тромбоз ветвей легочной артерии (30 %), полиорганная недостаточность (25 %).
Таблица 1
|
Название антитела |
Прозводитель (фирма) |
Клон |
Происхождение антитела |
Разведение |
|
CD3 |
Cell Marque, США |
MRQ-39 |
rabbit monoclonal antibody |
1:200 |
|
CD45 |
Cell Marque, США |
LCA2811&PD7128 |
mouse monoclonal antibody |
1:200 |
|
CD15 |
Cell Marque, США |
MMA |
mouse monoclonal antibody |
rtu |
|
CD68 |
Cell Marque, США |
Kp-1 |
rabbit monoclonal antibody |
1:200 |
Антитела, используемые в исследовании
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
В течение первых двух недель от начала COVID-19 пневмонии в стенках альвеол имелись белковые эозинофильные преципитаты с формированием гиалиновых мембран, в их просветах – лизированные эритроциты, нейтрофилы, макрофаги (рис. 1). В эти сроки отмечалась умеренная экспрессия CD3+, CD45+, CD15+ с периваскулярной локализацией, в то время как CD68+ обнаруживались внутриальвеолярно (рис. 2). В сроки 15–21 сутки COVID-19 пневмонии в просветах альвеол легких отмечалась резко выраженная нейтрофильная клеточная инфильтрация с участками деструкции межальвеолярных перегородок, скоплением гиалиновых мембран. Просветы мелких и средних артерий легких были резко эктазирова-ны, полнокровны. Экспрессия белков CD45+, CD3+ по сравнению с CD15+ и CD68+ была снижена. Отмечалось преобладание CD15+, CD68+ клеточной инфильтрации в просветах альвеол и периваскулярно.
Спустя 22–40 дней от начала развития COVID-19 пневмонии в паренхиме легочной ткани формировались фиброзные узелки, состоящие из фибробластов, макрофагов, лимфоцитов, вокруг которых имелись мелкие кровеносные сосуды с признаками резкого полнокровия и периваскулярными диапедезными кровоизлияниями. Фиброзные узелки были представлены CD68+ макрофагами с формированием веерообразных клеточных структур (рис. 3). Проведенная компьютерная морфометрия и статистическая обработка полученных данных позволила получить следующие результаты распределения воспалительных клеточных элементов (CD3, CD45, CD15, CD68) в легких при COVID-19 в динамике развития заболевания (рис. 4).
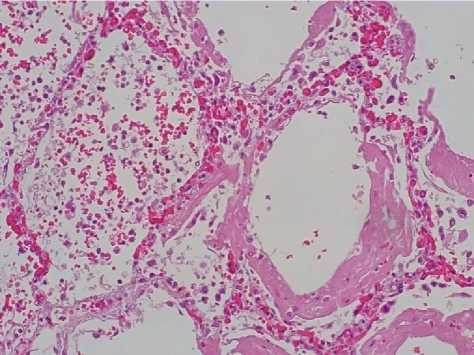
Рис. 1. В стенках альвеол – гиалиновые мембраны с резким утолщением. В просветах альвеол – лизированные эритроциты, нейтрофилы, макрофаги. Окраска гематоксилином-эозином. Увеличение ×200
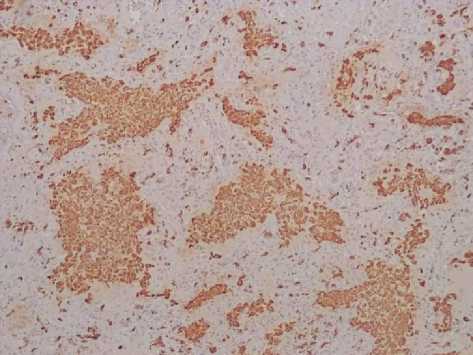
Рис. 2. Выраженная цитоплазматическая экспрессия CD68+ макрофагов с преимущественной внутриальвеолярной локализацией при COVID-19. Иммуногистохимическая реакция к CD68. Увеличение ×200
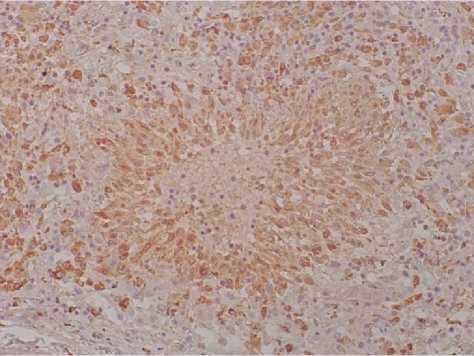
Рис. 3. Яркая экспрессия белка CD68+ в фиброзных узелках при COVID-19. Иммуногистохимическое исследование с антителом к CD68. Увеличение ×200
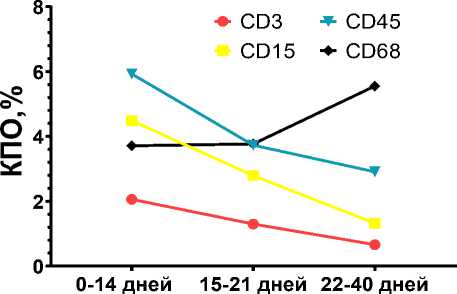
Рис. 4. Соотношения CD3, CD15, CD45, CD68
в разные сроки COVID-19 (КПО – коэффициент площади окрашивания, %)
Нами показано, что в первые две недели заболевания COVID-19 КПО экспрессии белков CD68, CD15 составляла 3,71; 4,49 %, CD3, CD45 2,06; 5,93 % соответственно. Спустя 15–21 дней COVID-19 пневмонии КПО экспрессии белков CD68, CD15 со- ставили 3,77; 2,79 %, CD3, CD45 – 1,3; 3,73 % соответственно.
Через 22–40 суток заболевания КПО экспрессии белков CD68, CD15 составили 5,55; 1,32 %, CD3, CD45 – 0,66; 2,91 % соответственно (табл. 2).
Таблица 2
КПО CD3, CD45, CD15, CD68 в разные сроки COVID-19 пневмонии
|
Срок |
CD3 |
CD15 |
CD45 |
CD68 |
|
КПО, % |
КПО, % |
КПО, % |
КПО, % |
|
|
0–14 |
2,06 |
4,49 |
5,93 |
3,71 |
|
15–21 |
1,3 |
2,79 |
3,73 |
3,77 |
|
22–40 |
0,66 |
1,32 |
2,91 |
5,55 |
Примечание. Нулевую гипотезу отвергали при пороговом значении p < 0,05.
ЗАКЛЮЧЕНИЕ
COVID-19 пневмония представляет собой острое инфекционное заболевание, вызываемое вирусом SARS-CoV-2, имеющее ряд патоморфологических и иммуногистохимических особенностей в динамике развития патологического процесса.
Работ, посвященных изучению данной проблемы в отечественной и зарубежной литературе, нам не встретилось. Отдельные работы отечественных исследователей указывают на важность участия клеток иммунокомпетентной системы в разные сроки заболевания. Однако компьютерная морфометрия с последующим выполнением статистического анализа клеточных коопераций при COVID-19 пневмонии на секционном материале в работах не был представлен.
В своем исследовании мы выделили наиболее значимые временные интервалы развития патологического процесса (до 14 суток, 15–21 суток, 22–40 суток), в течение которых наступал летальный исход пациентов в ковидных госпиталях.
На основании проведенного исследования нами было установлено, что в течение двух недель развития COVID-19 пневмонии в паренхиме легких наблюдались признаки острого дистресс-синдрома.
В клеточном воспалительном инфильтрате преобладало количество CD15 (4,49 %), CD45 (5,93 %) по сравнению с CD3 (2,06 %), CD68 (3,71 %), что вероятно указывало на нарушение клеточной кооперации.
Через 15–21 сутки развития COVID-19 пневмонии в просветах альвеол имелись гиалиновые мембраны, выраженная нейтрофильная инфильтрация с участками деструкции альвеолярных перегородок. В клеточном воспалительном инфильтрате отмечалась тенденция к снижению количества CD45 (3,73 %), CD15 (2,79 %), CD3 (1,3 %) c незначительным повышением CD68 (3,77 %). Данные изменения могут указывать на депрессию клеточного звена иммунитета за счет Т-лимфоцитов, моноцитов.
Через 22–40 суток развития COVID-19 пневмонии возникали пролиферативные и фибротические процессы, которые характеризовались развитием интерстициального фиброза, фиброзно-макрофагальных узелков.
В клеточном воспалительном инфильтрате отмечалось дальнейшее уменьшение количества CD45 (2,91 %), CD15 (1,32 %), CD3 (0,66 %) с одновременным увеличением количества CD68 (5,55 %), что возможно обусловлено незавершенным фагоцитозом вирусных частиц с последующим развитием фиброза. Полученные данные представлены на рис. 4.
Морфоиммуногистохимическое исследование легких при COVID-19 свидетельствует о существенном нарушении клеточной кооперации иммунокомпетентных клеток (CD3, CD45) с преобладанием макрофагов (CD68) в поздние сроки развития заболевания (22–40 суток).
Вероятно, активация макрофагального звена иммунитета может в дальнейшем инициировать развитие пневмофиброза и неоангиогенеза, что отмечается в некоторых исследованиях [11].
Список литературы Клеточные кооперации в разные сроки COVID-19 пневмонии
- Забозлаев Ф. Г., Кравченко Э. В., Галлямова А. Р., Летуновский Н. Н. Патологическая анатомия легких при новой коронавирусной инфекции (COVID-19). Предварительный анализ аутопсийных исследований. Клиническая практика. 2020;11(2):21–37.
- Рыбакова М. Г., Карев В. Е., Кузнецова И. А. Патологическая анатомия новой коронавирусной инфекции COVID-19. Первые впечатления. Архив патологии. 2020;82(5):5–15.
- Самсонова М. В., Михалева Л. М., Зайратьянц О. В. и др. Патология легких при COVID-19 в Москве. Архив патологии. 2020;82(4):32–40.
- Ackermann M., Verleden S. E., Kuehnel M. et al. Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19. N Engl J Med. 2020;383(2):120–128.
- Смирнов А. В., Бисинбекова А. И., Григорьева Н. В. и др. Патологическая анатомия коронавирусной инфекции в современных условиях. Волгоградский научно-медицинский журнал. 2021;4:5–12.
- Libby P., Lüscher T. COVID-19 is, in the end, an endothelial disease. Eur Heart J. 2020;41(32):3038–3044.
- Brasier A. R., Recinos A. 3rd, Eledrisi M. S. Vascular in-flammation and the renin-angiotensin system. Arterioscler Thromb Vasc Biol. 2002; 22(8):1257–1266.
- Gómez-Moreno D., Adrover J. M., Hidalgo A. Neutrophils as effectors of vascular inflammation. Eur J Clin Invest. 2018;48(2):e12940.
- Тодоров С. С., Казьмин А. С., Тодоров, С. С. (мл.) Эндотелиопатия сосудов легких в динамике развития COVID-19. Волгоградский научно-медицинский журнал. 2022;19(2):18–22.
- Ермилов В. В., Смирнов А. В., Дорофеев Н. А. и др. COVID-19 у молодых пациентов с коморбидной патологией на фоне иммуносупрессии (случай из практики). Вестник Волгоградского государственного медицинского университета. 2021;1(77):84–88.
- Mauad T., Duarte-Neto A. N., da Silva L. F. F. [et al.] Tracking the time course of pathological patterns of lung injury in severe COVID-19. Respir Res. 2021;22(1):32.


