Клеточные механизмы ремоделирования кости в ответ на повышение внешней нагрузки и в условиях остеоинтеграции титановых имплантатов
Автор: Гайфуллин Нуршат Миннулаевич
Журнал: Природные системы и ресурсы @ns-jvolsu
Рубрика: Биология и биотехнология
Статья в выпуске: 1 (15), 2016 года.
Бесплатный доступ
В экспериментах на 28 белых крысах изучали клеточный состав и иммуногистохимические маркеры ремоделирования бедренной кости, вызванного двумя процессами: повышенной нагрузкой на опорные ткани в результате перерезки передних крестообразных связок и после установки внутрикостных титановых имплантатов с трехмерной капиллярно-пористой биоактивной поверхностью. Процесс ремоделирования прослежен через 4, 8 и 12 недель с момента начала эксперимента. Костную ткань исследовали с помощью классических методов гистологии и морфометрии, а также выявляли в области ремоделирования экспрессию остеонектина, кислой фосфатазы, матриксных металлопротеиназ MMP-2, MMP-9 и их тканевого ингибитора TIMP-1. В результате исследования установлено, что ремоделирование кости, вызванное установкой имплантатов с пористой биоактивной поверхностью, по своей интенсивности и динамике превосходило аналогичный процесс в условиях повышенной нагрузки на кость после перерезки передней крестообразной связки. Это свидетельствует о высоком остеоиндуктивном эффекте биоактивного покрытия, позволяющего не только достичь полной остеоинтеграции, но и стимулировать процесс интенсивного ремоделирования прилегающей губчатой кости. В его развитии ремоделирования в этих условиях показано совместное участие клеточных популяций остеобластов/остеоцитов, остеокластов и эндотелиальных клеток с характерным параллельным увеличением экспрессии матриксных металлопротеиназ MMP-2, MMP-9 и их тканевого ингибитора TIMP-1.
Кость, внутрикостные имплантаты, остеокласты, матриксные металлопротеиназы, кислая фосфатаза, остеоцитарное ремоделирование
Короткий адрес: https://sciup.org/149131377
IDR: 149131377 | УДК: 576.7 | DOI: 10.15688/jvolsu11.2016.1.2
Текст научной статьи Клеточные механизмы ремоделирования кости в ответ на повышение внешней нагрузки и в условиях остеоинтеграции титановых имплантатов
DOI:
Костная ткань, как и остальные опорные ткани организма, характеризуется тем, что ее основные свойства определяются наличием высокоспецифичного экстрацеллюлярного матрикса, динамические изменения объема и молекулярного состава которого в ответ на изменяющиеся условия функционирования кости и определяют сущность ее ремоделирова- ния [1; 8; 9]. Этот процесс происходит за счет совместной деятельности остеобластов, ос-теоцитов и остеокластов при участии эндотелиальных клеток сосудов, питающих кость. Соотношение активности этих клеток осуществляется сложным комплексом нервных, иммунных и эндокринных механизмов, на уровне кости представленным пулом биоло- гически активных медиаторов, часть из которых поступает также из прилегающего костного мозга [3; 14; 15; 21].
Изменения массы тела, типа нагрузок при перемене образа жизни, последствия травм или заболеваний опорно-двигательного аппарата, нервной или мышечной системы существенно изменяют механическую нагрузку на отдельные кости (или части костей), что должно сопровождаться запуском механизмов динамического ремоделирования [17; 19; 25].
Одним из бурно развивающихся направлений современной медицины является восстановительная хирургия костей и суставов, основанная на использовании биомиметичных протезов. Современные внутрикостные имплантаты, помимо полной биосовместимости, за счет наличия биоактивной трехмерно-пористой поверхности, обладают комплексом остеоиндуктивных и остеокондуктивных свойств, что обеспечивает влияние на костную ткань не только непосредственно у контактной поверхности, но и в прилегающей ткани [4; 11; 12; 24; 26]. Отдельным механизмом, стимулирующим ремоделирование, становится иная передача прямых и рассеянных нагрузок имплантатом, в сравнении с аналогичным по объему участком костной ткани. Изучение биологической роли такого влияния на кость в условиях долговременного функционирования имплантатов только начинается [16; 20; 23].
Цель работы
Изучить и сопоставить состав и свойства клеток в зоне ремоделирования костной ткани, индуцированного повышенной внешней нагрузкой и наличием материала с высокими остеогенными свойствами биоактивной поверхности.
Материал и методы исследования
Материалом для исследований послужили образцы тканей бедренной кости 28 белых крыс-самцов линии Wistar массой 220–290 г. Протокол экспериментов соответствовал этическим нормам, изложенным в «Правилах работ с использованием экспериментальных животных», Хельсинской декларации (2000) и Директивах Европейского сообщества 86/
609 EEC. Все болезненные манипуляции и операции проводили при необходимом уровне обезболивания (Золетил в дозе 40 мг/кг массы внутрибрюшинно), выведение животных из эксперимента – пятикратной передозировкой того же препарата.
Повышенную механическую нагрузку на суставную поверхность и прилегающий эпифиз бедренной кости в первой экспериментальной группе вызывали путем перерезки обеих передних крестообразных связок (ПКС) обоих коленных суставов [22] у 12 животных. Для изучения ремоделирования кости в динамике остеоинтеграции во второй экспериментальной группе 12 крысам устанавливали в дистальные эпифизы бедренных костей титановые имплантаты. Стержни длиной до 4 мм и диаметром 1,2 мм имели трехмерное капиллярно-пористое (ТКП) биоактивное покрытие с дополнительным биокерамическим слоем толщиной 10 до 40 мкм, созданное с помощью микродугового оксидирования в Институте металлургии и материаловедения им. А.А. Байкова РАН [2]. Адгезивные свойства и наличие пор размером 150–250 мкм обеспечивали имплантатам высокую способность к остеоинтеграции [4; 5]. По четыре животных в каждой группе выводили из эксперимента спустя 4, 8 и 12 недель от начала эксперимента. В качестве контрольных были исследованы 8 образцов тканей бедренной кости четырех крыс, находящихся все время эксперимента в стандартных условиях того же вивария.
Для исследования использовали сертифицированное гистологическое оборудование – аппарат для проводки Microm STP 420 (Microm, Германия), модульную систему заливки Leica EG 1160 (Leica, Германия), ротационный микротом Leica RM 2255 (Leica, Германия), коверстейнер Dako (Dako, Дания), иммуногистостейнер Dako Link 48 (Dako, Дания), микроскоп Leica DM 6000B с цифровой камерой Leica DFC50С (Leica, Германия). Имидж-анализ проводили с помощью программы «ImageJ» (США).
Костные фрагменты фиксировали в 10 % забуференном нейтральном формалине в течение 24 ч, промывали 6 ч в проточной водопроводной воде при комнатной температуре. Гистологические препараты приготавливали после декальцинации в растворе «Cal-Ex®»
(Fisher Scientific, Германия) в течение 18–20 ч, окрашивали гематоксилином и эозином, трихром по Массону [13]. При гистоморфометрии определяли среднюю толщину кортикального слоя кости (мкм), среднюю толщину (мкм) и объемную долю (%) костных трабекул в губчатой кости. В серии с внутрикостными имплантатами ткань исследовали не ближе, чем в 1 мм от места их установки.
Иммуногистохимическое исследование проводили с использованием моноклональных антител производства Leica Biosystems – Novocastra (Germany): к маркеру клеток остеогенного ряда остеонектину (NCL O-nectin, 15G12), маркеру остеокластов тартрат-рези-стентной кислой фосфатазе (NCL-TRAP), маркеру эндотелиальных клеток CD-31 (NCL-CD31-1A10), матриксным металлопротеиназам MMP-2 (NCL-MMP2-507) и MMP-9 (MMP9-439), а также их тканевому ингибитору TIMP-1 (NCL-TIMP1-485). Все этапы проводили в соответствии с протоколами про- изводителей, использовали вариант микроволновой температурной демаскировки антигенов, позитивные и негативные контроли антигенов, а также негативные контроли антител. Типичные визуализации клеток после их иммуногистохимического типирования в зоне остеоинтеграции приведены на рисунке 1.
Подсчитывали численную плотность иммунопозитивных клеток в ткани, результаты выражали в 1/мкм3 (экспрессию CD31 оценивали как показатель васкуляризации, численно равный удельной площади в процентах, занимаемой иммунопозитивным материалом). Все морфометрические определения проводили в двух препаратах от одного образца кости в пяти полях зрения, весь статистический массив по каждой выборке включал в себя от 50 до 60 измерений.
Обработку количественных данных проводили с помощью программы Statistica 8.0 (StatSoft Inc., США) с учетом общепринятых требований для медико-биологических иссле-
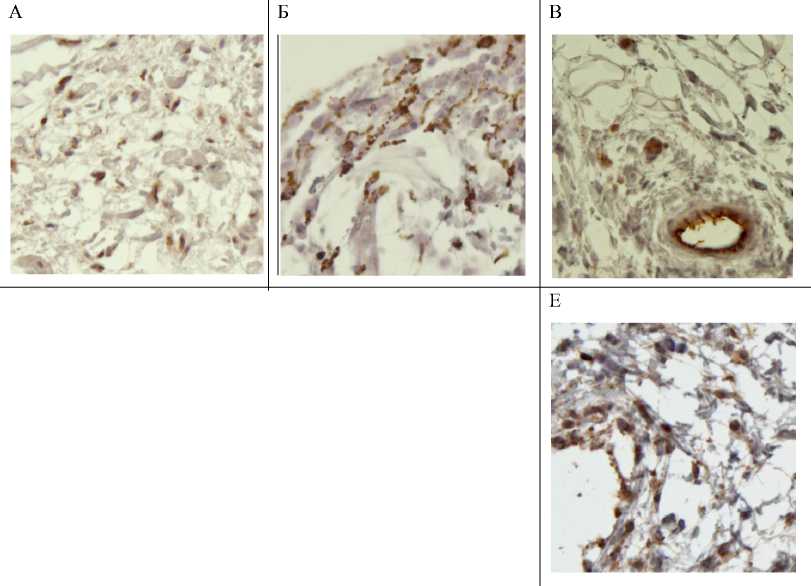
Рис. 1. Клетки регенерата в области остеоинтеграции титановых имплантатов с биоактивной поверхностью на 4-й неделе после установки в бедренную кость крыс. А. Остеонектин-позитивные остеоциты.
Б. Экспрессия тартрат-резистентной кислой фосфатазы в остеокластах. В. Сосуды, визуализированные за счет экспрессии CD31 в эндотелиальных клетках. Г. Небольшая часть остеобластов и остеокласты экспрессируют MMP-2. Д. Большинство остеобластов MMP-9-позитивны. Е. Экспрессия TIMP-1 обнаруживается в небольших группах остеогенных клеток. Непрямой иммунопероксидазный метод. Ув. съемки 300
Г
Д
дований. Поскольку с помощью критериев Колмогорова-Смирнова и Шапиро-Уилка было выявлено отсутствие нормальности распределения полученных параметров, для статистической обработки были использованы непараметрические критерии. Распределение в группах выражали в виде медианы Me и интервала между первым и третьим квартилем [ Q 1 ÷ Q 3]. При сравнении результатов на разных сроках эксперимента с контролем использовали непараметрический критерий Фридмана для множественных групп ( p < 0,01), для анализа различий между опытными группами – непараметрический критерий Манна – Уитни ( p < 0,01).
Результаты исследования
В первой экспериментальной группе при микроскопическом исследовании костная ткань на 4-й неделе после начала эксперимента имела обычное строение. К 8-й неделе пластинка компактной кости также не претерпевала каких-либо изменений, но в губчатой кости выявлялось умеренное увеличение толщины и плотности костных балок без нарушений трехмерной их организации. В части костных балок выявлялись признаки ремоделирования в виде появления групп остеокластов и признаков остеокластической резорбции матрикса, а также цепочки остеобластов по краям костных балок. На 12-й неделе эксперимента толщина кортикальной пластинки отчетливо увеличивалась, параллельно уменьшались размеры лакун губчатой кости. Ремоделирование губчатой кости вблизи эпифизов, то есть в наиболее нагружаемых участках кости, сопровождалось небольшим увеличением васкуляризации кости, которая в этих участках приобретала мозаичное строение с чередованием участков уплотнения и остеопороза.
Во второй группе на 4-й неделе эксперимента вокруг имплантатов обнаруживали тонкий слой рыхлой соединительной ткани, богатой сосудами с очагами остеогенеза и немногочисленными остеогенными участками. В прилежащей губчатой кости выявлялись небольшие участки остеокластической резорбции и цепочки остеобластов по краям костных балок, что свидетельствовало об активной перестройке костной ткани. К 8-й неделе ткань вокруг имплантата представляла собой смешанный регенерат, в котором преобладала грубоволокнистая костная ткань с концентрическим направлением волокон вокруг имплантата. Глубокие слои регенерата без четких границ переходили в прилежащую губчатую кость с признаками активного ремоделирования. На завершающем сроке эксперимента вокруг титановых имплантатов была сформирована плотная зона остеоинтеграции, прилежащая губчатая кость была представлена плотной упаковкой костных балок с признаками остеогенного ремоделирования.
Показатели количественного морфологического исследования приведены на рисунках 2–4.
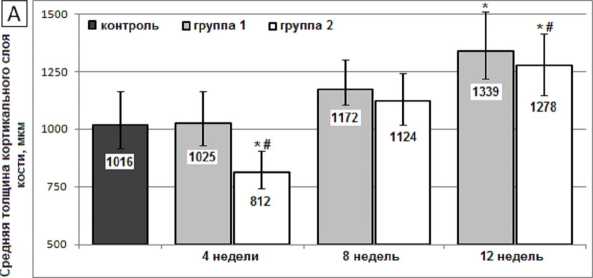
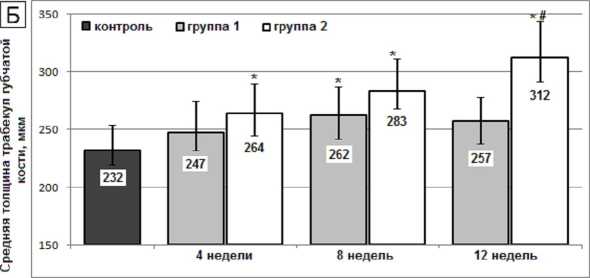
Как перевязка ПКС, так и установка имплантатов с ТКП биоактивным покрытием сопровождались увеличением толщины кортикального слоя бедренной кости, более динамично развивающимся в первой группе (рис. 2А). Средняя толщина и объемная доля трабекул в губчатой кости, напротив, более интенсивно увеличивались во второй группе (рис. 2Б, 2В).
Перерезка ПКС сопровождалась монотонным приростом популяции остеогенных клеток в губчатой кости (на 18,2 % к 16-й неделе эксперимента, p < 0,01). В серии с установкой имплантатов с ТКП биоактивным покрытием этот прирост был более динамичным, интенсивным (на 55,9 % к 8-й неделе эксперимента, p < 0,01) и сопровождался последующим снижением числа остеобластов и ос-теоцитов в губчатой кости (рис. 3А).
Динамика менее многочисленной популяций остеокластов имела сходные характеристики, но пик их численности во второй группе был более интенсивным и приходился на 4-ю неделю с момента постановки имплантатов (рис. 3Б). Ремоделирование кости сопровождалось умеренным повышением показателя васкуляризации: в первой группе с максимумом на 4-й неделе (на 37,1 %, p < 0,01), во второй группе – на 4–8-й неделях (на 71,4 %, p <0,01) (рис. 3В).
После перерезки ПКС в костной ткани наблюдалось увеличение числа клеток, экспрессирующих MMP-2 и MMP-9 с максимумом на 8-й неделе эксперимента (на 86,8 % и 37,0 % соответственно, оба p < 0,01). В группе с установкой имплантатов максимум
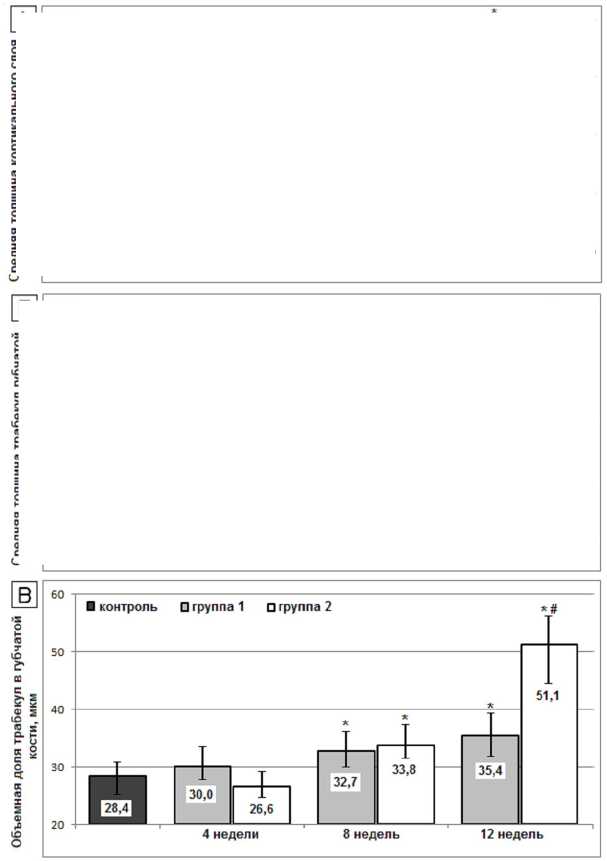
Рис. 2. Средняя толщина кортикального слоя ( А ), средняя толщина ( Б ) и объемная доля трабекул ( В ) в бедренной кости крыс после перерезки передних крестообразных связок (1-я группа) и после установки внутрикостных титановых имплантатов с биоактивным покрытием (2-я группа). Высота столбцов – медиана; вертикальные отрезки – квартильный интервал Q 1 ÷ Q 3; * – достоверные различия с величиной показателя в контрольной группе (критерий Фридмана, p < 0,01); # – достоверные различия между показателями в экспериментальных группах (критерий Манна – Уитни, p < 0,01)
подъема MMP-2 и MMP-9 приходился на 4-ю неделю, и был выше по амплитуде (на 142,1 % и 125,0 % соответственно, оба p < 0,01). Количество клеток, экспрессирующих TIMP-1, было не столь велико, в обеих группах для них была характерна та же динамика (рис. 4).
Как известно, изменение условий функционирования кости сопровождается активацией тканевого ремоделирования, которое протекает с участием нескольких процессов, за каждый из которых отвечает специализированная клеточная популяция [1; 18]. Обнаруженные нами изменения, вызванные в данном случае повышением механической нагрузки на дистальный эпифиз кости или путем установки имплантата с биоактивной поверхностью, свидетельствуют о развитии такого ремоделирования в виде увеличения толщины кортикального слоя и утолщения трабекул губчатой кости. Количественными характеристиками, указывающими на механизмы процесса ремоделирования, выступают содружественный прирост клеточных популяций, повышение экспрессии матриксных металлопротеиназ MMP-2, MMP-9 и TIMP-1, а также увеличение васкуляризации ткани.
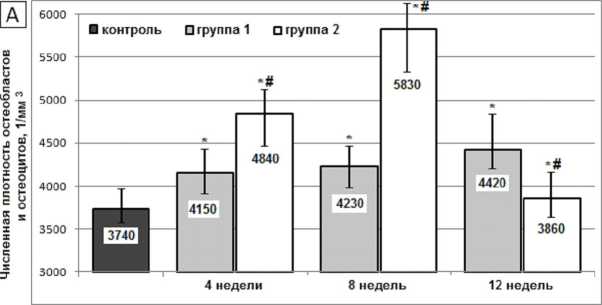
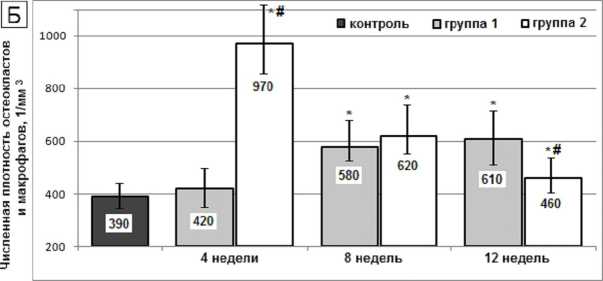
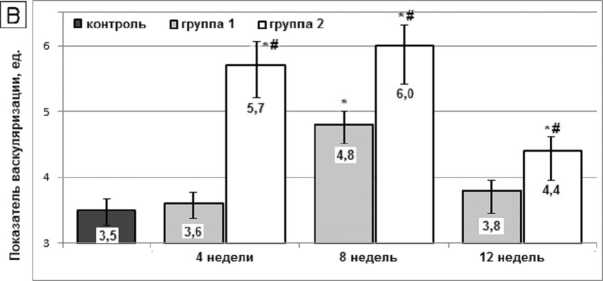
Рис. 3. Численная плотность остеоцитов и остеобластов ( А ), остеокластов ( Б ) и показатель васкуляризации ( В ) в бедренной кости крыс после перерезки передних крестообразных связок (1-я группа) и после установки внутрикостных титановых имплантатов с биоактивным покрытием (2-я группа). Обозначения, как на рисунке 2
В этом комплексе процессов MMP-2 и MMP-9, к секреции которых способны макрофаги, остеокласты и молодые клетки остео- и хондрогенного ряда, призваны растворять низкоминерализованные компоненты матрикса регенерирующих опорных тканей. Этим обеспечивается возможность доступа новых остеогенных клеток, а также эндотелия в зону. Mатриксные металлопротеиназы также участвуют в балансе цитокинов и факторов роста в зоне ремоделирования [8; 10; 18]. Высокая активность TIMP-1 на этом этапе необходима для обеспечения очеред- ности смены фаз отдельных клеточных популяций [11].
В результате исследования получены доказательства усиленного ремоделирования ткани не только непосредственно в зоне осте-интеграции, но и в прилегающей губчатой кости. По своей интенсивности и динамике оно превосходило аналогичный процесс в условиях повышенной нагрузки на кость после перерезки ПКС. Совершенно очевидно, что осте-индуктивный эффект титановых имплантатов с биоактивной ТКП поверхностью распространяется достаточно далеко за пределы соб-
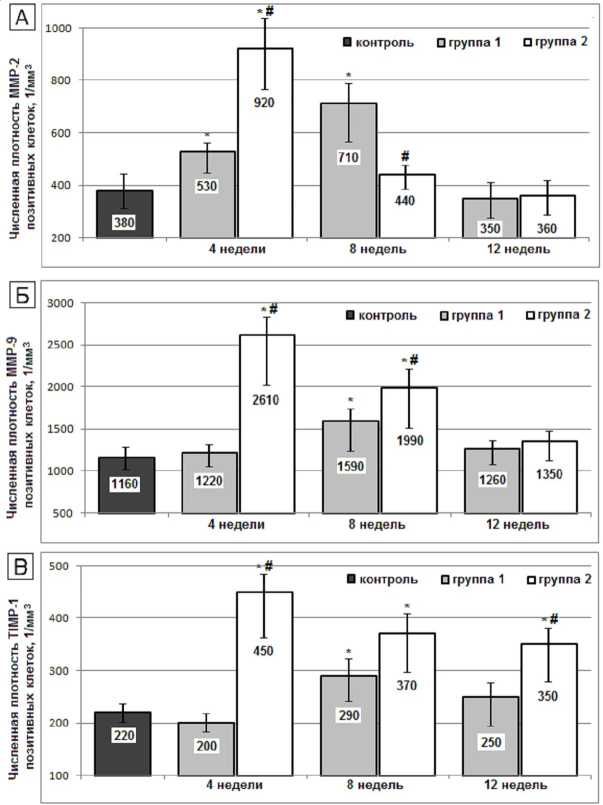
Рис. 4. Численная плотность MMP-2- (А), MMP-9- (Б) и TIMP-1- позитивных клеток (В) в бедренной кости крыс после перерезки передних крестообразных связок (1-я группа) и после установки внутрикостных титановых имплантатов с биоактивным покрытием (2-я группа). Обозначения, как на рисунке 2
ственно зоны остеинтеграции, что вызывает ремоделирование прилегающей губчатой кости и необходимую адаптацию к новым амплитудам и векторам нагрузок [9; 26].
Заключение
Полученные результаты экспериментов свидетельствуют о том, что при постановке в кость лабораторных животных титановых имплантатов с трехмерным капиллярно-пористым биоактивным покрытием наблюдается высокий остеоиндуктивный эффект, в результате чего улучшаются не только морфологические показатели остеоинтеграции, но запускается процесс интенсивного ремоделирования прилегающей губчатой кости. В его раз- витии принимают совместное участие популяции остеобластов/остеоцитов, остеокластов и эндотелиальных клеток. Для процесса ремоделирования кости в этих условиях характерно параллельное увеличение экспрессии матриксных металлопротеиназ MMP-2, MMP-9 и их тканевого ингибитора TIMP-1.
Список литературы Клеточные механизмы ремоделирования кости в ответ на повышение внешней нагрузки и в условиях остеоинтеграции титановых имплантатов
- Аврунин, А. С. Остеоцитарное ремоделирование костной ткани: история вопроса, морфологические маркеры / А. С. Аврунин, Р. М. Тихилов // Морфология. - 2011. - № 1. - С. 86-94.
- Калита, В. И. Плазменные покрытия с нанокристаллической и аморфной структурой: монография / В. И. Калита, Д. И. Комлев. - М.: Лидер М, 2008. - 388 с.
- Лычкова, А. Э. Нервная регуляция метаболизма костной ткани / А. Э. Лычкова // Вестник РАМН. - 2011. - № 3. - С. 42-47.
- Модификация поверхностей внутрикостных имплантатов: современные исследования и нанотехнологии / В. И. Калита, Д. А. Маланин, В. А. Мамаева [и др.] // Вестник Волгоградского государственного медицинского университета. - 2009. - № 4. - С. 17-22.
- Структура и сдвиговая прочность имплантатов с плазменными покрытиями / В. И. Калита, А. И. Мамаев, В. А. Мамаева [и др.] // Физика и химия обработки материалов. - 2015. - № 6. - С. 30-46.


