Клиническая характеристика ревматических болезней и детского мультисистемного воспалительного синдрома, ассоциированных с COVID-19
Автор: Саатова Г. М., Узакбаев К. А., Фуртикова А. Б., Алмазбекова Р. А., Асан кызы А.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 11 т.7, 2021 года.
Бесплатный доступ
При новой коронавирусной инфекции практически все системы организма вовлекаются в патологический процесс, что приводит к развитию во время заболевания или в постковидном периоде как новых болезней, так и осложнений имеющихся хронических заболеваний, требующих проведения лечения или реабилитации. Оставшиеся после перенесенного заболевания симптомокомплексы жалоб и клинические проявления могут беспокоить без проведения терапии и реабилитации на протяжении многих месяцев. Цель исследования. Представить основанные на собственных наблюдениях ориентиры закономерностей клинической картины и возможностей терапии детского мультисистемного воспалительного синдрома (ДМВС) и системных заболеваний соединительной ткани, ассоциированных с COVID-19. Результаты исследования. Представленная первая в Кыргызстане серия собственных клинических наблюдений 31 пациента с ДМВС и 23 пациентов с системными заболеваниями соединительной ткани (СЗСТ), ассоциированных COVID-19, и 29 — с обострением СЗСТ в связи с перенесенной коронавирусной инфекцией наглядно демонстрирует этиологическую и патогенеическую значимость SARS CoV2 в возникновении тяжелого системного воспалительного ответа. Своевременное противовоспалительное лечение ДМВС имеет решающее значение и должно быть адаптировано для каждого пациента с целью достижения наиболее благоприятного эффекта. Пациенты СЗСТ составляют группу риска в отношении заболевания COVID-19 и неблагоприятного течения болезни.
Детский мультисистемный воспалительный синдром, COVID 19, Кавасаки подобный синдром, клиника, терапия.
Короткий адрес: https://sciup.org/14121244
IDR: 14121244 | УДК: 616-039.38 | DOI: 10.33619/2414-2948/72/21
Текст научной статьи Клиническая характеристика ревматических болезней и детского мультисистемного воспалительного синдрома, ассоциированных с COVID-19
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616-039.38
С марта 2020 г. на фоне пандемии COVID-19 в европейских странах (Италия, Франция, Швейцария, Великобритания) и США стали появляться сообщения о новом заболевании, ассоциированном с COVID-19, у детей, с выраженным гипервоспалительным ответом, соответствующим диагностическим критериям болезни Кавасаки (БК), а у ряда пациентов протекающим в виде синдрома токсического шока или миокардита с кардиогенным шоком.
В систематическом обзоре на основании 39 обсервационных исследований, опубликованных в зарубежной литературе, были проанализированы данные о 662 детях с ДМВС. На основании обобщения клинических данных и результатов лабораторноинструментальных методов обследования больных авторы пришли к заключению, что ДМВС – опасное системное инфекционное заболевание, характеризующееся воспалением крайней степени выраженности, лихорадкой, абдоминальными симптомами, конъюнктивитом и сыпью [1–3].
NICE предлагает считать длительным заболевание COVID-19, если симптомы проявляются в течение одного-трех месяцев после начала острой фазы болезни, а если симптомы продолжают проявляться после 12 недель — диагностировать постковидный синдром
Постковидный синдром — это мультисистемное поражение, возникающее после новой коронавирусной инфекции. Патогенетической основой мультисистемного воспалительного синдрома является хронически протекающий тромбоваскулит [4].
При новой коронавирусной инфекции практически все системы организма задействуются в патологическом процессе, что приводит к развитию во время заболевания или в постковидном периоде как новых болезней, так и осложнений имеющихся хронических заболеваний, требующих проведения лечения или реабилитации. Более того, оставшиеся после перенесенного заболевания жалобы могут беспокоить без проведения реабилитации на протяжении многих месяцев.
Пандемия COVID-19 затронула и ревматические заболевания, которые часто имеют аутоиммунную природу, усугубляя существующий иммунодефицит [5].
Данные о частоте и степени тяжести коронавирусной инфекции у пациентов с ревматологическими заболеваниями крайне ограничены. Пациенты с СЗСТ находятся в группе высокого (очень высокого) риска инфицирования SARS-CoV-2 вследствие имеющегося иммунодефицита. Присоединение инфекции SARS-CoV-2 обусловливает развитие постковидных поражений, в патогенезе которых одним из ведущих причин является аутоагрессия с формированием большого количества коморбидных состояний, требующих назначения базисной терапии иммуносупрессивными препаратами.
Требуется накопление и обобщение опыта ведения пациентов детского возраста с ДМВС и с системными проявлениями ревматических болезней, ассоциированными с перенесенной новой коронавирусной инфекцией, изучение катамнеза пациентов, определение риска формирования осложнений для совершенствования терапевтических подходов,
Цель настоящего исследования - представить основанные на собственных наблюдениях ориентиры закономерностей клинической картины и возможностей терапии детского мультисистемного воспалительного синдрома и системных заболеваний соединительной ткани, ассоциированных с COVID-19.
Материалы и методы исследования
Проведено проспективное открытое исследование в отделении кардиоревматологии НЦОМиД.
Обследованы 3 группы больных детей:
-
1. ДМВС (ПЦР SARS Cov-2 отрицательно; ИФА SARS Cov-2 IgG положительно).
-
2. СЗСТ, возникшие после перенесенной COVID-19 (ПЦР SARS Cov-2 отрицательно; ИФА SARS Cov-2 IgG положительно)
-
3. СЗСТ, зарегистрированные до периода пандемии и не связанные с COVID-19 (ПЦР SARS Cov-2 отрицательно; ИФА SARS Cov-2 IgG отрицательно).
Критерии отбора больных в группы обследованных .
Критерии включения :
-Соответствие диагностическим критериям ДМВС ВОЗ,
-
- Больные с различными формами СЗСТ 1–3 степени активности с острым, подострым, и хроническим течением, перенесшие COVID-19 (ПЦР SARS Cov-2 отрицательно, ИФА SARS Cov-2 IgG положительно и отрицательно).
Критерии исключения :
-
- Не соответствие диагностическим критериям ДМВС ВОЗ.
-
- Дети без признаков СЗСТ.
-
- Острые респираторные и вирусные заболевания.
-
- Отказ родителей от участия в исследовании.
Методы исследования
Всем больным проведено традиционное клинико-инструментальное обследование:
-
1. Анализ предшествующего и семейного анамнеза, с уточнением наличия среди
-
2. Оценка клинических данных за весь период наблюдения.
-
2.1. Оценка суставного синдрома включала уточнение времени появления и характера суставного синдрома в дебюте, оценку активности суставного синдрома в период обострения заболевания до начала терапии и затем в течение 1-3-6 месяцев.
-
-
2.2. Наличие и выраженность системных проявлений заболевания оценивалась на основании жалоб больных, данных физикального обследования, а также данных инструментального обследования (ЭКГ, ЭХО-кардиографии и допплерографии, УЗИ органов брюшной полости, рентгенологического обследования органов грудной клетки).
-
2.3. Структурные изменения в хрящевой и костной ткани суставов оценивались до начала лечения и далее каждые 6 месяцев. Стадия анатомических изменений диагностировалась по Штейнброккеру (1988 г).
-
2.4. Лабораторные показатели активности; гемоглобин, содержание эритроцитов, цветовой показатель, содержание тромбоцитов, лейкоцитов, лейкоцитарная формула, СОЭ, тест на С-реактивный белок, концентрация иммуноглобулинов (Ig) А, М, G по методу Манчини, ревматоидного фактора в сыворотке крови — 1 раз в месяц. Степень активности заболевания оценивалась до начала лечения и далее каждый месяц. Специальные методы обследования:
cc) ® I
родственников первой и второй степени родства ревматологической патологии, изучение провоцирующих факторов развития заболевания.
Активность суставного синдрома оценивалась по: количеству суставов с экссудацией и выраженности экссудации (0–3 балла); распространенности суставного поражения; количеству болезненных суставов; выраженности боли в баллах (от 0 до 3 баллов); количеству суставов с ограничением подвижности; количеству активных суставов. Локальная активность оценивалась согласно критериям, разработанным В. П. Павловым, В. А. Дуляпиной, М. Г. Астапенко (1972).
-
- выявление и идентификация специфических фрагментов РНК SARS-CoV-2 в мазках из верхних дыхательных путей методом полимеразной цепной реакции (ПЦР, использовали набор реагентов для выявления РНК SARS-CoV-2 методом ПЦР «АмплиТест SARS-CoV-2»);
-
- серологическое обследование с определением специфических иммуноглобулинов классов IgM, IgG методом иммунохемилюминесцентного анализа Mindray;
-пульсоксиметрия;
-
- мониторинг артериального давления,
-
- эхокардиография (ЭхоКГ) с исследованием коронарных артерий (КА);
-исследование коагулограммы,
-
- УЗИ органов брюшной полости;
-
- рентгенография органов грудной клетки; компьютерная томография органов грудной клетки.
Исследование состояния клеточного иммунитета проведено на базе лаборатории иммунологии НЦОМиД и (или) коммерческой лаборатории методом иммунохемилюминесцентного анализа при помощи зарегистрированных наборов реагентов. Период включения в исследование: сентябрь 2020 г., март 2021 г.
Исследование было пилотным, в связи, с чем расчет необходимого объема выборки не проводился. Статистическая обработка. Номинальные данные описывали с указанием абсолютных значений и процентных долей.
Результаты и их обсуждение
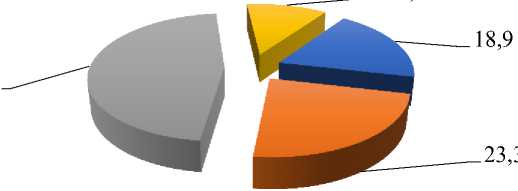
По данным официальной статистики (РМИЦ МЗ КР) в Кыргызстане с марта по декабрь 2020 г. 1053 ребенка получили стационарное лечение по поводу COVID-19. В структуре больных преобладали дети от 5 до 15 лет (46,4%) и от 1 до 4 лет (23,3%) (Рисунок 1).
11,4
46,4
■ до 1 года м 1-4 года ■ 5-15 лет - старше 16 лет
Рисунок 1. Возрастная структура детей с COVID-19 в Кыргызстане
Доминировали дети в удовлетворительном состоянии (59,5%), хотя не редкими были случаи тяжелого и крайне тяжелого состояния (18,0%) (Рисунок 2).
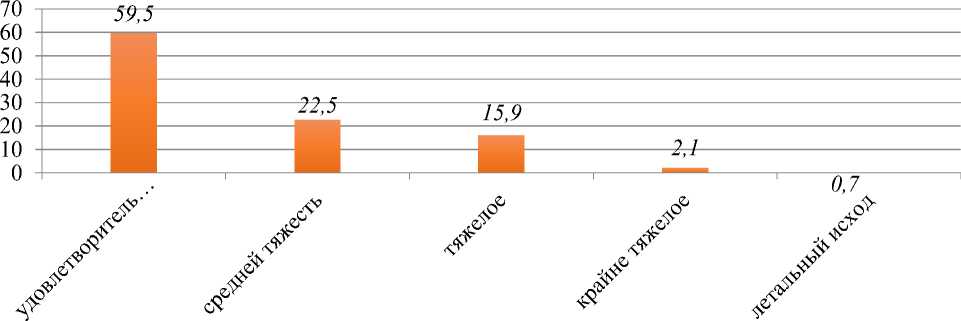
Рисунок 2. Распределение детей по степени тяжести COVID 19 - в Кыргызстане
ДМВС выявлен у 27 из 1057 зарегистрированных случаев новой коронавирусной инфекцией, в 2-х случаях ДМВС отмечен летальный исход (Рисунок 3).
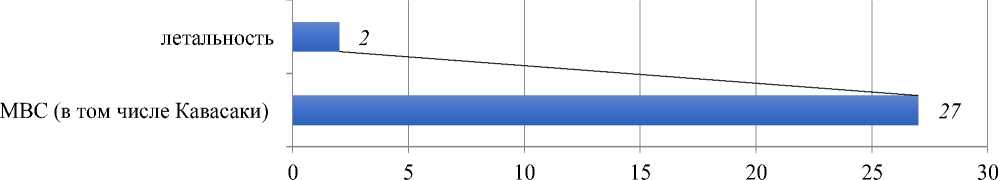
Рисунок 3. МВС у детей в КР (2,5% из числа зарегистрированных 1057 детей с COVID-19)
Проанализированы типичные проявления и исходы ДМВС, ассоциированного с COVID-19, по данным нашей клиники (по обращаемости).
Среди 31 наблюдаемого больного с ДМВС преобладали мальчики (54,8%), возраст пациентов от 15 месяцев до 17 лет, средний возраст пациентов составил 5,5 года. Положительный эпидемиологический анамнез по COVID-19 был у 20 больных (64,5%), IgM и (или) IgG SARS CoV 2 были выявлены у всех детей, при этом ПЦР была отрицательной у всех больных.
Таблица 1 ХАРАКТЕРИСТИКА ДЕМОГРАФИЧЕСКИХ ДАННЫХ,
КЛИНИЧЕСКОЙ МАНИФЕСТАЦИИ У НАБЛЮДАЕМЫХ ПАЦИЕНТОВ С ДМВС (n=31)
|
Признаки абс. (%) |
|
Медиана, средний возраст, годы 5,5 |
|
Мальчики 17 (54,8%) |
|
Девочки 14 (45,2%) |
|
Клиническая характеристика |
|
Патогенетические критерии Кавасаки подобного синдрома, |
|
неспецифические проявления с шоком или лихорадкой или с обоими симптомами |
|
Лихорадка |
31 (100%) |
|
Склерит, конъюнктивит |
17 (54,8%) |
|
Хейлит |
18 (58,0%) |
|
Глоссит |
16 (51,6%) |
|
Сыпь |
26 (83,8%) |
|
Шейная лимфаденопатия |
15 (48,38%) |
|
Поражение кистей и стоп (эритема, отек, шелушение) |
19 (61,2%) |
|
Шок |
3 (9,6%) |
|
Сердечно-сосудистые нарушения |
|
|
Аритмии |
7 (22,5%) |
|
Повреждение миокарда и миокардит |
12 (38,7%) |
|
Сердечная недостаточность (СН) и кардиомиопатия, |
23 (74,2%) |
|
Острый коронарный синдром |
1 (3,2%) |
|
Риск венозной тромбэмболии |
18 (58,0%) |
|
Тромб в полости желудочков и предсердий сердца |
3 (9,6%) |
|
Суставной синдром |
|
|
Боль |
23 (74,2%) |
|
Припухлость |
8 (25,8%) |
|
Олигоартрит |
5 (16,1%) |
|
Полиартрит |
3 (9,6%) |
|
Неврологические проявления |
|
|
Менингит, менингизм |
12 (38,7%) |
|
Головная боль, головокружение |
28 (90,3%) |
|
Сонливость, вялость, беспокойство, изменения |
28 (90,3%) |
|
психического состояния |
|
Респираторные симптомы |
|
|
Кашель, одышка, снижение Spo2 |
12 (38,7%) |
|
Симптомы поражение желудочно-кишечного тракта |
|
|
Тошнота, рвота, диарея, боли в животе |
14 (45,1%) |
Клинические проявления ДМВС во многом зависели от возраста пациентов. Помимо лихорадки и гуморальной активности, у детей до 5 лет чаще, по сравнению с другими возрастными группами, преобладали кожные и кожно-слизистые симптомы, симптомы поражения желудочно-кишечного тракта, респираторные симптомы, в то время как у детей школьного возраста чаще манифестировали сердечно-сосудистые и неврологические нарушения, кардиореспираторная недостаточность. Суставной синдром отмечался одинаково часто в разных возрастных группах.
Нарушения иммунной регуляции у обследованных с ДМВС характеризовались низким уровнем Т и В лимфоцитов.
Мы поддерживаем мнение ряда авторов о том, что снижение количества Т-клеток (CD3, CD4, CD8) находится во взаимодействии с уровнем противовоспалительных цитокинов в плазме крови, в том числе с содержанием фактора некроза опухоли (TNF-a) и интерлейкинов IL-6 IL-10 [6].
Важно обращать внимание на количество и активность Т-клеток не меньше, чем на состояние функции дыхания у пациентов. Пациентам с более низким уровнем Т-лимфоцитов требуется более раннее медицинское вмешательство [7 ].
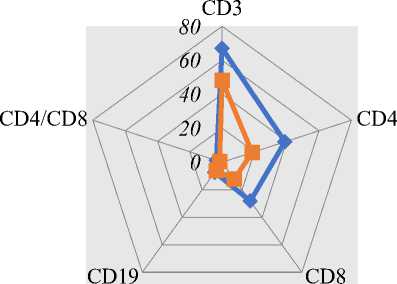
Рисунок 4. Нарушения иммунной регуляции у пациентов с детским мультивоспалительным синдромом, ассоциированным с COVID-19
-^контроль
—•—ДМВС
С учетом инфекционного, воспалительного патогенеза ДМВС с развитием нарушений гемостаза, иммунной дисрегуляции пациентам назначали соответствующую терапию, рекомендуемую международными и отечественным протоколам [8, 9]. Отмечалась большая потребность в системных глюкокортикоидах (пульс-терапия метипреднизолоном, терапия дексаметазоном), антикоагулянтах. Применение иммуноглобулина для внутривенного введения было показано 18 больным, преимущественно у пациентов с менингитом и менгоэнцефалитом, Кавасаки - подобном синдромом (Таблица 2). Потребность в назначении генно-инженерных биологических препаратов отмечалась у пациентов при неэффективности предшествующей терапии.
Пандемия COVID-19 спровоцировала рост новых СЗСТ или ревматических заболеваний, которые имеют аутоиммунную природу, усугубляя существующий иммунодефицит.
Развитие аутоиммунных состояний после инфекции COVID-19 может быть связано с двумя факторами. Это подавление иммунитета и генетическая предрасположенность к аутоиммунным состояниям.
Таблица 2
|
Терапия |
|
|
Иммуноглобулины для внутривенного применения |
18 (58,0%) |
|
Системные глюкокортикостероиды |
29 (93,5%) |
|
Антикоагулянты |
29 (93,5%) |
|
Анакинра (ингибитор ИЛ-1) |
- |
|
Тоцилизумаб (ингибитор ИЛ-6) |
5 (16,1%) |
|
Инфликсимаб (ингибитор ФНО альфа) |
- |
|
В условиях ОРИТ |
5 (16,1%) |
|
Вазоактивная (вазопрессорная поддержка) |
15 (48,4%) |
|
ИВЛ |
3 (9,6%) |
|
Экстракорпоральная мембранная оксигенация |
- |
При COVID-19 происходит подавление иммунной системы, что, возможно, провоцирует развитие аутоиммунных процессов. После заражения коронавирусом у 23 пациентов развились СЗСТ (системная красная волчанка, дерматомиозит, полимиозит, ювенильный артрит, синдром Гийена-Барре, васкулиты — иммунологическое воспаление сосудов (Таблица 3).
Таблица 3
ЧАСТОТА РЕВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ, СПРОВОЦИРОВАННЫХ ПЕРЕНЕСЕННОЙ НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИЕЙ У ДЕТЕЙ В УСЛОВИЯХ ПАНДЕМИИ
|
Заболевание (синдром) |
абс. % |
|
СКВ |
2 (8,6%) |
|
Дерматомиозит |
3 (13,3%) |
|
Полимиозит |
3 (13,3%) |
|
Васкулит |
4 (17,4%) |
|
Синдром Гийена Барре |
6 (26,08%) |
|
Ювенильный идиопатический артрит (ЮИА) |
5 (21,7%) |
|
Всего |
23 (100%) |
Течение СЗСТ спровоцированных SARS CoV 2 отличается прогностически неблагоприятным течением и торпидностью к лечению.
У больных СЗСТ, спровоцированных SARS CoV 2, был выявлен значительный дисбаланс неспецифического, клеточного и гуморального иммунитета. Установлена депрессия Т-зависимого иммунитета одновременно с резкой активизацией В-зависимого иммунитета, уменьшение уровня Т-лимфоцитов (CD3, CD4, CD8) приводит к снижению иммуно-регуляторного индекса, депрессия которого соответствовала тяжести течения и активности болезни (Рисунок 7).
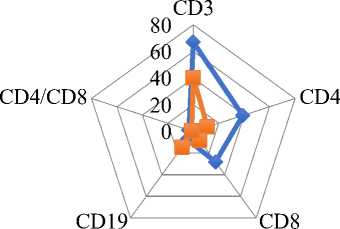
Рисунок 7. Нарушение иммунной регуляции у детей с системными заболеваниями соединительной ткани, ассоциированными с COVID 19
—♦— контроль
-►СЗСТ
Наиболее обоснованным методом лечения была программная синхронная интенсивная терапия (СИТ) (плазмаферез, мегадозы метипреда и цитостатики). СИТ способствовала снижению активности заболевания, хотя к концу 1 месяца от начала лечения сохранялось торпидное течение заболевания, склонность к хронизации (Таблица 4).
Таблица 4
ХАРАКТЕРИСТИКА ТЕРАПИИ ПАЦИЕНТОВ С СИСТЕМНЫМИ ЗАБОЛЕВАНИЯМИ СОЕДИНИТЕЛЬНОЙ ТКАНИ, АССОЦИИРОВАННЫМИ С COVID-19
|
Потребность |
Обеспечение абс. (%) |
|
Синхронная интенсивная терапия (пульс-терапия метилпреднизолоном _ цитостатики) |
9 (39,13%) |
|
Плазмаферез |
1 (4,3%) |
|
Генноинженерная биологическая терапия |
3 (13,0%) |
|
НПВП+ цитостатики (в том числе комбинированная терапия) |
23 (100%) |
|
ГКС |
18 (78,3%) |
|
Местная терапия (ГКС+ цитостатики) |
15 (65,2%) |
Имелись показания для применения генно-инженерной биологической терапии. Пандемия COVID-19 у ряда больных спровоцировала обострение уже имеющихся системных заболеваний соединительной ткани (СЗСТ). Пациенты с СЗСТ находятся в группе высокого (очень высокого) риска инфицирования SARS-CoV-2 вследствие имеющегося иммунодефицита. Присоединение инфекции SARS-CoV-2 обусловливает развитие постковидных синдромов, в патогенезе которых одним из ведущих причин является аутоагрессия с формированием большого количества коморбидных состояний, требующих назначения базисной терапии иммуносупрессивными препаратами (Рисунок 8).
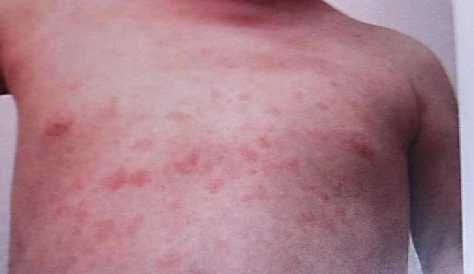
Рисунок 8. Пятнистые высыпания у ребенка А. Ж. 7 лет с системным вариантом ЮРА, ассоциированным с COVID 19. Начало заболевания через 3 месяца после коронавирусной инфекции ИФА SARS CoV 2 IgG - 9,5 IgM – отр.
Нами выявлено 29 клинических случаев СЗСТ, обострившихся после перенесенной коронавирусной инфекции (Таблица 5). В структуре перечисленных заболеваний в 13,7% случаев выявлялись OVERLAP синдромы (СД+ЮРА, СКВ+ЮРА).
Таблица 5
ЧАСТОТА РЕВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ, ОБОСТРИВШИХСЯ ПОСЛЕ ПЕРЕНЕСЕННОЙ НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИИ У ДЕТЕЙ В УСЛОВИЯХ ПАНДЕМИИ
|
Заболевания (синдромы) |
абс. % |
|
Перекрестные формы (OVERLAP синдром) СД+ЮРА, СКВ+ЮРА |
4 (13,7%) |
|
Узелковый периартерии |
6 (20,6%) |
|
Системные васкулиты |
4 (13,7%) |
|
СКВ |
5 (17,24%) |
|
Склеродермия |
5 (17,24%) |
|
Ювенильный дерматомиозит |
4 (13,7) |
|
Узловатая эритема |
1 (3,4%) |
|
Всего |
29 (100%) |
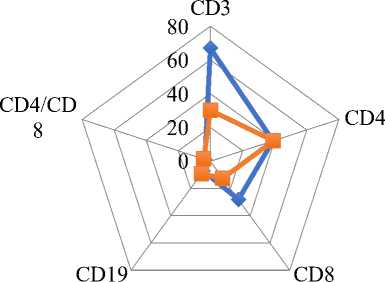
Нарушения иммунного статуса у этой категории больных характеризуется абсолютной CD3+ и CD8+ лимфопенией (Рисунок 9) Эта группа СЗСТ отличалась длительным прогрессированием, формированием ранних функциональных нарушений.
Патология иммунной системы при СЗСТ и сопутствующая коронавиирусная инфекция утяжеляет течение основного заболевания.
У данной категории пациентов была потребность не только в ГКС терапии с применением антикоагулянтов и вазодилятаторов, но и в ВВИГ и генноинженерной биологической терапии (Таблица 6).
Таким образом, новая коронавирусная инфекция у детей чревата тяжелыми последствиями в постинфекционном периоде. Роль вирусной инфекции в развитии различных нозологических форм СЗСТ изучена недостаточно, особенно в детском возрасте, несмотря на предположение инфекционных факторов.
о провоцирующем и даже этиологическом значении
—♦— контроль
-► СЗСТ
ХАРАКТЕРИСТИКА ТЕРАПИИ ПАЦИЕНТОВ С ДМВС НА ОСНОВАНИИ СОБСТВЕННЫХ НАБЛЮДЕНИЙ
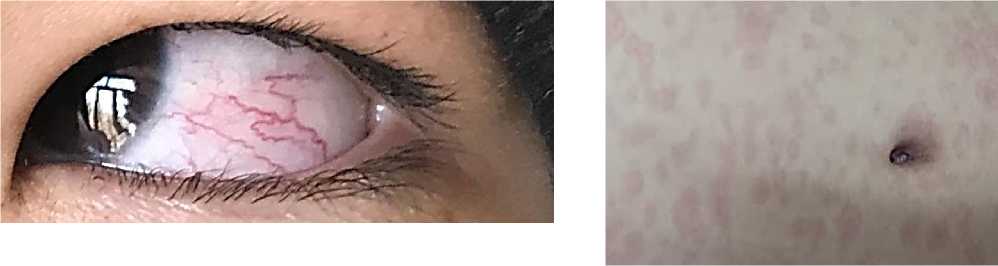
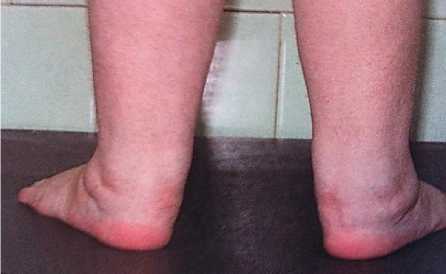
Рисунок 5. Клинический пример. МВС Кавасаки подобный синдром. Девочка Ребенок К. С., 28.01.09 года рождения, город Бишкек, Диагноз «Мультисистемный воспалительный синдром.
Кавасаки подобный синдром (сыпь, склерит)»
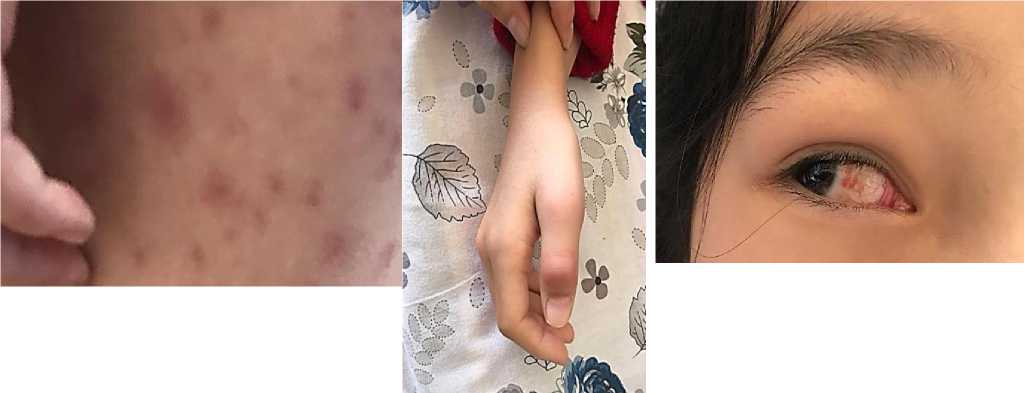
Рисунок 6. Ребенок К. С., 28.01.09 года рождения. Диагноз «Мультисистемный воспалительный синдром. Кавасаки подобный синдром (сыпь, склерит, артрит)»
Рисунок 9. Нарушения иммунной регуляции у детей с системными заболеваниями соединительной ткани, обострившимися после COVID-19
Таблица 6
ХАРАКТЕРИСТИКА ТЕРАПИИ ПАЦИЕНТОВ С СИСТЕМНЫМИ ЗАБОЛЕВАНИЯМИ
СОЕДИНИТЕЛЬНОЙ ТКАНИ, ОБОСТРИВШИМИСЯ ПОСЛЕ COVID-19
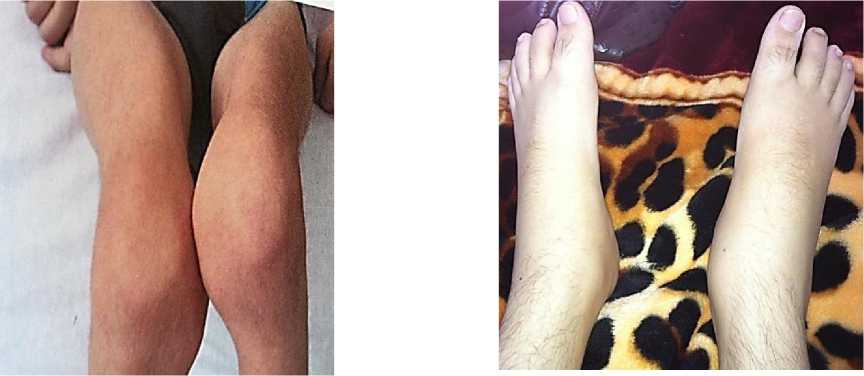
Рисунок 9. У мальчиков Б. Б. 15 лет и С. А., 16 лет с суставной формой ЮРА после перенесенной COVID-19 обострение заболевания. Отмечалась генерализация процесса с поражением коленных, голеностопных суставов, развитием васкулита, лихорадки, полиорганных поражений
|
Потребность |
Обеспечение абс. (%) |
|
Глюкокортикоиды (ГК) — препараты противовоспалительного, иммуносупрессивного действия: преднизолон, метипред |
29 (100%) |
|
Цитостатики (ЦС) — препараты иммуносупрессивного, антипролиферативного, противовоспалительного, антифиброзного действия: циклофосфан, азатиоприн, метотрексат, Д-пенициламин |
29 (100%) |
|
Антикоагулянты, антиагреганты, — гепарин, фраксипарин, аспирин, дипиридамол |
14 (48,2%) |
|
Периферические вазодилататоры, пентоксифиллин, вазопростан и др. |
18 (62,1%) |
|
Препараты ВВИГ |
3 (10,3%) |
|
Генно-инженерная биологическая терапия |
2 (6,8%) |
Требуется накопление и обобщение опыта ведения пациентов детского возраста с ДМВС и с системными проявлениями ревматических болезней, ассоциированными с перенесенной новой коронавирусной инфекцией, совершенствование терапевтических подходов, изучение катамнеза пациентов, определение риска формирования осложнений.
Важно разработать единый подход к пациентам, перенесшим COVID ‑ 19, и к возникшим, в связи с этим мультисистемным заболеваниям.
Выводы:
Представленная первая в нашей стране серия собственных клинических наблюдений 31 пациентов с ДМВС, 23 пациентов с СЗСТ, ассоциированных COVID ‑ 19, и 29 — с обострением СЗСТ в связи с перенесенной коронавирусной инфекцией наглядно демонстрирует этиологическую и патогенетическую значимость SARS CoV2 в возникновении тяжелого системнго воспалительного ответа.
Своевременное противовоспалительное лечение ДМВС имеет решающее значение и должно быть адаптировано для каждого пациента с целью достижения наиболее благоприятного эффекта.
Пациенты СЗСТ составляют группу риска в отношении заболевания COVID-19 и неблагоприятного течения болезни
Основными принципами лечения СЗСТ являются подавление активности патологического процесса и поддержание ремиссии. Индукция ремиссии осуществляется путем назначения противовоспалительных иммуносупрессивных препаратов. При тяжелых (кризовых) состояниях (почечном или полиорганном волчаночном кризе, миопатическом кризе при ЮДМ, тромбангиотическом — при ЮП) обоснована инфузионная терапия, пульс-терапия (ГК, ГК+ЦС), плазмаферез, синхронизированный с пульс-терапией, ВВИГ.
Список литературы Клиническая характеристика ревматических болезней и детского мультисистемного воспалительного синдрома, ассоциированных с COVID-19
- Verdoni L., Mazza A., Gervasoni A., Martelli L., Ruggeri M., Ciuffreda M., D'Antiga L. An outbreak of severe Kawasaki like disease at the Italian epicentre of the SARS CoV 2 epidemic: an observational cohort study // The Lancet. 2020. V. 395. №10239. P. 1771 1778. https://doi.org/10.1016/S0140 6736(20)31103 X
- Feldstein L. R., Rose E. B., Horwitz S. M., Collins J. P., Newhams M. M., Son M. B. F., Randolph A. G. Multisystem inflammatory syndrome in US children and adolescents // New England Journal of Medicine. 2020. V. 383. №4. P. 334 346. https://doi.org/10.1056/NEJMoa2021680
- Belhadjer Z., Méot M., Bajolle F., Khraiche D., Legendre A., Abakka S., Bonnet D. Acute heart failure in multisystem inflammatory syndrome in children in the context of global SARS CoV 2 pandemic // Circulation. 2020. V. 142. №5. P. 429 436. https://doi.org/10.1161/CIRCULATIONAHA.120.048360
- Whittaker E., Bamford A., Kenny J., Kaforou M., Jones C. E., Shah P., Levin M. Clinical characteristics of 58 children with a pediatric inflammatory multisystem syndrome temporally associated with SARS CoV 2 // Jama. 2020. V. 324. №3. P. 259 269. 1 https://doi.org/10.1001/jama.2020.10369
- Новикова Ю. Ю., Овсянников Д. Ю., Глазырина А. А., Жданова О. И., Зверева Н. Н., Карпенко М. А., Горев В. В.Клиническая, лабораторно инструментальная характеристика, течение и терапия детского мультисистемного воспалительного синдрома, ассоциированного с COVID 19 // infection. 2020. Т. 33. №7. С. 824 825. https://doi.org/10.24110/0031 403X 2020 99 6 73 83
- Каратеев Д. Е., Лучихина Е. Л. Иммуномодулирующая медикаментозная терапия при заболевании, вызванном инфекцией SARS CoV 2 (COVID 19) // Альманах клинической медицины. 2020. Т. 48. №S1. 51 67. https://doi.org/10.18786/2072 0505 2020 48 036
- Мареев В. Ю., Орлова Я. А., Павликова Е. П., Мацкеплишвили С. Т., Краснова Т. Н., Малахов П. С., Камалов А. А. Пульс Терапия стероидными гормоНамИ больных с Коронавирусной пневмонией (COVID 19), системным воспалением и риском венозных тромбозов и тромбоэмболий (исследование ПУТНИК) // Кардиология. 2020. Т. 60. №6. С. 15 29. https://doi.org/10.18087/cardio.2020.6.n1226
- Gautret P., Lagier J. C., Parola P., Hoang V. T., Meddeb L., Mailhe M., Doudier B., Courjon J., Giordanengo V., Vieira V. E., Tissot Dupont H., Honore S., Colson P., Chabriere E., La Scola B., Rolain J. M., Brouqui P., Raoult D. Hydroxychloroquine and azithromycin as a treatment of COVID 19: results of an open label non randomized clinical trial. Int J. Antimicrob Agents. 2020; 56(1):105949.
- Omarjee L., Janin A., Perrot F., Laviolle B., Meilhac O., Mahe G. Targeting T cell senescence and cytokine storm with rapamycin to prevent severe progression in COVID 19 // Clinical immunology. 2020. V. 216. P. 108464. https://doi.org/10.1016/j.clim.2020.108464


