Клиническая эффективность применения ривароксабана у пациента с идиопатическим легочным фиброзом и тромбозом правого желудочка
Автор: Муркамилов Илхом Торобекович, Айтбаев Кубаныч Авенович, Фомин Виктор Викторович, Муркамилова Жамиля, Юсупов Фуркат Абдулахатович, Айдаров Зиябидин Абдирайимович, Байжигитова Айгуль Акылбековна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 1 т.7, 2021 года.
Бесплатный доступ
Цель исследования. Изучить эффективность терапии ривароксабаном, динамику показателей почечной функции и цитокинового статуса у пациента с идиопатическим легочным фиброзом и тромбозом правого желудочка. Материал и методы. Приводится разбор клинического случая пациента Б., 49 лет, страдающего идиопатическим легочным фиброзом (ИЛФ) с медленно прогрессирующим течением, осложненным хронической дыхательной недостаточностью, вторичной легочной гипертензией, легочным сердцем и тромбозом правого желудочка. Проведены лабораторные (определение содержания креатинина, цистатина С, фактора некроза опухоли-альфа (TNF-α) и интерлейкина (IL) -10) и инструментальные (эхокардиография и ультразвуковое сканирование каротидных артерий) исследования исходно и в динамике лечения комбинацией «ривароксабан + ацетилсалициловая кислота (АСК)». В течение всего периода наблюдения пациент принимал ривароксабан 20 мг, АСК 100 мг, лизиноприл 5 мг, бисопролол 2,5 мг в сутки и оксигенотерапию в амбулаторных условиях. Результаты. Комбинированная терапия «ривароксабан 20 мг + ацетилсалициловая кислота 100 мг» в сутки привела к растворению тромба у данного пациента. В динамике наблюдения отмечалось снижение содержание цистатина С (1,10 мг/л против и 1,13 мг/л) и увеличение (72,0 мл/мин против 66,7 мл/мин) расчетной скорости клубочковой фильтрации. Выросла концентрация IL-10 плазмы крови (исходно 8,904 пг/мл против 16,216 пг/мл в динамике, соответственно), снизился уровень TNF-α (исходно 3,750 пг/мл против 1,957 пг/мл в динамике, соответственно). В процессе лечения выявлено уменьшение полости правого желудочка (3,2 см против 3,5 см), диаметра легочной артерии (3,1 см против 3,5 см), давления в легочной артерии (63 мм рт. ст. против 74 мм рт. ст.) и прирост величины систолической экскурсии кольца трехстворчатого клапана (2,1 см против 2,0 см) по сравнению с исходными данными. Заключение. Применение ривароксабана в дозе 20 мг и ацетилсалициловой кислоты 100 мг в сутки у пациента с тромбозом правого желудочка вследствие идиопатического легочного фиброза, осложненного хронической сердечной недостаточностью является эффективным и безопасным в отношении профилактики системной эмболии церебрального инсульта. Комбинация ривароксабан + низкие дозы ацетилсалициловой кислоты в составе традиционной терапии оказывает положительный кардио-и нефропротективный эффект.
Идиопатический легочный фиброз, легочная гипертензия, дыхательная недостаточность, правый желудочек, тромбоз, ривароксабан
Короткий адрес: https://sciup.org/14117920
IDR: 14117920 | УДК: 616-002.2, | DOI: 10.33619/2414-2948/62/15
Текст научной статьи Клиническая эффективность применения ривароксабана у пациента с идиопатическим легочным фиброзом и тромбозом правого желудочка
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616-002.2;615.035.1
Клинический анализ крови: гемоглобин (Hb) 153 г/л, эритроциты 5,0×1012/л, тромбоциты 174×109/л, скорость оседания эритроцитов — 3 мм/час. Биохимический анализ крови: концентрация мочевины 4,7 ммоль/л, остаточного азота 16,8 ммоль/л, креатинина 80,0 мкмоль/л, расчетная скорость клубочковой фильтрации (рСКФ) 99 мл/мин по CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) [15]. Уровень цистатина С плазмы крови составил 1,13 мг/л, а рСКФ по формуле F. J. Hoek et al. (2003) [16] — 66,7 мл/мин. Липидный профиль: общий холестерин (ХС) 3,37 ммоль/л, ХС липопротеинов высокой плотности 1,11 ммоль/л, ХС липопротеинов низкой плотности 1,88 ммоль/л, триглицериды 0,99 ммоль/л. Д-димер (количественный) 536 нг/мл (норма до 500). Элементный состав крови: магний 0,82 ммоль/л, кальций 2,16 ммоль/л, фосфор неорганический 1,41 ммоль/л, натрий 144 ммоль/л, калий 4,0 ммоль/л. Мочевая кислота 0,45 ммоль/л. Цитокиновый статус: фактор некроза опухоли-альфа (TNF-α) 3,750 пг/мл (норма до 6 пг/мл), интерлейкин (IL) 10 — 8,904 пг/мл (норма до 31 пг/мл).
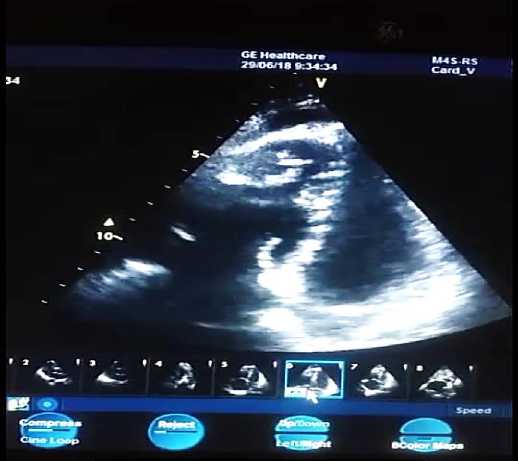
Рисунок 1. Тромб в полости правого желудочка (исходно).
Рентгенография грудной клетки: диффузный пневмосклероз, больше выраженный в нижних и средних отделах; рассеянные очаговые тени, местами сливающиеся между собой. Компьютерная томография грудной клетки соответствует картине обычной интерстициальной пневмонии — изменения по типу «сотового легкого», нерегулярные линейные тени, утолщение междольковых перегородок.
На основании жалоб, анамнеза, клинической картины и результатов обследования пациенту был поставлен клинический диагноз [17]: «Идиопатический легочный фиброз, медленно прогрессирующее течение. Хроническая дыхательная недостаточность II степени. Вторичная легочная гипертензия. Хроническое легочное сердце, компенсация. Сердечная недостаточность функциональный класс II NYHA (New York Heart Association) Functional Classification. Тромбоз правого желудочка. Хронический неатрофический гастрит. Хроническая болезнь почек, 2 стадия. Высокий (дополнительный) сердечно-сосудистый и церебральный риск.
Наряду с оксигенотерапией (4 л/мин), пациенту были назначены: глюкокортикоиды (преднизалон 90 мг внутривенно капельно), цефалоспорины (цефтриаксон 1 г внутривенно), отхаркивающие (амброксол 90 мг в сутки), ингибиторы протоновой помпы (омепразол 40 мг в сутки), ингибиторы ангиотензин-превращающего фермента (иАПФ) (лизиноприл 10 мг в сутки), антиагреганты (ацетилсалициловая кислота (АСК) 100 мг в сутки), низкомолекулярные гепарины (эноксапарин натрия 40 мг в сутки, строго в положении пациента лежа глубоко, подкожно). Далее, учитывая отсутствие возможностей у пациента для проведения оценки контроля внешнего состояния свертывающей системы крови (протромбиновое время (ПТВ), протромбиновый индекс (ПТИ) и международное нормализованное отношение (МНО)) по месту жительства, ему назначен прием ривароксабана в суточной дозе 20 мг. При выписке из клиники рекомендовано проведение контрольной ЭхоКГ через два месяца на фоне терапии ривароксабаном и АСК 100 мг в сутки. Кроме того, пациенту также была рекомендована дополнительно оксигенотерапия в амбулаторных условиях, прием иАПФ 5 мг и бисопролола 2,5 мг в сутки. В динамике через два месяца пациент повторно прошел клинико-лабораторное обследование и контрольную ЭхоКГ. Так, число тромбоцитов и эритроцитов, а также концентрация Hb в периферической крови существенно не изменились. Биохимический анализ крови: аспартатаминотрансфераза 35 ед./л, аланинаминотрансфераза 38 ед./л, калий плазмы крови 4,6 ммоль/л, С-реактивный белок (СРБ) 15 МЕ/л, ПТИ 66,5%, ПТВ 13,3 сек., фибриноген 2,6 г/л. Показатели азотовыделительной функции почек: креатинин 61,7 мкмоль/л, рСКФ 111 мл/мин по CKD-EPI [15], цистатин С — 1,10 мг/л, рСКФ по формуле F. J. Hoek et al. (2003) [16] 72 мл/мин. Цитокины центральной крови: TNF-α — 1,957 пг/мл (норма до 6 пг/мл), IL-10 — 16,216 пг/мл (норма до 31 пг/мл). Концентрация Д-димера составила 486 нг/мл, фибриногена — 3,6 г/л.
В анализах мочи неизмененные эритроциты отсутствуют, а измененные эритроциты – единичные в поле зрения. Протеинурия 0,34 г/л. ЭхоКГ, проведенная в динамике через два месяца, выявила некоторое сокращение диаметра легочной артерии (3,1 см) и полости ПЖ (3,2 см), прирост величины систолической экскурсии кольца трехстворчатого клапана (2,1 см) и снижение систолического легочного АД (63 мм рт. ст.). Признаков тромбоза ПЖ (Рисунок 2) не выявлено.
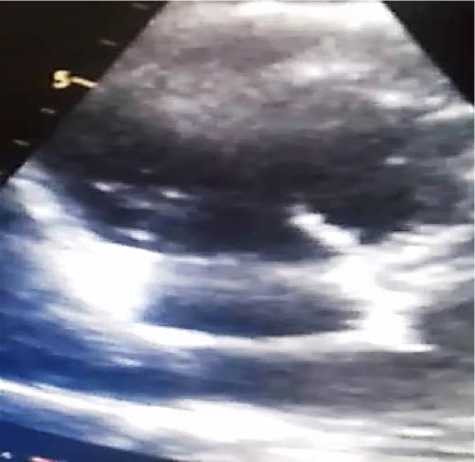
Рисунок 2. Полость правого желудочка (в динамике).
Обсуждение
Важную роль в развитии тромбоза играет тромбин, важнейший компонент системы свертывания крови [18]. Тромбин относится к ферментам класса гидролаз и образуется при энзиматическом отщеплении двух участков от протромбина активированным фактором X (Xa) [19]. Активность фактора Xa существенно повышается при его связывании с активированным фактором V(Va), что приводит к образованию протромбиназного комплекса. Таким образом, тромбин считается ключевым фактором свертывания крови, превращающим растворимый фибриноген в фибрин, а Xa-фактор является непосредственным активатором тромбина [20]. Установлено, что тромбин и Xa-фактор воздействуют на специфические PAR-рецепторы (protease activated receptors), представленные на поверхностях эндотелиоцитов, лейкоцитов и тромбоцитов, которые поддерживают процессы повреждения эндотелия и агрегации тромбоцитов [21–22]. В экспериментальных исследованиях продемонстрировано, что увеличение содержания тромбина в результате чрезмерного действия Xa-фактора, способствует прогрессированию сосудистого воспаления и образованию тромбов [23–24].
Роль фибриногена в развитии кардиоваскулярных осложнений может быть обусловлена тем, что он в значительной степени определяет вязкость плазмы, участвует в адгезии клеток, агрегации тромбоцитов, проникает в атеросклеротические бляшки (АСБ), где превращается в фибрин, связывающий тромбин и стимулирующий миграцию и пролиферацию гладкомышечных клеток и моноцитов [25]. Традиционно артериальные тромбы образуются обычно в области поврежденных АСБ и состоят преимущественно из агрегатов тромбоцитов, скрепленных нитями фибрина [26]. В отличие от артериальных тромбов, венозные тромбы могут образовываться в участках без видимых повреждений стенки сосуда, но с замедленной скоростью тока крови и состоят преимущественно из фибрина, эритроцитов и небольшого числа тромбоцитов [27]. Как установлено, высокий риск тромбозов и тромбоэмболии характерен для лиц с ИЛФ. Тромбообразование в полости сердца при ИЛФ обусловлено локальными нарушениями внутрисердечной гемодинамики, активацией свертывающей системы крови, тромбоцитов, снижением фибринолитической активности, повышением вязкости крови и дисфункцией эндотелия [28–29]. Очевидно, что изложенные патофизиологические сдвиги, обусловленные, в частности, хронической ДН, сердечной недостаточностью, легочной гипертензией и ограничением движения, имели место и у нашего пациента. Д-димер — это общепризнанный лабораторный маркер фибринообразования, повышенный уровень которого свидетельствует об активации каскада коагуляции [30–31], что и наблюдалось у нашего пациента с тромбозом ПЖ. Этот факт еще раз подтверждает положение о том, что при подозрении на наличие тромбозов и эмболии измерение содержание Д-димера дает весьма ценный результат, так как Д-димер является важнейшим лабораторным тестом, обладающим весьма высокой чувствительностью и средней специфичностью, а также высокой отрицательной прогностической значимостью [32]. А при референсных значениях, Д-димер крови позволяет надежно исключить тромбоз с вероятностью 98% [33]. Было показано, что повышенный уровень Д-димера, измеренный через 3–4 недели после прекращения лечения антикоагулянтами, соотносится с повышенным риском рецидива тромбоэмлолических событий [34]. Важно отметить, что появилось предположение, что определение Д-димера может помочь в оптимизации антикоагулянтной терапии у больных с тромбозом [34]. Измерение содержания Д-димера в динамике на протяжении 18 месяцев показало, что на фоне антикоагулянтной терапии у большинства пациентов его уровень снижается до нормы уже в течение первого месяца лечения. Сохранение повышенного уровня Д-димера через 1 месяц лечения оказалось одним из двух независимых предикторов рецидива тромбозов в течение 18 месяцев [35]. Как уже сказано выше, лабораторно у нашего пациента выявлено повышение концентрации Д-димера.
Предполагается, что ривароксабан, действуя через Ха-фактор свертываемости крови, за счет снижения образования тромбина [36] нарушает формирование тромба и делает его более восприимчивым к действию фибринолитических ферментов [37]. Стоит отметить, что применение для профилактики тромбоэмболических событий антиагрегантов и, даже двойной антиагрегантной терапии (АСК + клопидогрель), дает незначительное улучшение прогноза и может использоваться только при невозможности применения антикоагулянтов [38–39]. Несмотря на достигнутые определенные успехи в кардиологии и ангиологии, эффективность мер по предотвращению появления тромбозов все еще остается далекой от совершенства [40]. Так, до 10% лиц с сердечно-сосудистыми заболеваниями ежегодно переносят тяжелые обострения или погибают [41], причем двойная антитромбоцитарная терапия, весь комплекс профилактических мер в том числе, не вполне адекватно защищают от тромботических осложнений [42]. Полученные на сегодня результаты международных исследований позволили экспертам рекомендовать новые пероральные антикоагулянты (НОАК), такие как дабигатран [43], апиксабан [44] и ривароксабан [45] для лечения острого эпизода венозной тромбоэмболии [46–47]. Так, с появлением на фармацевтическом рынке прямых НОАК все чаще стал применяться ривароксабан [48–51]. Безусловно, этому способствовала высокая терапевтическая эффективность, безопасный профиль, простота режима титрования и межлекарственное взаимодействие указанного препарата [52]. К тому же, часто цитируемое исследование ROCKET-AF (Rivaroxaban Once Daily, Oral, Direct Factor Xa Inhibition Compared With Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation) показало, что ривароксабан способен предотвращать тромбозы и эмболии, связанные с фибрилляцией предсердий (ФП) не менее эффективно, чем варфарин [53–54]. Примечательно, что ривароксабану свойственно быстрое начало действия, отсутствие необходимости мониторинга параметров гемостаза в процессе лечения, высокая биодоступность и низкий почечный клиренс [52, 55–56]. Большая часть препарата метаболизируется печенью, выводится в неактивном виде почками [52, 57–58], период полувыведения ривароксабана составляет примерно 7–11 часов, максимальная концентрация в плазме крови достигается через 2–4 ч после приема внутрь [52].
Следующей причиной, способствующей широкому применению НОАК в клинической практике, явились рекомендации экспертов Российского кардиологического общества (РКО), Всероссийского научного общества специалистов по клинической электрофизиологии, аритмологии и кардиостимуляции (ВНОА) и Ассоциации сердечно-сосудистых хирургов (АССХ) по применению дабигатрана и ривароксабана у пациентов с неклапанной ФП и средним или высоким риском развития ишемического инсульта [59–60].
Так, А. Ю. Рычков и соавт. (2014) показали, что прием ривароксабана в суточной дозе 20 мг на протяжении трех месяцев приводит к растворению тромба в ушке левого предсердия (ЛП) у пациента с артериальной гипертензией и пароксизмальной формой ФП при проведении катетерной аблации [61]. По мнению авторов, данное клиническое наблюдение демонстрирует возможность применения нового перорального антикоагулянта ривароксабана при тромбозе ушка ЛП у пациентки с пароксизмальной формой ФП при подготовке и проведении операции катетерной аблации [61]. Отрадно отметить, что случаи успешного растворения тромба ЛЖ при приеме ривароксабана 20 мг в сутки у пациента с постинфарктным кардиосклерозом (ПК), тромбозами стентов, с резистентностью к терапии клопидогрелом и прасугрелом, описаны в наблюдении С. В. Шекоян и соавт. (2016) [62]. В этом клиническом наблюдении подробно описан лизис тромба ЛЖ при приеме ривароксабана у больного с ПК, тромбозами стентов, с резистентностью к терапии клопидогрелом и прасугрелом [62]. Обращает на себя внимание другой клинический случай, описанный Д. А. Иткин и соавт. (2015), где показано, что применение НОАК даже в столь пожилом возрасте и при наличии высокого кардиоваскулярного риска на протяжении более пяти лет, эффективно и безопасно предупреждает развитие тромбоэмболических осложнений [63]. В другом исследовании Н. Г. Ложкина и соавт. (2015) показали, что использование ривароксабана в дозе 20 мг и 15 мг в сутки у пациентов с хронической и перманентной формой ФП неклапанного происхождения с сопутствующей хронической болезнью почек 2– 3 стадии, эффективно и безопасно в отношении профилактики церебрального инсульта и системной эмболии [64].
Важно подчеркнуть, что ни один из изученных альтернативных режимов антитромбоцитарной терапии (клопидогрел против АСК, комбинация клопидогрела и АСК против АСК, тикагрелор против клопидогрела, комбинация тикагрелора и АСК против АСК)
у стабильных пациентов на клинической стадии атеросклероза с различной локализацией поражения артерий не демонстрировал достоверного снижения смертности по сравнению с режимом обычной терапии [65–66]. К тому же добавление ворапаксара к моно- или двойной антитромбоцитарной терапии не давало дополнительных преимуществ в отношении снижения смертности [67]. Ранее предполагалось, что варфарин в качестве монотерапии или в комбинации с АСК эффективнее последнего, однако в большей степени увеличивает риск кровотечений, в том числе — внутричерепных [68]. Кроме того, варфарин не имел преимуществ перед АСК у пациентов с периферическим атеросклерозом артерий.
В известном исследовании II фазы ATLAS ACS-TIMI 46 (Anti-Xa Therapy to Lower cardiovascular events in addition to Aspirin with or without thienopyridine therapy in Subjects with Acute Coronary Syndrome — Thrombolysis In Myocardial Infarction 46) проводилась оценка эффективности и безопасности применения ингибитора Ха-фактора ривароксабана у пациентов с острым коронарным синдромом, принимавших только АСК или АСК в сочетании с клопидогрелом [69]. Установлено, что применение ривароксабана в течение шести месяцев способствовало не только снижению риска атеротромботических событий, но и достоверно уменьшало частоту вторичной конечной точки [69].
В нашем клиническом случае пациент Б., находился в стационаре в режиме антикоагулянтной терапии инъекционным низкомолекулярным гепарином (НМГ). По данным Н. М. Воробьевой и соавт. (2015), преимущества эноксапарина над традиционной терапией НФГ связаны с более быстрым созданием адекватной антикоагуляции [70]. Вместе с тем, эти же исследователи, основываясь на собственном опыте перевода больных с эноксапарина на варфарин в амбулаторных условиях показали, что для подбора адекватной поддерживающей дозы варфарина у большинства пациентов требуется около 10 дней [71].
Рядом исследований установлено, что высокие дозы ривароксабана не уступают по эффективности НМГ [72]. Полагают, что ривароксабан в высокой дозе может быть конкурентной альтернативой НМГ у пациентов, нуждающихся в «переходной» терапии [73]. В клиническом исследовании EINSTEIN-DVT было продемонстрировано, что у пациентов с острым симптомным тромбозом глубоких вен ривароксабан обладает, по крайней мере, такой же эффективностью в профилактике рецидивов тромбоэмболии, как и стандартная терапия инъекционным эноксапарином с переходом на варфарин, при сопоставимом профиле безопасности [74]. Примечательно, что в исследовании EINSTEIN-Extension пациенты были рандомизированы на 3 группы в зависимости от показателя массы тела [75]. При этом отмечалась одинаковая эффективность ривароксабана во всех группах, на основании чего был сделан вывод о том, что фиксированная доза ривароксабана 20 мг 1 раз в сутки является оптимальной и достаточной для пациентов с избыточной массой тела. Обсуждая профиль безопасности препарата, следует отметить, что частота массивных кровотечений на фоне терапии ривароксабаном в дозе 20 мг один раз в сутки была низкой. Кроме того, результаты исследования EINSTEIN-Extension не показали отрицательного воздействия ривароксабана на функцию печени и почек — не было обнаружено случаев повышения мембранных ферментов более чем в три раза от нормы и билирубина более чем в два раза от нормального показателя, а также каких-либо серьезных нарушений функций печени. Существующее мнение о том, что носовые кровотечения и гематурия значительно чаще регистрируются у лечившихся ривароксабаном, носит противоречивый характер. Так, встречаемость геморрагических событий на фоне терапии НОАК были отмечены в исследовании А. А. Соколовой и соавт. (2015). При этом пациенты, вошедшие в данный регистр, были подразделены на три подгруппы в зависимости от вида терапии пероральными антикоагулянтами [76]. В когорте лиц, находившихся на терапии ривароксабаном, частота геморрагических событий была ниже по сравнению с апиксабаном и варфарином. Авторы исследования сообщают, что ни одного случая внутричерепного кровоизлияния в процессе проспективного наблюдения отмечено не было [76]. Примечательно, что в описанном нами случае в процессе терапии ривароксабаном в комбинации с АСК каких-либо геморрагических осложнений у пациента выявлено не было.
Вопросы, касающиеся комбинации низких доз АСК и ривароксабана полностью отражены в ряде проспективных вмешательствах. Так, по данным J. W. Eikelboom et al. (2017) в исследовании COMPASS (Cardiovascular Outcomes for People Using Anticoagulation Strategies Trial), в котором принимали участие 27395 пациентов (подгруппа ривароксабан + АСК, подгруппа ривароксабан, и подгруппа АСК), частота первичной конечной точки (кардиоваскулярная смерть, инфаркт миокарда, церебральный инсульт) была наименьшей в группе комбинированной терапии «ривароксабан + АСК» и достоверно отличалась от таковой в группе стандартной терапии АСК [77]. Этот факт нашел подтверждение и в нашем наблюдении, т. е. пациенту, как уже отмечалось, был назначен режим комбинированной терапии «ривароксабан + низкие дозы АСК». При этом, серьезных эпизодов кровотечения или отклонения со стороны лабораторных показателей выявлено не было, что еще раз согласуется с результатами проспективного исследования COMPASS, где отмечено, что режим терапии ривароксабан + низкие дозы АСК обладает большей суммарной клинической эффективностью.
Хочется отметить, что в динамике лечения ривароксабаном, иАПФ, бета-блокаторами и антиагрегантом у пациента Б. заметно выросла азотовыделительная функция почек. Так, в динамике, произошло снижение содержания цистатина С плазмы крови и повышение величины СКФ. Полученные нами данные вполне согласуются с результатами других исследований, где терапия НОАК у лиц с высоким нефроцеребральным риском не сопровождалась торможением СКФ [78–79]. На наш взгляд, снижение уровня цистатина С плазмы крови имеет двоякое клиническое значение: во-первых — нефропротекция, во-вторых, редукция кардиоцеребрального риска. Роль цистатина С в формировании нефро- и кардиоцеребрального риска описаны нами в ранее проведенных исследованиях [80].
Предполагается, что нефропротективный потенциал НОАК связан, прежде всего, с улучшением микроциркуляции в почечной паренхиме, снижением интенсивности воспаления [78]. Противовоспалительные свойства НОАК были отмечены в недавно проведенных популяционных исследованиях [81–84]. Ряд исследователей, основываясь на научных фактах о высокой эффективности избирательного подавления Ха-фактора в предотвращении атеротромбоза, выдвигают предположение о том, что применение ривароксабана может обладать антиатерогенным и противовоспалительным действием [40].
Однако, в доступной литературе мы не нашли работ, где оценивались бы показатели TNF-α и IL-10 плазмы крови на фоне терапии ривароксабаном. Как отмечено, в нашем клиническом случае терапия ривароксабаном + АСК привела к снижению концентрации провоспалительного цитокина (TNF-α исходно 3,750 пг/мл против 1,957 пг/мл в динамике). Что же касается противовоспалительного цитокина IL-10, то его уровень в динамике терапии ривароксабаном + АСК существенно повысился (16,216 пг/мл против 8,904 пг/мл). Данный факт наводит на мысль о возможном обострении ИЛФ у нашего пациента, так как по современным данным, цитокины принимают участие в прогрессировании заболевания и присоединении неблагоприятных осложнений [85–86]. Что же касается появления протеинурии у нашего пациента (чего не отмечалось в начале терапии), то в данном случае она является либо проявлением системного воспаления в рамках обострения ИЛФ, либо индуцирована ривароксабан-терапией. Полагаем, что развитие протеинурии отчасти может объясняться улучшением клубочковой фильтрации и кровотока в паренхиме почках, а слущивающийся эпителий в канальцах, возможно, служит источником образования белка в конечном продукте почек. Весьма привлекательным моментом в нашем клиническом случае является тенденция уменьшения полости ПЖ с одновременным снижением давления в малом круге кровообращения на фоне терапии ривароксабаном и АСК в сочетании с иАПФ и бета-блокаторами. На наш взгляд, на основе полученных данных можно сделать вывод о том, что НОАК, в частности ривароксабану, свойственен и кардиопротективный эффект.
В наши дни вопрос продления разных режимов терапии НОАК отдельным категориям лиц остается дискутабельным, хотя и известно, что американские, европейские и российские эксперты сходятся во мнении о том, что минимальная длительность антикоагулянтной терапии у всех пациентов тромбозом и эмболией должна составлять три месяца [87–89]. Есть данные, свидетельствующие о целесообразности пролонгирования антикоагулянтной терапии после завершения основного курса лечения НОАК. На это указывают результаты двух исследований с НОАК — EINSTEIN-Extension с ривароксабаном и AMPLIFY-EXT с апиксабаном [90–91]. В исследовании AMPLIFY-EXT [90] сравнили между собой и с плацебо лечебную (5 мг 2 раза в день) и профилактическую (2,5 мг 2 раза в день) дозы апиксабана. В EINSTEIN-Extension [91] ривароксабан (20 мг 1 раз в день) также сравнили с плацебо. Длительность терапии равнялась 6 или 12 месяцам в EINSTEIN-Extension и 12 месяцев — в AMPLIFY-EXT. Оба исследования показали существенные преимущества продления антикоагулянтной терапии в сравнении с плацебо. Прогностическая роль Д-димера и связанное с ним определение времени антикоагулянтной терапии становится краеугольным камнем в клинической медицине.
Стоит отметить, что в описанном нами клиническом случае концентрация Д-димера в динамике терапии ривароксабаном + АСК составила 486 нг/мл против 536 нг/мл (исходно), т. е. произошел спад его уровня.
Так, уровень Д-димера является предиктором осложненного течения многих заболеваний [32]. У больных, перенесших тромбоэмболические события, повышенный уровень Д-димера свидетельствует о высоком риске рецидива и целесообразности возобновления антикоагулянтной терапии [92–93]. В проспективных исследованиях Д-димер проявил себя как фактор риска ишемической болезни сердца, инсульта и смерти [94].
В заключение хотелось бы остановиться на некоторых фармакоэкономических аспектах применения НОАК. Так, недавние исследования подтвердили, что при выборе стратегии фармакотерапии с целью профилактики инсультов у пациентов с неклапанной ФП применение ривароксабана с клинической и фармакоэкономической точек зрения является более эффективным и выгодным, чем применение апиксабана [95]. В частности, по результатам выполненного фармакоэкономического исследования показано, что стратегия применения ривароксабана для профилактики мозгового инсульта у лиц с неклапанной ФП является менее затратной (49558,43 руб./год против 50027,57 руб./год) по сравнению с лечением апиксабаном. Сходные данные были получены в работе [96]. Стоимость годового курса приема дабигатрана была на 0,7% выше таковой ривароксабана: 36 524 руб. и 36 254 руб., соответственно.
Резюмируя наше исследование отметим, что в настоящее время ривароксабан является единственным антикоагулянтом из существующих НОАК, который в соответствии с Национальными рекомендациями «Сердечно-сосудистый риск и хроническая болезнь почек:
стратегии кардио-нефропротекции» может назначаться пациентам со СКФ от 15 до 29 мл/мин/1,73 м2, при этом доза составляет 15 мг один раз в день [97]. Здесь важно отметить, что у пациентов с СКФ <15 мл/мин/1,73 м2 прием ривароксабана не показан или должен быть приостановлен [98–99].
Заключение
Результаты описания клинического случая и анализ литературных данных позволяют сделать следующие выводы:
-
1. Использование ривароксабана в дозе 20 мг + ацетилсалициловая кислота 100 мг в сутки у пациента с тромбозом правого желудочка вследствие идиопатического легочного фиброза, осложненного хронической сердечной недостаточностью, эффективно и безопасно в отношении профилактики системной эмболии инсульта.
-
2. Комбинация ривароксабан + низкие дозы АСК в составе традиционной терапии оказывает положительный кардио- и нефропротективный эффект.
Список литературы Клиническая эффективность применения ривароксабана у пациента с идиопатическим легочным фиброзом и тромбозом правого желудочка
- Авдеев С. Н. Идиопатический легочный фиброз: современные подходы к терапии // Практическая пульмонология. 2015. №1. 22-31.
- Murkamilov I., Sabirov I., Fomin V., Aitbaev K., Yusupov F. Idiopathic pulmonary fibrosis: prevalence and risk factors (literature review) // The scientific heritage. 2020. №49. P. 42-49.
- Richeldi L. Assessing the treatment effect from multiple trials in idiopathic pulmonary fibrosis // European Respiratory Review. 2012. V. 21. №124. P. 147-151. DOI: 10.1183/09059180.00000912
- Raghu G., Chen S. Y., Hou Q., Yeh W. S., Collard H. R. Incidence and prevalence of idiopathic pulmonary fibrosis in US adults 18-64 years old // European Respiratory Journal. 2016. V. 48. №1. P. 179-186. DOI: 10.1183/13993003.01653-2015
- Sgalla G., Iovene B., Calvello M., Ori M., Varone F., Richeldi L. Idiopathic pulmonary fibrosis: pathogenesis and management // Respiratory research. 2018. V. 19. №1. P. 32. DOI: 10.1186/s12931-018-0730-2
- Leslie K. O. Idiopathic pulmonary fibrosis may be a disease of recurrent, tractional injury to the periphery of the aging lung: a unifying hypothesis regarding etiology and pathogenesis // Archives of pathology & laboratory medicine. 2012. V. 136. №6. P. 591-600.
- DOI: 10.5858/arpa.2011-0511-OA
- Nakamura Y., Suda T. Idiopathic pulmonary fibrosis: Diagnosis and clinical manifestations // Clinical Medicine Insights: Circulatory, Respiratory and Pulmonary Medicine. 2015. V. 9. P. CCRPM. S39897.
- DOI: 10.4137/CCRPM.S39897
- Бровко М. Ю., Акулкина Л. А., Шоломова В. И., Лебедева М. В. Идиопатический легочный фиброз (ИЛФ): современный подход к классификации и диагностике // Клиническая фармакология и терапия. 2018. Т. 27. №2. С. 43-49.
- Визель А. А., Белевский А. С. Современные аспекты лечения идиопатического легочного фиброза // Практическая пульмонология. 2017. №2. C. 93-98.
- Hutchinson J., Fogarty A., Hubbard R., McKeever T. Global incidence and mortality of idiopathic pulmonary fibrosis: a systematic review // European Respiratory Journal. 2015. V. 46. №3. P. 795-806.
- DOI: 10.1183/09031936.00185114
- Crooks M. G., Hart S. P. Coagulation and anticoagulation in idiopathic pulmonary fibrosis // European respiratory review. 2015. V. 24. №137. P. 392-399.
- DOI: 10.1183/16000617.00008414
- Farghaly S., El-Abdin A. Z. Pulmonary fibrosis as a risk factor for thromboembolic disease // Egyptian Journal of Bronchology. 2015. V. 9. №2. P. 160.
- DOI: 10.4103/1687-8426.158056
- Dinić M. Ž., Zečević R. D., Hajduković Z., Mijušković M., Đurić P., Jović Z.,.., Kandolf-Sekulović L. Psoriasis is the independent factor for early atherosclerosis: A prospective study of cardiometabolic risk profile // Vojnosanitetski pregled. 2016. V. 73. №12. P. 1094-1101.
- DOI: 10.2298/VSP150510134D
- Шиллер Н. Б., Осипов М. А. Клиническая эхокардиография. М: Практика. 2005.
- Levey A. S., Eckardt K. U., Tsukamoto Y., Levin A., Coresh J., Rossert J.,.., & Eknoyan G. Definition and classification of chronic kidney disease: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO) // Kidney international. 2005. V. 67. №6. P. 2089-2100.
- DOI: 10.1111/j.1523-1755.2005.00365.x
- Hoek F. J., Kemperman F. A. W., Krediet R. T. A comparison between cystatin C, plasma creatinine and the Cockcroft and Gault formula for the estimation of glomerular filtration rate // Nephrology Dialysis Transplantation. 2003. V. 18. №10. P. 2024-2031.
- DOI: 10.1093/ndt/gfg349
- Lynch D. A., Sverzellati N., Travis W. D., Brown K. K., Colby T. V., Galvin J. R.,.. Wells A. U. Diagnostic criteria for idiopathic pulmonary fibrosis: a Fleischner Society White Paper // The Lancet Respiratory Medicine. 2018. V. 6. №2. P. 138-153.
- DOI: 10.1016/S2213-2600(17)30433-2
- Абрамов М. Г. Руководство по гематологии. М.: НЬЮДИАМЕД, 2007. 1275 с.
- Lim T. K., Bloomfield V. A., Nelsestuen G. L. Structure of the prothrombin-and blood clotting factor X-membrane complexes // Biochemistry. 1977. V. 16. №19. P. 4177-4181.
- DOI: 10.1021/bi00638a007
- Ten Cate H., Bauer K. A., Levi M., Edgington T. S., Sublett R. D., Barzegar S.,.. Rosenberg R. D. The activation of factor X and prothrombin by recombinant factor VIIa in vivo is mediated by tissue factor // The Journal of clinical investigation. 1993. V. 92. №3. P. 1207-1212.
- DOI: 10.1172/JCI116691
- Coughlin S. R. Protease-activated receptors in hemostasis, thrombosis and vascular biology // Journal of Thrombosis and Haemostasis. 2005. V. 3. №8. P. 1800-1814.
- DOI: 10.1111/j.1538-7836.2005.01377.x
- Valente-Acosta B., Baños-González M. A., Peña-Duque M. A., Martínez-Ríos M. A., Quintanar-Trejo L., Aptilon-Duque G.,.. de la Peña-Díaz A. Association between stable coronary artery disease and in vivo thrombin generation // Cardiology Research and Practice. 2016. V. 2016.
- DOI: 10.1155/2016/5149825
- Grainger D. J., McWilliam N. A., Baglin T. P., Byrne C. D. Suppressing thrombin generation is compatible with the development of atherosclerosis in mice // Thrombosis research. 2001. V. 102. №1. P. 71-80.
- DOI: 10.1016/S0049-3848(01)00211-0
- Kalz J., Ten Cate H., Spronk H. M. H. Thrombin generation and atherosclerosis // Journal of thrombosis and thrombolysis. 2014. V. 37. №1. P. 45-55.
- DOI: 10.1007/s11239-013-1026-5
- Ariëns R. A. S. Fibrin (ogen) and thrombotic disease // Journal of Thrombosis and Haemostasis. 2013. V. 11. P. 294-305.
- DOI: 10.1111/jth.12229
- Hagedorn I., Vögtle T., Nieswandt B. Arterial thrombus formation // Hämostaseologie. 2010. V. 30. №03. P. 127-135.
- DOI: 10.1055/s-0037-1619045
- Turpie A. G. G., Esmon C. Venous and arterial thrombosis-pathogenesis and the rationale for anticoagulation // Thrombosis and haemostasis. 2011. V. 105. №04. P. 586-596.
- DOI: 10.1160/TH10-10-0683
- Çaylý M., Kanadaşi M., Demir M., Acartürk E. Mitral annular systolic velocity reflects the left atrial appendage function in mitral stenosis // Echocardiography. 2006. V. 23. №7. P. 546-552.
- DOI: 10.1111/j.1540-8175.2006.00260.x
- Rastegar R., Harnick D. J., Weidemann P., Fuster V., Coller B., Badimon J. J.,.. Goldman M. E. Spontaneous echo contrast video density is flow-related and is dependent on the relative concentrations of fibrinogen and red blood cells // Journal of the American College of Cardiology. 2003. V. 41. №4. P. 603-610.
- DOI: 10.1016/S0735-1097(02)02898-X
- Adam S. S., Key N. S., Greenberg C. S. D-dimer antigen: current concepts and future prospects // Blood, The Journal of the American Society of Hematology. 2009. V. 113. №13. P. 2878-2887.
- DOI: 10.1182/blood-2008-06-165845
- Орел Е. Б., Виноградов В. Л., Андреева А. С., & Васильев, С. А. Д-димер-маркер диагностики, мониторирования и прогнозирования тромбозов // Тромбоз, гемостаз и реология. 2012. №4. C. 33-40.
- Папаян Л. П., Князева Е. С. Д-димер в клинической практике. М., 2002.
- Schreiber D. H. The role of D-dimer in the diagnosis of venous thromboembolism // Laboratory Medicine. 2002. V. 33. №2. P. 136-141.
- DOI: 10.1309/JM5E-QQAD-XN79-00PY
- Fahrni J., Husmann M., Gretener S. B., Keo H. H. Assessing the risk of recurrent venous thromboembolism-a practical approach // Vascular health and risk management. 2015. V. 11. P. 451.
- DOI: 10.2147/VHRM.S83718
- Воробьева Н. М., Панченко Е. П., Добровольский А. Б., Титаева Е., Хасанова З., Коновалова Н.,.., Кириенко А. Независимые предикторы рецидива тромбоза глубоких вен (результаты проспективного 18-месячного наблюдения) // Кардиология. 2010. Т. 50. №12. С. 52-58.
- Gerotziafas G. T., Elalamy I., Depasse F., Perzborn E., Samama M. M. In vitro inhibition of thrombin generation, after tissue factor pathway activation, by the oral, direct factor Xa inhibitor rivaroxaban // Journal of Thrombosis and Haemostasis. 2007. V. 5. №4. P. 886-888.
- DOI: 10.1111/j.1538-7836.2007.02429.x
- Varin R., Mirshahi S., Mirshahi P., Klein C., Jamshedov J., Chidiac J.,.., Soria J. Whole blood clots are more resistant to lysis than plasma clots-greater efficacy of rivaroxaban // Thrombosis research. 2013. V. 131. №3. P. e100-e109.
- DOI: 10.1016/j.thromres.2012.11.029
- Holmes D. R., Kereiakes D. J., Kleiman N. S., Moliterno D. J., Patti G., Grines C. L. Combining antiplatelet and anticoagulant therapies // Journal of the American College of Cardiology. 2009. V. 54. №2. P. 95-109.
- DOI: 10.1016/j.jacc.2009.03.044
- Braun O. Ö., Bico B., Chaudhry U., Wagner H., Koul S., Tydén P.,.. van der Pals J. Concomitant use of warfarin and ticagrelor as an alternative to triple antithrombotic therapy after an acute coronary syndrome // Thrombosis Research. 2015. V. 135. №1. P. 26-30.
- DOI: 10.1016/j.thromres.2014.10.016
- Хирманов В. Н. Влияние ингибирования Xa фактора с помощью ривароксабана на прогрессирование, риск осложнений и смертность при ИБС // Российский кардиологический журнал. 2018. №3. C. 65-70.
- DOI: 10.15829/1560-4071-2018-3-65-70
- Bhatt D. L., Eagle K. A., Ohman E. M., Hirsch A. T., Goto Sh., Mahoney E. M., Wilson P. W. F., Alberts M. J., D'Agostino R., Liau Ch.-S., Mas J.-L., Röther J., Smith S. C., Salette G., Contant Ch. F., Massaro J. M., Steg Ph. G. Comparative determinants of 4-year cardiovascular event rates in stable outpatients at risk of or with atherothrombosis // Jama. 2010. V. 304. №12. P. 1350-1357.
- DOI: 10.1001/jama.2010.1322
- Sahlen A., Varenhorst Ch., Lagerqvist B., Renlund H., Omerovic E., Erlinge D., Wallentin L., James S. K., Jernberg T. Outcomes in patients treated with ticagrelor or clopidogrel after acute myocardial infarction: experiences from SWEDEHEART registry // European heart journal. 2016. V. 37. №44. P. 3335-3342.
- DOI: 10.1093/eurheartj/ehw284
- Wallentin L., Yusuf S., Ezekowitz M. D., Alings M., Flather M., Franzosi M. G., Pais P., Dans A., Eikelboom J., Oldgren J., Pogue J., Reilly P. A., Yang S., Connolly S. J. Efficacy and safety of dabigatran compared with warfarin at different levels of international normalised ratio control for stroke prevention in atrial fibrillation: an analysis of the RE-LY trial // The Lancet. 2010. V. 376. №9745. P. 975-983.
- DOI: 10.1016/S0140-6736(10)61194-4
- Avezum A., Lopes R. D., Schulte P. J., Lanas F., Gersh B. J., Hanna M.,.. Alexander J. H. Apixaban in comparison with warfarin in patients with atrial fibrillation and valvular heart disease: findings from the apixaban for reduction in stroke and other thromboembolic events in atrial fibrillation (ARISTOTLE) trial // Circulation. 2015. V. 132. №8. P. 624-632.
- DOI: 10.1161/CIRCULATIONAHA.114.014807
- The Executive Steering Committee, on behalf of the ROCKET AF Study Investigators Rivaroxaban - once daily, oral, direct factor Xa inhibition compared with vitamin K antagonism for prevention of stroke and embolism trial in atrial fibrillation: rationale and design of the ROCKET AF study // American heart journal. 2010. V. 159. №3. P. 340-347. e1.
- DOI: 10.1016/j.ahj.2009.11.025
- Воробьева Н. М., Панченко Е. П. Новые пероральные антикоагулянты и ацетилсалициловая кислота в лечении венозных тромбоэмболических осложнений // Атеротромбоз. 2013. №1. C. 53-64.
- Воробьева Н. М. Особенности применения ривароксабана у больных венозными тромбоэмболическими осложнениями // Медицинский алфавит. 2014. Т. 1. №3. С. 28-34.
- Anand S. S., Bosch J., Eikelboom J. W., Connolly S. J., Diaz R., Widimsky P.,.., Gosselin G. Rivaroxaban with or without aspirin in patients with stable peripheral or carotid artery disease: an international, randomised, double-blind, placebo-controlled trial // The Lancet. 2018. V. 391. №10117. P. 219-229.
- DOI: 10.1016/S0140-6736(17)32409-1
- Connolly S. J., Eikelboom J. W., Bosch J., Dagenais G., Dyal L., Lanas F.,.., Pilon C. Rivaroxaban with or without aspirin in patients with stable coronary artery disease: an international, randomised, double-blind, placebo-controlled trial // The Lancet. 2018. V. 391. №10117. P. 205-218.
- DOI: 10.1016/S0140-6736(17)32458-3
- Кузнецова Т. Ю., Малыгин А. Н., Белозеров Г. Н., Игнатенко О. В., Сергеева С. С., Кочерина В. В., Макарова С. Т. Применение ривароксабана для профилактики повторных атеротромботических событий после острого коронарного синдрома // Кардиология. 2017. Т. 57. №10. С. 89-97.
- DOI: 10.18087/cardio.2017.10.10046
- Есаян А. М. Антикоагулянтная терапия у пациента с хронической болезнью почек и фибрилляцией предсердий // Журнал сердечная недостаточность. 2017. Т. 18. №4. С. 243-252.
- DOI: 10.18087/RHFJ.2017.4.2395
- Mueck W., Stampfuss J., Kubitza D., Becka M. Clinical pharmacokinetic and pharmacodynamic profile of rivaroxaban // Clinical pharmacokinetics. 2014. V. 53. №1. P. 1-16.
- DOI: 10.1007/s40262-013-0100-7
- Patel M. R., Mahaffey K. W., Garg J., Pan G., Singer D. E., Hacke W., Breithardt G., Halperin J. L., Hankey G. J., Piccini J. P., Becker R. C., Nessel Ch. C., Paolini J. F., Berkowitz S. D., Fox K. A. A., Califf R. M. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation // New England Journal of Medicine. 2011. V. 365. №10. P. 883-891.
- DOI: 10.1056/NEJMoa1009638
- Tanahashi N., Hori M., Matsumoto M., Momomura S. I., Uchiyama S., Goto S., Izumi T., Koretsune Yu., Kajikawa M., Kato M., Ueda H., Iwamoto K., Tajiri M. Rivaroxaban versus warfarin in Japanese patients with nonvalvular atrial fibrillation for the secondary prevention of stroke: a subgroup analysis of J-ROCKET AF // Journal of Stroke and Cerebrovascular Diseases. 2013. V. 22. №8. P. 1317-1325.
- DOI: 10.1016/j.jstrokecerebrovasdis.2012.12.010
- Шостак Н. А., Клименко А. А., Андрияшкина Д. Ю., Кондрашов А. А., Новикова А. В. Роль антикоагулянтной терапии в лечении пациентов с протезированными клапанами сердца // Клиницист. 2016. Т. 10. №2. C. 10-17.
- DOI: 10.17650/1818-8338-2016-10-2-10-17
- Сулимов В. А., Напалков Д. А., Соколова А. А. Сравнительная эффективность и безопасность новых пероральных антикоагулянтов // Рациональная фармакотерапия в кардиологии. 2013. Т. 9. №4. C. 433-438.
- DOI: 10.20996/1819-6446-2013-9-4-433-438
- Steinberg B. A., Hellkamp A. S., Lokhnygina Y., Patel M. R., Breithardt G., Hankey G. J.,.., Piccini J. P. Higher risk of death and stroke in patients with persistent vs. paroxysmal atrial fibrillation: results from the ROCKET-AF Trial // European heart journal. 2015. V. 36. №5. P. 288-296.
- DOI: 10.1093/eurheartj/ehu359
- Harel Z., Sood M. M., Perl J. Comparison of novel oral anticoagulants versus vitamin K antagonists in patients with chronic kidney disease // Current opinion in nephrology and hypertension. 2015. V. 24. №2. P. 183-192.
- DOI: 10.1097/MNH.0000000000000098
- Сулимов В. А., Голицын С. П., Панченко Е. П., Попов С. В., Ревишвили А. Ш., Шубик Ю. В.,.. Шварц Ю. Г. Диагностика и лечение фибрилляции предсердий. Рекомендации РКО, ВНОА и АССХ // Российский кардиологический журнал. 2013. Т. 18. №4 S3. С. 1-100.
- Ревишвили А. Ш., Шляхто Е. В., Сулимов В. А., Рзаев Ф. Г., Горев М. В., Нардая Ш. Г.,.., Медведев М. М. Диагностика и лечение фибрилляции предсердий (Рекомендации РКО, ВНОА, АССХ). 2017.
- Рычков А. Ю., Хорькова Н. Ю., Ярославская Е. И. Ривароксабан при тромбозе левого предсердия у пациента с фибрилляцией предсердий при проведении катетерной абляции // Атеротромбоз. 2014. №2. 82-85.
- DOI: 10.18565/cardio.2014.10.93-96
- Шекоян С. В., Джндоян З. Т., Сисакян А. С. Случай эффективной антикоагулянтной терапии у больного с ишемической болезнью сердца, хронической сердечной недостаточностью, фибрилляцией предсердий и тромбозом левого желудочка // Клиницист. 2016. Т. 10. №1. C. 48-51.
- DOI: 10.17650/1818-8338-2016-10-1-48-51
- Иткин Д. А., Моисеева Ю. Н., Либов И. А. Применение новых оральных антикоагулянтов для профилактики тромбоэмболических осложнений при неклапанной форме мерцательной аритмии // Российский кардиологический журнал. 2015. №2 (118). C. 115-122.
- DOI: 10.15829/1560-4071-2015-02-115-122
- Ложкина Н. Г., Абуздина А. А., Куимов А. Д. Типичный пациент с фибрилляцией предсердий и почечной дисфункцией - как предотвратить инсульт? // Российский кардиологический журнал. 2015. №5 (121). C. 134-138.
- DOI: 10.15829/1560-4071-2015-05-134-138
- Berger J. S. Aspirin, clopidogrel, and ticagrelor in acute coronary syndromes // The American journal of cardiology. 2013. V. 112. №5. P. 737-745.
- DOI: 10.1016/j.amjcard.2013.04.055
- Verdoia M., Sartori Ch., Pergolini P., Nardin M., Rolla R., Barbieri L., Schaffer A., Marino P., Bellomo G., Suryapranata H., De Luca G. Prevalence and predictors of high-on treatment platelet reactivity with ticagrelor in ACS patients undergoing stent implantation // Vascular pharmacology. 2016. V. 77. P. 48-53.
- DOI: 10.1016/j.vph.2015.04.014
- Morrow D. A., Alberts M. J., Mohr J. P., Ameriso S. F., Bonaca M. P., Goto S.,.., Braunwald E. Efficacy and safety of vorapaxar in patients with prior ischemic Stroke // Stroke. 2013. V. 44. №3. P. 691-698.
- DOI: 10.1161/STROKEAHA.111.000433
- Hylek E. M., Singer D. E. Risk factors for intracranial hemorrhage in outpatients taking warfarin // Annals of internal medicine. 1994. V. 120. №11. P. 897-902.
- DOI: 10.7326/0003-4819-120-11-199406010-00001
- Mega J. L., Braunwald E., Mohanavelu S., Burton P., Poulter R., Misselwitz F. Rivaroxaban versus placebo in patients with acute coronary syndromes (ATLAS ACS-TIMI 46): a randomised, double-blind, phase II trial // The Lancet. 2009. V. 374. №9683. P. 29-38.
- DOI: 10.1016/S0140-6736(09)60738-8
- Воробьёва Н. М., Панченко Е. П. Антикоагулянтная терапия венозных тромбоэмболических осложнений: проблемы и перспективы // Российский кардиологический журнал. 2015. №3 (119). C. 7-17.
- DOI: 10.15829/1560-4071-2015-03-7-17
- Панченко Е. П., Явелов И. С., Грацианский Н. А., Кропачева Е. С., Аверков О. В., Барбараш О. Л.,.., Шальнова С. А. Антитромботическая терапия у больных со стабильными проявлениями атеротромбоза // Кардиоваскулярная терапия и профилактика. 2009. Т. 8. №6 S6. С. 163-188.
- Eriksson B. I., Borris L. C., Friedman R. J., Haas S., Huisman M. V., Kakkar A. K.,.., Geerts W. Rivaroxaban versus enoxaparin for thromboprophylaxis after hip arthroplasty // New England Journal of Medicine. 2008. V. 358. №26. P. 2765-2775.
- DOI: 10.1056/NEJMoa0800374
- Kaeberich A., Reindl I., Raaz U., Maegdefessel L., Vogt A., Linde T.,.., Schlitt A. Comparison of unfractionated heparin, low-molecular-weight heparin, low-dose and high-dose rivaroxaban in preventing thrombus formation on mechanical heart valves: results of an in vitro study // Journal of thrombosis and thrombolysis. 2011. V. 32. №4. P. 417.
- DOI: 10.1007/s11239-011-0621-6
- Prins M. H., Lensing A. W., Bauersachs R., Van Bellen B., Bounameaux H., Brighton T. A.,.., Wells P. S. Oral rivaroxaban versus standard therapy for the treatment of symptomatic venous thromboembolism: a pooled analysis of the EINSTEIN-DVT and PE randomized studies // Thrombosis journal. 2013. V. 11. №1. P. 21.
- DOI: 10.1186/1477-9560-11-21
- Romualdi E., Donadini M. P., Ageno W. Oral rivaroxaban after symptomatic venous thromboembolism: the continued treatment study (EINSTEIN-extension study) // Expert review of cardiovascular therapy. 2011. V. 9. №7. P. 841-844.
- DOI: 10.1586/erc.11.62
- Соколова А. А., Жиленко А. В., Царев И. Л., Напалков Д. А., Сулимов В. А. Практические аспекты применения антикоагулянтной терапии у пациентов с фибрилляцией предсердий неклапанной этиологии: данные регистра университетской клиники // Российский кардиологический журнал. 2015. №9 (125). C. 32-37.
- DOI: 10.15829/1560-4071-2015-09-32-37
- Eikelboom J. W., Connolly S. J., Bosch J., Dagenais G. R., Hart R. G., Shestakovska O.,.. Yusuf S. Rivaroxaban with or without aspirin in stable cardiovascular disease // New England Journal of Medicine. 2017. V. 377. №14. P. 1319-1330.
- DOI: 10.1056/NEJMoa1709118
- Madhusudhan T., Kerlin B. A., Isermann B. The emerging role of coagulation proteases in kidney disease // Nature reviews nephrology. 2016. V. 12. №2. P. 94.
- DOI: 10.1038/nrneph.2015.177
- Zou R., Tao J., Shi W., Yang M., Li H., Lin X.,.. Hua P. Meta-analysis of safety and efficacy for direct oral anticoagulation treatment of non-valvular atrial fibrillation in relation to renal function // Thrombosis research. 2017. V. 160. P. 41-50.
- DOI: 10.1016/j.thromres.2017.10.013
- Муркамилов И. Т., Фомин В. В., Айтбаев К. А., Райимжанов З. Р., Реджапова Н. А., Юсупов Ф. А., Айдаров З. А. Хроническая болезнь почек и цереброваскулярные расстройства: роль цистатина С // Клиническая нефрология. 2017. №3. С. 60-67.
- Katoh H., Nozue T., Michishita I. Anti-inflammatory effect of factor-Xa inhibitors in Japanese patients with atrial fibrillation // Heart and Vessels. 2017. V. 32. №9. P. 1130-1136.
- DOI: 10.1007/s00380-017-0962-y
- Komiyama M., Miyazaki Y., Wada H., Iguchi M., Abe M., Ogawa H.,.., Hasegawa K. A study on indices of apixaban anticoagulation: A single-center prospective study // Journal of pharmacological sciences. 2018. V. 137. №2. 105-109.
- DOI: 10.1016/j.jphs.2018.05.001
- Ellinghaus P., Perzborn E., Hauenschild P., Gerdes C., Heitmeier S., Visser M.,.. Laux V. Expression of pro-inflammatory genes in human endothelial cells: Comparison of rivaroxaban and dabigatran // Thrombosis research. 2016. V. 142. P. 44-51.
- DOI: 10.1016/j.thromres.2016.04.008
- Richards G. A., Theron A., Tintinger G., Anderson R. The effects of dabigatran and rivaroxaban on markers of polymorphonuclear leukocyte activation // Pharmaceuticals. 2018. V. 11. №2. P. 46.
- DOI: 10.3390/ph11020046
- Bergeron A., Soler P., Kambouchner M., Loiseau P., Milleron B., Valeyre D.,.., Tazi A. Cytokine profiles in idiopathic pulmonary fibrosis suggest an important role for TGF-β and IL-10 // European Respiratory Journal. 2003. V. 22. №1. P. 69-76.
- DOI: 10.1183/09031936.03.00014703
- Agostini C., Gurrieri C. Chemokine/cytokine cocktail in idiopathic pulmonary fibrosis // Proceedings of the American Thoracic Society. 2006. V. 3. №4. P. 357-363.
- DOI: 10.1513/pats.200601-010TK
- Kearon C., Akl E. A., Comerota A. J., Prandoni P., Bounameaux H., Goldhaber S. Z.,.., Kahn S. R. Antithrombotic therapy for VTE disease: antithrombotic therapy and prevention of thrombosis: American College of Chest Physicians evidence-based clinical practice guidelines // Chest. 2012. V. 141. №2. P. e419S-e496S.
- DOI: 10.1378/chest.11-2301
- Lancellotti P., Linhart A., Piepoli M. F. 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism // European Heart Journal. 2014. V. 35. P. 3033-3080.
- DOI: 10.1093/eurheartj/ehu283
- Андрияшкин А. В., Андрияшкин В. В., Арутюнов Г. П., Баринов В. Е., Бицадзе В. О., Бодыхов М. К.,.., Вавилова Т. В. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО) // Флебология. 2015. Т. 2. №4. С. 2.
- Liu X., Thompson J., Phatak H., Mardekian J., Porcari A. R., Johnson M. R. Apixaban reduces hospitalization in patients with venous thromboembolism: an analysis of the AMPLIFY-EXT trial // Blood. 2013. V. 122. №21. P. 3638.
- DOI: 10.1182/blood.V122.21.3638.3638
- The EINSTEIN Investigators. Oral rivaroxaban for symptomatic venous thromboembolism // New England Journal of Medicine. 2010. V. 363. №26. P. 2499-2510.
- DOI: 10.1056/NEJMoa1007903
- Palareti G., Cosmi B., Legnani C., Tosetto A., Brusi C., Iorio A.,.. Tripodi A. D-dimer testing to determine the duration of anticoagulation therapy // New England Journal of Medicine. 2006. V. 355. №17. P. 1780-1789.
- DOI: 10.1056/NEJMoa054444
- Tosetto A., Iorio A., Marcucci M., Baglin T., Cushman M., Eichinger S.,.., Douketis J. Predicting disease recurrence in patients with previous unprovoked venous thromboembolism: a proposed prediction score (DASH) // Journal of thrombosis and haemostasis. 2012. V. 10. №6. P. 1019-1025.
- DOI: 10.1111/j.1538-7836.2012.04735.x
- Di Castelnuovo A., Agnoli C., de Curtis A., Giurdanella M. C., Sieri S., Mattiello A.,.., Iacoviello L. Elevated levels of D-dimers increase the risk of ischaemic and haemorrhagic stroke // Thrombosis and haemostasis. 2014. V. 112. №11. P. 941-946.
- DOI: 10.1160/th14-04-0297
- Недогода С. В., Барыкина И. Н., Саласюк А. С., Смирнова В. О. Сравнительная клинико-экономическая оценка применения ривароксабана и апиксабана у больных с неклапанной фибрилляцией предсердий // Рациональная фармакотерапия в кардиологии. 2017. Т. 13. №1. C. 45-50.
- DOI: 10.20996/1819-6446-2017-13-1-45-50
- IMS Health, 2015. http://www.imshealth.com.
- Мухин Н. А., Смирнов А. В., Кобалава Ж. Д., Бобкова И. Н., Виллевальде С. В., Ефремовцева М. А.,.., Гринштейн Ю. И. Сердечно-сосудистый риск и хроническая болезнь почек: стратегии кардио-нефропротекции // Российский кардиологический журнал. 2014. №8 (112). C. 4-29.
- Harder S. Renal profiles of anticoagulants // The Journal of Clinical Pharmacology. 2012. Т. 52. №7. С. 964-975.
- DOI: 10.1177/0091270011409231
- Муркамилов И. Т., Айтбаев К. А., Фомин В. В., Муркамилова Ж. А., Райимжанов З. Р., Реджапова Н. А., Юсупов Ф. А. Торможение прогрессирования нефро-и цереброваскулярных осложнений при фибрилляции предсердий: возможности ривароксабана // Терапия. 2020. Т. 6. №1. С. 112-120.
- DOI: 10.18565/therapy.2020.1.112-120


