Клиническая значимость простатического специфического антигена у больных раком молочной железы
Автор: Сергеева Наталья Сергеевна, Кармакова Татьяна Анатольевна, Алентов Игорь Игоревич, Зикиряходжаев Азизжон Дилшодович, Ортабаева Дзерасса Радионовна, Каприн Андрей Дмитриевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 т.19, 2020 года.
Бесплатный доступ
Ведение. Простатический специфический антиген (ПСА) преимущественно продуцируется клетками предстательной железы, однако его минорными источниками могут служить и другие ткани организма как у мужчин, так и у женщин, включая ткани молочных желез. У женщин повышенные сывороточные уровни ПСА описаны при ряде физиологических и патологических состояний, в том числе при доброкачественных заболеваниях молочной железы и при раке молочной железы (РМЖ). ПСА рассматривают как потенциальный серологический опухолеассоцированный маркер РМЖ, однако сведения о его возможной клинической значимости недостаточно убедительны. Цель исследования - оценка уровней ПСА у женщин с РМЖ и оценка перспективности его изучения как диагностического показателя при начальных стадиях заболевания. Материал и методы. Сывороточные уровни ПСА измерены иммунохемилюминесцентным методом (ARCHITECT, Abbott) у 99 пациенток с гистологически верифицированным РМЖ (карцинома in situ - 11, 1А стадия - 56, 11А стадия - 32) и у 25 условно здоровых женщин-доноров. Результаты. В группе здоровых женщин ПСА был выявлен в 22/25 (88,0 %) образцах крови, среднее значение составило 4,0 ± 0,9 нг/л. В группе больных РМЖ детектируемый уровень ПСА обнаружен в 68/99 (68,7 %) случаях, его средний уровень - 2,8 ± 0,9 нг/л. Отличия между группами больных РМЖ и доноров по среднему уровню маркера статистически недостоверны (p>0,05). Значения ПСА были выше у молодых женщин: у больных РМЖ моложе 40 лет доля ПСА-положительных случаев составила 89 %, у пациенток старше 50 лет - 60 %; в группах доноров моложе 40 лет и старше 50 лет - 100 % и 80 % соответственно. При карциноме in situ средний уровень ПСА оказался выше, чем при I и II стадии заболевания (3,0 ± 1,2 нг/л против 1,9 ± 0,3 нг/л и 1,6 ± 0,3 нг/л соответственно; p>0,05). У больных РМЖ не выявлено зависимости концентраций ПСА от гистотипа, степени дифференцировки и молекулярного подтипа опухоли. Заключение. Уровень ПСА не обладает клинической значимостью при ранних стадиях РМЖ, так как доля случаев с повышенным уровнем ПСА и среднее значение показателя у больных РМЖ на начальных этапах заболевания не отличаются от таковых в группе здоровых женщин.
Простатический специфический антиген, пса, рак молочной железы, диагностика
Короткий адрес: https://sciup.org/140254395
IDR: 140254395 | УДК: 618.19-006.6-07:577.21 | DOI: 10.21294/1814-4861-2020-19-6-28-37
Текст научной статьи Клиническая значимость простатического специфического антигена у больных раком молочной железы
Рак молочной железы (РМЖ) – самое распространенное злокачественное новообразование у женщин во всем мире. Среди женского населения России в 2018 г. выявлено более 70 000 случаев РМЖ, наблюдается тенденция роста показателя заболеваемости [1]. Благодаря улучшению организации здравоохранения и внедрению современных методов инструментальной диагностики в России за последние годы значительно увеличилась доля случаев РМЖ I–II стадии [1], при которых шансы пациенток на полное выздоровление достаточно велики. Тем не менее проблема своевременной диагностики РМЖ сохраняет свою актуальность по причине бессимптомного течения заболевания на ранней стадии и объективных ограничений возможностей инструментальных диагностических процедур, часто не позволяющих выявить злокачественную опухоль на доклиническом этапе ее развития.
Простатический специфический антиген (ПСА) – протеолитический фермент, относящийся к се- мейству калликреинов (KLK3), является одним из наиболее хорошо изученных серологических опухолеассоциированных маркеров и широко используется в диагностических исследованиях и для мониторинга пациентов при заболеваниях предстательной железы [2]. С появлением высокочувствительных методов определения ПСА было установлено, что в организме как у мужчин, так и у женщин существуют другие, минорные источники этого белка, в число которых входит ткань молочных желез [3–5]. Методами иммуногистохимического анализа показана экспрессия ПСА в эпителии молочной железы в норме, при доброкачественных изменениях и при РМЖ [6, 7]. Наличие мРНК ПСА в цитозольных фракциях ткани РМЖ подтверждено с использованием полимеразной цепной реакции [8].
В сыворотке крови здоровых женщин содержание ПСА значительно меньше, чем у мужчин. При этом концентрация ПСА у женщин зависит от фазы менструального цикла и повышается при беремен- ности, что отражает влияние стероидных гормонов на продукцию этого фермента клетками эпителия [5, 9]. С изменением общего гормонального фона связывают и обратную корреляцию между уровнем ПСА и возрастом женщин [10].
Повышенные, по сравнению со здоровыми женщинами, значения ПСА наблюдаются в части случаев при доброкачественных заболеваниях молочной железы и при РМЖ [11–16]. Обнаруженное в ряде исследований снижение уровня общего ПСА у больных РМЖ после мастэктомии, по мнению авторов, косвенно указывает на то, что источником повышенного содержания антигена в крови пациенток в этих случаях являлась пораженная опухолью молочная железа [4, 12–14].
Обращает на себя внимание, что у больных РМЖ женщин отмечают обратную корреляцию между содержанием общего ПСА в сыворотке крови и стадией заболевания [4, 17, 18], размером опухоли [13, 17], а также степенью дифференцировки новообразования [16]. Такой характер корреляций дает основания полагать, что повышенный уровень ПСА преимущественно ассоциирован с ранними формами заболевания. В то же время при сравнении результатов, полученных разными исследовательскими группами, обращают на себя внимание противоречивые данные в отношении частоты наблюдения повышенного содержания ПСА в крови у женщин при РМЖ, неоднозначная его взаимосвязь с клинико-патологическими особенностями заболевания, а также вариабельность количественной оценки этого антигена.
Целью работы являлись исследование сывороточного уровня ПСА у женщин и оценка перспективности его изучения как диагностического показателя при начальных стадиях РМЖ.
Материал и методы
В исследование включены 99 пациенток с ранними формами РМЖ (табл. 1), проходивших обследование в МНИОИ им. П.А. Герцена – филиале ФГБУ «НМИЦ радиологии» Минздрава России в 2018–19 гг. Контрольную группу составили 25 условно здоровых женщин-доноров. От всех больных и доноров получено информированное согласие на участие в проведении исследования. В обеих когортах обследуемых были представлены все возрастные группы, однако среди доноров преобладали молодые женщины, а среди больных РМЖ – пациентки старше 50 лет (рис. 1). Средний возраст пациенток составил 51,3 года (25–79 лет), средний возраст доноров – 43,8 года (24–68 лет; р=0,04). Диагноз РМЖ верифицирован морфологически, стадия заболевания установлена согласно системе TNM (7-е издание, 2010 г.).
Образцы венозной крови у больных РМЖ получали до начала специфического лечения. После забора образцы крови больных и доноров выдерживали 30 мин при комнатной температуре, после чего центрифугировали 15 мин при 3000 g для отделения сывороточной фракции. Полученную сыворотку хранили при температуре –80 ºС до выполнения анализа. Измерение уровней общей фракции ПСА проводили на автоматическом иммуноанализаторе ARCHITECT i1000SR (Abbott Diagnostics, США) двухэтапным хемилюминесцентным иммунологическим методом на микрочастицах с использованием наборов реактивов ARCHITECT total PSA. Принцип метода заключается в инкубации образцов сыворотки крови с парамагнитными частицами, покрытыми антителами против ПСА, затем – с антителами, конъюгированными с акридином, и последующей индукции хемилюминесценции добавлением в реакционную смесь растворов перекиси водорода и едкого натра.
Статистическую обработку данных выполняли с использованием программы STATISTICA 10 (StatSoft. Inc.). Для оценки распределения значений показателя в группах рассчитывали величины среднего арифметического (М), стандартной ошибки среднего (m) и медианы. Отличия средних величин показателя в группах оценивали с применением t-критерия Стьюдента, различия между группами по частоте встречаемости признака – с применением χ 2-критерия Пирсона. Проверку на нормальность распределения осуществляли с помощью теста Шапиро–Уилка. Построение гра-
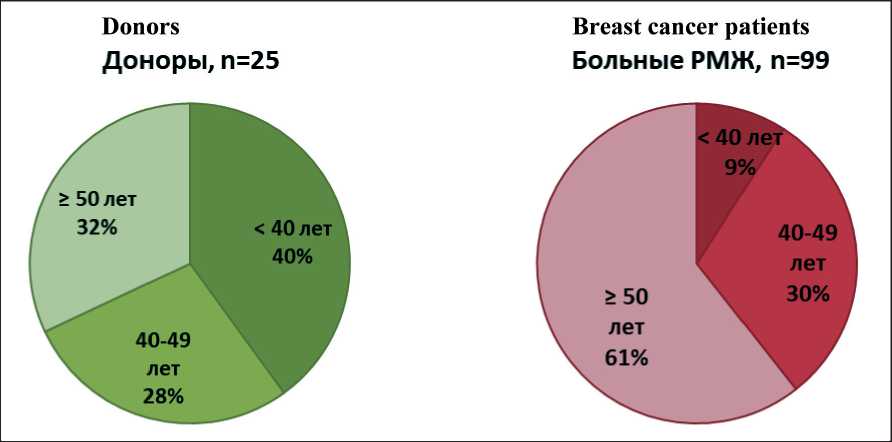
Рис. 1. Распределение доноров и больных РМЖ по возрасту Fig. 1. Distribution of donors and breast cancer patients by age
Таблица 1/table 1
Характеристика больных РМЖ, включенных в исследование characteristics of Bc patients included in the study
Результаты
У подавляющего большинства женщин в обследованных группах, как у больных РМЖ, так и у доноров, содержание общего ПСА в сыворотке крови оказалось значительно ниже значений, которые обычно определяются у мужчин. В связи с этим результаты количественной оценки уровня маркера в данном исследовании представлены с использованием величины, соответствующей количеству нанограмм не в миллилитре (нг/мл), как это принято у мужчин, а в литре (нг/л).
В группе здоровых женщин ПСА был выявлен в 22/25 (88,0 %) случаях, а его определяемая концентрация варьировала от 1 до 24 нг/л. Среднее значение ПСА в общей группе здоровых женщин составило 4,0 ± 0,9 нг/л, среди женщин с определяемым уровнем маркера – 5,0 ± 1,0 нг/л. В группе больных РМЖ детектируемый уровень ПСА был обнаружен в 68/99 (68,7 %) случаях, а вариации определяемого уровня соответствовали диапазону 1,0146,0 нг/л. Среднее значение ПСА в общей группе больных РМЖ составило 2,8 ± 0,9 нг/л, а среди больных с отличными от нуля значениями показателя – 4,1 ± 1,2 нг/л. Значительно превышающая средние значения концентрация ПСА
(более 20,0 нг/л) выявлена у 1 здоровой женщины и у 2 больных РМЖ. Различия между группами больных РМЖ и здоровых женщин как по доле случаев с определяемым уровнем ПСА (р=0,092), так и по средним величинам показателя (р=0,45) не достигали статистически значимого уровня.
Анализ полученных данных показал, что содержание ПСА в сыворотке крови в обеих группах женщин зависит от возраста. Так, средний уровень ПСА у доноров и больных РМЖ был выше в группах более молодых женщин, чем у женщин старшего возраста, как при сравнении показателя в общих группах наблюдений, так и при сравнении случаев с определяемым уровнем маркера (рис. 2, А и Б). Однако разница средних значений маркера у женщин моложе 40 лет и старше 50 лет оказалась статистически недостоверной как среди больных РМЖ (р=0,42), так и среди доноров (р=0,25). Кроме того, отмечено, что среди больных РМЖ во всех возрастных группах доля случаев, в которых концентрация общего ПСА была ниже предела детекции, оказалась выше, чем среди доноров (рис. 2В).
Среднее значение ПСА у больных РМЖ в пременопаузе составило 2,5 ± 0,4 нг/л, а у менопаузальных пациенток – 1,6 ± 0,3 нг/л (p=0,09). В группе здоровых женщин в пременопаузе средний уровень ПСА был равен 4,5 ± 0,8 нг/л, а в постменопаузе – 2,2 ± 0,8 нг/л (р=0,08). При этом раз-
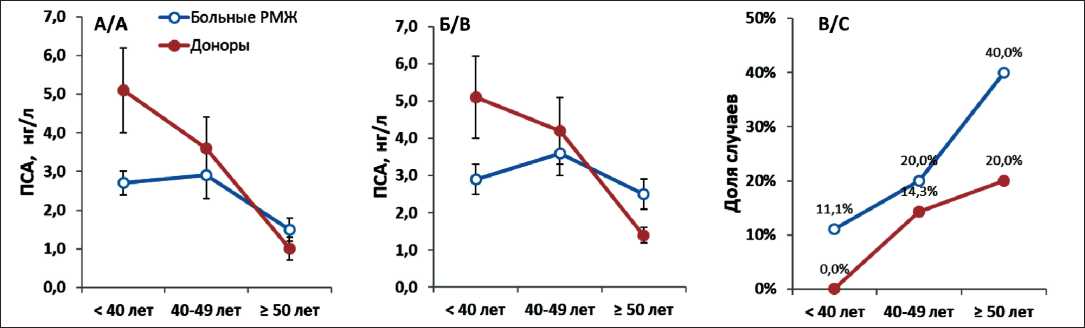
Рис. 2. Уровни ПСА в сыворотке крови у больных РМЖ и доноров в зависимости от возраста:
А. Средние значения ПСА в общих группах наблюдений; Б. Средние значения ПСА в случаях с определяемым уровнем маркера; В. Доля случаев с уровнем ПСА ниже предела детекции.
Данные на диаграммах А и Б представлены в виде M ± m
Fig. 2. PSA levels in blood serum of breast cancer patients and donors with respect to the age group:
A. Average PSA values in general groups of patients; B. Average PSA values in cases with a detectable marker level;
С. Proportion of cases with PSA levels below the detection limit. Data in charts A and B are presented as M ± m
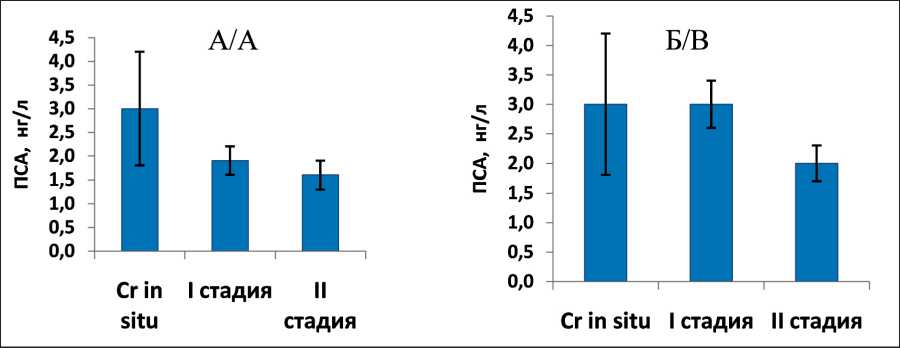
Рис. 3. Средние уровни ПСА у больных РМЖ в зависимости от стадии опухолевого процесса в общих группах наблюдений (А) и в группах с определяемым уровнем маркера (Б). Данные представлены в виде M ± m
Fig. 3. Average PSA levels in breast cancer patients with respect to the stage of the tumor in general groups of patients (A) and in groups with a detectable marker level (B). Data are presented as M ± m
личия в концентрациях маркера между группами больных РМЖ и здоровых женщин в пременопаузе оказались статистически достоверными (р=0,04), а среди пациенток и доноров в менопаузе не достигали статистической достоверности (р=0,49).
Анализ результатов определения уровня ПСА у больных РМЖ в зависимости от клиникоморфологических особенностей заболевания показал следующее. Средние концентрации общего ПСА при карциноме in situ оказались выше, чем при РМЖ I и II стадии (рис. 3; различия статистически не значимы, р=0,15), причем эта тенденция сохранялась и при стратификации больных по возрастным группам. Значения ПСА не зависели от молекулярного подтипа опухоли (табл. 2). Корреляции между уровнем ПСА и степенью дифференцировки опухоли, гистологическим типом РМЖ, а также индексом массы тела и наличием сопутствующих хронических заболеваний не выявлено (данные не представлены).
Обсуждение
Стимулом к выполнению настоящей работы стали данные ряда исследований, свидетельствующие о том, что у больных РМЖ сывороточные концентрации ПСА в ряде случаев значительно выше, чем у здоровых женщин [14–16], повышение уровня ПСА чаще обнаруживают при ранних формах заболевания [4, 13, 17, 18], а динамика показателя может быть дополнительным критерием оценки эффективности противоопухолевого лечения [12–14, 16].
В нашем исследовании измерение уровня общего ПСА выполнено на автоматическом иммуноанализаторе ARCHITECT i1000SR с использованием высокочувствительной системы на основе иммунохемилюминесцентного анализа с пределом детекции общего ПСА, равным 1 нг/л (0,001 нг/мл). Полученные результаты показали, что ПСА с использованием данной технологии выявляется у большинства здоровых женщин (88,0 %) и у
Таблица 2/table 2
Уровни ПСА у больных РМЖ при разных молекулярных подтипах опухоли psa levels in breast cancer patients with different molecular tumor subtypes
Доля случаев, в которых концентрация ПСА в сыворотке крови была доступна для определения, а также средние значения показателя в группах больных РМЖ и условно здоровых женщин в нашем исследовании статистически не отличались. При этом отмечено, что средний уровень ПСА как у доноров, так и у больных РМЖ снижается с возрастом, что согласуется с данными опубликованных исследований. Считается, что это может быть обусловлено угасанием гормональной активности у женщин с наступлением менопаузы [13, 14]. Более высокие показатели ПСА при карциноме in situ , чем при опухолях большего размера (T1–2N0M0), выявленные в нашем исследовании, также согласуются с наблюдениями других авторов [13], которые связывают снижение уровня ПСА в крови при увеличении размера узловых образований с нарушением архитектоники ткани.
Обращает на себя внимание более высокий средний уровень ПСА у здоровых женщин преме-нопаузального возраста по сравнению с больными РМЖ в пременопаузе. Подобное наблюдение не описано в литературе и в определенной степени противоречит тому, что в многочисленных исследованиях установлена корреляция между повышенным уровнем андрогенов в крови у женщин в пременопаузе и риском развития РМЖ [19–21]. Можно предположить, что выявленные нами отличия являются случайными и не будут воспроизведены при наборе большего числа наблюдений. С другой стороны, медиана возраста здоровых женщин в пременопаузе в нашем исследовании была несколько ниже, чем больных РМЖ в пременопаузе, и составила 35 ± 1,9 года и 44 ± 1,2 года соответственно (отличия незначимы). Известно, что активность продукции ПСА эпителиальными клетками находится под контролем андрогенных гормональных сигналов [22], при этом содержание андрогенов в крови женщин существенно изменяется с возрастом. Так, в работе A. Guay et al. показано, что у здоровых женщин в возрасте 20–29 лет сывороточный уровень общего тестостерона и его предшественников был достоверно выше, чем у женщин в возрасте 40–49 лет [23]. Группа женщин в возрасте 30–39 лет по этим показателям занимала промежуточное положение, но достоверно отличалась от старшей группы более высоким содержанием в сыворотке крови дегидроэпиандростерона – физиологически активного предшественника тестостерона [23]. Можно предположить, что даже такие небольшие отличия могут оказывать влияние на синтез ПСА в чувствительных к андрогенам тканях организма, что, соответственно, отражается на уровне ПСА в крови.
Для анализа причин существенных расхождений в результатах количественного определения ПСА и оценки диагностической значимости маркера при опухолевых заболеваниях молочной железы, полученных в разное время разными исследовательскими группами, мы сопоставили собственные результаты с ранее опубликованными данными. Для этого были отобраны публикации, в которых, в том числе, содержались сведения о технических характеристиках метода анализа. В соответствии с указанным авторами пределом детекции метода были выделены исследования, в которых использовались высокочувствительные тест-системы (группа I), тест-системы со средним уровнем чувствительности (группа II) и тест-системы с низким уровнем чувствительности (группа III; табл. 3). Согласно данному критерию, наше исследование относится к группе I.
Анализ представленных в этих публикациях данных свидетельствует о том, что высокие уровни ПСА, сравнимые с таковыми у мужчин, были получены лишь при использовании низкочувствительных методов определения (группа III, табл. 3). Именно в этих работах авторы делают выводы о существенных отличиях уровней ПСА у здоровых женщин и у пациенток с заболеванием молочной железы. В то же время при использовании тест-систем со средним или высоким уровнем чувствительности наблюдается, с одной стороны,
Таблица 3/table 3
Уровень ПСА в сыворотке крови у здоровых женщин и пациенток с заболеваниями молочной железы: анализ данных литературы
the psa level in blood serum of healthy women and patients with breast diseases: analysis of literature data
|
S' g о "ci |
Метод определения/ Determination method |
Предел детекции, нг/л/ Detection limit, ng/l |
Клиническая группа/ Clinical group of patients |
N |
Возраст, лет/ Age, years |
Позитивный/ Positive |
Уровни ПСА, Вариация (мин– макс)/ Variation (min–max) |
нг/л/PSA levels Медиана/ |
|
|
М ± σ |
(IQR) Medium |
||||||||
|
I |
ИФА (ручной метод) [11]/ ELISA (manual method) [11] |
1 |
Доноры/ Donors ДЗМЖ/BBD РМЖ/BC |
99 162 118 |
40–60 30–88 |
29 % 75 % 57 % |
0–55 0–221 0–8153 |
0 3,5 1,3 |
|
|
ИФА (ручной метод) [13]/ ELISA (manual method) [13] |
1 |
Контроль# ДЗМЖ/BBD РМЖ/BC |
100 90 107 |
47 ± 10* |
33 % 86 % 70 % |
||||
|
ИХА (IMMULITE Third generation DPC, LA, CA) [10]/ ICA (IMMULITE Third generation DPC, LA, CA) [10] |
3 |
Доноры/ Donors ДЗМЖ/BBD РМЖ/BC |
100 94 90 |
32–77 16–75 31–89 |
3–90 3–100 3–110 |
6 (4–10) 4 (2–10) 4 (2–11) |
|||
|
II |
ИХА (TOSOH Co, LTD, Tokyo, Япония) [28]/ ICA (TOSOH Co, LTD, Tokyo, Japan) [28] |
3 |
Доноры/ Donors РМЖ/BC |
132 144 |
53 ± 11 63 ± 13 |
26 % 29 % |
0 (0–3) 0 (04) |
||
|
ФИА-ВР (ручной метод) [29]/ FIA [29] |
10 |
Доноры/ Donors РМЖ/BC |
674 198 |
17–69 29–93 |
17 %** 22 %** |
От 0 до >30* |
|||
|
ИХА (Diasorin, LIAISON, Германия) [15]/ ICA (Diasorin, LIAISON, Germany) [15] |
<40 |
ДЗМЖ/BBD РМЖ/BC |
90 90 |
28–63 36–84 |
170 ± 16 770 ± 100 |
||||
|
ИФА (ручной метод) [14]/ ELISA (manual method) [14] |
50 |
Доноры/ Donors РМЖ/BC |
82 55 |
48 ± 10 49 ± 11 |
0–1300 100–3620 |
517 ± 381 1373 ± 855 |
|||
|
III |
ФИА-ВР (DELFIA ® PSA) [30]/ FIA [30] |
100 |
Доноры/ Donors Мастопатия/ Mastopathy Киста МЖ/ Cyst |
46 114 62 |
18–45* |
39 % 56 % 56 % |
0–3980 0–10700 0–13700 |
670 ± 1860 800 ± 2550 |
0 40 20 |
|
ИФА (DS-EIA-TOTAL PSA kit; Siemens Limited) [16]/ ELISA (DS-EIA-TOTAL PSA kit; Siemens Limited) |
300 |
Доноры/ Donors ДЗМЖ/BBD РМЖ/BC |
50 50 50 |
43 ± 11 36 ± 10 43 ± 11 |
129 1037 1139 |
||||
Примечания: N – число обследованных; Поз, % – частота случаев с определяемым уровнем общего ПСА; М ± σ – среднее ± стандартное отклонение; IQR – интерквартильный размах; ИФА – иммуноферментный анализ; ИХА – иммунохемилюминесцентный анализ; ФИА – флуоресцентный иммуноанализ; ДЗМЖ – доброкачественные заболевания молочной железы; # –пациентки, не имеющие заболевания молочной железы; * – для всей обследованной когорты женщин; ** – для уровня >10 нг/л
Note: N – number of patients; Positive, % – the frequency of cases with a definable level of total PSA; М ± σ – mean ± standard deviation; IQR – interquartile range; ELISA – enzyme immunoassay; ICA – immunochemiluminescent analysis; FIA – fluorescence immunoassay; BBD – benign breast diseases; BC – breast cancer; # –patients who do not have breast disease; * – for the entire surveyed cohort of women; ** – for level >10 ng/l высокий разброс величин показателя, с другой стороны, в подавляющем большинстве случаев определяются низкие концентрации маркера. Это нашло отражение в способе представления авторами данных (расчеты средних величин показателя в публикациях часто не представлены). При этом доля наблюдений с определяемым уровнем общего ПСА в сыворотке крови у больных РМЖ варьирует в разных исследованиях от 22 до 70 %, что сходно с аналогичным показателем, полученным в нашей работе, а доля ПСА-положительных случаев в группах доноров (26–33 %) существенно меньше, чем в наших данных. Возможно, это обусловлено выбором дискриминационного уровня при разделении наблюдений на положительные и отрицательные по уровню маркера.
Необходимо отметить и сходство абсолютных значений уровня общего ПСА в публикациях, относящихся к группам I и II, включая наше исследование, а также то обстоятельство, что в отдельных наблюдениях уровни ПСА у женщин были достаточно высокими. В целом, приведенный анализ свидетельствует о том, что ПСА не может быть позиционирован как маркер, полезный для ранней диагностики РМЖ. Низкая частота случаев с относительно высокой концентрацией ПСА при РМЖ также ставит под сомнение возможность его использования для мониторинга пациенток после специфического лечения.
В то же время наличие у некоторых больных РМЖ высокого уровня ПСА, по нашему мнению, представляет определенный интерес. Известно, что экспрессия ПСА индуцируется стероидными гормонами группы андрогенов и контролируется
Список литературы Клиническая значимость простатического специфического антигена у больных раком молочной железы
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). М., 2019. 250 с. [Kaprin A.D., Starinskiy V.V., Petrova G.V. Malignant neoplasms in Russia in 2018 (morbidity and mortality). Moscow, 2019. 250 p. (in Russian)].
- Сергеева Н.С., Скачкова Т.Е., Маршутина Н.В., Алексеев Б.Я., Каприн А.Д. Клиническая значимость ПСА-ассоциированных тестов в диагностике и стадировании рака предстательной железы. Онкология. Журнал им. П.А. Герцена. 2018; 7(1): 55-63. [Sergeeva N.S., Skachkova T.E., Marshutina N.V., Alekseev B.Ya., Kaprin A.D. Clinical significance of PSA-associated tests in the diagnosis and staging of prostate cancer. P. A. Herzen Journal of Oncology. 2018; 7(1): 55-63. (in Russian)]. doi: 10.17116/onkolog20187155-67.
- YuH., DiamandisE.P., LevesqueM., GiaiM., RoagnaR., PonzoneR., Sismondi P., Monne M., Croce C.M. Prostate specific antigen in breast cancer, benign breast disease and normal breast tissue. Breast Cancer Res Treat. 1996; 40(2): 171-8. doi: 10.1007/BF01806212.
- Yu H., Berkel H. Prostate-specific antigen (PSA) in women. J La State Med Soc. 1999 Apr; 151(4): 209-13.
- Olsson A.Y., BjartellA., LiljaH., LundwallA. Expression of prostate-specific antigen (PSA) and human glandular kallikrein 2 (hK2) in ileum and other extraprostatic tissues. Int J Cancer. 2005; 113(2): 290-7. doi: 10.1002/ijc.20605.
- Narifa D., RaicaM., Anghel A., Suciu C., Cimpean A. Immunohis-tochemical localization of prostate-specific antigen in benign and malignant breast conditions. Rom J Morphol Embryol. 2005; 46(1): 41-5.
- Kraus T.S., Cohen C., SiddiquiM.T. Prostate-specific antigen and hormone receptor expression in male and female breast carcinoma. Diagn Pathol. 2010 Sep 23; 5: 63. doi: 10.1186/1746-1596-5-63.
- Mohajeri A., Zarghami N., Pourhasan Moghadam M., Alani B., Montazeri V., BaiatA., Fekhrjou A. Prostate-specific antigen gene expression and telomerase activity in breast cancer patients: possible relationship to steroid hormone receptors. Oncol Res. 2011; 19(8-9): 375-80. doi: 10 .3727/096504011x13123323849636.
- Zarghami N., Grass L., Sauter E.R., Diamandis E.P. Prostate-specific antigen in serum during the menstrual cycle. Clin Chem. 1997 Oct; 43(10): 1862-7.
- Romppanen J., KeskikuruR., Kataja V., EskelinenM., Kosma V.M., SavolainenK., UusitupaM., MononenI. Measurement of prostate-specific antigen in detection of benign or malignant breast disease in women. Br J Cancer. 1999 Mar; 79(9-10): 15837. doi: 10.1038/sj.bjc.6690252.
- Black M.H., Giai M., Ponzone R., Sismondi P., Yu H, Diamandis E.P. Serum total and free prostate-specific antigen for breast cancer diagnosis in women. Clin Cancer Res. 2000 Feb; 6(2): 467-73.
- Dash P., Pati S., Mangaraj M., Sahu P.K., Mohapatra P.C. Serum total PSA and free PSA in breast tumors. Indian J Clin Biochem. 2011 Apr; 26(2): 182-6. doi: 10.1007/s12291-011-0115-5.
- Das S., Paul R., De U., Mukhopadhyay M. The lady with raised prostate specific antigen: do we need to worry? Asian Pac J Cancer Prev. 2011; 12(8): 2051-3.
- Mashkoor F.C., Al-Asadi J.N., Al-Naama L.M. Serum level of prostate-specific antigen (PSA) in women with breast cancer. Cancer Epidemiol. 2013 Oct; 37(5): 613-8. doi: 10.1016/j.canep.2013.06.009.
- Razavi S.H., Ghajarzadeh M., Abdollahi A., Shoar S., Omrani-pourR. Is Serum Prostate-specific Antigen a Diagnostic Marker for Benign and Malignant Breast Tumors in Women? Int J Prev Med. 2015; 6: 15. doi: 10.4103/2008-7802.151824.
- JahirE.T., DeviR., BorthakurB.B. Study of Serum Total PSA and Free PSA as an Oncological Marker in Breast Tumour. J Clin Diagn Res. 2017 Mar; 11(3): BC13-BC16. doi: 10.7860/JCDR/2017/22111.9543.
- Yu H., Giai M., Diamandis E.P., Katsaros D., Sutherland D.J., Levesque M.A., Roagna R., Ponzone R., Sismondi P. Prostate-specific antigen is a new favorable prognostic indicator for women with breast cancer. Cancer Res. 1995 May 15; 55(10): 2104-10.
- Borchert G.H., Melegos D.N., Tomlinson G., GiaiM., Roagna R., Ponzone R., Sgro L., Diamandis E.P. Molecular forms of prostate-specific antigen in the serum of women with benign and malignant breast diseases. Br J Cancer. 1997; 76(8): 1087-94. doi: 10.1038/bjc.1997.512.
- Clendenen T.V., Ge W., Koenig K.L., Afanasyeva Y., Agnoli C., Brinton L.A., Darvishian F., Dorgan J.F., Eliassen A.H., Falk R.T., Hallmans G., Hankinson S.E., Hoffman-Bolton J., Key T.J., Krogh V., Nichols H.B., Sandler D.P., Schoemaker M.J., Sluss P.M., Sund M., Werdlow A.J., Visvanathan K., Zeleniuch-Jacquotte A., Liu M. Breast cancer risk prediction in women aged 35-50 years: impact of including sex hormone concentrations in the Gail model. Breast Cancer Res. 2019 Mar; 21(1): 42. doi: 10.1186/s13058-019-1126-z.
- 20.HüsingA.,FortnerR.T.,KühnT., OvervadK., Tj0nnelandA., OlsenA., Boutron-RuaultM.C., Severi G., FournierA., BoeingH., TrichopoulouA., Benetou V., Orfanos P., Masala G., Pala V., Tumino R., Fasanelli F., Panico S., Bueno deMesquitaH.B., PeetersP.H., van Gills C.H., Quirós J.R., Agudo A., Sánchez M.J., Chirlaque M.D., Barricarte A., Amiano P., Khaw K.T., Travis R.C., Dossus L., Li K., Ferrari P., Merritt M.A., Tzoulaki I., Riboli E., Kaaks R. Added Value of Serum Hormone Measurements in Risk Prediction Models for Breast Cancer for Women Not Using Exogenous Hormones: Results from the EPIC Cohort. Clin Cancer Res. 2017; 23(15): 4181-4189. doi: 10.1158/1078-0432.CCR-16-3011.
- KaaksR., TikkK., SookthaiD., SchockH., Johnson T., Tj0nnelandA., Olsen A., Overvad K., Clavel-Chapelon F., Dossus L., Baglietto L., Rinaldi S., Chajes V., Romieu I., Boeing H., Schütze M., Trichopoulou A., Lagiou P., Trichopoulos D., Palli D., Sieri S., Tumino R., Ricceri F., Mattiello A., Buckland G., Ramón Quirós J., Sánchez M.J., Amiano P., Chirlaque M.D., Barricarte A., Bas Bueno-de-Mesquita H., van Gils C.H., PeetersP.H., Andersson A., SundM., WeiderpassE., KhawK.T., WarehamN., Key T.J., Travis R.C., MerrittM.A., Gunter M.J., Riboli E., Lukanova A. Premenopausal serum sex hormone levels in relation to breast cancer risk, overall and by hormone receptor status - results from the EPIC cohort. Int J Cancer. 2014; 134(8): 1947-57. doi: 10.1002/ijc.28528.
- ZarghamiN,, GrassL,, DiamandisE,P. Steroid hormone regulation of prostate-specific antigen gene expression in breast cancer. Br J Cancer. 1997; 75(4): 579-88. doi: 10.1038/bjc.1997.101.
- Guay A., Munarriz R., Jacobson J., Talakoub L., Traish A., QuirkF., Goldstein I., Spark R. Serum androgen levels in healthy premenopausal women with and without sexual dysfunction: Part A. Serum androgen levels in women aged 20-49 years with no complaints of sexual dysfunction. Int J Impot Res. 2004 Apr; 16(2): 112-20. doi: 10.1038/sj.ijir.3901178.
- Kim J., Coetzee G.A. Prostate specific antigen gene regulation by androgen receptor. J Cell Biochem. 2004 Oct 1; 93(2): 233-41. doi: 10.1002/jcb.20228.
- Majumder A., SinghM., Tyagi S.C. Post-menopausal breast cancer: from estrogen to androgen receptor. Oncotarget. 2017 Oct 27; 8(60): 102739-758. doi: 10.18632/oncotarget.22156.
- Седаков И.Е., Рогалев А.В., Садрицкая Я.В., Стеценко И.Н. Андрогены и рак молочной железы: что мы знаем? Новообразование. 2019; 11(2): 63-7. [Sedakov I.E., Rogalev A.V., Sadritskaya Ya.V., Stetsen-ko I.N. Androgens and breast cancer: what do we know? Neoplasm. 2019; 11(2): 63-7. (in Russian)]. doi: 10.26435/neoplasm.v11i2.276.
- Gerratana L., Basile D., Buono G., De Placido S., Giuliano M., Minichillo S., Coinu A., Martorana F., De Santo I., Del Mastro L., De Laurentiis M., Puglisi F., Arpino G. Androgen receptor in triple negative breast cancer: A potential target for the targetless subtype. Cancer Treat Rev. 2018 Jul; 68: 102-110. doi: 10.1016/j.ctrv.2018.06.005.
- Hanamura T., OhnoK., Hokibara S., MurasawaH., Nakamura T., Watanabe H., Kaizuka M., Sawano S., Koyama H., Ito K.I. Clinical significance of serum PSA in breast cancer patients. BMC Cancer. 2019 Oct 29; 19(1): 1021. doi: 10.1186/s12885-019-6256-2.
- GiaiM., YuH., RoagnaR., PonzoneR., KatsarosD., LevesqueM.A., Diamandis E.P. Prostate-specific antigen in serum of women with breast cancer. Br J Cancer. 1995 Sep; 72(3): 728-31. doi: 10.1038/ bjc.1995.401.
- Radowicki S., Kunicki M., Bandurska-Stankiewicz E. Prostate-specific antigen in the serum of women with benign breast disease. Eur J Obstet Gynecol Reprod Biol. 2008 Jun; 138(2): 212-6. doi: 10.1016/j. ejogrb.2007.05.023.


