Клиническая значимость задержки старта специального лечения у больных неоперабельным немелкоклеточным раком лёгкого III стадии: результаты собственного исследования и литературный обзор
Автор: Соловьева Е.П., Асахин С.М., Вальков М.Ю.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 (63), 2014 года.
Бесплатный доступ
Введение. До 30 % больных немелкоклеточным раком лёгкого (НМРЛ) имеют местнораспространённую опухоль, что является показанием для проведения консервативного лечения. Увеличение времени ожидания лучевой и/или химиотерапии может привести к прогрессированию опухоли и ухудшению показателей выживаемости. Цель исследования. Оценить влияние продолжительности времени до старта терапии (ВСТ) на общую выживаемость (ОВ) больных с неоперабельным местнораспространённым НМРЛ. Материал и методы. В ретроспективном исследовании 139 больных НМРЛ, получавших химиолучевое лечение, были разделены на подгруппы по длительности ВСТ. Оценку ОВ осуществляли методом Каплана-Майера с определением различий между группами лог-ранговым методом, кумулятивную ОВ сравнивали с помощью метода χ 2. Коррекцию ОВ с учётом влияния различных исходных факторов осуществляли с помощью регрессии Кокса. Результаты. В течение 1 мес после установления диагноза ХЛТ была начата у 87 (63 %), через 31 день и более - у 52 (37 %) больных. Распределение по исходным факторам прогноза было равномерным, за исключением эксплоративной торакотомии, которая чаще была проведена в группе ВСТ>1 мес (р=0,001). Медиана ОВ при ВСТ≤ 1 месяца составила 14,2 мес (95 % ДИ 11,8-16,7), при ВСТ>1 мес - 19,1 мес (95 % ДИ 14,7-23,5), лог-ранговый тест χ 2=0,562, р=0,453. Отношение рисков (ОР) смерти у больных с поздним началом специального лечения составило 0,87 (95 % ДИ 0,59-1,26), после коррекции по другим факторам - 0,86 (95 % ДИ 0,58-1,30). Заключение. При ретроспективном анализе установлено, что время до начала химиолучевого лечения у больных с НМРЛ III стадии не оказывает влияния на прогноз выживаемости как при исходной химиотерапии, так и при лучевой терапии. Эти результаты требуют подтверждения в рандомизированном исследовании.
Неоперабельный немелкоклеточный рак легкого iii стадии, лучевая терапия, химиотерапия
Короткий адрес: https://sciup.org/14056427
IDR: 14056427 | УДК: 616.24-006:615.849.1:615.28
Текст обзорной статьи Клиническая значимость задержки старта специального лечения у больных неоперабельным немелкоклеточным раком лёгкого III стадии: результаты собственного исследования и литературный обзор
CLINICAL SIGNIFICANCE OF THE DELAY IN STARTING SPECIAL TREATMENT FOR PATIENTS WITH SATGE III INOPERABLE NON-SMALL CELL LUNG CANCER: RESULTS OF STUDY AND LITERATURE REVIEW
Е.P. Solovyeva1,2, S.М. Asakhin1,2, М.Yu. Valkov1,2 Arkhangelsk Clinical Cancer Center Arkhangelsk1 Northern State Medical University, Arkhangelsk2
Introduction. Up to 30 % of patients with non-small cell lung cancer have locally advanced tumor. Increased waiting time for radiation therapy and/or chemotherapy can result in tumor progression and impaired survival.
The purpose of the study was to evaluate the influence of the length of time before starting therapy on the overall survival in patients with inoperable locally advanced non-small cell lung cancer.
Materials and methods. In the retrospective study, 139 patients with non-small cell lung cancer, receiving chemoradiotherapy were divided into subgroups by the length of time before starting therapy. The overall survival was assessed using the Kaplan-Meier method with determination of differences between groups by long-rank test, and the cumulative overall survival was compared using the χ2 test. The Cox regression model was applied to evaluate the effect of covariates on overall survival.
Results. Chemoradiotherapy was started within 1 month after diagnosis in 87 (63 %) patients and in 31 days and later in 52 (37 %) patients. Distribution by initial prognostic factors was uniform, except for exploratory thoracotomy, which was performed more often in patients who received chemotherapy within 1 month after diagnosis (р=0.001). The median overall survival rate was 14.2 months (95 % CI: 11.8–16.7) for patients who received chemoradiotherapy within 1 month after diagnosis and 19.1 months (95 % CI: 14.7–23.5) for patients, who received therapy at least 1 months after diagnosis (χ2=0.562, р=0.453). Risk ratio (RR) of death was 0.87 (95 % CI: 0.59–1.26) in patients with late onset of special treatment.
Conclusion. The retrospective analysis showed that time before onset of chemoradiotherapy in patients with stage III non-small cell lung cancer had no influence on prognosis of survival, with the initial chemotherapy as well as radiotherapy. These results require confirmation in randomized trials.
В структуре онкологической заболеваемости РФ рак лёгкого (РЛ) занимает первое место в течение последних 15 лет, на его долю приходится 22 % всех случаев рака у мужчин и 4 % – у женщин [1], ежегодно заболевает около 60 тыс. человек. Распространенность РЛ в России за последние 10 лет выросла с 76,2 в 2002 г. до 86,7 в 2012 г. на 100 тысяч населения (оба пола) [2]. Показатель летальности в течение первого года после установления диагноза при РЛ остается одним из самых высоких по сравнению с другими онкологическими заболеваниями: в 2012 г. он составил в РФ – 52 % [2], в Архангельской области – 56 % [3].
Особенно тяжёлым является прогноз при распространённых формах РЛ. При условно локализованной III стадии немелкоклеточного рака лёгкого (НМРЛ) 5-летняя выживаемость не превышает 10 % [4]. Большинство больных НМРЛ являются неоперабельными при IIIA-B стадиях заболевания на момент постановки диагноза. Рекомендованным методом лечения при неоперабельных формах НМРЛ является сочетание лучевой (ЛТ) и химиотерапии (ХТ). Лечение может быть начато с ХТ или с ЛТ при последовательном варианте. Одновременная химиолучевая терапия, согласно данным рандомизированных исследований [6, 10], приводит к улучшению выживаемости ценой усиления токсичности и может быть рекомендована больным в хорошем исходном состоянии.
Диагностика, стадирование и определение тактики лечения неоперабельного НМРЛ порой занимают много времени [8]. При этом время ожидания начала лечения, по мнению некоторых исследователей, может быть важным фактором, определяющим прогноз у этих больных. Время удвоения плоскоклеточного рака легкого, оценен- ное на биологической модели, определяет риск снижения локального контроля при ЛТ на 0,31 % ежедневно [19]. Более того, некоторые пациенты подвергаются риску стать неизлечимыми и во время ожидания терапии [13]. Таким образом, очевидно, что лечение РЛ необходимо начинать как можно раньше.
В ряде клинических исследований показано, что время до старта специального лечения (ВСТ) неоперабельного НМРЛ может сильно варьировать [16–21], при этом было обнаружено его негативное влияние на прогноз [9, 21, 22]. Однако в других исследованиях [13, 17, 20] такой взаимосвязи не выявлено. Важно учесть, что большинство исследований по оценке роли ВСТ при ЛТ/ХЛТ являлись одноцентровыми, включали гетерогенные когорты пациентов как с ранними, так и поздними стадиями РЛ, получавших ЛТ по разным методикам [9, 17, 18, 21, 22].
Цель исследования состоит в оценке влияния продолжительности времени до старта терапии на выживаемость когорты больных неоперабельным местнораспространённым немелкоклеточным раком лёгкого, получавших консервативное лечение в условиях ГБУЗ Архангельской области «Архангельский клинический онкологический диспансер» (АКОД).
Материал и методы
Ретроспективно прослежены данные о методах и исходах лечения больных неоперабельным местнораспространенным НМРЛ III стадии, получавших консервативное лечение в условиях АКОД. Для этого произведен отбор больных из госпитальной базы данных АКОД за период с 01.02.2000 по 12.02.2010 г. Подробная характеристика указанной когорты была опубликована ранее [5].
Согласно внутреннему протоколу АКОД, больным местнораспространенным неоперабельным РЛ в удовлетворительном состоянии изначально планируется химиолучевое лечение, как правило, последовательное. Ранее нами было показано, что при последовательной ХЛТ выбор первого метода (ЛТ либо ХТ) может оказать существенное влияние на прогноз [5]: выявлено статистически значимое преимущество в выживаемости у больных, исходно получавших ЛТ. В настоящем исследовании больные были разделены на группы по длительности ВСТ. В соответствии с рекомендациями [20, 23] ожидание начала консервативного лечения до 1 мес является приемлемым. Поэтому точкой разделения групп был выбран временной интервал 30 дней: ВСТ≤30 дней и ВСТ>30 дней.
Подробное описание методик ЛТ и ХТ было представлено ранее [5]. Дистанционную ЛТ планировали до радикальной суммарной дозы не менее 60 Гр. Тем не менее в окончательный анализ были также включены больные, получившие ЛТ в СОД 50–59 Гр. В облучаемый объем исходно включали первичную опухоль и регионарные лимфатические узлы. Лимфатические узлы корня легкого и средостения со стороны поражения облучали даже в отсутствие признаков их поражения, в таких случаях элективная доза составляла 40–44 Гр. В объем облучения не входили надключичные лимфатические узлы в случае отсутствия явных признаков метастатического поражения. Плановых перерывов в ЛТ не допускали.
Химиотерапию большинству больных, согласно локальному стандарту, принятому на основании международных рекомендаций, с 2005 г. проводили сочетанием препарат платины и этопозида (EP) в стандартных дозовых режимах. При лечении пациентов до 2005 г. применялись схемы, включавшие циклофосфан, доксорубицин, этопозид, цисплатин. В исследование включали больных, прошедших не менее 2 курсов ХТ.
Основным критерием сравнительной оценки эффективности методов установили общую выживаемость (ОВ), измеренную как промежуток между датой начала специального лечения и смертью от любой причины. Время до старта терапии определяли как промежуток в днях между датами установления диагноза и начала любого специального лечения: ЛТ или ХТ.
Оценка распределения по непрерывным характеристикам проводилась с помощью критерия Стьюдента либо его непараметрического аналога Mann – Whitney (U-тест). Статистическую значимость различий в распределении по порядковым и качественным характеристикам определяли с помощью метода χ2 с точным критерием Фишера при ожидаемом количестве наблюдений в сравниваемых группах менее 5. Все сравнения были двусторонними. Значения показателей кумулятивной выживаемости представляли в виде процентов с доверительными интервалами (ДИ). Выживаемость больных измеряли в месяцах и представляли в виде медианы (Ме), 95% ДИ, ее оценка осуществлялась методом Каплана – Майера. Различия в выживаемости между группами определяли лонг-ранговым методом. Цензурирование проводили по дате последней проверки базы госпитального регистра либо по дате последней явки на контрольный осмотр для выбывших из-под наблюдения. Оценку степени влияния исходных факторов на выживаемость осуществляли с помощью регрессионной модели пропорциональных рисков Кокса. Введение факторов, оказавших значимое влияние на прогноз в однофакторных моделях, в многофакторную регрессионную модель осуществляли форсированным методом.
Результаты исследования
Одновременную ХЛТ в анализируемый период времени применяли 3 пациентам, один из них по своим характеристикам соответствовал критериям отбора/невключения. Остальные больные получали последовательное консервативное лечение, начинавшееся с ХТ у 104, а с ЛТ – у 35. В итоге для анализа было отобрано 139 пациентов. Медиана ВСТ составила 23 дня (1–568 дней). У 4 больных (трое из них исходно получали ЛТ) ВСТ составила более 6 мес (185–568 дней). При анализе причин позднего начала специального лечения удовлетворительных объяснений этому не найдено: зарегистрированного в официальных медицинских документах специального противоопухолевого лечения эти больные в этот период не получали. Консервативное лечение было начато в течение 1 мес после установления диагноза 87 (63 %) пациентам, 52 (37 %) больным начато специальное лечение через 31 день и более. Распределение в подгруппах по исходным характе-
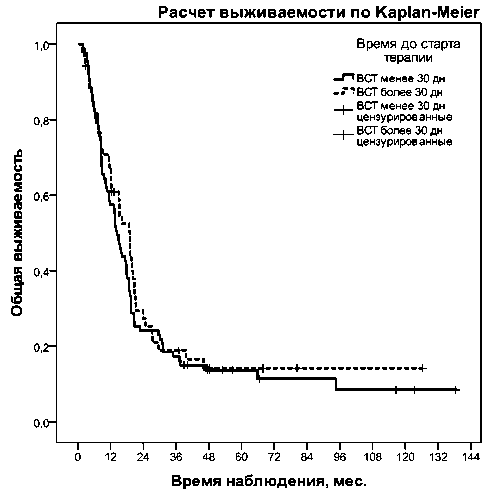
Рис. 1. Общая выживаемость в зависимости от времени старта терапии (ВСТ)
ристикам равномерное (табл. 1), за исключением проведенной эксплоративной торакотомии перед началом специальных методов лечения. Также несколько чаще (р=0,079) в группе ВСТ>30 встречались больные в состоянии ECOG 2.
Медиана общей выживаемости для всех больных составила 17,4 (95 % доверительный интервал (ДИ), 14,3–20,6) мес. Медиана ОВ при ВСТ≤1 мес составила 14,2 мес (95 % ДИ, 11,8–16,7), при ВСТ>1 мес – 19,1 мес (95 % ДИ, 14,7–23,5), лог-ранговый тест χ2=0,562, р=0,453 (рис. 1).
Регрессионный анализ пропорциональных рисков Кокса для всей группы больных был проведен в связи с неравномерностью распределения больных по исходным параметрам (табл. 2). В модели множественной регрессии по Коксу относительный риск (ОР) смерти от любой причины у больных с поздним началом специального лечения составил 0,87 (95 % ДИ 0,59–1,26), после коррекции – 0,86 (95 % ДИ 0,58–1,30).
Обсуждение
В последние годы откладывание начала специальной терапии становится все более серьезной проблемой. Помимо психологического стресса у больных, ожидание и задержки могут повлиять на результаты лечения и прогноз заболевания. Так, в ряде исследований обнаружена достоверная зависимость выживаемости больных немелкоклеточным раком лёгкого от объёма опухоли [12, 25].
С биологической точки зрения длительное время до старта терапии может привести к увеличению размеров опухоли, росту регионарных и отдалённых метастазов, что будет иметь потенциальное негативное влияние на прогноз. Рак лёгкого долгое время остаётся потенциально излечимым и сначала растет медленно: до достижения опухолью 1 см в диаметре проходит около 130 мес [14]. В дальнейшем объём опухоли может экспоненциально увеличиваться, что приводит к переходу в неизлечимое состояние за 1 мес [21].
M. Hasegawa et al. [15] рассмотрели время удвоения объема опухоли (ВУО) при РЛ по данным серий скрининговых компьютерных томограмм. Обнаружено, что ВУО значительно различалось в зависимости от гистологического варианта: оно составило 533 ± 381; 129 ± 97 и 97 ± 46 дней для аденокарциномы, плоскоклеточного рака и мелкоклеточного рака соответственно. По другим данным, время удвоения для плоскоклеточного рака и аденокарциномы составляет 88 дней и 161 день соответственно [14, 25]. Таким образом, РЛ, который к моменту выявления едва определяется рентгенологически, возможно, возник несколько месяцев и даже лет назад.
При клинически определяемых опухолях темпы роста могут значительно увеличиваться. Так, в исследовании N. O’Rourke et al. [21] показано, что в период ожидания потенциально радикальной ЛТ, который длился от 35 до 187 дней, 6 из 29 (21 %) больных РЛ стали неизлечимыми. При этом опухоль увеличилась в размерах от 0 до 373 %. В исследовании El Sharouni et al. [11] доля ставших неизлечимыми пациентов была ещё выше: 9 из 22 (41 %) потенциально излечимых пациентов после исходной ХТ в дальнейшем лечились с паллиативной целью после периода ожидания от 29 до 141 дня. Первичная опухоль при сравнении диагностической (после ХТ) и планирующей (перед ЛТ) компьютерной томограмм увеличилась в размерах в 1,1–81,8 раза, медиана времени удвоения составила 29 дней.
В исследовании Wang Li et al. [24] по изучению ВСТ при III стадии НМРЛ медиана времени между датой первого диагностического снимка и снимка перед началом ЛТ/ХЛТ составила для когорты из 237 пациентов 57 дней. В более раннем исследовании по оценке взаимосвязи между временем ожи- дания и ростом опухоли [21] от первого посещения клиники до начала лечения пациента прошло от 35 до 187 дней, с медианой 94 дня. В ещё одном распределение больных по исходным характеристикам
Таблица 1
|
Характеристика |
ВСТ≤30 (n=87) |
ВСТ>30 (n=52) |
р |
|
Пол |
0,650* |
||
|
мужчины |
83 (95,4 %) |
51 (98,1 %) |
|
|
женщины |
4 (4,6 %) |
1 (1,9 %) |
|
|
Возраст, лет |
0,438 |
||
|
до 50 |
6 (6,9 %) |
8 (15,4 %) |
|
|
50–59 |
36 (41,4 %) |
19 (36,5 %) |
|
|
60–69 |
34 (39,1 %) |
18 (34,6 %) |
|
|
70 и старше |
11 (12,6 %) |
7 (13,5 %) |
|
|
Гистология |
0,251 |
||
|
плоскоклеточный |
59 (67,8 %) |
40 (76,9 %) |
|
|
другой немелкоклеточный |
28 (32,2 %) |
12 (23,1 %) |
|
|
Статус по ECOG |
0,079 |
||
|
ECOG 0–1 |
78 (89,7 %) |
41 (78,8 %) |
|
|
ECOG 2 |
9 (10,3 %) |
11 (21,2 %) |
|
|
Размер первичной опухоли |
0,184 |
||
|
т . 1–2 |
33 (37,9 %) |
14 (26,9 %) |
|
|
т 3–4 |
54 (62,1 %) |
38 (73,1 %) |
|
|
Поражение лимфоузлов |
0,887 |
||
|
N0–1 |
21 (24,1 %) |
12 (23,1 %) |
|
|
N2–3 |
66 (75,9 %) |
40 (76,9 %) |
|
|
Подстадия |
0,495 |
||
|
А |
42 (48,3 %) |
22 (42,3 %) |
|
|
В |
45 (51,7 %) |
30 (57,7 %) |
|
|
Эксплоративная торакотомия |
0,001 |
||
|
нет |
80 (92,0 %) |
37 (71,2 %) |
|
|
да |
7 (8,0 %) |
15 (28,8 %) |
|
|
ХЛТ начата с… |
0,398 |
||
|
ХТ |
24 (27,6 %) |
11 (21,2 %) |
|
|
ЛТ |
63 (72,4 %) |
41 (78,8 %) |
|
Примечание: * – точный тест Фишера.
одноцентровом исследовании из Великобритании [7] оценили среднее время от направления к специалисту до начала лечения в 48 дней. Шведские исследователи [17] проанализировали данные о 134 пациентах с НМРЛ I–IV стадий и показали, что среднее время от первого визита к специалисту до установления диагноза составило 9 дней, а от постановки диагноза до начала лечения – 79 дней. Среди 466 шведских пациентов с НМРЛ I–IV стадий G. Myrdal et al. [20] определили медиану времени от первого визита к специалисту до начала лечения около 48 дней. В нашем исследовании медиана времени до старта терапии составила 23 дня (табл. 3).
В нашем исследовании установлено, что длительная задержка до начала лечения больных раком лёгкого III стадии не вызвала снижения их выживаемости. Вероятно, причина этого в том, что пациенты с более агрессивным фенотипом опухоли и быстро прогрессирующими симптомами заболевания быстрее получают лечение. Наоборот, как правило, пациенты с медленно растущими бессимптомными опухолями менее охотно и быстро проходят обследование и соглашаются на лечение. При этом скорость роста опухоли, как было показано во многих исследованиях [11, 21], является одним из основных факторов прогноза. Ретроспективный характер исследования и невозможность клинического измерения скорости роста опухоли не позволяют определить возможную причину отсутствия взаимосвязи между временем ожидания и выживаемостью.
Заключение
Наши результаты показывают, что время до начала химиолучевого лечения больных неоперабельным немелкоклеточным раком легкого III стадии не оказывает влияния на прогноз выживаемости как при исходной химиотерапии, так и лучевой терапии. Ретроспективный характер работы не исключает возможности селекции в группы раннего старта терапии больных с более агрессивно текущими процессами. Для определения влияния задержки начала лечения на прогноз необходимо проспективное планирование исследования с привлечением методов (лучше биологических) оценки исходной скорости роста опухоли.
результаты однофакторного и многофакторного анализа выживаемости в зависимости от ВСТ
Таблица 2
|
Характеристика |
Нескорректированная |
Скорректированная * |
||||
|
ОР |
95 % ДИ |
р |
ОР |
95 % ДИ |
р |
|
|
ВСТ менее 30 дней |
1,00 |
Референтная |
1,00 |
Референтная |
||
|
ВСТ более 30 дней |
0,87 |
0,59 – 1,26 |
0,45 |
0,86 |
0,58 – 1,30 |
0,48 |
Примечание: * – после коррекции по полу, возрасту, исходному состоянию по ECOG, подстадии, распространённости по T и N, последовательности методов лечения, пробной торакотомии.
Время до старта терапии при раке легкого по данным литературы
Таблица 3
|
Автор (год) |
Кол-во пациентов в исследовании |
Медиана времени до старта терапии |
|
Wang Li et al. (2009) [24] |
237 |
57 |
|
N. О'Rourke et al. (2000) [21] |
29 |
94 |
|
H. Bozcuk et al. (2001) [7] |
198 |
48 |
|
H. Koyi et al. (2002) [17] |
134 |
79 |
|
G. Myrdal (2004) [20] |
466 |
48 |
|
Е.П. Соловьева и др. (2013) [5] |
139 |
23 |


