Клинические особенности BRCA-позитивного рака яичников
Автор: Максимов С.Я., Имянитов Е.Н., Гусейнов К.Д., Городнова Т.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 (60), 2013 года.
Бесплатный доступ
Роведена оценка клинической значимости носительства мутаций в геле BRCA1 в формировании ответа на химиотерапию, а также на продолжительность жизни у больных распространенным РЯ. Из архива института (с января 2000 г. по январь 2008 г.) была отобрана 21 больная распространенным РЯ с наследственной мутацией в гене BRCA1. Контрольную группу составили 42 (1:2) случая распространенного ненаследственного РЯ, сопоставимые по стадиям, гистологическому типу, возрасту и объему первичной циторедукции — известные прогностические факторы. Все BRCA-позитивные пациентки ответили на неоадъювантную платиносодержащую химиотерапию, в то время как в группе ненаследственного РЯ общий ответ был зафиксирован у 36 % (8/8 (100 %) vs 9/25 (36 %); OR 14,8; 95 % CI 1,78-100; р=0,002). По сравнению с больными контрольной группы BRCA-позитивные больные характеризовались более высокой частотой общего ответа (81 % vs 33,4 %; OR 8,50; 95 % CI 2,52- 34,89; р=0,001) на первую линию платиносодержащей химиотерапии и на вторую (62 % vs 21,4 % OR 5,96; 95 % CI 1,76-22,50; р=0,004). После третьей линии химиотерапии у BRCA-позитивных больных отмечалась выраженная тенденция к лучшим результатам (18,8 % vs 5,6 %; р=0,233). У больных с BRCA1 мутациями, по сравнению с контрольной группой, наблюдалось статистически значимое улучшение среднего значения безрецидивного периода после первой линии химиотерапии (20,05 vs 7,21 мес; р=0,005). Продолжительность жизни у BRCA-позитивных больных была значимо больше по сравнению с больными с ненаследственным РЯ (медиана 9,3 vs 3,4 года; р=0,001).
Brca-позитивные больные, платиночувствительный рак яичников, наследственные мутации в гене brca1, длительность безрецидивного периода, общая выживаемость
Короткий адрес: https://sciup.org/14056374
IDR: 14056374 | УДК: 618.11-006.6-056.7:575.113
Текст научной статьи Клинические особенности BRCA-позитивного рака яичников
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2013. № 6 (60)
Семейный наследственный рак яичников (РЯ) – результат мутаций генов BRCA1 и BRCA2. Каждая седьмая больная РЯ в России – это пациентка с наследственной мутацией в гене BRCA1 [1, 2, 7]. Гены-супрессоры опухолевого роста BRCA1 и BRCA2 участвуют в регуляции пролиферации клеток и репарации молекулы ДНК посредством механизмов гомологичной рекомбинации [9, 10]. Клетки с нарушенной функцией генов BRCA1/2 не способны восстанавливать разрывы двойной цепи ДНК и демонстрируют высокую чувствительность к препаратам платины, точкой приложения которых и является молекула ДНК опухолевых клеток. Таким образом, «недостаточные» функциональные возможности систем репарации в клетке опухоли могут служить поводом для выделения группы пациентов с повышенной чувствительностью к определенной цитостатической терапии. Многочисленные работы убедительно демонстрируют, что у BRCA-позитивных больных РЯ протекал более благоприятно, это, вероятно, связано с сохраняющейся чувствительностью к препаратам платины на протяжении нескольких рецидивов заболевания [3, 4, 8].
Цель исследования – оценить клиническую значимость носительства мутаций в гене BRCA1 в формировании ответа на химиотерапию (ХТ), а также их влияние на продолжительность жизни у больных распространенным РЯ.
Материал и методы
Все больные с распространенным РЯ, наблюдавшиеся в НИИ онкологии им. Н.Н. Петрова (г. Санкт-Петербург) с января 2000 г. по январь 2008 г., были протестированы на носительство 3 мутаций в гене BRCA1. В группу BRCA-позитивного РЯ вошла 21 пациентка с распространенным РЯ, в том числе 17 (81 %) женщин с мутацией BRCA1 5382insC и 4 (19 %) – с мутациями BRCA1 4153delA. Из них 9 (43 %) пациенток имели клинические признаки наследственного рака: 5 (24 %) – отягощенный семейный онкологический анамнез, 4 (19 %) – случаи метахронного первично-множественного рака.
В контрольную группу были включены 42 (1:2) пациентки с ненаследственным распространенным РЯ, сначала по точному совпадению стадии и гистологического типа, затем по соответствию возраста на момент постановки диагноза, объему произведенной первичной циторедукции – известные прогностические факторы для РЯ. Случаи ненаследственного РЯ определяли по следующим критериям: отсут- ствие мутаций в гене BRCA1; отсутствие у больной рака молочной железы (РМЖ) и/или РМЖ и РЯ в семейном анамнезе. Преобладающим гистотипом опухоли у пациенток в обеих группах был серозный рак. Важно отметить, что в настоящее исследование включены 3 (14 %) BRCA-позитивных больных с низкодифференцированной эндометриоидной аденокарциномой; им соответствовали 3 (7 %) случая ненаследственного РЯ с аналогичным гистотипом, 2 (5 %) случая с умеренно дифференцированной и 1 (2 %) случай с высокодифференцированной эндометриоидной аденокарциномой. У 10 больных в контрольной группе был серозно-папиллярный, светлоклеточный рак, а также смешанные формы опухоли. Одной BRCA-позитивной больной с низкодифференцированным РЯ соответствовало 2 случая ненаследственного РЯ с тем же морфологическим описанием (табл. 1).
Медиана возраста на момент постановки диагноза для BRCA-позитивных больных РЯ составила 51 год (диапазон от 39 до 74 лет) и была близкой к медиане возраста в контрольной группе больных ненаследственным РЯ (медиана – 50 лет, диапазон – от 35 до 72 лет).
Все больные в составе ХТ первой линии как неоадъювантной, так и адъювантной получали препараты платины. Хирургическую стадию определяли по FIGO (International Federation of Gynecology and Obstetrics) после анализа анамнеза и данных, полученных в ходе операции и патоморфологического исследования. При оценке объема первичной циторедукции за оптимальную операцию принимали ту, при которой максимальные размеры оставшихся опухолевых образований не превышают 1 см; субоптимальной циторедукции соответствовал размер оставшейся опухоли 1–2 см. При размерах оставшихся опухолевых масс более 2 см объем операции считался неоптимальным.
Показатели эффективности лечения устанавливали по Response Evaluation Criteria In Solid Tumors (RECIST). За полный ответ принимали исчезновение всех измеряемых очагов; за неполный ответ – уменьшение на 30 % суммы наибольших диаметров измеряемых очагов; за прогрессирование заболевания – увеличение на 20 % суммы наибольших диаметров измеряемых очагов; стабилизация заболевания определялась как изменения, не соответствующие ни одному из перечисленных выше критериев. Дату рецидива заболевания определяли по первому при- знаку прогрессирования заболевания на основании данных КТ, либо МРТ, либо УЗИ, оцениваемых по шкале RECIST, а также по повышению уровня маркера СА-125.
Статистической обработке подвергались показатели ответа после предоперационной, 1, 2, 3-й линий ХТ ( χ 2), а также безрецидивный период и интервал без лечения после первой, второй, третьей линий
Таблица 1
|
Показатель |
BRCA-позитивный РЯ (n=21) |
Ненаследственный РЯ (n=42) |
|
Возраст на момент постановки диагноза, годы |
||
|
Медиана |
51 |
50 |
|
Диапазон |
39–74 |
35–72 |
|
Год постановки диагноза |
||
|
Диапазон |
2000–2008 |
2001–2008 |
|
Стадия |
||
|
IIC |
3 (14 %) |
6 (14 %) |
|
III |
10 (48 %) |
21 (50 %) |
|
IV |
8 (38 %) |
15 (36 %) |
|
Гистологический тип |
||
|
G3 серозная аденокарцинома |
9 (43 %) |
18 (43 %) |
|
G2 серозная аденокарцинома |
2 (10 %) |
4 (9,5 %) |
|
Эндометриоидная аденокарцинома |
3 (14 %) |
6 (14 %) |
|
Светлоклеточная карцинома |
1 (5 %) |
2 (5 %) |
|
Серозно-папиллярная аденокарцинома |
3 (14 %) |
6 (14 %) |
|
Смешанная, преимущественно серозная аденокарцинома |
2 (9 %) |
4 (9,5 %) |
|
Низкодифференцированная карцинома |
1 (5 %) |
2 (5 %) |
|
Объем циторедукции |
||
|
Оптимальныая циторедукция |
11 (52 %) |
20 (48 %) |
|
Субоптимальная циторедукция |
8 (38 %) |
17 (40 %) |
|
Неоптимальная циторедукция |
2 (10 %) |
4 (10 %) |
|
Без операции |
– |
1 (2 %) |
|
Мутация BRCA1 |
||
|
BRCA1 5382insC |
17 (81 %) |
– |
|
BRCA1 4153delA |
4 (19 %) |
– |
|
BRCA1 185delAG |
– |
– |
Таблица 2
общий ответ (полный ответ + частичный ответ) у больных с brCa-позитивным и ненаследственным раком яичников в зависимости от срока рецидива
ХТ (t-критерий, U-критерий), общая выживаемость (метод Каплана–Мейера). Для всех статистических анализов использовался пакет SPSS (версия 13).
Анализ мутаций в гене BRCA1 проводился методом аллель-специфической полимеразной цепной реакции в режиме реального времени (iCycler iQ5 Real Time Detection System (Bio-Rad)). Учет результатов производился при оценке графиков амплификации и кривых плавления. В качестве источника ДНК использовалась ткань из парафиновых блоков.
Результаты и обсуждение
Предоперационную платиносодержащую ХТ получали 37 % пациенток с BRCA-позитивным РЯ и 63 % – с ненаследственным РЯ. Все BRCA-позитивные пациентки ответили на неоадъювантную ХТ, тогда как в группе ненаследственного РЯ общий ответ был зафиксирован у 36 %, отличия статистически значимы (8/8 (100 %) vs 9/25 (36 %); OR 14,8; 95 % CI 1,78–100; p=0,002). В 12 % случаев ненаследственного РЯ при предоперационной платиносодержащей ХТ наблюдалось увеличение размера опухоли.
В клинической практике выбор терапии рецидивов РЯ основан на том, что общий ответ на повторное применение платиносодержащих программ четко пропорционален длительности без-рецидивного периода: при сроках <6 мес частота объективного ответа составляет около 5 %, при 6–12 мес – 26–30 %, при 12–24 мес – 30–60 %, более 24 мес – 77–80 % [5, 6]. Мы проанализировали частоту ответа на платиносодержащую ХТ при первом рецидиве заболевания в зависимости от срока возникновения рецидива. BRCA-позитивные больные характеризовались более высокой частотой общего ответа даже при сроке <6 мес: у 4 из 21 (19 %) BRCA-позитивные пациенток возникли рецидивы в этом интервале, при этом у двух из них наблюдался полный ответ на ХТ по схеме цисплатин + циклофосфан, а две другие не ответили на монохимиотерапию таксанами. В группе ненаследственного
Таблица 3
|
Химиотерапия |
Ответ на химиотерапию (ПР + ЧР) |
р |
Отношение шансов для ответа |
95 % допустимый интервал |
|
Вторая линия |
||||
|
Любая химиотерапия |
||||
|
BRCA-позитивный РЯ (n=21) |
13 (62 %) |
0,0041 |
5,96 |
1,76–22,50 |
|
Ненаследственный РЯ (n=28) |
6 (21 %) |
|||
|
Платиносодержащая химиотерапия |
||||
|
BRCA-позитивный РЯ (n=17) |
13 (76 %) |
>0,0011 |
12,35 |
3,02–62,26 |
|
Ненаследственный РЯ (n=24) |
5 (21 %) |
|||
|
Неплатиновая химиотерапия |
||||
|
BRCA-позитивный РЯ (n=4) |
– |
– |
– |
– |
|
Ненаследственный РЯ (n=4) |
1 (25 %) |
|||
|
Третья линия |
||||
|
Любая химиотерапия |
||||
|
BRCA-позитивный РЯ (n=16) |
3 (19 %) |
0,2852 |
3,46 |
0,39–74,81 |
|
Ненаследственный РЯ (n=16) |
1 (6 %) |
|||
|
Платиносодержащая химиотерапия |
||||
|
BRCA-позитивный РЯ (n=8) |
1 (12 %) |
0,7162 |
1,71 |
0,06–8,16 |
|
Ненаследственный РЯ (n=13) |
1 (8 %) |
|||
|
Неплатиновая химиотерапия |
||||
|
BRCA-позитивный РЯ (n=8) |
2 (25 %) |
– |
– |
– |
|
Ненаследственный РЯ (n=3) |
– |
|||
Примечание: 1 –критерий ( χ 2), 2 – критерий Фишера.
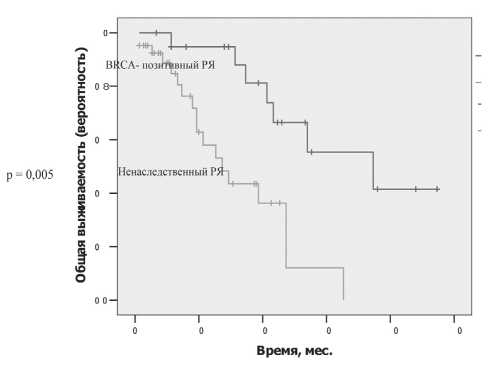
Рис. 1. Общая продолжительность жизни для BRCA-позитивных больных по сравнению с больными ненаследственным РЯ
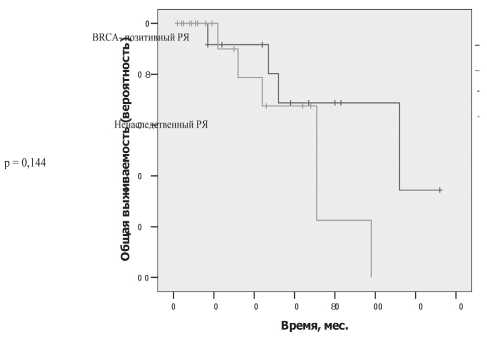
Рис. 2. Общая продолжительность жизни для BRCA-позитивных больных по сравнению с больными ненаследственным РЯ в группах только с оптимальной циторедукцией
Таблица 4
Интервал без лечения при brCa-позитивном и ненаследственном раке яичников
РЯ болезнь рецидивировала у 30 из 40 (72 %) больных при сроке <6 мес, при этом общего ответа на платиновую терапию не наблюдалось (табл. 2).
По сравнению с больными контрольной группы BRCA-позитивные больные характеризовались более высокой частотой общего ответа на первую линию платиносодержащей ХТ (81 % vs 33,4 %; OR 8,50; 95 % СI 2,52–34,89; p=0,001), а также на вторую (62 % vs 21.4 %; OR 5,96; 95 % СI 1,76–22,50; p=0,004). После третьей линии ХТ у BRCA-позитивных больных отмечалась выраженная тенденция к улучшению результатов (18,8 % vs 6,2 %; p=0,285) (табл. 3).
Сопоставление эффективности цитостатической терапии только по показателю общего ответа не вполне оправдано. При несомненном выигрыше в частоте общего ответа его продолжительность при последующих рецидивах не отличается от таковой у больных с ненаследственным РЯ. В нашем исследовании уже после второго рецидива заболевания статистически значимой разницы между группами не наблюдается – медиана интервала без лечения после завершения 3-й линии ХТ в группе BRCA-позитивных больных составила 2,5 мес против 1,1 мес (р=0,085) в группе ненаследственного РЯ (табл. 4).
У больных с BRCA1 мутациями, по сравнению с пациентками контрольной группы, наблюдалось статистически значимое улучшение среднего значения безрецидивного периода после ХТ первой линии (20,05 vs 7,21 мес; p=0,005). При анализе в группах сравнения только с оптимальной первичной циторедукцией безрецидивный период достигал больших значений у носительниц мутаций (21,5 vs 9,5 мес; p=0,083), однако значимых различий не было. Оценка выживаемости по методу Каплана–Мейера с момента постановки диагноза выявила статистически значимое улучшение показателей общей продолжительности жизни для больных с BRCA-позитивным РЯ (медиана продолжительности жизни – 9,3 года) по сравнению с больными ненаследственным РЯ (медиана продолжительности жизни – 3,4 года; p=0,001) (рис. 1). Общая продолжительность жизни в группе ненаследственного РЯ с оптимальной первичной циторедукцией была лучше, чем в общей, но в сравнении с BRCA-позитивными пациентками значимых различий не получено (медиана 9,3 vs 5,9 мес; p=0,144) (рис. 2).
Выводы
Все BRCA-позитивные пациентки ответили на неоадъювантную платиносодержащую
ХТ, в то время как в группе ненаследственного РЯ общий ответ был зафиксирован у 36 % (8/8 (100 %) vs 9/25 (36 %); OR 14,8; 95 % CI 1,78–100; p=0,002). В результате анализа групп сравнений, подобранных по гистологическому типу, стадии, возрасту, объему первичной циторедукции, было выявлено, что BRCA-позитивные больные характеризуются более высокой частотой общего ответа (81 % vs 33,4 %; OR 8,50; 95 % СI 2,52–34,89; p=0,001) на первую линию платиносодержащей ХТ и на вторую (62 % vs 21,4 %; OR 5,96; 95 % СI 1,76–22,50; p=0,004). После третьей линии ХТ у BRCA-позитивных больных отмечалась выраженная тенденция к лучшим результатам (18,8 % vs 5,6 %; p=0,233). У больных с BRCA1 мутациями, по сравнению с пациентками контрольной группы, наблюдалось статистически значимое улучшение среднего значения безрецидивного периода после первой линии ХТ (20,05 vs 7,21 мес; p=0,005). Продолжительность жизни у BRCA-позитивных больных составила 9,3 года и была достоверно больше по сравнению с больными с ненаследственным РЯ (медиана 9,3 vs 3,4 года; p=0,001).


