Клинические результаты применения серебросодержащего препарата в составе антимикробного спейсера при лечении перипротезной инфекции тазобедренного сустава
Автор: Божкова С.А., Гаджимагомедов М.Ш., Тихилов Р.М., Артюх В.А., Антипов А.П., Афанасьев А.В., Торопов С.С., Муравьева Ю.В.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 6 т.30, 2024 года.
Бесплатный доступ
Введение. Перипротезная инфекция (ППИ) является одним из самых серьезных осложнений при первичной артропластике. В данной работе представлен сравнительный анализ результатов санирующего этапа двухэтапного лечения пациентов с хронической ППИ тазобедренного сустава (ТБС) с использованием антимикробного спейсера (АМС) с добавлением высокодисперсного серебра (ВД-Ag) и без его импрегнации.Цель работы - провести сравнительный анализ клинической эффективности санирующего этапа лечения пациентов с хронической ППИ при использовании ВД-Ag для дополнительной импрегнации АМС.Материалы и методы. Ретроспективное исследование основано на анализе исходов лечения 223 пациентов с ППИ ТБС, которым при выполнении санирующего этапа были установлены АМС. Были сформированы 2 группы пациентов в зависимости от импрегнации костного цемента (КЦ) только антибиотиком или его комбинацией с ВД-Ag, соответственно группы 1 (n = 112) и группа 2 (n = 111). Оценку исходов лечения пациентов при сроке наблюдения не менее двух лет проводили в соответствии с модифицированными критериями Delphi. Достоверность различий количественных параметров между группами анализировали с применением непараметрического теста Манна - Уитни, для анализа относительных показателей использовали тест Фишера. Различия считали значимыми при p 0,05), при этом частота рецидивов монобактериальной инфекции, обусловленной грамположительными бактериями, была значимо ниже в группе 2 (p = 0,012).Обсуждение. Согласно данным научных публикаций, частота рецидивов перипротезной инфекции варьирует от 8 до 40 % в зависимости от характера инфекционного процесса и вида возбудителя. В группе с применением препарата Вд-Ag в составе АМС эффективность санирующего этапа составила 82,9 %, в группе сравнения - 76,8 %. Однако субанализ влияния этиологии ППИ на результаты лечения показал, что применение АМС с комбинацией Вд-Ag и ванкомицина привело к статистически значимому снижению риска развития рецидива у пациентов с монобактериальной инфекцией, вызванной грамположительными возбудителями, и позволило купировать инфекцию в 89,7 % случаев.Заключение. При выполнении санирующего этапа двухэтапного лечения хронической ППИ ТБС, обусловленной грамположительными бактериями, АМС с добавлением ВД-Ag показал высокую эффективность, однако требуется дальнейшая разработка новых комбинаций для импрегнации КЦ с целью расширения спектра антимикробной активности устанавливаемых спейсеров.
Периимплантная инфекция, перипротезная инфекция, антимикробный спейсер, высокодисперсное серебро, импрегнация костного цемента
Короткий адрес: https://sciup.org/142243865
IDR: 142243865 | УДК: 616-022:616.728.2-77-089.843:615.33:615.036 | DOI: 10.18019/1028-4427-2024-30-6-822-830
Текст научной статьи Клинические результаты применения серебросодержащего препарата в составе антимикробного спейсера при лечении перипротезной инфекции тазобедренного сустава
В настоящее время эндопротезирование (ЭП) является эффективным методом лечения целого ряда заболеваний и травм тазобедренного сустава, которому в ряде случаев нет альтернатив. За много лет широкого применения данного вмешательства в практической медицине существенно усовершенствованы модели эндопротезов, операционная техника, периоперационное фармакологическое сопровождение пациентов, что в подавляющем большинстве случаев приводит к отличным анатомо-функциональным результатам. Одним из нечастых, но наиболее тяжелых осложнений данного оперативного вмешательства является развитие перипротезной инфекции, частота которого варьирует от 1,1 % после первичного ЭП по причине остеоартрита до 2 % после замены тазобедренного сустава (ТБС) при переломе шейки бедренной кости [1]. Выполнение ревизионных операций заканчивается развитием инфекционного осложнения уже в 7–15 % случаев [2, 3, 4], и в настоящее время именно инфекция, по мнению отечественных и зарубежных авторов, является одной из основных причин ревизионного ЭП [5, 6, 7].
Двухэтапное ревизионное ЭП до настоящего времени является операцией выбора в большинстве случаев лечения пациентов с хронической ППИ ТБС [8]. В недавно опубликованном метаанализе проанализировано 46 публикаций с исходами двухэтапного лечения 5009 пациентов с инфекций в области тазобедренного сустава [9]. В среднем частота рецидивов инфекционного процесса составила 8,35 %, при этом в семи исследованиях, включенных в данный анализ, рецидив ППИ был установлен более чем в 15 % случаев: от 16,7 % в первые два года после второго этапа [10] до 27 % при пятилетнем наблюдении в исследовании C. Theil et al. [11]. Установка спейсера любого типа может сопровождаться такими осложнениями как рецидив инфекционного процесса, вывих, перелом или миграция спейсера, перелом бедренной кости [12, 13]. При этом одним из наиболее значимых факторов риска неудачи лечения было получение бактериального роста из области сустава при выполнении второго этапа лечения [14]. По-видимому, одной из причин отсутствия эрадикации возбудителя в области очага инфекции может быть создание неэффективного локального депо антибиотиков при установке антимикробного спейсера (АМС) на первом этапе лечения. Несмотря на то, что процедура импрегнации костного цемента различными антибактериальными препаратами в настоящее время является рутинной, по данным разных авторов, выделение антибиотиков ограничено только внешним слоем цемента толщиной 100 мкм [15] и продолжается в течение первых 24–48 час., после чего элюция препаратов замедляется и не позволяет достичь эффективных локальных концентраций в отношении микробных возбудителей [16, 17]. По окончании антимикробной активности костного цемента (КЦ) спейсер становится инородным телом, на котором могут адгезироваться бактериальные клетки с последующим формированием биопленок, что может приводить к рецидиву инфекционного процесса [18]. Таким образом, необходимы новые подходы для повышения эффективности локальной АБ-терапии за счет разработки методов расширения спектра и увеличения продолжительности антимикробной активности цементных спейсеров. Одним из таких способов может быть дополнительная импрегнация АМС препаратами, содержащими ионы металлов, в частности, ионы серебра [RU 2 707 734 C1, RU 2 754 075 C1]. Исследование in vitro установило что импрегнация КЦ ванкомицином и высокодисперсным серебром (ВД-Ag) способствует существенной пролонгации антимикробной активности (до 34 сут.) полученных образцов, что эффективно препятствовало формированию микробных биопленок на их поверхности в течение всего срока выделения АБ [19]. Однако клиническая эффективность данной комбинации антимикробных препаратов не оценена.
Цель работы — провести сравнительный анализ клинической эффективности санирующего этапа лечения пациентов с хронической ППИ при использовании ВД-Ag для дополнительной импрегнации АМС.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование носит ретроспективный характер и основано на анализе результатов лечения 223 пациентов, оперированных по поводу хронической ППИ ТБС в отделении гнойной хирургии за период 2014–2018 гг. В исследование включены все пациенты с ППИ ТБС, которым за указанный период времени выполнен первый этап двухэтапного лечения ППИ ТБС с установкой антимикробного спейсера (АМС) из костного цемента на основе ППМА и у которых забраны материалы для бактериологического исследования до операции (аспираты, тканевые биоптаты) и/или интраоперационно (тканевые биоптаты и удаленные конструкции).
Пациенты разделены на две группы в зависимости от применения препарата высокодисперсного серебра (ВД-Ag) (Повиаргол, ООО «Технолог», Россия) для импрегнации костного цемента. В группу 1 включены 112 пациентов, пролеченных в 2014–2016 гг., которым при двухэтапном лечении ППИ ТБС в ходе выполнения первого (санирующего) этапа установлен АМС на основе гентамицин-содержащего КЦ из полиметилметакрилата (ПММА), дополнительно импрегнированный ванкомицином. В группу 2 включено 111 пациентов, пролеченных с 2016 по 2018 г., которым был установлен АМС с добавлением ванкомицина и препарата серебра.
Этапы выполнения санирующего этапа двухэтапного лечения ППИ ТБС: кожный разрез по наружной поверхности бедра с последующим передне-боковым доступом к тазобедренному суставу; иссечение рубцов в полости сустава; удаление бедренного и вертлужного компонентов эндопротеза или спейсе-ра; обработка вертлужной впадины фрезами до симптома кровяной росы; обильная промывка раны растворами антисептиков; установка цементного спейсера и дренажа; ушивание раны.
В ходе исследования оценивали пол, возраст пациента, продолжительность инфекционного процесса на момент индексной операции, количество лейкоцитов, уровень СРБ и СОЭ в крови при поступлении и на 5–7 сут. после операции, вид возбудителя, соответствие результатов микробиологического исследования (культуральное исследование и ПЦР-диагностика) до- и интраоперационных образцов. Оценку исходов лечения пациентов проводили в соответствии с модифицированными критериями Delphi [20]. За удовлетворительный исход принимали отсутствие признаков рецидива ППИ после второго этапа лечения (реимплантации ЭП) или «жизнь со спейсером» без развития признаков инфекционно-воспалительного процесса в течение двух лет после санирующего этапа. Неблагоприятным исходом считали развитие рецидива после санирующей операции или после реимплантации ЭП, а также летальный исход в связи с генерализацией инфекционного процесса в течение срока наблюдения.
Регистрацию, систематизацию первичных данных и визуализацию полученных результатов выполняли в электронных таблицах Microsoft Office Excel. Статистический анализ проводили средствами программной системы Past 4. Для описания количественных показателей выполняли проверку на нормальность распределения. Принормальном распределениидляописанияпризнакаиспользовалиего среднее значение и среднее квадратичное отклонение. При распределении, отличном от нормального, медиану (Ме), а в качестве мер рассеяния нижний (Q1) и верхний (Q3) квартили (25–75 % МКИ). Достоверность различий количественных параметров (возраст, длительность инфекционного процесса, количество санирующих операций на момент индексной операции) между группами анализировали с применением непараметрического теста Манна – Уитни. Для анализа относительных показателей использовали тест Фишера. Различия между группами считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
Сформированные в ходе исследования группы сопоставимы по половозрастному составу: в группах 1 и 2 средний возраст больных составил соответственно 58 лет (ДИ 95 % 53–63) и 60 лет (ДИ 95 % 55–65), доля мужчин — 48,2 % и 51,5 %, женщин — 51,8 % и 49,5 %. Доля пациентов с санирующими операциями в анамнезе в группе 1 несколько больше, чем в группе 2: соответственно 22,1 % и 14,4 % ( p = 0,098), однако средняя длительность инфекционного процесса значимо не отличалась в группах сравнения ( p = 0,560).
Группы сравнения сопоставимы по уровню маркеров воспаления крови (СРБ, СОЭ) и количеству лейкоцитов на момент поступления пациентов в стационар (табл. 1). При этом в группе с применением препарата серебра наблюдали более выраженную динамику нормализации СОЭ в сравнении с доопе-рационным уровнем ( p = 0,003) и при сопоставлении с группой 1 ( p = 0,005).
Таблица 1
Динамика лабораторных показателей в группах сравнения
|
Маркеры воспаления |
При поступлении |
P value |
Перед выпиской |
P value |
||
|
Группа 1 |
Группа 2 |
Группа 1 |
Группа 2 |
|||
|
Лейкоциты, 109/л, Ме (МКИ) |
7,8 (6,4–9,4) |
7,6 (6–9,3) |
0,325 |
7,2 (5,5–8,2) |
6,1 (4,9–8,1) |
0,623 |
|
СРБ, мг/мл, Ме (МКИ) |
25,9 (11,2–44,8) |
23,8 (9,3–42,8) |
0,203 |
19,2 (12–31,6) |
13,8 (7,2–23,4) |
0,339 |
|
СОЭ, мг/мл, Ме (МКИ) |
50 (28–75,5) |
51 (27–68) |
0,533 |
47 (34–67,7) |
*35 (14–50) |
0,005 |
Примечание :* — значимо отличается от исходного уровня при поступлении ( p = 0,003)
Анализ результатов бактериологических исследований интраоперационного материала показал, что положительный рост микроорганизмов получен в 96,4 и 98,2 % случаев ( p = 0,415), соответственно, в группах 1 и 2, при этом в 27,6 % (31 из 112) и 18,9 % (21 из 111) случаев ( p = 0,122) этиология ППИ была полимикробной.
Видовой спектр возбудителей ППИ ТБС сопоставим в группах сравнения (табл. 2). Ведущими патогенами были стафилококки ( S. aureus, S. epidermidis и другие коагулазонегативные стафилококки), доля которых в общей структуре составила 63 % и 56,3 %, соответственно, в группах 1 и 2. При этом частота выделения резистентных к метициллину штаммов была 32,1 % (36 из 112) и 31,5 % (35 из 111) случаев ( p = 0,922). Среди грамотрицательных возбудителей в обеих группах неферментирующие бактерии ( Pseudomonas aeruginosa и Acinetobacter spp .) встречались чаще, чем представители семейства Enterobacteriaceae .
Таблица 2
Спектр возбудителей в группах сравнения
|
Возбудители |
Группа 1 ( n = 112) |
Группа 2 ( n = 111) |
P value |
||
|
абс. |
% |
абс. |
% |
||
|
S. epidermidis |
46 |
32,2 |
39 |
29,3 |
0,610 |
|
S. aureus |
37 |
25,9 |
32 |
24,0 |
0,729 |
|
Enterococcus spp. |
12 |
8,4 |
20 |
15,0 |
0,073 |
|
Неферментирующие бактерии ( P. aeruginosa и Acinetobacter spp .) |
8 |
5,6 |
10 |
7,5 |
0,627 |
|
Другие CoNS |
7 |
4,9 |
4 |
3,0 |
0,424 |
|
Streptococcus spp. |
10 |
7 |
6 |
4,5 |
0,379 |
|
fem.Enterobacteriace |
7 |
4,9 |
4 |
3,0 |
0,424 |
|
Propionibacterium spp. |
5 |
3,5 |
3 |
2,2 |
0,540 |
|
Corynebacterium spp. |
3 |
2,1 |
2 |
1,5 |
0,712 |
|
Candida |
2 |
1,1 |
0 |
0,172 |
|
|
Другие |
6 |
4,2 |
13 |
9,8 |
0,107 |
|
Итого |
143 |
100 |
133 |
100 |
|
Примечание : другие CoNS — коагулазонегативные стафилококки за исключением S. Epidermidis ; n – количество больных в группе
Установлено, что только в 47,3 % (53 из 112) и 56,7 % (63 из 111) случаев, соответственно, в группах 1 и 2 результаты микробиологического исследования до- и интраоперационных материалов полностью совпадали (рис. 1).
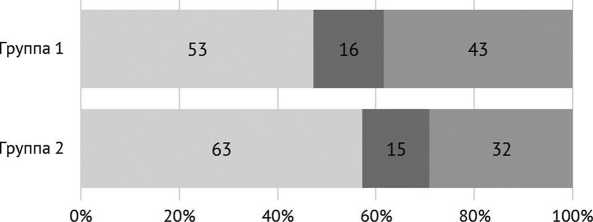
полное соответствие
■ частичное соответствие
■ нет соответствия
Рис. 1. Соответствие результатов микробиологического исследования до- и интраоперационных образцов биоматериала
Анализ исходов лечения показал, что частота рецидивов в группе 1 была в 1,7 раза больше, чем в группе с применением повиаргола, и составила, соответственно, 23,2 % (26 из 112) и 17,1 % (19 из 111) ( p = 0,257). При этом у пациентов с монобактериальной ППИ, обусловленной грамположительными бактериями, при использовании препарата серебра рецидивы инфекционного процесса диагностировались почти в два раза реже ( p = 0,012), чем в группе сравнения (табл. 3).
Таблица 3
Частота рецидивов инфекции в зависимости от этиологии ППИ на момент индексной операции
|
Этиология инфекции |
Группа 1 |
Группа 2 |
P value |
||||
|
Всего |
Рецидив |
Всего |
Рецидив |
||||
|
абс. |
% |
абс. |
% |
||||
|
Монобактериальная Гр+ |
69 |
18 |
26,1 |
78 |
8 |
10,3 |
0,012 |
|
Монобактериальная Гр– |
8 |
1 |
12,5 |
10 |
4 |
40 |
0,196 |
|
Полибактериальная |
31 |
7 |
22,6 |
21 |
7 |
33,3 |
0,345 |
Реэндопротезирование выполнено у 73,2 % (82 из 112) и 73,0 % (81 из 111) пациентов в группах 1 и 2 соответственно. Средний срок между этапами составил 8,4 мес. На момент анкетирования информации о развитии рецидива инфекции после второго этапа не установлено. Остальные пациенты предпочли «жизнь со спейсером» или ждут очереди на госпитализацию для выполнения второго этапа.
ОБСУЖДЕНИЕ
Установка антимикробного спейсера на санирующем этапе двухэтапной ревизии имеет две основные цели: повышение эффективности системной антибактериальной терапии за счет создания локального депо антибиотиков в костном цементе, а также сохранение анатомического соотношения в суставе путем восполнения тканевых дефектов, формирующихся после удаления компонентов эндопротеза [21].
Идеальный спейсер должен обеспечивать длительную элюцию антимикробного препарата в эффективной концентрации, чтобы купировать инфекцию и предотвратить селекцию и распространение по-лирезистентных штаммов бактерий [22].
Известно много факторов, влияющих на фармакокинетические свойства антимикробных спейсеров in vivo , включая различия в марке используемого костного цемента, способе его замешивания, добавление одного или комбинации двух или более антибиотиков, их доза и/или соотношение, продолжительность имплантации спейсера и пр. [22]. Несмотря на то, что длительность антимикробной активности костного цемента хорошо изучена in vitro [16, 23], эти данные нельзя напрямую экстраполировать в клинику. При этом количество публикаций, которые демонстрируют элюцию антибиотиков in vivo , ограничено, и они характеризуются значительными расхождениями в результатах определения максимальной концентрации препарата и продолжительности его выхода из цемента [22]. В связи с этим в нашем исследовании за клиническую эффективность лечения ППИ мы приняли долю пациентов с отсутствием признаков инфекции в течение двух лет после санирующей операции.
В целом в анализируемой выборке пациентов при двухлетнем наблюдении эффективность лечения хронической ППИ ТБС составила 79,3 %. Необходимо отметить, что данные об эффективности купирования хронической периимплантной инфекции в области ТБС в научной литературе очень различаются. К примеру, в работе S. Petis et al. доля пациентов с купированной ППИ ТБС при наблюдении через 1 год после ревизионной операции составила 90 % и 86 % — через 5 лет [24]. В другом исследовании авторы отметили отсутствие признаков инфекционного процесса в течение двух лет у 83,3 % пациентов [10]. В то же время известно, что риск развития рецидива после санирующей операции при ППИ ТБС и КС значимо зависит от возбудителя и составляет 25–67 % [21, 25, 26]. Одним из наиболее значимых предикторов неудачи лечения считают участие в этиологии ППИ грамотрицательных бактерий и микробных ассоциаций, которые почти в половине случаев вызывают неблагоприятные исходы [27, 28, 29].
Грамотрицательные бактерии в нашем исследовании выделены у 15,4 % пациентов, и в 21,8 % случаев ППИ была вызвана микробными ассоциациями, что в целом соответствует данным научных публикаций. Разброс доли грамотрицательных бактерий в спектре возбудителей ППИ у разных авторов варьирует от 11,3 до 60,0 % [30, 31, 32], частота встречаемости полимикробной инфекции — от 25 до 45 % случаев [20, 33]. При этом в нашей когорте пациентов при участии грамотрицательных патогенов в этиологии инфекционного процесса рецидивы в первые два года после санирующей операции развивались в 1,5 раза чаще, чем при ППИ, обусловленной грамположительными бактериями, а в случае выделения микробных ассоциаций — в 1,4 раза чаще, чем при монобактериальной инфекции. Одной из причин этого может быть низкая эффективность антимикробных спейсеров, импрегнированных ванкомицином, — препаратом, активным только в отношении грамположительных бактерий. Выявленное нами несоответствие (частичное или полное) результатов микробиологического исследования до- и интраоперационно забранных материалов свидетельствует о невозможности в 47,5 % случаев импрегнации костного цемента антибиотиком с этиотропным действием.
В группе с применением препарата Вд-Ag в составе антимикробного спейсера в нашем исследовании эффективность санирующего этапа составила 82,9 %, в группе сравнения — 76,8 %. Однако субанализ влияния этиологии ППИ на результаты лечения показал, что применение АМ-спейсера с комбинацией препарата серебра и ванкомицина привело к статистически значимому снижению риска развития рецидива у пациентов с монобактериальной инфекцией, вызванной грамположительными возбудителями (ОР 0,840; ДИ 95 % 0,735–0,960), и позволило купировать инфекцию в 89,7 % случаев. Однако данная комбинация не оказала положительного эффекта в подгруппах с ППИ, вызванной грамотрицательны-ми бактериями и микробными ассоциациями.
Известно, что наночастицы серебра обладают антибактериальным действием, при этом механизм их действия на бактерии не специфический, и поэтому они практически одинаково действуют на грамположительные и грамотрицательные бактерии [34]. Сообщается, что наночастицы серебра проникают внутрь клетки и связываются с клеточными структурами [35], действуют на ДНК, препятствуя размножению бактериальных клеток, а также разрушают цитоплазматическую мембрану и приводят к гибели бактерии [36]. На сегодняшний день ряд исследований показывает, что комбинации наносеребра с антибиотиками повышают активность последних в отношении штаммов с множественной лекарственной устойчивостью [37, 38]. Ранее нами было показано, что повиаргол способствовал сохранению антимикробной активности образцов КЦ до 34 сут. и препятствовал формированию на них микробных биопленок. По-видимому, именно с этим и связана большая эффективность комплексного лечения пациентов с хронической ППИ ТБС, обусловленной грамположительными бактериями. По нашему мнению, данный результат может являться следствием как более длительного выхода антимикробного препарата из костного цемента за счет увеличения его пористости, так и наличием синергидного действия ванкомицина и препарата Вд-Ag в отношении ингибирования биопленкообразования, доказанного в исследовании других авторов [39]. Возможно, влиянием повиаргола на микроорганизмы на клеточном уровне обусловлена и более выраженная динамика нормализации СОЭ (p = 0,005) и тенденция к большему снижению СРБ (p > 0,05) в группе с применением препарата серебра в составе костного цемента.
Важно помнить, что импрегнация костного цемента дополнительными препаратами влияет на механические и физические свойства антимикробного спейсера. Ранее нами было показано, что при добавлении в состав костного цемента ванкомицина или его комбинации с 2,5 масс. % серебра не приводило к нарушениям механических свойств костного цемента при изгибе и сжатии. Дальнейшее увеличение содержания серебра до 10 масс. % ухудшало прочность и упругость при изгибе, но значимо не влияло на механические свойства при сжатии и при этом значимо увеличивало антимикробную активность образцов [40]. По нашему мнению, на санирующем этапе снижение прочности спейсера в большей степени является положительным фактором, т.к. позволяет затем на этапе реимплантации ЭП удалить спейсер без особых технических трудностей. Однако это ограничивает применение используемой нами комбинации для фиксации постоянных конструкций.
Стоит также отметить, что в нашем исследовании не было выявлено случаев реакции препарата серебра с окружающими тканями, случаев аргирии и других нежелательных явлений.
ЗАКЛЮЧЕНИЕ
Импрегнация костного цемента на основе полиметилметакрилата с комбинацией ванкомицина и препарата высокодисперсного серебра продемонстрировала значимую клиническую эффективность в отношении купирования перипротезной инфекции тазобедренного сустава, вызванной грамположительными бактериями ( Staphylococcus spp., Streptococcus spp., Enterococcus spp . и др.). Однако отсутствие значимого клинического эффекта в подгруппе пациентов с инфекцией, вызванной грамотрицательными патогенами и микробными ассоциациями, а также значительная доля случаев, когда окончательный микробиологический диагноз устанавливается только по результатам исследования интраоперационно забранных материалов, свидетельствуют о необходимости разработки новых комбинаций для импрегнации костного цемента с целью расширения спектра антимикробной активности устанавливаемых спейсеров.
Список литературы Клинические результаты применения серебросодержащего препарата в составе антимикробного спейсера при лечении перипротезной инфекции тазобедренного сустава
- Szymski D, Walter N, Krull P, et al. Comparison of mortality rate and septic and aseptic revisions in total hip arthroplasties for osteoarthritis and femoral neck fracture: an analysis of the German Arthroplasty Registry. J Orthop Traumatol. 2023;24(1):29. doi: 10.1186/s10195-023-00711-9
- Павлов В.В., Петрова Н.В., Шералиев T.y Cреднесрочные результаты двухэтапного лечения перипротезной инфекции. Травматология и ортопедия России. 2019;25(4):109-116. doi: 10.21823/2311-2905-2019-25-4-109-116
- 1ихилов Р.Ы., Шубняков И.И., ^валенко A.R и др. Cтруктура ранних ревизий эндопротезирования тазобедренного сустава. Травматология и ортопедия России. 2014;20(2):5-13. doi: 10.21823/2311-2905-2014-0-2-5-13
- Dietz J, Zeidler A, Wienke A, et al. Periprosthetic infection after total hip replacement: Risk factors for an early infection after primary implantation. Orthopadie (Heidelb). 2022;51(12):969-975. (In German) doi: 10.1007/s00132-022-04279-w
- Шубняков И.И., 1ихилов Р.Ы., Денисов A.Ü. и др. Что изменилось в структуре ревизионного эндопротезирования тазобедренного сустава в последние годы? Травматология и ортопедия России. 2019;25(4):9-27. doi: 10.21823/2311-2905-2019-25-4-9-27
- Шубняков И.И., Риахи A., Денисов A.Œ и др. Основные тренды в эндопротезировании тазобедренного сустава на основании данных регистра артропластики НЫИЦ ТО им. Р.Р. Вредена с 2007 по 2020 г. Травматология и ортопедия России. 2021;27(3):119-142. doi: 10.21823/2311-2905-2021-27-3-119-142
- Moore AJ, Blom AW, Whitehouse MR, et al. Deep prosthetic joint infection: a qualitative study of the impact on patients and their experiences of revision surgery. BMJ Open. 2015;5(12):e009495. doi: 10.1136/bmjopen-2015-009495
- Ыурылев В.Ю., Kуковенко T.A., Елизаров П.Ы. и др. Aлгоритм первого этапа лечения поздней глубокой перипротезной инфекции тазобедренного сустава. Травматология и ортопедия России. 2018;24(4):95-104. doi: 10.21823/2311-2905-2018-24-4-95-104
- Goud AL, Harlianto NI, Ezzafzafi S, et al. Reinfection rates after one- and two-stage revision surgery for hip and knee arthroplasty: a systematic review and meta-analysis. Arch Orthop Trauma Surg. 2023;143(2):829-838. doi: 10.1007/ s00402-021-04190-7
- Efremov K, Benedetti Valentini M, et al. Periprosthetic hip and knee infections: comparison of etiology, perioperative management and costs. Eur Rev Med Pharmacol Sci. 2019;23(2 Suppl):217-223. doi: 10.26355/eurrev_201904_17496
- Theil C, Freudenberg SC, Gosheger G, et al. Do Positive Cultures at Second Stage Re-Implantation Increase the Risk for Reinfection in Two-Stage Exchange for Periprosthetic Joint Infection? J Arthroplasty. 2020;35(10):2996-3001. doi: 10.1016/j.arth.2020.05.029
- Anagnostakos K, Jung J, Schmid NV, et al. Mechanical complications and reconstruction strategies at the site of hip spacer implantation. Int J Med Sci. 2009;6(5):274-279. doi: 10.7150/ijms.6.274
- Jones CW, Selemon N, Nocon A, et al. The influence of spacer design on the rate of complications in two-stage revision hip arthroplasty. J Arthroplasty. 2019;34(6):1201-1206. doi: 10.1016/j.arth.2019.02.012
- Theil C, Schmidt-Braekling T, Gosheger G, et al. Clinical use of linezolid in periprosthetic joint infections - a systematic review. J Bone Jt Infect. 2020;6(1):7-16. doi: 10.5194/jbji-6-7-2020
- Wang Z, Carli A, Bhimani S, et al. The elution characteristics of vancomycin from simplex cement. Poster No. 2168. In: 2017 Annual Meeting of the Orthopaedic Research Society. San Diego, CA, March 19-22, 2017.
- Божкова С.А., Полякова Е.М., Афанасьев А.В. и др. Фосфомицин — возможности применения для локальной терапии перипротезной инфекции. Клиническая микробиология антимикробная химиотерапия. 2016;18(2):104-112.
- Gasparini G, De Gori M, Calonego G, et al. Drug elution from high-dose antibiotic-loaded acrylic cement: a comparative, in vitro study. Orthopedics. 2014;37(11):999-1005 doi:10.3928/01477447-20141023-57
- Винклер Т., Трампуш А., Ренц Н. и др. Классификация и алгоритм диагностики и лечения перипротезной инфекции тазобедренного сустава. Травматология и ортопедия России. 2016;22(1):33-45. doi: 10.21823/2311-29052016-0-1-33-45
- Божкова С.А., Гордина Е.М., Марков М.А. и др. Влияние комбинации ванкомицина с препаратом серебра на длительность антимикробной активности костного цемента и формирование биопленки штаммом MRSA. Травматология и ортопедия России. 2021;27(2):54-64. doi: 10.21823/2311-2905-2021-27-2-54-64
- Tai DBG, Patel R, Abdel MP, et al. Microbiology of hip and knee periprosthetic joint infections: a database study. Clin Microbiol Infect. 2022;28(2):255-259. doi: 10.1016/j.cmi.2021.06.006
- Rava A, Bruzzone M, Cottino U, et al. Hip Spacers in Two-Stage Revision for Periprosthetic Joint Infection: A Review of Literature. Joints. 2019;7(2):56-63. doi: 10.1055/s-0039-1697608
- Anagnostakos K, Meyer C. Antibiotic Elution from Hip and Knee Acrylic Bone Cement Spacers: A Systematic Review. Biomed Res Int. 2017;2017:4657874. doi: 10.1155/2017/4657874
- Bitsch RG, Kretzer JP, Vogt S, et al. Increased antibiotic release and equivalent biomechanics of a spacer cement without hard radio contrast agents. Diagn Microbiol InfectDis. 2015;83(2):203-209. doi: 10.1016/j.diagmicrobio.2015.06.019
- Petis SM, Abdel MP, Perry KI, et al. Long-Term Results of a 2-Stage Exchange Protocol for Periprosthetic Joint Infection Following Total Hip Arthroplasty in 164 Hips. J Bone Joint Surg Am. 2019;101(1):74-84. doi: 10.2106/JBJS.17.01103
- Beck M, Brand C, Christen B, et al. SIRIS Report 2019. Annual report of the Swiss National Joint Registry, Hip and Knee, 2012 - 2018. 2019. doi:10.13140/RG.2.2.15632.56323
- Gellert M, Hardt S, Köder K, et al. Biofilm-active antibiotic treatment improves the outcome of knee periprosthetic joint infection: Results from a 6-year prospective cohort study. Int J Antimicrob Agents. 2020;55(4):105904. doi: 10.1016/j. ijantimicag.2020.105904
- Pfang BG, García-Cañete J, García-Lasheras J, et al. Orthopedic implant-associated infection by multidrug resistant Enterobacteriaceae. J Clin Med. 2019;8(2):220. doi: 10.3390/jcm8020220
- Jhan SW, Lu YD, Lee MS, et al. The risk factors of failed reimplantation arthroplasty for periprosthetic hip infection. BMCMusculoskeletDisord. 2017;18(1):255. doi: 10.1186/s12891-017-1622-1
- Yoon YC, Lakhotia D, Oh JK, et al. Is two-stage reimplantation effective for virulent pathogenic infection inaperiprosthetic hip? A retrospective analysis. World J Orthop. 2015;6(9):712-718. doi: 10.5312/wjo.v6.i9.712
- Иванцов В. А., Богданович И.П., Лашковский В.В. Аносов В.С. Клинические и микробиологические характеристики перипротезной инфекции тазобедренного и коленного суставов. Клиническая микробиология и антимикробная химиотерапия.2020;22(3):237-240. doi: 10.36488/cmac.2020.3.237-240
- Li ZL, Hou YF, Zhang BO, et al. Identifying common pathogens in periprosthetic joint infection and testing drug-resistance rate for different antibiotics: a prospective, single center study in Beijing. Orthop Surg. 2018;10(3):235-240. doi: 10.1111/os.12394
- Sanders PTJ, Bus MPA, Scheper H, et al. Multiflora and gram-negative microorganisms predominate in infections affecting pelvic endoprostheses following tumor resection. J Bone Joint Surg Am. 2019;101(9):797-803. doi: 10.2106/ JBJS.18.00836.
- Preobrazhensky P, Bozhkova S, Kochish A, et al. Comparative analysis of pathogen structure in patients with PJI after primary total hip and knee arthroplasty. Arch Orthop Trauma Surg. 2021;141(11):1963-1969. doi: 10.1007/s00402-021-04139-w
- Ржеусский С.Э. Наночастицы серебра в медицине. Вестник ВГМУ. 2022;21(2):15-24. doi: 10.22263/23124156.2022.2.15
- Liao C, Li Y, Tjong SC. Bactericidal and cytotoxic properties of silver nanoparticles. Int J Mol Sci. 2019;20(2):449. doi: 10.3390/ijms20020449
- Tang S, Zheng J. Antibacterial activity of silver nanoparticles: structural effects. Adv Healthc Mater. 2018;7(13):e1701503. doi: 10.1002/adhm.201701503.
- Baptista PV, McCusker MP, Carvalho A, et al. Nano-strategies to fight multidrug resistant bacteria "a battle of the titans". Front Microbiol. 2018;9:1441. doi: 10.3389/fmicb.2018.01441
- Katva S, Das S, Moti HS, et al. Antibacterial synergy of silver nanoparticles with gentamicin and chloramphenicol against Enterococcus faecalis. PharmacognMag. 2018;13(4):S828-S833. doi: 10.4103/pm.pm_120_17
- Hashimoto A, Miyamoto H, Kobatake T, et al. The combination of silver-containing hydroxyapatite coating and vancomycin has a synergistic antibacterial effect on methicillin-resistant Staphylococcus aureus biofilm formation. Bone Joint Res. 2020;9(5):211-218. doi: 10.1302/2046-3758.95.BJR-2019-0326.R1
- Божкова С.А., Гордина Е.М., Артюх В.А., Юдин В.Е. Комбинированное действие серебра и ванкомицина в составе костного цемента в отношении основных возбудителей перипротезной инфекции. Сибирское медицинское обозрение. 2023;(1):37-45. doi: 10.20333/25000136-2023-1-37-45


