Клинический опыт имплантации сфероидов аутологичных хондроцитов человека для лечения дефектов хряща коленного сустава
Автор: Лычагин А.В., Свистунов А.А., Калинский Е.Б., Гаркави А.В., Кавалерский Г.М., Кудрачев Т.Р., Гончарук Ю.Р., Азаркин К.М., Погосян Д.А., Мурдалов Э.Э.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 4 (62), 2025 года.
Бесплатный доступ
Введение. Суставной хрящ обладает крайне ограниченным потенциалом к самовосстановлению, поэтому его повреждения нередко приводят к необратимым изменениям. Для восстановления хрящевой ткани разработаны различные технологии, среди которых имплантация аутологичных хондроцитов (ACI). Метод основан на культивировании аутологичных клеток, продуцирующих хрящевой матрикс, с последующей их имплантацией в зону дефекта суставного хряща. Цель. Представить клинические случаи первого в России применения аутологичных хондроцитов человека в рутинной практике. Материалы и методы исследования. Представлены два клинических случая с дефектами суставного хряща различной локализации. Период наблюдения пациентов составил 4 месяца. В ходе контрольных визитов проводились опросы пациентов, физикальный осмотр, оценка амплитуды движений и объективное клиническое обследование. МРТ целевых коленных суставов выполнялись до первого оперативного вмешательства и спустя 4 месяца после него. По представленной методике каждому пациенту были выполнены два хирургических вмешательства на целевом коленном суставе; во время операций осуществлена фотодокументация состояния сустава до и после имплантации аутологичных хондросфер. Результаты. В ходе наблюдения двух клинических случаев с дефектами суставного хряща, пролеченных методом имплантации сфероидов аутологичных хондроцитов, получены положительные ранние результаты. Отмечено снижение болевого синдрома, увеличение амплитуды движений и улучшение функционального состояния суставов. Контрольные МРТ прооперированных коленных суставов представленных пациентов через 4 месяца подтвердили формирование однородного регенерата и удовлетворительную интеграцию сфероидов с окружающим хрящом. Послеоперационный период протекал без осложнений, пациенты отмечали улучшение качества жизни. Заключение. Имплантация сфероидов аутологичных хондроцитов представляет собой перспективный и эффективный метод восстановления хрящевых дефектов коленного сустава. Методика обеспечивает стойкое улучшение функции сустава и подтверждённую морфологически регенерацию хрящевой ткани.
Аутологичные хондроциты, хондросферы, дефект хряща надколенника, дефект хряща бедренной кости, БМКП
Короткий адрес: https://sciup.org/142246876
IDR: 142246876 | УДК: 617.3 | DOI: 10/17238/issn2226-2016.2025.4.53-61
Текст научной статьи Клинический опыт имплантации сфероидов аутологичных хондроцитов человека для лечения дефектов хряща коленного сустава
Повреждения суставного хряща коленного сустава представляют собой нарушения целостности хрящевого покрова, возникающие вследствие травматических или патологических процессов. Эти дефекты, как правило, локализованы в одном анатомическом отделе сустава и могут проникать вглубь гиалинового хряща, вплоть до субхондральной кости, при отсутствии выраженного генерализованного дегенеративнодистрофического поражения сустава [1, 2]. Причиной повреждений хряща являются острая травма или хроническая микротравматизация коленного сустава. Как острое, так и хроническое повреждение ведёт к прогрессирующему разрушению этой важнейшей структуры коленного сустава и в конечном итоге способствует развитию деформирующего артроза [3, 4].
Хотя истинная частота поражений хряща неизвестна, многочисленные исследования сообщают о дефектах хряща в 60–66 % случаях всех артроскопии коленного сустава [5, 6]. По оценкам эпидемиологических исследований, в США ежегодно регистрируется около одного миллиона случаев травматических повреждений хряща коленного сустава [7]. Согласно действующим клиническим рекомендациям, утверждённым Министерством здравоохранения Российской Федерации, частота выявления хрящевых повреждений – как изолированных, так и сочетающихся с другими интраартикулярными нарушениями – составляет 14–26 % среди обследуемых пациентов, что эквивалентно более чем 975 случаям в год [8, 9].
Хрящевая ткань обладает крайне низким регенеративным потенциалом вследствие ограниченной пролиферативной активности хондроцитов и отсутствия сосудистой сети [5]. Это обусловило появление широкого спектра методов лечения, направленных на восстановление структуры и функции хряща [10]. Консервативные и малоинвазивные подходы, такие как PRP-терапия, микрофрактурирование, способны уменьшать выраженность симптомов, однако их эффективность ограничена формированием в зоне дефекта преимущественно фиброзного, а не гиалинового хряща [11, 12]. Мозаичная костно-хрящевая аутопластика подходит только для замещения дефектов малых размеров и позволяет заменить дефект участками жизнеспособного гиалинового хряща, однако не обеспечивает полной регенерации гиалинового матрикса, поскольку межблочные зоны заполняются преимущественно фиброзной или фиброгиалиновой тканью [13].
В результате такие методики нередко оказываются недостаточными для предотвращения дальнейшей дегенерации суставного хряща, что повышает риск прогрессирования заболевания, хронизации боли и ухудшения качества жизни пациентов [10,14]. Более радикальный вариант лечения – эндопротезирование сустава – хоть и обеспечивает выраженное снижение болевого синдрома и восстановление функции, не является органосберегающим вмешательством и сопряжено с риском осложнений, включая инфекции, нестабильность компонентов протеза и последующую необходимость ревизионных операций [15, 16].
На этом фоне биотехнологические методы восстановления гиалинового хряща, основанные на применении аутологичных клеточных продуктов, в частности аутологичных хондросфер, рассматриваются как одно из наиболее перспективных направлений регенеративной медицины [17]. Эти технологии направлены на формирование хрящевой ткани, по структуре и свойствам максимально приближенной к нативному гиалиновому хрящу, что потенциально позволяет добиться более сто А йкого клинического эффекта и замедлить прогрессирование дегенеративных изменений [18]. Впервые применение аутологичных хондроцитов в клинической практике было описано Mats Brittberg в 1994 году, и с тех пор данный подход на протяжении почти 30 лет используется в Европе [17, 19]. Настоящий отчет о клиническом опыте применения аутологичных хондросфер представляет подробное описание применения биомедицинского клеточного продукта (БМКП) Изитенс, впервые произведенного и апробированного на территории Российской Федерации.
Материалы и методы исследования
В настоящей статье описаны два клинических случая пациентов с дефектами суставного хряща различной локализации и степени выраженности. Период наблюдения для каждого пациента составил 4 месяца после второго этапа хирургического лечения. Программа наблюдения включала контрольные визиты, в ходе которых проводился сбор жалоб, физикальное обследование, оценка функционального состояния сустава и измерение амплитуды движений. Для объективной оценки состояния хрящевой ткани всем пациентам была выполнена магнитно-резонансная томография (МРТ) целевых коленных суставов до оперативного вмешательства (на этапе планирования) и через 4 месяца после второго этапа лечения для оценки динамики. Хирургическое лечение проводилось в два этапа в соответствии с представленной методикой. Во время операций осуществлялась фотодокументация интраоперационной картины: состояния дефекта и зоны реконструкции после имплантации БМКП. В качестве БМКП использован Изитенс – сфероиды аутологичных хондроцитов человека (РУ: БМКП №1 от 12.12.2023 г.).
Методика отбора пациентов для проведения клинического исследования
Важно тщательно отбирать пациентов для проведения данной процедуры и учитывать существующие ограничения применения аутологичных хондроцитов человека при восстановлении хрящевых дефектов, включая размер и локализацию повреждения, а также сопутствующие патологии [19]. Для включения пациента в данное лечение необходимо выполнение ряда критериев, представленных ниже.
Критерии включения:
-
• Изолированный одиночный хрящевой дефект коленного сустава III–IV степени по классификации ICRS.
-
• Площадь дефекта от 1 до 10 см².
-
• Возраст пациента ≥ 18 лет.
Критерии исключения:
-
• Прогрессирующий остеоартроз поражённого сустава (степень выше II по классификации Kellgren–Lawrence).
-
• Наличие признаков воспалительных заболеваний сустава (например, активных воспалительных артропатий).
-
• Инфекционные заболевания: активные вирусные инфекции (гепатит B, C, ВИЧ 1/2), сифилис и другие – являются противопоказанием.
Терапия сопутствующих поражений сустава должна быть по возможности завершена до или на момент имплантации сфероидов. Лечение БМКП не рекомендуется пациентам с ожирением (индекс массы тела > 30 кг/м2).
Во время первичного осмотра проводится оценка состояния нижней конечности, включая наличие варусной или вальгусной деформации более чем на 5°, оценивают симптомы повреждения медиального или латерального мениска, признаки нестабильности коленного сустава и локальные проявления воспаления.
Для использования данной методики важно убедиться в отсутствии патологических изменений других структур коленного сустава, а также учитывать размеры и локализацию хрящевого дефекта. Поэтому пациенту на первую клиническую консультацию необходимо прийти с результатами МРТ целевого коленного сустава. На первом визите помимо врачебного осмотра, пациенту предоставляется время для детального ознакомления с условиями лечения.
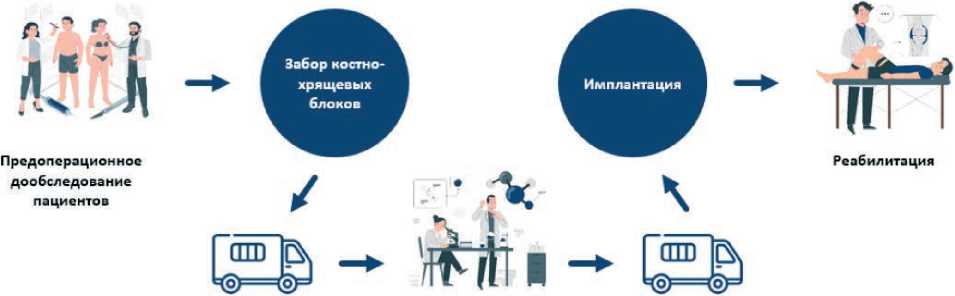
Дизайн клинических случаев представлен на рисунке 1.
Предимплантационный Предимплантационный Послеоперационное период! период 2 динамическое наблюдение

1*14 дней 5-8 недель 4 месяца
Транспортировка биоматериала
Линия производства
БМКП
Транспортировка БМКП
Рисунок 1. Дизайн клинических случаев
Методика лечения:
После выполнения полного комплекса предоперационного дообследования пациентов госпитализируют в плановом порядке для выполнения лечебно-диагностической артроскопии.
Первый этап лечения. Выполняется артроскопическая санация целевого коленного сустава. В ходе вмешательства уточняют локализацию хрящевого дефекта, проводят его измерение и определяют степень повреждения по классификации ICRS. Оценивается состояние хряща в других отделах сустава, состоятельность медиального и латерального менисков, а также передней и задней крестообразных связок. С ненагружаемой зоны латерального мыщелка бедренной кости производят забор двух или трех костно-хрящевых цилиндров (в зависимости от размера хрящевого дефекта) диаметром 6 мм. В предимплантационном периоде осуществляют отбор венозной крови для последующего приготовления питательной среды. Полученные биообразцы транспортируют на специализированное лицензированное производство (АО «ГЕНЕРИУМ») продукта в соответствии с технологическим регламентом согласно установленным нормативным требованиям.
Второй этап лечения: По истечении 5–8 недель, необходимых для осуществления технологического процесса и по- лучения БМКП [20], пациент повторно госпитализируется в отделение травматологии и ортопедии УКБ №1. Транспортировка биомедицинского клеточного продукта в клинику производится в специализированных герметичных термоконтейнерах с поддержанием требуемого температурного режима (0–10 °C).
На повторной артроскопии коленного сустава выполняется диагностический осмотр, кюретаж дефекта хряща в пределах здоровой хрящевой ткани. Одноразовый шприц объёмом 1 мл, предварительно заполненный 0,9 % раствором натрия хлорида, соединяют с катетером, содержащим хондросферы (сфероиды). Через артроскопический порт вводят катетер и осуществляют имплантацию хондросфер в область дефекта посредством постепенного выдавливания раствора из шприца. Для обеспечения адекватной адгезии культивированных сфероидов к поверхности дефекта предусматривается экспозиция приблизительно 20 минут. По её завершении выполняют послойное ушивание операционной раны без дополнительного покрытия зоны дефекта.
В раннем послеоперационном периоде пациентам была обеспечена иммобилизация оперированной конечности. Назначена медикаментозная терапия с ограничением приема НПВС и рекомендована специализированная реабилитационная программа.
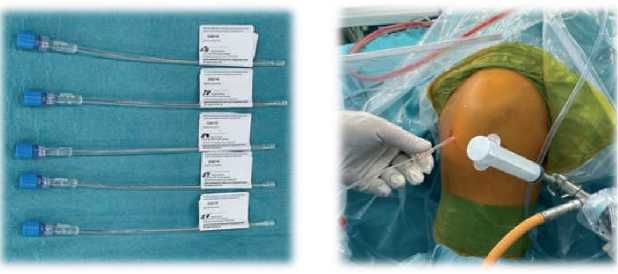
Рисунок 2. Катетеры, содержащие строго определённое количество хондросфер, размещены на операционном столике в стерильных условиях, предварительно наполненные раствором хлорида натрия 0,9%. Введение БМКП через один из артроскопических портов.
Клиническое наблюдение пациентки с хрящевым дефектом надколенника:
Пациентка С.А.А., 43 года, считает себя больной с 2015 года, когда начал беспокоить дискомфорт и боль в левом коленном суставе. Травматический эпизод отрицает, консервативной терапии не получала; хирургических вмешательств на коленном суставе ранее не проводилось. В связи с усилением болевого синдрома пациентка самостоятельно прошла МРТ-исследование левого коленного сустава и обратилась за консультацией в лечебно-диагностическое отделение УКБ № 1 Сеченовского университета. На основании клинического осмотра, а также данных рентгенографии и МРТ было рекомендовано двухэтапное восстановление хрящевого дефекта левого коленного сустава с применением БМКП. Пациентка была приглашена для госпитализации в предимплантационный период.
На рентгенографии не выявлено признаков костно-травматической патологии. На МРТ левого коленного сустава от марта 2025 – хрящевой дефект медиальной фасетки надколенника размером 13 мм × 40 мм (Рисунок 3).
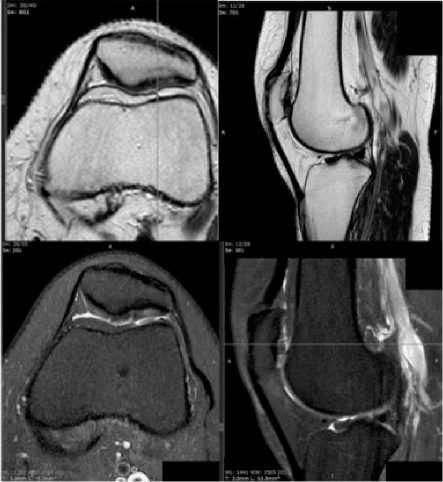
Рисунок 3. МРТ дефекта хряща левого надколенника в сагиттальном и аксиальных проекциях
На первом этапе пациентка была госпитализирована в отделение травматологии и ортопедии УКБ №1 Сеченовского университета для проведения диагностической артроскопии левого коленного сустава с забором костно-хрящевых фрагментов. При артроскопическом исследовании выявлен хрящевой дефект медиальной фасетки надколенника размерами 15 × 41 мм (6,15 см²) с неровными краями; других дефектов хряща и структурных повреждений коленного сустава не обнаружено (Рисунок 4). Для последующего клеточного культивирования выполнен забор биоматериала – трёх костно-хрящевых цилиндров диаметром 6 мм. Проведён обильный лаваж сустава, после чего произведено послойное ушивание операционной раны и наложение асептической повязки. Пациентка была выписана на следующий день после контрольной перевязки с рекомендациями, соответствующими стандартному послеоперационному ведению после артроскопических вмешательств.
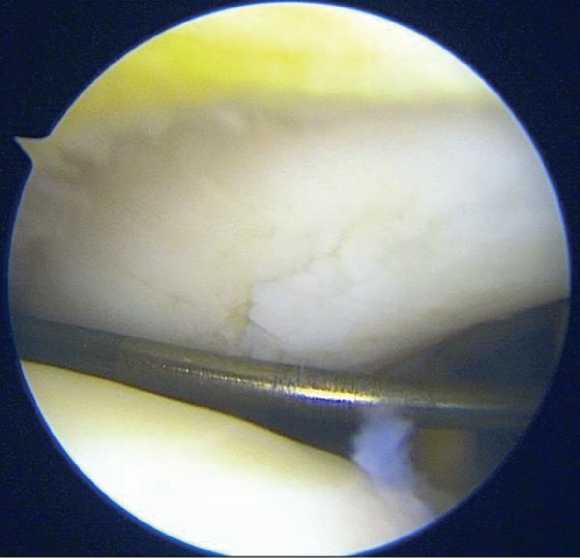
Рисунок 4. Повреждение хряща левого надколенника на первой артроскопии коленного сустава
Во время второй госпитализации пациентки было проведено предоперационное обследование и осмотр лечащим врачом. Выполнена хондропластика левого надколенника. Лежа на спине, под пневматическим турникетом выполнен медиальный линейный парапателлярный миниинвазив-ный (длиной около 6 см) хирургический доступ к левому коленному суставу. Дефект хряща медиальной суставной фасетки подготовили для имплантации хондросфер с окончательными размерами дефекта хряща надколенника после кюретажа – 20 мм × 15 мм (площадь 6,15 см²). Было использовано достаточное количество хондросфер из расчета 30 сфероидов на 1 см² (см. рис. 5). Согласно протоколу вы- держана экспозиция БМКП в течение 20 минут, после чего последовало послойное ушивание раны. Иммобилизации прооперированной нижней конечности в ортезе. Ей также были даны рекомендации по дальнейшей реабилитации.
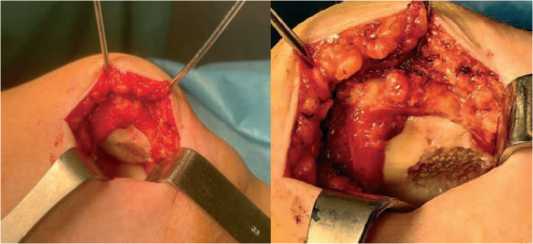
Рисунок 5 . Имплантация хондросфер на поверхность дефекта хряща надколенника
Визит пациентки через 4 месяца после хондропластики аутологичными хондроцитами
При осмотре левый коленный сустав обычной конфигурации, без отека. Движения в суставе в полном объеме, свободные и безболезненные. Выпота в суставе не обнаружено. На передней поверхности левого коленного сустава видны рубцы после операционного вмешательства, без признаков активного воспаления.
Выполнено МРТ исследование левого коленного сустава для оценки заполненности дефекта хряща надколенника регенератом (Рисунок 6).
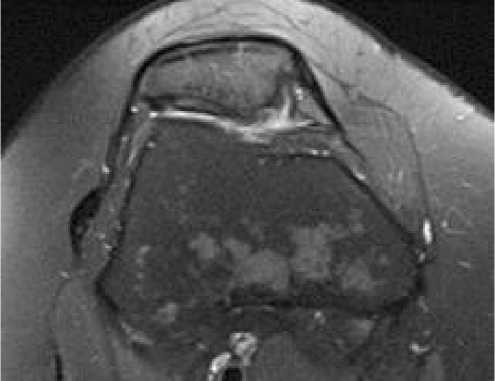
Рисунок 6 . МРТ исследование левого коленного сустава и зарастание дефекта хрящевой ткани суставной поверхности надколенника
Клинический пример с дефектом хряща бедренной кости:
Пациент М.Р.Р., 48 лет, считает себя больным с 2022 года, когда во время физической нагрузки почувствовал боль в правом коленном суставе. Оперативные вмешательства на целевом коленном суставе ранее не проводились. В связи с усилением болевого синдрома самостоятельно выполнил МРТ, обратился за консультацией в лечебно-диагностическое отделение УКБ №1 Сеченовского Университета. Было рекомендовано двухэтапное восстановление хрящевых и костно-хрящевых дефектов правого коленного сустава с применением БМКП.
При клиническом осмотре выявлено ограничение объёма движений с амплитудой сгибания–разгибания от 15° до 100°. Симптомы повреждения латерального мениска – отрицательные, однако с медиальной стороны отмечается болевой синдром при проведении тестов Мак-Мюрррея и Апли; признаков нестабильности коленного сустава, а также локальных проявлений воспаления не обнаружено. По данным рентгенографии признаков костно-травматической патологии не выявлено; определяется умеренное сужение медиальной суставной щели. МРТ-исследование выявило хрящевой дефект медиального мыщелка бедренной кости размерами 25 мм × 20 мм (площадь 5 см2) и разрыв в области заднего рога медиального мениска (Рисунок 7).
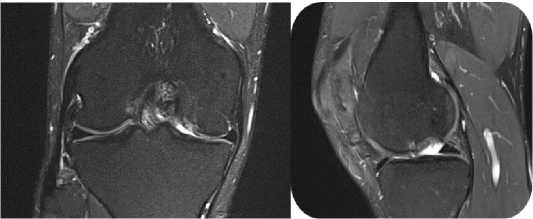
Рисунок 7 . Изображения снимков фронтального и сагиттального срезов с демонстрацией дефекта в области медиального мыщелка правой бедренной кости
На первом этапе лечения, в ходе артроскопии правого коленного сустава, был выявлен хрящевой дефект, проведена его визуальная оценка и определены размеры – 5,5 см2 (Рисунок 8), отмечен мультинаправленный разрыв тела и заднего рога медиального мениска. Повреждений хряща другой локализации не выявлено. Дно дефекта подвергнуто тщательной обработке в соответствии с хирургическим протоколом, частично резецированы тело и задний рог медиального мениска правого коленного сустава. Выполнено взятие трех костно-хрящевых блоков с ненагру-жаемой поверхности межмыщелкого отдела латерального мыщелка правой бедренной кости 6 мм. Пациент был выписан на следующий день после проведения контрольной перевязки, получив стандартные рекомендации, предусмотренные для послеоперационного периода после артроскопического вмешательства.
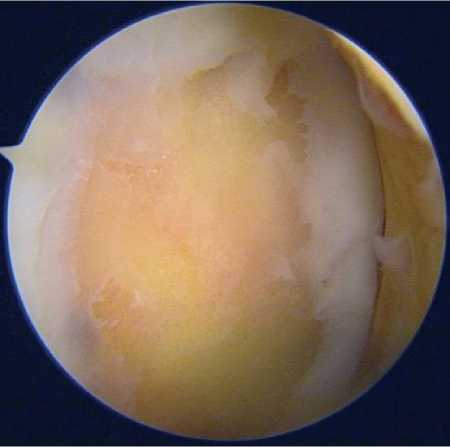
Рисунок 8. Снимок до обработки поверхности дефекта хрящевой ткани медиального мыщелка, который заполнен фиброзоподобной тканью
Через пять недель после первичной артроскопии правого коленного сустава пациент был приглашён для проведения повторного артроскопического вмешательства с целью имплантации биомедицинского клеточного продукта аутологичных хондроцитов в область хрящевого дефекта медиального мыщелка бедренной кости. Новых визуальных изменений по сравнению с данными первой артроскопии выявлено не было. После ревизии структур коленного сустава выполнили обработку дефекта до уровня субхондральной кости, затем осуществлена имплантация клеточного продукта в соответствии с ранее описанной методикой (Рисунок 9).
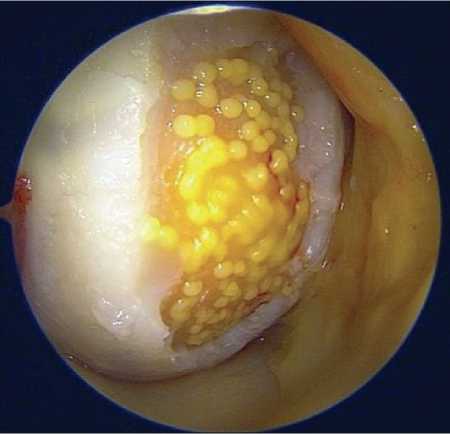
Рисунок 9. Аутологичные хондросферы распределены на поверхности дефекта хряща медиального мыщелка бедренной кости
Пациент был выписан на второй день после оперативного вмешательства, после проведения контрольной перевязки послеоперационных ран и выполнения иммобилизации оперированной конечности с использованием ортеза. Пациенту предоставлены подробные рекомендации по дальнейшему реабилитационному ведению.
Осмотр пациента через 4 месяца после пластики дефекта хряща медиального мыщелка правой бедренной кости
При клиническом осмотре область правого коленного сустава обычной конфигурации. Объем активных и пассивных движений в правом коленном суставе в пределах физиологической нормы. Выпота в полости коленного сустава не выявлено. На передней поверхности прооперированного коленного сустава рубцы в типичных местах наложения артроскопических портов, без признаков воспаления. Участков локальной гиперемии, гипертермии, флюктуации в области коленного сустава не выявлено.
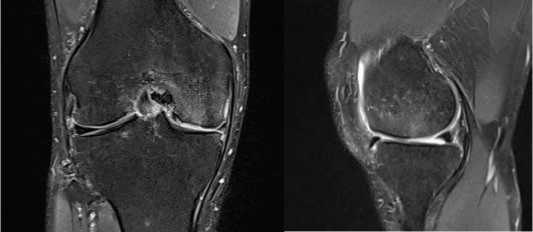
Рисунок 10. МРТ снимки хрящевой ткани суставной поверхности коленного сустава для выявления участков заращения у пациента с дефектом хряща левой бедренной кости
Таким образом, в обоих клинических случаях отмечена положительная динамика восстановления функции коленного сустава в течение 4-месячного периода наблюдения. Пациенты последовательно демонстрировали снижение выраженности болевого синдрома, улучшение походки и увеличение амплитуды движений в поражённом суставе. По данным физикального обследования уже к 4-му месяцу после вмешательства отмечалось восстановление полного или близкого к полному объёма движений, отсутствие признаков воспалительной реакции и удовлетворительное состояние мягкотканых структур.
Контрольные МРТ, выполненные через 4 месяца после первой операции, показали формирование однородного регенерата в зоне имплантации сфероидов аутологичных хондроцитов, соответствующее снижению дефекта суставного хряща. Отмечалась хорошая интеграция новообразованной хрящевой ткани с прилежащими структурами, отсутствие признаков нестабильности или дегенеративных изменений.
Оба пациента удовлетворительно перенесли вмешательства, ранний послеоперационный период протекал без ос- ложнений. Пациенты соблюдали предложенный протокол реабилитации и отмечали улучшение качества жизни уже к 4 месяцу наблюдения.
Заключение
Применение представленного в статье БМКП на основе сфероидов аутологичных хондроцитов сопровождается преимущественным формированием гиалинового хряща с морфологическими характеристиками, приближенными к нативным тканям. Данная методика относится к третьему поколению аутологичных хондроцитов и не требует использования периостального лоскута, мембраны, клея или иных средств для дополнительной фиксации имплантируемого материала. Кроме того, вмешательство может выполняться как малоинвазивно – артроскопически, так и традиционным способом – через артротомию. Существенным преимуществом является индивидуальное изготовление и персонализированное применение клеточного продукта, что минимизирует риски иммунологического отторжения и инфицирования.
Полученные результаты хорошо согласуются с данными МРТ исследованиями хрящевой ткани, что подтверждает положительную динамику восстановления хрящевой поверхности в течение наблюдаемого периода. Представленные в статье данные свидетельствуют о клинической и морфологической эффективности имплантации сфероидов аутологичных хондроцитов для лечения дефектов хряща коленного сустава.


