Клинический опыт применения низких доз хлорпромазина для лечения кататонического возбуждения у детей с расстройствами аутистического спектра
Автор: Балакирева Елена Евгеньевна, Никитина Светлана Геннадьевна, Куликов Антон Владиславович, Шушпанова Ольга Владимировна, Коваль-Зайцев Алексей Анатольевич, Иванов Михаил Владимирович, Блинова Татьяна Евгеньевна, Шалина Наталья Сергеевна
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Психофармакотерапия
Статья в выпуске: 2 (123), 2024 года.
Бесплатный доступ
Актуальность. Хлорпромазин, несмотря на практически 75-летний опыт использования в антипсихотической терапии, не утратил своего значения в психиатрической практике благодаря особенностям рецепторного взаимодействия и последующему быстрому клиническому ответу. Хлорпромазин одобрен для лечения психомоторного возбуждения, ажитации, тревоги, в том числе при расстройствах аутистического спектра (РАС). Психомоторное возбуждение у детей с РАС в ряде научных школ описывается как часть кататонического синдрома. Применение хлорпромазина в низких дозах может быть потенциально успешным в случаях кататонии с психомоторным возбуждением, в связи с этим представляется актуальным оценка его эффективности и возможности применения при данных состояниях с учетом нежелательных побочных эффектов терапии.
Хлорпромазин, расстройства аутистического спектра, кататония, детский возраст
Короткий адрес: https://sciup.org/142241574
IDR: 142241574 | УДК: 616.896,465?03/?15,:616.89-008.43:615.214:616-036.8:615.065 | DOI: 10.26617/1810-3111-2024-2(123)-92-100
Текст научной статьи Клинический опыт применения низких доз хлорпромазина для лечения кататонического возбуждения у детей с расстройствами аутистического спектра
Хлорпромазин является первым синтезированным антипсихотическим средством, появление которого в 1952 г. произвело революцию в психиатрии: выявленные на начальном этапе психиче- ские заболевания стали хорошо поддаваться медикаментозному лечению, что поставило их в один ряд с общесоматической медициной и значительно сократило сроки нахождения пациентов в стационарах [1].
За прошедшее время фармакологическая помощь пациентам психиатрического профиля значительно изменилась. Были разработаны антипсихотики второго, а затем третьего поколения, что расширило возможности врача в плане более гибкого подхода к подбору индивидуальной терапии. Вместе с тем хлорпромазин, являясь препаратом первого поколения, не утратил своего предшествующего ключевого значения в психиатрической практике вследствие особенностей рецепторного взаимодействия и последующего быстрого клинического ответа [1].
Хлорпромазин является алифатическим производным фенотиазина, блокирует центральные адренергические и серотонинергические рецепторы, обладает дофаминблокирующей, антигистаминной и М-холинолитической активностью. Главными особенностями хлорпромазина являются уменьшение психомоторного возбуждения, внутренней напряженности, тревоги, агрессии (без дальнейшего угнетения сознания, что, например, характерно для барбитуратов и препаратов бензодиазепинового ряда), мышечная релаксация, а также сравнительно редкое возникновение нейролепсии при применении низких доз (<100 мг/сут) [1, 2]. Хлорпромазин одобрен FDA для применения в детском возрасте при тяжелых поведенческих проблемах. [3]. В РФ может быть использован у детей с 1 года (в зависимости от лекарственной формы и производителя) для лечения психомоторного возбуждения, ажитации, тревоги, в том числе при расстройствах РАС. Вместе с тем препарат обладает рядом значимых побочных эффектов, таких как чрезмерная седация, экстрапирамидные расстройства, злокачественный нейролептический синдром, нарушения сердечного ритма, агранулоцитоз, помутнение хрусталика и роговицы [4, 5]. Принимая во внимание данные особенности лекарственного средства, считаем актуальной проблему оценки возможности применения хлорпромазина в детском возрасте для купирования психомоторного возбуждения, в том числе у детей с РАС.
В ряде научных школ психомоторное возбуждение у детей с РАС описывается как часть кататонического синдрома, для которого свойственны двигательное нецеленаправленное возбуждение, изменчивый мышечный тонус, негативизм, импульсивные поступки, эпизоды ступора, манерность, стереотипные движения и эхолалии [6]. В мировой литературе также отмечается новый виток интереса к данной проблеме, что отражается в числе публикаций на тему кататонических расстройств у пациентов с РАС [7, 8, 9, 10]. Пока не ясно, имеет ли кататония какие-либо специфические особенности, типичные для пациентов с РАС, или она аналогична таковой у людей без аутизма
-
[11] . Учитывая, что кататония является неспецифическим синдромом при различных состояниях, весьма вероятно, что пути развития данного синдрома могут различаться в соответствии с основным заболеванием [11, 12, 13]. На данный момент общепринятой гипотезой патогенеза кататонии является дисфункция NMDA- и GABA-A рецепторов, что подтверждают как нейровизуали-зационные исследования, так и эмпирические данные о заметном снижении кататонических расстройств при применении бензодиазепинов и NMDA-антагонистов [14, 15, 16]. Существуют также версии о дисбалансе ГАМК и дофамина в различных структурах головного мозга, что позволяет рассматривать применение низкопотентных и/или атипичных нейролептиков в качестве альтернативной терапевтической тактики при невозможности или противопоказаниях к использованию бензодиазепинов и электросудорожной терапии [13, 14, 15, 16]. Были проведены исследования о возможности применения клозапина в случаях такого рода [13]. Атипичные антипсихотики незаменимы при лечении симптомов аутизма (раздражительность, агрессия, членовредительство, гиперактивность и стереотипное поведение), но имеют побочные эффекты в виде набора веса и поздней дискинезии [17]. По данным обзора рандомизированных контролируемых исследований (21 РКИ, n=1 309), антипсихотики у детей и подростков с РАС эффективнее плацебо в снижении стереотипий, гиперактивности, раздражительности, навязчивых состояний и компульсий, улучшении социального общения и глобального функционирования [18]. После кратковременного приема ари-пипразола у детей и подростков уменьшались раздражительность, гиперактивность, стереотипии, однако имелись заметные побочные эффекты (увеличение веса, седативный эффект, слюнотечение, тремор) [19]. При РАС и умственной отсталости пациенты ежедневно получали 25 мг хлорпромазина, 1,5 мг лоразепама и 2500 мг дивалпроекса. Отмена хлорпромазина на 75-й неделе (дозы бензодиазепина и противоэпилептического препарата были сохранены) по-разному влияла на крупную двигательную активность, изменения в связывании дофаминовых рецепторов предположительно могли избирательно воздействовать на перемену стереотипного поведения [20].
Применение хлорпромазина в антипсихотической терапии систематически не изучалось, однако может быть потенциально успешным в случаях кататонии с психомоторным возбуждением. В собственном исследовании рассмотрен прием хлорпромазина без сопутствующего назначения бензодиазепинов. Терапевтические стратегии сочетания хлорпромазина и бензодиазепинов могут являться темой будущих работ.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить возможность применения хлорпромазина в детском возрасте для купирования кататонического возбуждения у детей с РАС.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование вошли пациенты, проходившие стационарное лечение в детском (№ 7) отделении ФГБНУ НЦПЗ. Критерии включения: I) соответствие критериям диагнозов по МКБ-10: детский аутизм (F84.0), атипичная форма аутизма (F84.1), 2) наличие психомоторного возбуждения в клинической картине РАС, 3) возраст обследуемых от 3 до 15 лет, 4) наличие информированного согласия от законных представителей пациентов на участие в исследовании.
Критерии невключения: 1) сопутствующие диагнозы: расстройства настроения (F3x), невротические, связанные со стрессом и соматоформные расстройства (F4х), 2) наличие выраженных неврологических расстройств (ДЦП, генерализованная эпилепсия, инсульт, ишемия ГМ, новообразования ЦНС), лактозной недостаточности, хромосомной патологии, инфекционного процесса, декомпенсация соматических заболеваний.
Длительность приема хлорпромазина составляла не менее 28 дней. Пациенты получали препарат в таблетированной форме в дозе 25 и 50 мг. Доза препарата подбиралась индивидуально с учетом возраста, веса и тяжести состояния пациента, в зависимости от эффективности и переносимости препарата. Психометрическая оценка проводилась трижды: в 1-й, 14-й и 28-й дни приема терапии. Результаты оценивались по шкале выявления кататонии Буша-Френсиса (BFCRS) и её подшкалам: гиперкинетической кататонии (BFCRS-I), гипокинетической кататонии (BFCRS-II), симптомов малой кататонии (BFCRS-III), со-матовегетативных нарушений (BFCRS-IV) [21]; по шкале общего клинического впечатления (CGI) и её подшкалам: тяжести заболевания (CGIS), улучшения состояния (CGI-I) и побочного действия (CGI-E). Выраженность аутизма оценивалась по рейтинговой шкале аутизма у детей (CARS).
До начала курса лечения хлорпромазином и по его завершении пациенты были осмотрены педиатром, неврологом, офтальмологом, выполнены клинические анализы крови и мочи, биохимический анализ крови, ЭКГ- и ЭЭГ-исследования.
Для статистического анализа были использованы t-критерий Уилкоксона, коэффициент ранговой корреляции Спирмена.
РЕЗУЛЬТАТЫ
Первоначально в исследование были включены пациенты (n=87) с диагнозами по МКБ-10: детский аутизм (F84.0) - n=51, 59%, атипичный аутизм (F84.1) - n=36, 41%.
Распределение по возрасту показало, что большинство пациентов приходилось на детей дошкольного возраста от 3 до 6 лет (n=36, 41%), с незначительной разницей зарегистрированы дети младшего школьного возраста от 7 до 11 лет (n=32, 37%), меньшинство составляли лица подросткового возраста от 12 до 15 лет (n=19, 22%). Среди обследуемых преобладали мальчики (n=77, 89%), что согласуется с эпидемиологическими данными о большей распространенности РАС у мальчиков. Большая часть выборки (n=48, 55%) с учётом особенностей психофизического развития обучалась в школе по адаптированной программе, 3 школьника (4%) учились по общеобразовательной программе. По данным анамнеза 22 пациента (25%) посещали ДДУ, 16% (n=14) были не организованы. Большинство обследуемых (n=86, 99%) имели инвалидность по психическому заболеванию.
На момент включения в исследование состояние пациентов оценивалось как тяжелое, тяжесть по шкале CGI-S составляла 6,06±0,64 балла (ДИ 95%). У пациентов наблюдались выраженные симптомы РАС. Так, в соответствии с полученными результатами средний балл по шкале CARS составлял 41,2±1,6 (ДИ 95%), что соответствует тяжелому аутизму. По шкале кататонии BFCRS выраженность симптоматики оценивалась как умеренная (25±0,89 балла, ДИ 95%), с преобладанием гиперкинетической кататонии (12,4±1,6 балла по подшкале BFCRS-I). Отмечалось умеренное присутствие симптомов малой кататонии (9,7±0,9 балла по подшкале BFCRS-III) и гипокинетической кататонии (3,5±0,7 балла по подшкале BFCRS-II). Вместе с тем ни у одного пациента не наблюдалось жизненно важных соматовегетатив-ных нарушений. Суточная доза хлорпромазина варьировалась от 12,5 до 200 мг, распределенная на 3-4 приема, составляя в среднем 75,8 мг/сут. Полностью завершили клиническое исследование 75 человек, досрочно прекратили исследование 19 человек: 17 - по причине нежелательных эффектов, развившихся в процессе лечения, 2 - в связи с досрочным выбытием из стационара.
Анализ эффективности терапии
На 14-й день терапии хлорпромазином отмечено статистически значимое (p<0,01) снижение тяжести кататонических расстройств, оцениваемое по шкале BFCRS (23±1,17 балла, легкая кататония). К 28-му дню исследования средний балл по шкале BFCRS составил 14,7±1,8 (легкая кататония). Наибольшая редукция баллов наблюдалась по подшкале BFCRS-I (3±1,1 балла), умеренное снижение выявлено по подшкале BFCRS-III (8,2±1,4 балла). В то время как баллы по подшкалам BFCRS-II и BFCRS-IV изменились минимально (рис. 1).
ИЗМЕНЕНИЕ ТЯЖЕСТИ КАТАТОНИЧЕСКОЙ СИМПТОМАТИКИ НА ФОНЕ ПРОВОДИМОЙ ТЕРАПИИ ПО ШКАЛЕ BFCRS, БАЛЛЫ
■ BFCRS-I «BFCRS-П «BFCRS-Ш 1BFCRS-IV «BFCRS
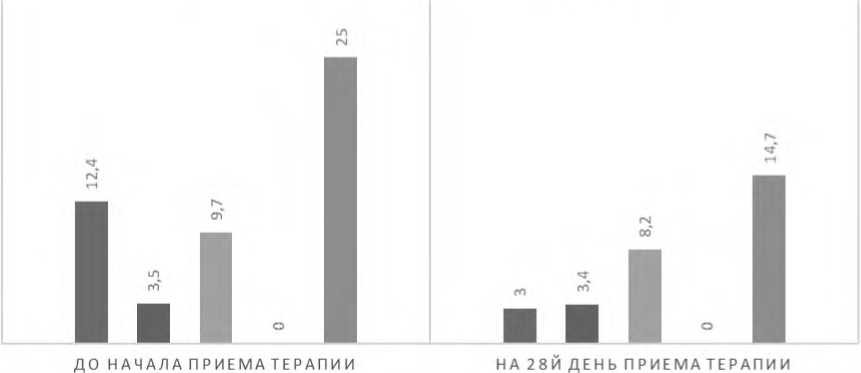
Рисунок 1. Динамика изменения тяжести кататонической симптоматики на фоне проводимой терапии хлорпромазином по шкале BFCRS (p<0,01)
По подшкале CGI-S тяжесть состояния статистически значимо (p<0,01) снизилась с 6,06±0,6 балла (тяжелое расстройство, ДИ 95%) до 5,5±0,29 балла (выраженное расстройство, ДИ 95%). По подшкале CGI-I у незначительной части пациентов зарегистрировано выраженное улучшение состояния (n=14, 16%), что позволяет отнести их к респондерам. У большинства пациентов (n=60, 69%) наблюдалось частичное улучшение состояния (частичные респондеры). В то время как у 13 человек в психическом статусе не отмечалось изменений (15%, нон-респондеры). При этом в возрастной группе подростков преобладало количество респондеров (32%) по сравнению с другими возрастами (14% - у детей дошкольного возраста, 12,5% - младшего школьного возраста).
Индекс эффективности с учетом побочных эффектов терапии хлорпромазином оценивался по подшкале CGI-E: средний балл по данной подшкале составлял 6±0,16 (ДИ 95%), что соответствует умеренному терапевтическому эффекту с частичной ремиссией симптомов и несущественным воздействием побочных эффектов на функциональный статус пациента (табл. 1).
Таблица 1. Количественная оценка общего состояния на фоне терапии хлорпромазином на 28-й день исследования по шкале CGI, баллы (p<0,01)
|
Подшкала CGI |
CGI-S |
CGi-i |
CG1-E |
|
Количество баллов на 28-й день приема хлорпромазиновой терапии |
5.5±0.29 Выраженное расстройство |
2.9±0.1 Сильное улучше-ние/минимальное улучшение |
6±0,16 Умеренный терапевтический эффект с частичной ремиссией симптомов и несущественным влиянием побочных эффектов на функциональный статус пациента |
Также поводилась оценка динамики выраженности аутизма по шкале CARS. Несмотря на статистически значимое (p<0,01) снижение среднего балла с 41 до 39, аутизм оценивался как тяжелый.
Анализ нежелательных явлений.
Нежелательные явления на фоне терапии хлорпромазином были зарегистрированы у большинства пациентов (n=78, 89,65%), включенных в исследование. У 17 пациентов выборки (19,7%) отмечались нежелательные явления умеренной степени тяжести, потребовавшие замены хлор- промазина: раздражительность, плаксивость, нейролептическая депрессия (n=9, 10,3%), выраженная гипотензия (n=4, 4,6%), лейкопения (n=2, 2,3%), удлинение интервала QT (n=1, 1,1%), фотосенсибилизация (n=1, 1,1%). У большинства обследуемых наблюдались легкие побочные явления, купируемые в первые дни приема самостоятельно либо требовавшие коррекции доз: сонливость (n=51, 58,6%), индифферентность (n=34, 39%), ортостатическая гипотензия (n=29, 33,3%), головокружение (n=29, 33,3%), тахикардия (n=29,
33,3%), заложенность носа и сухость во рту (n=22, 25,3%), запор (n=19, 21,8%), нечеткость зрения (n=9, 10,3%), бессонница (n=3, 3,4%), возбуждение (n=1, 1,1%). Серьезных нежелательных явле- ний (острая дистония, злокачественный нейролептический синдром, агранулоцитоз, судороги, отложения в хрусталике, эксфолиативный дерматит) не зафиксировано (рис. 2).
Возбуждение
Фотосенсибилизация Удлиненное интервала QT Лейкопения Выраженная гипотезия Бессонница
Депрессия
Нечеткость зрения
Запор
Сухость во рту Тахикардия Головокружение Ортостаческая гипотензия Индифферентность
Сонливость
I 1,10%
I 1,10%
I 1,10%
■ 2,30%
^Н 4,60%
-
■■ 3,40%
^■^М 10,30%
^^Ш 10,30%
^■^Ш^Н^МВ 21,80%
^^■^■t^^^H^M 25,30%
^^^^^М^^^М^^^Н 33,30%
,. ------ ■ .1 33,00%
^^^^^М^^^Ш^^М 33,30% ^^^М^^Н^^^Н 39% ^■^■^^^^■^^^■^■^■^^^^Ш 58,60%
0,00% 10,00% 20,00% 30,00% 40,00% 50,00% 60,00% 70,00%
Рисунок 2. Частота встречаемости нежелательных явлений, зарегистрированных при применении хлорпромазина на протяжении курса терапии
ОБСУЖДЕНИЕ
На фоне проводимой терапии хлорпромазином отмечалась редукция кататонических расстройств, характеризующаяся снижением выраженности кататонических симптомов по шкале BFCRS с умеренной до легкой, преимущественно за счет уменьшения выраженности гиперкинетической кататонии (на 75,8%) и смягчения симптомов малой кататонии (на 15,4%). Уменьшение тяжести состояния по подшкале CGI-S от тяжелого до выраженного, а также улучшение состояния по подшкале CGI-I оценивалось с учетом остальной клинической симптоматики, в том числе осевых симптомов РАС. Преобладание респондеров среди подростков с РАС, вероятно, было обусловлено длительно проводимой успешной аби-литацией, в связи с чем выраженность непосредственных симптомов РАС в подростковом возрасте была ниже, чем у детей дошкольной и младшей школьной групп, однако кататоническая симптоматика оставалась выраженной на протяжении всего онтогенетического периода развития. Следовательно, общая оценка состояния улучшалась за счет редукции кататонической гиперкинетической симптоматики. Эффективность проводимой терапии по подшкале CGI-E оценивалась как умеренная с частичной ремиссией симптомов и несущественным влиянием побочных эффектов на функциональный статус пациента. Тем не менее особенности спектра рецепторного действия обусловливают высокую распространенность нежелательных явлений легкой степени тяжести, в связи с чем требуется информирование родителей или опекающих лиц о длительности и выраженности побочных эффектов, а также контроль за соматическим состоянием пациента в первые дни приема терапии. Необходимо отметить отсутствие тяжелых нежелательных явлений при использовании хлорпромазина в низких дозах с целью лечения психомоторного возбуждения, что отличается от профиля побочных эффектов при его применении в высоких дозах с целью купирования психотической симптоматики.
Полученные нами данные об эффективности и частоте встречаемости побочных явлений при терапии РАС сопоставимы с результатами, представленными в других исследованиях. К недостаткам собственной работы можно отнести отсутствие данных по сопоставлению эффективности хлорпромазина с препаратами других фармакологических групп, одобренных для лечения кататонии, прежде всего бензодиазепинового ряда, а также ограниченный временной (4недельный) период наблюдения за пациентами. Указанные ограничения могут быть успешно преодолены в последующих работах.
ЗАКЛЮЧЕНИЕ
Таким образом, использование хлорпромазина в низких дозах для лечения кататонического возбуждения у детей с РАС является возможным. Препарат эффективен при наличии выраженной гиперкинетической составляющей кататонического синдрома. Нежелательные явления легкой степени достаточно распространены и требуют контроля со стороны врача в первые дни приема препарата.
Список литературы Клинический опыт применения низких доз хлорпромазина для лечения кататонического возбуждения у детей с расстройствами аутистического спектра
- Boyd-Kimball D, Gonczy K, Lewis B, Mason T, Siliko N, Wolfe J. Classics in chemical neuroscience: chlorpromazine. ACS Chem Neurosci. 2019 Jan 16;10(1):79-88. doi: 10.1021/acschemneuro. 8b00258. Epub 2018 Jul 16. PMID: 29929365.
- Dudley K, Liu X, De Haan S. Chlorpromazine dose for people with schizophrenia. Cochrane Database Syst Rev. 2017 Apr 13;4(4):CD007778. doi: 10.1002/14651858.CD007778.pub2. PMID: 28407198; PMCID: PMC6478116.
- Christian R, Saavedra L, Gaynes BN, Sheitman B, Wines RCM, Jonas DE, Viswanathan M, Ellis AR, Woodell C, Carey TS. future research needs for first- and second-generation antipsychotics for children and young adults [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US); 2012 Feb. Report No.: 12-EHC042-EF. PMID: 22439160.
- Государственный реестр лекарственных средств https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=f1fdf6a0-f388-416d-b379-4c8f12e0da9e
- Государственный реестр лекарственных средств https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=6b44a9d8-43c0-448a-8947-ee8cfa32e6c2
- Куликов А.В. Кататонические и кататоно-регрессивные расстройства при психотических формах расстройств аутистического спектра у детей: клиническая картина и подходы к терапии. Психиатрияипсихофармакотерапия. 2020. Т. 22, № 4. С. 21-24.
- Moore S, Amatya DN, Chu MM, Besterman AD. Catatonia in autism and other neurodevelopmental disabilities: a state-of-the-art review. Npj Ment Health Res. 2022 Sep 14;1(1):12. doi: 10.1038/s44184-022-00012-9. PMID: 38609506; PMCID: PMC10955936.
- Fink M. Rediscovering catatonia: the biography of a treatable syndrome. Acta Psychiatr Scand Suppl. 2013;(441):1-47. doi: 10.1111/acps.12038. PMID: 23215963.
- Fink M, Shorter E, Taylor MA. Catatonia is not schizophrenia: Kraepelin's error and the need to recognize catatonia as an independent syndrome in medical nomenclature. Schizophr Bull. 2010 Mar;36(2):314-20. doi: 10.1093/schbul/sbp059. Epub 2009 Jul 8. PMID: 19586994; PMCID: PMC2833121.
- Remberk B, Szostakiewicz Ł, Kałwa A, Bogucka-Bonikowska A, Borowska A, Racicka E. What exactly is catatonia in children and adolescents. Psychiatr Pol. 2020 Aug 31;54(4):759-775. English, Polish. doi: 10.12740/PP/113013. Epub 2020 Aug 31. PMID: 33386726.
- Wachtel LE. The multiple faces of catatonia in autism spectrum disorders: descriptive clinical experience of 22 patients over 12 years. Eur Child Adolesc Psychiatry. 2019 Apr;28(4):471-480. doi: 10.1007/s00787-018-1210-4. Epub 2018 Aug 1. PMID: 30069655.
- Poser HM, Trutia AE. Treatment of a Prader-Willi Patient with Recurrent Catatonia. Case Rep Psychiatry. 2015;2015:697428. doi: 10.1155/2015/697428. Epub 2015 May 7. PMID: 26064753; PMCID: PMC4439498.
- Thom RP, Wu M, Ravichandran C, McDougle CJ. Clozapine for treatment refractory catatonia in individuals with autism spectrum disorder: a retrospective chart review study. Expert Rev Clin Pharmacol. 2023 Jul-Dec;16(9):865-875. doi: 10.1080/17512433.2023.2243820. Epub 2023 Aug 8. PMID: 37526285.
- Neuropsychiatry of catatonia: Clinical implications psychiatric times [(accessed on 19 October 2021)]. Available online: https://www.psychiatrictimes.com/view/neuropsychiatry-catatonia-clinical-implications
- Madigand J, Lebain P, Callery G, Dollfus S. Catatonic syndrome: From detection to therapy. Encephale. 2016 Aug;42(4):340-5. doi: 10.1016/j.encep.2015.09.008. Epub 2016 May 20. PMID: 27216588.
- Edinoff AN, Kaufman SE, Hollier JW, Virgen CG, Karam CA, Malone GW, Cornett EM, Kaye AM, Kaye AD. Catatonia: Clinical overview of the diagnosis, treatment, and clinical challenges. Neurol Int. 2021 Nov 8;13(4):570-586. doi: 10.3390/neurolint13040057. PMID: 34842777; PMCID: PMC8628989.
- Posey DJ, Stigler KA, Erickson CA, McDougle CJ. Antipsychotics in the treatment of autism. J Clin Invest. 2008 Jan;118(1):6-14. doi: 10.1172/JCI32483. PMID: 18172517; PMCID: PMC2171144.
- D'Alò GL, De Crescenzo F, Amato L, Cruciani F, Davoli M, Fulceri F, Minozzi S, Mitrova Z, Morgano GP, Nardocci F, Saulle R, Schünemann HJ, Scattoni ML; ISACA Guideline Working Group. Impact of antipsychotics in children and adolescents with autism spectrum disorder: a systematic review and meta-analysis. Health Qual Life Outcomes. 2021 Jan 25;19(1):33. doi: 10.1186/s12955-021-01669-0. PMID: 33494757; PMCID: PMC7831175.
- Hirsch LE, Pringsheim T. Aripiprazole for autism spectrum disorders (ASD). Cochrane Database Syst Rev. 2016 Jun 26;2016(6):CD009043. doi: 10.1002/14651858.CD009043.pub3. PMID: 27344135; PMCID: PMC7120220.
- Valdovinos MG, Aguilar M, Piersma D, Wilkinson A, Kennedy CH. Changes in stereotypical behavior following chlorpromazine termination: polypharmcy effects on response class membership. Adv Neurodev Disord. 2020 Sep;4(3):247-252. doi: 10.1007/s41252-020-00158-7. Epub 2020 May 20. PMID: 33738335; PMCID: PMC7962922.
- Carroll BT, Kirkhart R, Ahuja N, Soovere I, Lauterbach EC, Dhossche D, Talbert R. Katatonia: a new conceptual understanding of catatonia and a new rating scale. Psychiatry (Edgmont). 2008 Dec;5(12):42-50. PMID: 19724775; PMCID: PMC2729619.


