Клинический случай 10-летнего успешного применения амбризентана у пациентки с идиопатической лёгочной гипертензией
Автор: Мартынюк Т.В., Саидова М.А., Данилов Н.М., Лазуткина В.К., Чазова И.Е.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Клинический случай
Статья в выпуске: 4, 2015 года.
Бесплатный доступ
Идиопатическая лёгочная гипертензия (ИЛГ) относится к числу редких заболеваний сердечно-сосудистой системы неустановленной этиологии, характеризуется повышением лёгочного сосудистого сопротивления (ЛСС) и давления в лёгочной артерии (ДЛА) вследствие выраженного ремоделирования мелких лёгочных артерий и артериол, часто имеет прогрессирующее течение с быстрым развитием декомпенсации правого желудочка. Ключевым звеном патогенеза ИЛГ является эндотелиальная дисфункция, приводящая к развитию вазоконстрикции, тромбозов in situ, пролиферативным и воспалительным изменениям в микроциркуляторном русле лёгких. Оптимизация медикаментозной терапии связана с внедрением в клиническую практику высокоэффективных лекарственных препаратов патогенетического действия, воздействующих на основные мишени заболевания - активацию системы эндотелина-1 (ЭТ-1), дефицит эндогенного простациклина и оксида азота. Роль ЭТ-1 обусловлена мощным вазоконстриктивным действием, способностью вызывать клеточную пролиферацию и дифференцировку клеток, продукцию факторов роста цитокинов, биологически активных веществ. Антагонисты рецепторов эндотелина (АРЭ) - это важнейший класс ЛАГ-специфической терапии, включающий два препарата - неселективный АРЭ бозентан и селективный - амбризентан. Представленный клинический случай демонстрирует долгосрочную эффективность и надёжную безопасность терапии амбризентаном на протяжении 10 лет у больной ИЛГ с исходным функциональным классом III (ВОЗ).
Идиопатическая лёгочная гипертензия, эндотелин-1, антагонисты рецепторов эндотелина, амбризентан
Короткий адрес: https://sciup.org/14342806
IDR: 14342806
Текст научной статьи Клинический случай 10-летнего успешного применения амбризентана у пациентки с идиопатической лёгочной гипертензией
Сведения об авторах:
|
Саидова Марина Абдулатиповна |
д.м.н., профессор, руководитель лаборатории ультразвуковой диагностики отдела новых методов исследования ИКК им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ |
|
Данилов Николай Михайлович |
к.м.н., старший научный сотрудник отдела гипертонии ИКК им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ |
|
Лазуткина Валентина Кирилловна |
к.м.н., врач рентгеновского кабинета ИКК им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ |
|
Чазова Ирина Евгеньевна |
кчлен-корр. РАН, профессор, д.м.н., и.о. генерального директора ФГБУ РКНПК МЗ РФ, директор ИКК им. А.Л. Мясникова, руководитель отдела гипертонии ИКК им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ |
|
Автор, ответственный оя рваяк р прпякнирй- |
д.м.н., руководитель лаборатории лёгочной гипертензии отдела гипертонии ИКК |
|
за связь с редакцией: Мартынюк Тамила Витальевна |
им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ, тел.: 8-495-414-64-50, 121552, Москва, ул. 3-я Черепковская, д. 15 а, trukhiniv@mail.ru |
Идиопатическая лёгочная гипертензия (ИЛГ) относится к числу редких заболеваний сердечно-сосудистой системы неустановленной этиологии, характеризуется повышением лёгочного сосудистого сопротивления (ЛСС) и давления в лёгочной артерии (ДЛА) вследствие выраженного ремоделирования мелких лёгочных артерий и артериол, часто имеет прогрессирующее течение с быстрым развитием декомпенсации правого желудочка [1]. В патогенезе заболевания ключевую роль играет эндотелиальная дисфункция, которая приводит к нарушению продукции вазодилатирующих и антипролифе-ративных веществ – оксида азота и простациклина, повышенному образованию вазоконстрикторных и пролиферативных веществ – тромбоксана А2 и эндотелина-1, что определяет основные подходы к лечению [2]. Основными терапевтическими мишенями при ИЛГ являются три патогенетических механизма: дефицит оксида азота (NO) и простациклина (ПЦ), повышенная продукция эндотелина-1 (ЭТ-1), которые способствует развитию ремоделирования мелких лёгочных артерий и артериол и участвуют в формировании и прогрессировании заболевания [1-3].
В эру стандартной терапии медиана выживаемости больных с ИЛГ, ранее называемой первичной лёгочной гипертензией, составляла 2,8 года [4]. В последнее десятилетие наметился значительный прогресс в лечении заболевания за счёт внедрения в клиническую практику новых лекарственных препаратов, которые коренным образом улучшили состояние больных, качество их жизни и прогноз [1,3,5]. В 2006 г. результаты французского регистра проедмонстрировали, что выживаемость больных ИЛГ к 1-му и 3-му году наблюдения составляла 90% и 75%, к 5-му году – 65% [2].
Эндотелин-1 (ЭТ-1) – наиболее мощный и длительно действующий эндогенный пептид с вазоконстриктивными свойствами, который вызывает пролиферацию и дифференцировку клеток, продукцию факторов роста, цитокинов, биологически активных веществ. Гипертрофия гладкомышечных и эндотелиальных клеток, фиброзные изменения, воспалительный ответ и вазоконстрикция способствуют развитию ремоделирования мелких лёгочных артерий и артериол [6-8]. Широкий спектр патологических эффектов позволяет рассматривать ЭТ-1 в качестве основного патогенетического медиатора и потенциальной мишени для терапевтического воздействия при ЛАГ [2,5].
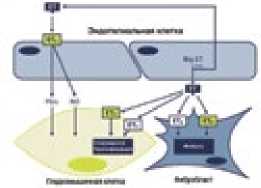
В нашей стране в конце 2006 г. самым первым препаратом ЛАГ-специфической терапии, одобренным Фармкомитетом, явился неселективный антагонист рецепторов эндотелина (АРЭ) бозентан. Применение лекарственных препаратов, блокирующих рецепторы ЭТ-1, у пациентов с ЛАГ позволяет достичь существенного повышения физической активности, уменьшить выраженность клинических симптомов, замедлить темпы прогрессирования заболевания и улучшить выживаемость больных, что было показано в серии рандомизированных клинических исследований (РКИ) [1]. В настоящее время этот класс представлен двумя препаратами: сульфонамидным производным – бозентаном и несульфонамидным производным – амбризентаном, которые обладают различной аффинностью к различным подтипам рецепторов эндотелина (рис. 1).
Рисунок 1. Эффекты стимуляции рецепторов эндотелина типа А и В
ЭTB рецепторы
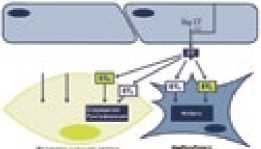
•NO опосредованная/ эндотелий- зависимая вазодилатация •Клиренс эндотелина в легких
•Натрийурез
ЭTA рецепторы
-
• Вазоконстрикция
-
• Прессорный эффект
-
• Митогенный эффект
-
• Воспаление
-
• Фиброз
В 2012 г. в России появился селективный АРЭ несульфонамидной структуры амбризентан (Волибрис®, ГлаксоСмитКляйн Трейдинг, Великобритания), одобренный в нашей стране для лечения больных с ЛАГ функционального класса II-III в дозе 5 и 10 мг с целью улучшения толерантности к физическим нагрузкам и предотвращения прогрессирования заболевания (рис. 2) [1].
Рисунок 2. Антагонисты рецепторов эндотелина.
Aмбризентан – первый несульфонамидный АРЭ
Бозентан
Дериваты класса сульфонамидов
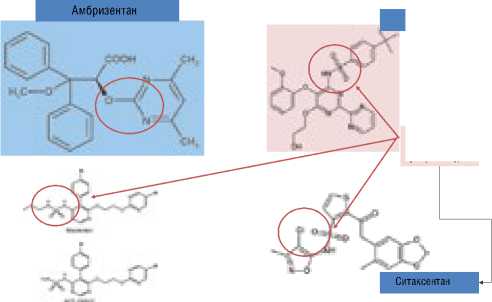
Амбризентан
Ситаксентан
Мацинтентан и его активный метаболит
Рисунок 3. История заболевания больной С.
1- е обращение к врачу
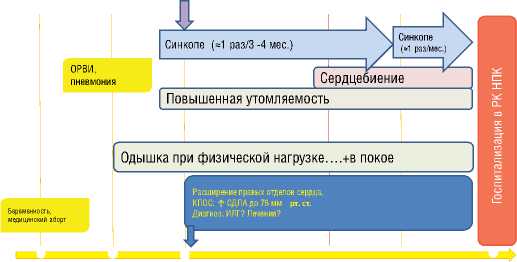
1993 1995 1996
21 год 23 года 24 года
28 лет
К настоящему времени накоплены экспериментальные данные и результаты клинических исследований, которые показали отсутствие очевидных преимуществ АРЭ в зависимости от их селективности [5]. Амбризентан обладает особым профилем фармакологических и фармакокинетических характеристик, что определяет особенности его метаболизма, побочных реакций и лекарственных взаимодействий. Мы представляем клинический случай пациентки с ИЛГ, демонстрирующий возможности успешного клинического применения АРЭ амбризентана при ИЛГ на протяжении 10 лет.
Больная С. 1972 года рождения наблюдается в Институте клинической кардиологии им. А.Л. Мясникова ФГБУ «РКНПК» МЗ РФ с 2000 г., когда впервые поступила в отдел гипертонии для уточнения причины высокой лёгочной гипертензии. Из анамнеза известно, что до 23 лет больная чувствовала себя удовлетворительно, вела активный образ жизни. Единственная беременность в 21 год завершилась медицинским абортом на раннем сроке (рис. 3). В 23 года после острой респираторной вирусной инфекции, осложнившейся пневмонией, больная стала отмечать снижение толерантности к физической нагрузке, появление одышки при физических нагрузках. В дальнейшем присоединилась общая слабость, утомляемость, синкопальные состояния (1 раз/ 3-4 месяца). Постепенно толерантность к физическим нагрузкам снижалась. Диагноз ИЛГ был выставлен пациентке в 24-летнем возрасте по месту жительства на основании обследования, включавшего катетеризацию правых отделов сердца (КПОС). При манометрии систолическое давление в лёгочной артерии (СДЛА) составило 76 мм рт. ст., остальные данные, включая результаты острых фармакологических проб, в медицинской документации представлены не были. В тот период от назначения медикаментозной терапии было решено воздержаться. В 2000 г. в связи с ухудшением состояния и появлением одышки и сердцебиений в покое, учащением синкопе до 1 раза в месяц пациентка впервые была госпитализирована в НИИ кардиологии им. А.Л. Мясникова для дообследования и решения вопроса о подборе терапии.
При поступлении предъявляла жалобы на одышку при небольших физических нагрузках, быструю утомляемость, эпизоды учащённого сердцебиения, синкопе (рис. 3). При объективном осмотре больной состояние средней тяжести, индекс массы тела=26 кг/м2. Обращало на себя внимание наличие акроцианоза. В лёгких дыхание проводилось во все отделы, с жёстким оттенком, ЧДД – 16 в минуту. При аускультации тоны сердца ясные, ритм правильный; акцент II тона над лёгочной артерией. Выслушивался систолический шум над проекцией трикуспидального клапана с проведением по 5 межреберью до передней ключичной линии. АД 100/70 мм рт. ст., ЧСС 72 в минуту. Живот при пальпации мягкий, безболезненный. Печень не увеличена. Симптом поколачивания по поясничной области отрицательный. Периферических отёков не выявлено.
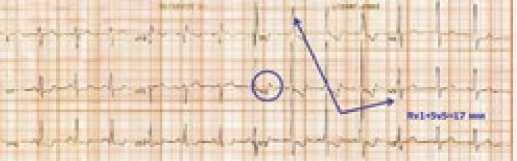
По данным электрокардиографии (ЭКГ): ритм синусовый, ЧСС 84 удара в минуту, отклонение электрической оси сердца вправо (патологическая правограмма), признаки выраженной гипертрофии правого желудочка (R-тип) с изменением конечной части желудочкового комплекса в правых и прекордиальных (V1-V3) отведениях (рис. 4).
Рисунок 4. ЭКГ больной С.
По данным рентгенологического исследования, в 2000 г. у пациентки наблюдались признаки артериальной лёгочной гипертензии: расширение ствола лёгочной артерии, коэффициент Мура составил 36% (в норме до 30%), коэффициент Люпи 34% (в норме до 30%), расширение правой и левой ветвей лёгочной артерии, обеднение периферического сосудистого рисунка, дилатация правого желудочка (рис. 5).
Рисунок 5. Рентгенограмма органов грудной клетки больной С.
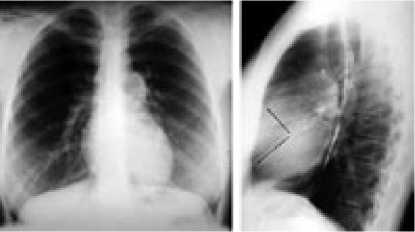
КТИ 52%
(N<50%)
Коэф. Мура 36%
(N<30%)
Коэф. Люпи 34%
(N ≤ 30%)
Ширина правого корня 18 мм (N ≤ 15 мм)
Больная С., 28 лет, 2000г.
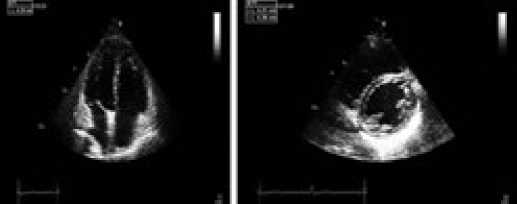
По данным эхокардиографии (ЭхоКГ) было выявлено расширение правых отделов сердца (увеличение переднезаднего размера правого желудочка (ПЗР ПЖ) до 4,0 см, площади правого предсердия (SПП) до 21 см2), гипертрофия миокарда ПЖ (толщина передней стенки правого желудочка (ТПСПЖ) – 0,9 см), дилатация лёгочной артерии (ЛА) до 3,1 см. Отмечалось парадоксальное движение межжелудочковой перегородки. При допплерЭхоКГ выявлена недостаточность трикуспидального клапана III степени, расчётное СДЛА составило 130 мм рт. ст.
Рисунок 6. Данные эхокардиографии больной С.
2000г. норма
|
Ао,см |
2,5 |
2,0 – 3,7 |
|
ЛП,см |
2,7 |
2,0 – 4,0 |
|
КДР,см |
3,5 |
4,0 – 5,5 |
|
КСР,см |
1,5 |
2,5 – 3,8 |
|
ФВ,% |
>60 |
>60 |
|
ТМЖП,см |
0,8 |
0,7 – 1,1 |
|
ТЗСЛЖ,см |
0,8 |
0,7 – 1,1 |
|
ПЗР ПЖ, см |
4,0 |
до 3,2 |
|
ПП, см (апик.) |
4,7х4,5 |
>5,3 х 4,4см |
|
ТПС ПЖ, см |
0,9 |
до 0,5 |
|
СДЛА,мм рт.ст. |
130 |
до 25 |
|
Ст. ЛА, см |
3,1 |
до 2,5 |
|
Митральная регургитация, ст |
1 |
0-1 |
|
Трикуспидальная регургитация, ст |
3 |
0-1 |
В тесте 6-минутной ходьбы (Т6МХ) пациентка прошла 402 м с индексом одышки 3. По данным КПОС у больной отмечалось повышение СДЛА до 90 мм рт. ст., диастолического давления в лёгочной артерии (ДДЛА) до 42 мм рт. ст., среднего ДЛА (ДЛАср.) до 58 мм рт. ст., при нормальном давлении заклинивания в лёгочной артерии (ДЗЛА) 3 мм рт. ст. ЛСС было повышено до 1081 дин х сек/см5. Сердечный выброс (СВ) снижен до 3,1 л/мин, сердечный индекс – до 2,1 л/мин/м2. Давление в правом предсердии составило 6 мм рт. ст., сатурация О2 крови – 71,6% (табл. 1).
При проведении острой фармакологической пробы (ОФП) с простагландином Е1 в дозе 40 мкг ДЛАср. снизилось с 58 до 34 мм рт. ст. при стабильной величине СВ, что указывает на положительный результат теста на вазореактивность.
По месту жительства в 1995 г. у пациентки отмечалось повышение титра антител к щитовидной железе, но потребности в медикаментозной терапии не возникало. В 2000 г. впервые в анализах крови обнаружено повышение уровня тиреотропного гормона до 5,04 мМЕ/л при нормальных значениях до
Таблица 1. Катетеризация правых отделов сердца
|
2000г. |
Норма |
|
|
Давление ЛА, мм рт.ст. |
90/42/58 |
<25 (среднее) |
|
Давление ПП, мм рт.ст. |
6 |
2-6 |
|
Давление ПЖ, мм рт.ст. |
88/2 |
15-25/0-8 |
|
ДЗЛА, мм рт.ст. |
3 |
6-12 |
|
СВ, л/мин |
3,1 |
4,0-8,0 |
|
СИ, л/мин/м2 |
2,1 |
2,5-4,0 |
|
ЛСС, дин х сек/см5 |
1081 |
<250 |
|
SО2 ЛА, % |
71,6 |
60-80 |
ОФП с ПГЕ1 (+)
Больная С., 28 лет
4,05 мМЕ/л, больная проконсультирована эндокринологом, рекомендованы продукты моря, йодированная соль, анализы гормонов щитовидной железы в динамике.
На основании комплекса неинвазивных методов обследования и данных катетеризации от 2000 г. у больной диагностирована: Первичная лёгочная гипертензия. Лёгочное сердце: относительная недостаточность трикуспидального клапана III ст. ФК III (ВОЗ). Аутоиммунный тиреоидит I ст., субклинический гипотиреоз. Антральный гастрит, ремиссия. Хронический некалькулезный холецистит.
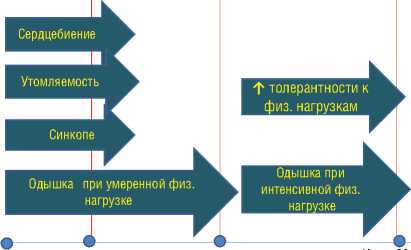
Пациенке была назначена терапия исрадипином 5 мг в комбинации с карведилолом 12,5 мг, а также ацетилсалициловая кислота 75 мг. В последующем пациентка 1–2 раза в год госпитализировалась в НИИ кардиологии, где проводилась коррекция терапии в виде замены исрадипина на амлодипин 5 мг, карведилола 12,5 мг на небивалол 2,5 мг. В ходе динамического наблюдения состояние оставалось стабильным, с 2002 г. пациентка отметила снижение толерантности к физическим нагрузкам, возобновление одышки при умеренных физических усилиях, сердцебиений, синкопе (рис. 7).
Рисунок 7. Клиническая симптоматика и лечение больной С.
Исрадипин 5мг →
Амлодипин 5мг
Карведилол 12,5мг →
Небиволол 2,5мг
Ацетилсалициловая к-та 75 мг
Амбризентан 10мг →
Амлодипин 5 мг →
Небиволол 2,5мг →
Ацетилсалициловая к - та
→ →→
→→
→ →→
75 мг →→
→→
→ →→
→→
→ →→
2002 2005 2007 Июнь 2014
33 года 35 лет 37 лет
28 лет
В связи с ухудшением самочувствия в 2005 г. больная поступила повторно в НИИ кардиологии, когда к терапии был добавлен селективный АРЭ в суточной дозе 5 мг в рамках международного многоцентрового исследования ARIES-2. В течение первых трёх месяцев в рамках РКИ больные рандомизировались на 3 группы для приёма 5 или 2,5 мг амбри-зентана или плацебо, соответственно, однократно в сутки [9]. Первичной конечной точкой явился прирост по сравнению с исходной дистанции в Т6МХ к 12 неделе лечения. Амбризен-тан в дозах 2,5, 5 и 10 мг получал 261 больной, плацебо – 132 пациента. Лечение амбризентаном сопровождалось существенным увеличением дистанции в Т6МХ. Причём позитивная динамика отмечалась через 4 недели терапии независимо от дозы амбризентана. К 4 неделе от начала наблюдения больные исключались из исследования при наличии следующих критериев: более чем 20% – снижение дистанции в тесте 6-минутной ходьбы (Т6МХ) по сравнению с исходной, увеличение ФК на 1 и больше, декомпенсация сердечной недостаточности (повышение центрального венозного давления, гепатомегалия, асцит, периферические отёки), прогрессирующая почечная или печёночная недостаточность, систолическое АД <85 мм рт. ст. К 12-й неделе лечения улучшение в Т6МХ имело дозозависимый характер: при лечении амбри-зентаном 2,5 мг (+31 м), 5 и 10 мг (+51 м). На фоне терапии стабилизировалось состояние больных ИЛГ, уменьшалась потребность в трансплантации, предсердной септостомии, госпитализациях по поводу прогрессирования ЛГ.
Пациенты, завершившие наблюдение в исследовании ARIES-1/2, а также досрочно прекратившие участие из группы плацебо, могли продолжить лечение амбризентаном в рамках длительного двойного слепого исследования с рандомизацией 1:1 [10]. Больная С., как стало известно, в течение всего периода наблюдения с 2005 г. принимала амбризентан в суточной дозе 5 мг с дальнейшей титрацией препарата в рамках продлённого исследования АRIES-Е до 10 мг. При этом признаков клинического ухудшения не отмечалось. Через 1 год терапии больная отметила повышение толерантности к физической нагрузке, одышка беспокоила лишь при чрезмерных физических напряжениях, что отразилось в уменьшении функционального класса больной по ВОЗ: с III до I.
В ранние сроки плацебоконтролируемого исследования у больной отмечались побочные эффекты амбризентана: эпизоды головных болей и заложенность носа, которые купировались самостоятельно через 1 месяц.
При повторной госпитализации в 2007 г. при поступлении пациентка предъявляла жалобы на одышку при интенсивной физической нагрузке. При поступлении: состояние относительно удовлетворительное. Кожные покровы чистые, физиологической окраски. Периферических отёков нет. Грудная клетка правильной формы, симметрично участвует в акте дыхания. Границы лёгких при перкуссии в пределах нормы. Частота дыхательных движений составила 18 в 1 мин. При аускуль тации лёгких дыхание с жёстким оттенком, проводится во все отделы, хрипы не выслушиваются. Область сердца визуально не изменена. Границы относительной сердечной тупости расширены вправо на 1 см. При аускультации сердца тоны ясные, ритм правильный. Частота сердечных сокращений составляет 80 уд/мин. Выслушивается акцент второго тона над лёгочной артерией, систолический шум над мечевидным отростком и по левому краю грудины. Артериальное давление 110/70 мм рт. ст. Живот мягкий, безболезненный при пальпации. Печень у края реберной дуги.
На ЭКГ от 2007 г. определялась патологическая правограм-ма, отмечалось уменьшение вольтажных характеристик зубцов R и S, свидетельствующее в пользу уменьшения степени гипертрофии правого желудочка, а также приближение сегмента ST в V2 к изолинии. По данным рентгенологического исследования в динамике отмечалось уменьшение коэффициента Мура с 36% по данным 2000 г. до 32%. За период наблюдения с 2005 по 2007 г. на фоне терапии амбризентаном, амлодипином и небивололом по данным ЭхоКГ отмечалось уменьшение переднезаднего размера правого желудочка с 3,6 до 3,1 см, толщины передней стенки правого желудочка с 0,8 до 0,4 см, СДЛА с 80 до 68 мм рт. ст.
При проведении теста 6-минутной ходьбы, при сравнении с результатами от 2005 г., достигнута положительная динамика в виде увеличения дистанции с 376 до 430 м (рис. 8). В динамике индекс по Боргу снизился с 3 до 1.
Рисунок 8. Динамика дистанции в тесте 6-минутной ходьбы
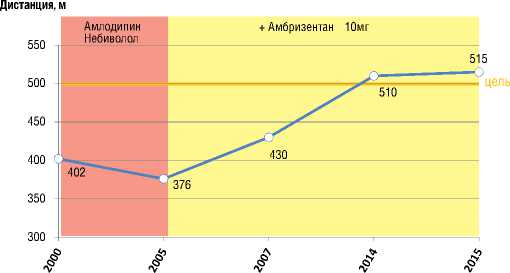
В дальнейшем больная продолжила принимать терапию амлодипином 5 мг, небивололом 2,5 мг, ацетилсалициловой кислотой 100 мг, амбризентаном 10 мг/сут. В связи с невозможностью контролировать международное нормализующее отношение по месту жительства от назначения варфарина было решено воздержаться. Как видно на рисунке 8, к 2015 г. наблюдался дальнейщий прирост дистанции в Т6МХ до 515 м при индексе одышки 1. Динамика данных ЭхоКГ и КПОС к 2015 г. представлена в таблицах 2 и 3.
По данным общего анализа крови за период наблюдения патологии не определялось. Уровень Д-димера находился в пределах нормальных значений.
По данным биохимического анализа крови за годы наблюдения отмечалось повышение уровня холестерина максимально до 6,9 ммоль/л в 2005 г. Повышенный исходно уровень BNP (до 415 пг/мл) нормализовался после 2005 г. (табл. 4).
По данным РКИ ARIES-2 у пациентов наблюдалось достоверное снижение уровней BNP в плазме крови в группах лечения амбризентаном в отличие от плацебо. Концентрации BNP существенно снизились по сравнению с исходными уровнями на 30% в группах 2,5 мг и 5 мг , на 45% – в группе 10 мг [9]. Напротив, в группах плацебо к неделе 12 наблюдения концентрации BNP несколько повысились.
Как и у нашей больной, в РКИ ARIES-2 ни у одного пациента не наблюдалось повышения уровня трансаминаз, превысившего 3-кратную границу нормы. Терапия амбризентаном характеризовалась хорошей переносимостью и низкой часто-
Таблица 2. Данные эхокардиографии больной С. в динамике
|
2000 |
2005 |
2014 |
2015 |
норма |
|
|
Ао,см |
2,5 |
2,9 |
2,9 |
2,9 |
2,0 – 3,7 |
|
ЛП,см |
2,7 |
3,1 |
3,0 |
3,2 |
2,0 – 4,0 |
|
КДР,см |
3,5 |
4,6 |
4,9 |
5,0 |
4,0 – 5,5 |
|
ФВ,% |
>60 |
>60 |
>60 |
>60 |
>60 |
|
ТМЖП,см |
0,8 |
0,7 |
0,9 |
0,9 |
0,7 – 1,1 |
|
ТЗСЛЖ,см |
0,8 |
0,8 |
0,9 |
0,9 |
0,7 – 1,1 |
|
ПЗР ПЖ, см |
4,0 |
3,6 |
3,0 |
3,0 |
до 3,2 |
|
ПП, см (апик.) |
4,7х4,5 |
4,2х4,3 |
4,4х3,3 |
4,0х3,3 |
>5,3 х 4,4см |
|
ТПС ПЖ, см |
0,9 |
0,7-0,8 |
0,4 |
0,4 |
до 0,5 |
|
СДЛА,мм рт.ст. |
130 |
80 |
55 |
52 |
до 25 |
|
Ст. ЛА, см |
3,1 |
3,0 |
2,8 |
2,4 |
до 2,5 |
|
Митральная регургитация, ст |
1 |
1 |
1 |
1 |
|
|
Трикуспидальная регургитация, ст |
3 |
2 |
1 |
1 |
Таблица 3. Данные катетеризации правых отделов сердца больной С.
|
2000г. |
2015г. |
Норма |
|
|
Давление ЛА, мм рт.ст. |
90/42/58 |
77/28/44 |
<25 (среднее) |
|
Давление ПП, мм рт.ст. |
6 |
2 |
2-6 |
|
Давление ПЖ, мм рт.ст. |
88/2 |
76/3 |
15-25/0-8 |
|
ДЗЛА, мм рт.ст. |
3 |
3 |
6-12 |
|
СВ, л/мин |
3,1 |
6,1 |
4,0-8,0 |
|
СИ, л/мин/м2 |
2,1 |
3,4 |
2,5-4,0 |
|
ЛСС, дин х сек/см5 |
1081 |
537 |
<250 |
|
SО2 ЛА, % |
71,6 |
79 |
60-80 |
Таблица 4. Данные биохимического анализа крови больной С.
Вероятный механизм повышения аминотрансфераз состоит в том, что АРЭ способны конкурировать с солями желчных кислот за общий транспортёр, называемый желчевыводящим насосом. Увеличение концентрации солей желчных кислот в клетках печени может сопровождаться их обратимым повреждением. В марте 2011 г. Администрацией по контролю качества продуктов питания и лекарственных средств (США) подтверждено, что при назначении амбризентана риск повышения трансаминаз крайне низкий, что позволило удалить из инструкции предостережение о необходимости регулярного контроля печёночных тестов [1]. Препарат не рекомендуется больным с тяжелым поражением печени, поскольку такие больные не включались в РКИ. По-прежнему, учитывая тератогенный эффект АРЭ, требуется ежемесячный контроль тестов на беременность у женщин в репродуктивном периоде.
В длительном исследовании ARIES-E оценивались результаты 3-летней терапии амбризентаном у больных, завершивших участие в РКИ ARIES-1/2 [10,11]. Первичной конечной точкой была оценка частоты и тяжести нежелательных явлений у больных с ЛАГ при длительном лечении амбризентаном. Вторичным конечными точками явилась оценка долгосрочной эффективности и выживаемости больных в результате проводимой терапии. Всего было включено 383 больных, ранее получавших амбризентан в установленных дозовых режимах, а также пациенты из групп плацебо, которые рандомизировались для приёма амбризентана 2,5 мг, 5 мг и 10 мг в соотношении 1:1:1. Лечение больных в первые 24 недели наблюдения осуществлялось в фиксированной дозе, затем допускалось титрование дозы при необходимости в рамках двойного слепого исследования. Допускалась сопутствующая терапия простаноидами и ИФДЭ-5. Эффективность лечения оценивалась на основании оценки динамики дистанции в Т6МХ, индекса одышки по Боргу, ФК, выживаемости, влияния терапии на время до развития клинического ухудшения. В результате терапии амбризентаном у больных достигалось значительное улучшение толерантности к физическим нагрузкам с приростом дистанции в Т6МХ на 28 м при назначении 5 мг и 37 м – 10мг через 12 месяцев от начала терапии. Ко 2 году лечения благоприятные эффекты терапии сохранялись (+23 м и +28 м при назначении амбризентана в дозах 5 и 10 мг, соответственно). Если к 1 году наблюдения у больных сохранялся прирост дистанции в Т6МХ во всех дозовых группах амбризентана, то ко 2 и 3 году лечения стабильный эффект сохранялся только у больных, получавших 5 и 10 мг амбризентана [11].
При анализе выживаемости больных с ЛАГ 1-, 2-, 3-летняя выживаемость на фоне терапии амбризентаном составила 91%, 82% и 79% [12]. Результаты лечения не различались при разделении больных на три группы в зависимости от дозы амбризентана. Кривые выживаемости были сходны при анализе прогноза у больных с различными формами ЛАГ: при ИЛГ (96% через 1 год и 89% через 2 года), при ЛАГ вследствие системных заболеваний соединительной ткани – 91% через 1 год и 83% через 2 года.
Клиническим ухудшением у больных в долгосрочном наблюдении считалась также потребность в присоединении терапии простаноидами. Наиболее частыми причинами клинического ухудшения были следующие: госпитализация вследствие ухудшения ЛАГ (n=76), смерть (n=42) и потребность в дополнительной терапии простаноидами (n=34) [12]. В общей группе больных с ЛАГ отсутствие клинического ухудшения через 1, 2 и 3 года от начала наблюдения соответственно наблюдалось у 83%, 71% и 64% пациентов.
При регулярном мониторинге печёночных трансаминаз в течение 2 лет терапии у 999 больных в исследовании VOLT (VOLibris Tracking) не наблюдалось тревожных наблюдений. Риск более чем 3-кратного повышения трансаминаз на фоне терапии амбризентаном составил 1,8% при 1-годичном и 3,9% при 2-летнем лечении [13].
В заключение следует отметить, что блокада эффектов ЭТ-1 с помощью АРЭ неселективного и селективного действия обеспечивает высокую клиническую эффективность и хорошую переносимость при ИЛГ и ЛАГ. Основные различия препаратов из класса АРЭ связаны не столько с их селективностью в отношении рецепторов ЭТ-1, сколько с фармакологическими характеристиками, особенностями метаболизма, лекарственных взаимодействий, кратности приёма, частоты побочных эффектов. Амбризентан существенно улучшает толерантность к физическим нагрузкам, снижает риск ухудшения ЛАГ с усугублением ФК, развитием клинического ухудшения, способствует значительному улучшению выживаемости пациентов. В отличие от бозентана амбризентан обладает целым рядом важных преимуществ, уникальным спектром фармакологических и фармакокинетических характеристик. Во-первых, это однократный приём в сутки, что обеспечивает удобство приёма и повышает приверженность пациентов к лечению. Во-вторых, отличный профиль переносимости с возможностью инициации терапии у больных с начальным нарушением функции печени, а также отсутствие потребности в ежемесячном мониторинге печёночных тестов. Наконец, если при назначении бозентана важно учитывать взаимодействия с целым рядом лекарственных препаратов, включая применяемые для лечения ЛАГ, то амбризентан противопоказан при применении циклоспорина А и рифампицина. Представленный клинический случай больной с ИЛГ демонстрирует, что современная ЛАГ-специфическая терапия позволяет достигать наилучших результатов лечения, он является яркой демонстрацией того, что успех лечения амбризентаном не ускользает, а сохраняется на протяжении многих лет.
Список литературы Клинический случай 10-летнего успешного применения амбризентана у пациентки с идиопатической лёгочной гипертензией
- Чазова И.Е., Авдеев С.Н., Царева Н.А. и др. Клинические рекомендации по диагностики и лечению лёгочной гипертензии. Терапевтический архив 2014;86(9):4-23
- Galie N., Hoeper M.M., Humbert M. et al. ESC Committee for Practice Guidelines. Guidelines for the diagnosis and treatment of pulmonary hypertension: The Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS)., endorsed by the International Society of Heart and Lung Transplantation (ISHLT). Eur Heart J 2009;30:2493-2537
- Archer S.L., Weir E.K., Wilkins M.R. Basic science of pulmonary arterial hypertension for clinicians: new concepts and experimental therapies. Circulation 2010; 121: 2045-2066
- D’Alonzo G.E., Barst R.J., Ayres S.M., et al. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry. Ann. Intern. Med. 1991; 115:343-349
- Dupuis J., Hoeper M.M. Endothelin receptor antagonists in pulmonary arterial hypertension. Eur Respir J 2008; 31: 407-415
- Galie N., Manes A., Branzi A. The endothelin system in pulmonary hypertension. Cardiovasc Res 2004; 61:227-237.
- Ito H., Hirata Y., Hiroe M., et al. Endothelin-1 induces hypertrophy with enhanced expression of muscle-specific genes in cultured neonatal rat cardiomyocytes. Circ Res 1991; 69:209-215.
- Stewart D.J., Levy R.D., Cernacek P. Increased plasma endothelin-1 in primary pulmonary hypertension: marker or mediator of disease? Ann Intern Med 1991;114:464-469.
- Olschewski H., Galie N., Ghofrani H et al. Ambrisentan improves exercise capacity and time to clinical worsening in patients with pulmonary arterial hypertension: Results of the ARIES-2 study. Proc Am Thorac Soc 2006;3:A728.
- Cheng J.W. Ambrisentan for the Management of Pulmonary Arterial Hypertension. Clinical Therapeutics 2008; Vol. 30 (5):825-832.
- Oudiz R., Badesch D., Rubin L. ARIES-E: Long-term safety and efficacy of ambrisentan in pulmonary arterial hypertension. Chest 2007;132:474a.
- Elshaboury S.M., Anderson J.R. Ambrisentan for the treatment of pulmonary arterial hypertension: improving outcomes. Patient Preference and Adherence 2013;7:401-409.
- Vachiéry J.L., Hoeper M.M., Paruchuru P., et al. Pulmonary Arterial Hypertension in a Contemporary Drug Registry: The VOLT study. 3d SSWC., 2014. poster 191.


