Клинический случай чрескожной чреспеченочной внутрипортальной трансплантации больному циррозом печени аутологических костномозговых мультипотентных мезенхимальных стволовых клеток
Автор: Агаев Р.М., Попандопуло А.Г., Джафарли Р.Э.
Журнал: Академический журнал Западной Сибири @ajws
Рубрика: Хирургия. Онкология
Статья в выпуске: 6 (55) т.10, 2014 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/140221578
IDR: 140221578
Текст статьи Клинический случай чрескожной чреспеченочной внутрипортальной трансплантации больному циррозом печени аутологических костномозговых мультипотентных мезенхимальных стволовых клеток
В настоящее время все большее внимание исследователей уделяется поиску более эффективных и доступных способов лечения больных циррозом печени (ЦП) [2, 3]. Вышеуказанное обстоятельство в первую очередь объясняется тенденцией к росту числа больных указанной патологией, а также неблагоприятными результатами лечения, вследствие прогрессирования заболевания и высоким процентом летального исхода [3]. В последние годы увеличилось работ, посвященных использованию для трансплантации в печень стволовых клеток [1, 4-6].
Международный центр клеточного культивирования Донецкого института неотложной и восстановительной хирургии им. В.К. Гусака (НАМН Украины) имеет опыт различных способов трансплантации стволовых клеток при лечении ряда болезней, в том числе и при ЦП.
Ниже мы приводим результаты трансплантации аутологических мезенхимальных мультипотентных стволовых клеток (АММСК) в печень посредством воротной вены путем чрескожной чреспеченочной катетеризации последней под контролем УЗИ больному ЦП.
Пациент В.Д.С. в возрасте 52 лет, поступил в хирургическое отделение Донецкого института неотложной и восстановительной хирургии им. В.К. Гусака (НАМН Украины) по поводу острого желудочно-кишечного кровотечения.
При поступлении его в клинику отмечались жалобы на общую слабость, недомогание, быструю утомляемость, вздутие живота, кровавую рвоту.
Объективно: состояние оценивалось больной тяжелое. Кожные покровы и склеры бледные, слегка иктеричные. Живот в правом подреберье и в эпигастрии слегка болезнен при пальпации. Печень увеличена. Отмечается спленомегалия. Гемодинамика нестабильная. АД – 80/55 мм рт. ст., пульс – 100 ударов в минуту. Тоны сердца приглушены. Аускультативно над легкими выслушивается везикулярное дыхание, ослабленное в нижних отделах.
Анализы при поступлении: Нв – 66 г/л; Эр – 2,7ˣ1012/л, тромбоциты – 150ˣ109/л, лейкоциты – 5,6ˣ109/л; СОЭ – 56 мм/час, общий белок – 76 г/л; альбумин – 28 г/л; общий билирубин – 36 мкмоль/л; АлАТ – 136; АсАТ – 185; глюкоза крови – 3,5 ммоль/л.
Заражение вирусными гепатитами не выявлено.
При УЗИ брюшной полости: печень +2 см, структура неоднородная, диффузно изменена. Селезенка увеличена. Воротная вена – 1,2 см, воротный кровоток 420 мл/мин, асцит в брюшной полости незначителен.
Во время ЭГДС причиной возникновения желудочно-кишечного кровотечения явились ВРВПЖ III степени. Клипированием последних удалось остановить кровотечение.
Тяжесть цирротического поражения печени оценивалась критериями Child-Pugh [6]. У больного был определен функциональный класс «В».
Больному проведенные интенсивные лечебнопрофилактические мероприятия, направленные на предупреждение повторного развития кровотечения, улучшение функциональной способности печени, почек оказались эффективными и пациент через неделю в удовлетворительном состоянии выписан.
Через месяц больной вновь обратился в стационар, где ему после повторного исследования был осуществлен забор костного мозга для проведения трансплантации в печень АММСК.
Культуру АММСК человека предварительно выделяли из костного мозга, полученного при пункции крыла подвздошной кости (за 2 месяца до трансплантации АММСК). Аспират костного мозга разбавляли раствором Хэнкса («Биолот», Россия) в соотношении 1:2/5. В центрифужные пробирки емкостью 50 мл наливали градиент плотности Histopaque 1077 (Sigma, США) из расчёта 1 мл градиента на 1 мл костного мозга. Аккуратно наслаивали разбавленный костный мозг на градиент. Затем центрифугировали пробирку при комнатной температуре в режиме 1800-2000 об/мин. в течение 30-40 минут. Собирали клетки интерфазы, содержащей МСК, в центрифужную пробирку объемом 15 мл с небольшим количеством раствора Хэнкса и ресуспендировали взвесь. Центрифугировали пробирку при 800-1000 об/мин. в течение 8-10 минут. Сливали надосадок, ресуспендировали осадок в растворе Хэнкса и дважды повторяли центрифугирование. Затем осадок смешивали с ростовой средой, содержащей DMEM/F12 (Sigma, США), 20% ЭТС («Биолот», Россия) и митогены. После этого взвесь высеивали на пластиковые флаконы площадью 75 см2 (Nuclon, США) плотностью 1-2*105/см2 и помещали их в углекислотный инкубатор на 3 суток (370С; 5% СО 2 ). Затем меняли среду, параллельно удаляя не прикрепившиеся (гемопоэтические) клетки. В последующем замену среды осуществляли каждые 2 дня [3].
Для идентификации и характеристики клеточных линий мезенхимальных стволовых клеток учитывали основные критерии, рекомендованные Международным обществом клеточных технологий (ISCT) в 2006 году, которые использованы в нашей работе [3].
Срок культивации АММСК составило 42 дня.
Предварительно пациент был ознакомлен о планируемой методике трансплантации, возможными побочными эффектами, осложнениями и о применяемых технологиях. В последующем согласие пациента подтверждалось в письменной форме.
Биопсию бессосудистой зоны печени проводили под контролем УЗИ местной анестезией. Использовали иглы типа monojekt ABC (Sherwood Medical).
Пациенту в стационаре в условиях операционной местной анестезией была осуществлена чрескожная, чреспеченочная катетеризация воротной вены с последующей трансплантация в нее культивируемых ранее АММСК.
Для изучения эффективности лечения мы через 2 месяца после внутрипортальной трансплантации
АММСК произвели сравнительные общеклинические, а также лабораторно-инструментальные исследования.
Для изучения влияния различных способов трансплантации АММСК на морфологическое состояние печени мы до, а также через 2 месяца после начала лечения в стационарных условиях осуществляли пункционную биопсию печени.
Полученные результаты показали, что через 8 недель отмечалось значительное улучшение общего состояния пациента.
Жалобы, связанные с общей слабостью, быстрой утомляемостью, недомоганием уменьшились.
Объективно: кожные слегка иктеричны. При пальпации поверхность печени плотная и бугристая. При УЗИ брюшной полости асцита не было. Размеры печени были практически прежними. Воротная вена не расширена, кровоток 380 мл/мин. Селезенка увеличена.
Лабораторные показатели: НЬ – 108 г/л; Эр. – 3,2ˣ1012/л, тромбоциты – 170ˣ109/л, лейкоциты – 4,2ˣ109/л; СОЭ – 32 мм/час; общий белок – 78 г/л; альбумин – 26 г/л; билирубин – 28 мкмоль/л; АЛТ – 72; ACT – 86; сахар – 4,5 ммоль/л.
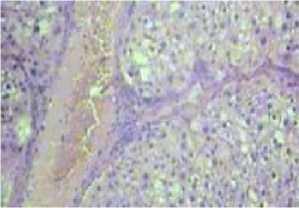
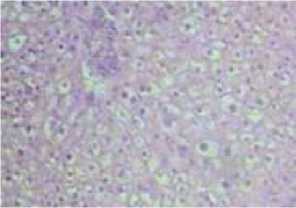
В результате гистоморфологических исследований, проведенных у исследуемых больных до начала лечения были выявлены характерные признаки выраженного дистрофического поражения печени. На таком тяжелом патофизиологическом фоне дистрофия гепатоцитов практически сводила к минимуму их способность к регенерации. До начала лечения микроскопическая картина печени характеризовалась резко выраженным нарушением цитоархитектоники и потерей балочной структуры печеночных долек. Разросшаяся соединительная ткань в виде прослоек окружают ложные дольки, где нет центральных вен (рис. 1А). Формированные множественные узелки состоят из гепатоцитов, которые в одних случаях представлены крупными, а в других уменьшенными пикнотическими ядрами. Исследования выявили также наличие выраженных дистрофических и некробиотических нарушений в последних. В некоторых случаях в единичном порядке обнаруживались двухъядерные гепатоциты. Это оценивалось нами как результат гидропического перерождения гепатоцитов. В поле зрения часто обнаруживались густая лимфо-гистиоцитарная инфильтрация множества порто-портальных, а также порто-центральных септ (рис. 1Б). Обращало на себя внимание расположение центральной вены в области разросшейся соединительной ткани. Такое расположение было характерным для следа деструкции части печеночной дольки. Обращал на себя внимание обширный склероз синусоидных капилляров, что также является характерным для цирротического поражения печени (рис. 1А).
А
Б
Рис. 1. Гистоморфологическая картина печени. Макропрепарат печени (А – признаки лейкоцитарной инфильтрации; Б – отмечается гидропическая дистрофия и гиперхроматоз ядер гепатоцитов с лейкоцитарной их инфильтрацией. Окраска гематоксилином и эозином. Увеличение 160).
У этого же больного к концу 2 месяца после трансплантации в воротную вену АММСК в ткани печени на фоне уменьшения соединительнотканных элементов печеночная структура приобретала мелкодольчатый характер (рис. 2). Сравнительное уменьшение интенсивности соединительной ткани происходило за счет регенерации гепатоцитов в периваскулярной зоне портальных венул, за счет чего и отмечалась определенная нормализация цитоархитектоники печени.
На рисунке 2 можно обнаружить и уменьшение лимфоцитарно-гистиоцитарной инфильтрации пе-рипортальных триад в сравнении с исходной картиной исследуемой биопсии. Регенерирующие гепатоциты в большей своей части были гипертрофированы, и в которых отсутствовали явления жировой дистрофии.
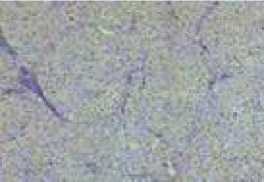
Рис. 2. Мелкодольчатая структура паренхимы печени с сравнительно уменьшенной междольковой соединительной тканью. Окраска по Ван Гизон. Увеличение 70.
Таким образом, в результате проведенных исследований было установлено, что интрапортальная трансплантация АММСК способствует восстановлению структуры печеночной ткани, за счет их вживления и стимуляции регенерации в периваскулярном пространстве печеночной паренхимы. Усиление репаративных же процессов по нашему мнению также было связано за счет активизации пролиферации и гипертрофии гепатоцитов пораженной паренхимы печени паракринными фукнциями пересаженных стволовых клеток.
Вышеуказанные данные показывают высокую информативность и необходимость проведения гистологического исследования для изучения эффективности лечения больных ЦП.
Анализ этих наблюдений привел нас к выводу о том, что при трансплантации в печень АММСК является эффективной для улучшения морфофункционального состояния печени и характера ее гемодинамики. В приведенных наблюдениях имела место субкомпенсация заболевания, с нерезким снижением воротного и артериального кровообращения в печени.
Список литературы Клинический случай чрескожной чреспеченочной внутрипортальной трансплантации больному циррозом печени аутологических костномозговых мультипотентных мезенхимальных стволовых клеток
- Агаев Б.А., Агаев Р.М., Попандопуло А.Г. клиническая эффективность трансплантации аутологических мезенхимальных мультипотентных стволовых клеток в лечении больных циррозом печени и портальной гипертензией//Georgian medical news. -2014. -№ 9. -C. 39-44.
- Буеверов А.О., Ивашкин В.Т., Маевская М.В. Алкогольная болезнь печени//Русский медицинский журнал. -2001. -№ 2. -C. 34-36.
- Ardizzone G., Arrigo A., Schellino M.M. et al. Neurological complications of liver cirrhosis and orthotopic liver transplant//Transplant. Proc. -2006. -Vol. 38, № 3. -P. 789-792.
- Esch J.S., Knoefel W.T., Klein M. et al. Portal application of autologous CD133+ bone marrow cells to the liver: a novel concept to support hepatic regeneration//Stem Cells. -2005. -Vol. 23, № 4. -Р. 463-470.
- Fujii H., Hirose T., Oe S. et al. Contribution of bone marrow cells to liver regeneration after partial hepatectomy in mice//J. Hepatol. -2002. -Vol. 36, № 5. -Р. 653-659.
- Gasbarrini A., Rapaccini G.L., Rutella S. et al. Rescue therapy by portal infusion of autologous stem cells in a case of drug-induced hepatitis//Dig. Liver Dis. -2007. -№ 39. -С. 878-882.


