Клинический случай острого тромбоза вен у футболиста с наследственной предрасположенностью в условиях жаркого влажного климата
Автор: Постников П.В., Павлов В.И., Пронина И.В., Орджоникидзе З.Г., Бадтиева В.А.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Восстановительная и спортивная медицина
Статья в выпуске: 2 т.25, 2025 года.
Бесплатный доступ
Цель: определить генетические предпосылки клинического случая окклюзионного тромбоза правых подключичной и подмышечной вен.
Синдром педжета-фон шреттера, тромбоз вен верхних конечностей, полиморфные маркеры тромбофилии, неблагоприятные климатические условия
Короткий адрес: https://sciup.org/147251200
IDR: 147251200 | УДК: 575.22, | DOI: 10.14529/hsm250222
Текст научной статьи Клинический случай острого тромбоза вен у футболиста с наследственной предрасположенностью в условиях жаркого влажного климата
P.V. Postnikov1, ,
V.I. Pavlov2, ,
I.V. Pronina1,3, ,
Z.G. Ordzhonikidze2, ,
V.A. Badtieva2, ,
Введение. Синдром Пэджета – фон Шрет-тера представляет собой тромбоз глубоких вен подключично-подмышечного русла, чаще всего возникающий ввиду физического усилия или нагрузки. Существует несколько гипотез, объясняющих причины развития патологии, – травматическая, инфекционная и нейрогенная. Исходя из травматической гипотезы, повреждение внутренней оболочки глубоких вен вследствие нагрузки приводит к формированию тромба в участке повреждения [11, 17, 19]. Также возможными причинами синдрома выступают резкий подъем венозного давления по причине внезапного сокращения мышц [19], сдавление подключичной вены из-за сужения щели между первым ребром и ключичной костью [7, 8]. Обнаружение сужения подключичной вены при наличии шейных узлов симпатического ствола привело к развитию нейрогенной гипотезы, основным постулатом которой является присутствие в перивенозных мягких тканях патологического очага раздражения, приводящего к вазомоторным нарушениям [23].
Несмотря на то, что анатомотопографические особенности вен подключично-подмышечного русла имеют основополагающее значение при патогенезе синдрома Пэджета – фон Шреттера, важную роль в его этиологии играют мутации факторов свертывания крови. Наиболее часто встречаются генетические аномалии фактора V Лейдена, мутация гена протромбина (например, G20210A), а также дефицит белков C и S [16]. В литературе описаны случаи влияния точечных мутаций в гене фактора свертывания VII [12, 14], гене SERPINE1 ингибитора активатора плазминогена (PAI-1) [22] на риск возникновения тромбоза. Помимо этого, важно учитывать наследуемые дефекты тромбоцитов, влияющие на свертывание крови. Приводятся данные о полиморфизмах в гене GP1BA, отвечающем за продукцию тромбоцитарного гликопротеина GP1b [2], ITGB3 тромбоцитарного рецептора фибриногена [2], приводящего к повышенному риску тромбозов, а также повышенной агрегации тромбоцитов, ассоциированной с мутацией JAK2 [21]. Часто наследственная предрасположенность к тромбофилиям и тромбозам остается клинически незаметной, пока не влияет какой-либо дополнительный фактор, например, климатический.
В статье приведен случай тромбоза правых подключичной и подмышечных вен у футболиста с гетерозиготной точечной мутацией гена SERPINE1 (PAI-1), гомозиготной мутацией гена фактора свертывания VII F7 и гетерозиготной точечной мутацией гена GP1BA, сопровождаемого отеком, набуханием мышц и болью после тренировочной и соревновательной нагрузки в условиях жаркого влажного климата.
Материалы и методы. Диагноз тромбоза подключичной и подмышечных вен был поставлен на основании ультразвукового сканирования. Определение гематологических параметров выполнено на анализаторе Sysmex XN-1000 согласно руководству пользователя. Кровь для исследований отбирали в пробирки Vacutainer с К2ЭДТА. Измерение показателей коагулограммы проводили на автоматическом коагулометре Sysmex CS-2000 при помощи соответствующих наборов и инструкций к ним. Для коагулогических исследований кровь отбирали в пробирки Vacutainer, содержащие цитрат натрия 3,2 %.
Для исследования вариантов генов F2, F5, F7, FGB, SERPINE1 и GP1BA, ITGB3, JAK2, SELPLG применяли метод пиросеквенирования с использованием готовых коммерческих панелей «Плазмо-скрин» для исследования плазменных факторов системы свертываемости крови и «Тромбо-скрин» – для исследования агрегационных факторов свертываемости крови, разработанных на базе Национального агентства клинической фармакологии и фармации (НАКФФ) National Agency for Clinical Pharmacology and Pharmacy (NACPP). Для отбора образцов цельной крови использовали пробирки типа Vacutainer, содержащие К2ЭДТА.
Результаты. 20-летний футболист (рост 190 см, вес 90 кг), голкипер, входит в основной состав команды. Продолжительность нескольких тренировочных игр с его участием составила примерно 120 мин при температуре 32–33 °С и влажности воздуха 94 %. Спустя 4 дня после игры обратился с жалобами на острую боль, отёк и набухание мышц в области подмышечной впадины и был госпитализирован.
Клинический анализ крови при поступлении: гемоглобин (HGB) – 150 г/л, эритроциты (RBC) – 5,4 ⋅ 1012/л, гематокрит (HCT) – 45,4 %; лейкоциты (WBC) – 9,8 ⋅ 109/л; лимфоциты – 2,7 ⋅ 109/л; моноциты – 0,5 тыс./мкл; гранулоциты – 6,6 ⋅ 109/л; нормобласты (NRBC) – 0 тыс./мкл; средний объем эритроцита (MPV) – 7,2 фл; анизотропия эритроцитов (RDW) – 14,0 %; тромбоциты (PLT) – 2376 ⋅ 109/л; среднее содержание гемоглобина (MCH) – 27,5 пг; средняя концентрация гемоглобина в эритроците (MCHC) – 330 г/л; средний объем эритроцита (MCV) – 83,0 фл; ширина распределения тромбоцитов (PDW) – 13,0 фл. Скорость оседания эритроцитов – 5 мм/ч.
Показатели коагулограммы: международное нормальзованное отношение (МНО) 1,13; протромбиновый индекс 89 %; активированное частичное тромбопластиновое время (АЧТВ) 90,6 с.
При ультразвуковом сканировании глубоких вен левой верхней конечности нарушений проходимости сосудов не выявлено на всем протяжении кровотока. При исследовании глубоких вен правой верхней конечности (рис. 1А) нарушений проходимости до верхней трети плеча не выявлено, хотя кровоток замедлен, в верхней трети плеча наблюдаются окклюзионные тромбозы (рис. 1B). Подмышечная и подключичная вены справа тотально тромбированы и окклюзированы (см. рис. 1B).
В результате был поставлен диагноз – окклюзионный тромбоз правых подмышечной и подключичной вен. Больному проведен курс консервативной терапии, включая антикоагулянтную (ривароксабан (Ксарелто) по 15 мг 2 раза в день в течение 14 дней, затем – по 20 мг в течение 6 мес.) с положительным эффектом. На 5-й день терапии отек правой верхней конечности регрессировал, боли не беспокоят. По данным контрольного ультразвукового исследования уровень тромбоза не нарастает. Рекомендовано ношение компрессионного рукава (2-й класс компрессии), ограничение физической нагрузки сроком на 2 месяца, анализ крови на генетическую предрасположенность к тромбофилии.
Согласно рекомендациям, спортсмену было проведено исследование генов факторов свертывания крови с целью выявления
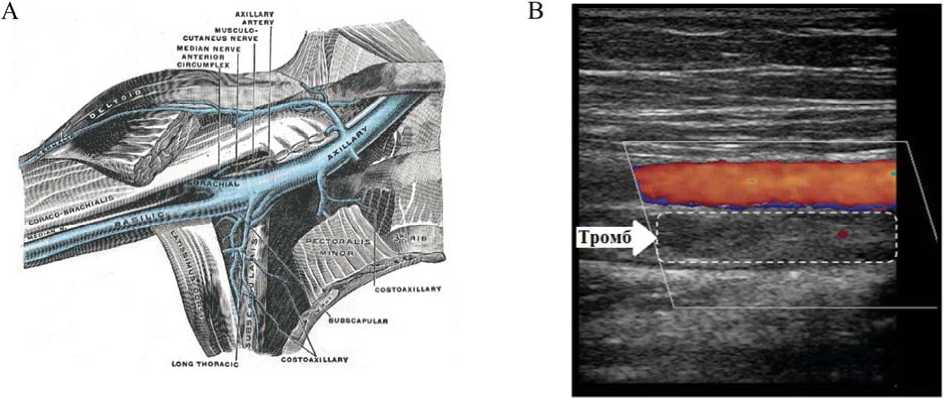
Рис. 1. Расположение подключичной и подмышечной вен (А – рисунок заимствован из открытых источников: By Henry Vandyke Carter – Henry Gray (1918) Anatomy of the Human Body)1; В – фотография изображения ультразвукового сканера с отмеченным тромбом (получена авторами)
Fig. 1. Anatomical localization of axillary-subclavian venous occlusion (A – adapted from Henry Vandyke Carter – Henry Gray (1918) Anatomy of the Human Body)1; B – ultrasonographic image demonstrating thrombotic occlusion (original data)
Таблица 1
Table 1
Профиль генетического исследования спортсмена
«Плазменные факторы системы свертывания крови» («ПЛАЗМО-скрин»), предназначенный для выявления полиморфизмов в генах, кодирующих плазменные факторы системы свертывания крови
Genetic polymorphisms analyzed by the PLASMO-screen: profiling plasma coagulation factor genes
|
Ген Gene |
Белок, кодируемый геном Protein |
Полиморфизм Polymorphism |
Аллель риска Risk allele |
Результат пациента Patient’s result |
Комментарий Comment |
|
F2 |
Протромбин Prothrombin |
20210 G>A, rs1799963 |
A |
G/G |
Гомозигота по дикому типу Wild-type homozygote |
|
F5 |
Фактор Лейдена Factor V Leiden |
R534Q G>A, rs6025 |
A |
G/G |
Гомозигота по дикому типу Wild-type homozygote |
|
F7 |
Коагуляционный фактор VII Coagulation factor VII |
R353Q G>A, rs6046 |
G |
G/A |
Гетерозигота Heterozygote |
|
FGB |
Фибриноген Fibrinogen |
455 G>A, rs1800790 |
A |
G/G |
Гомозигота по дикому типу Wild-type homozygote |
|
SERPINE1 |
Ингибитор активатора плазминогена Plasminogen activator inhibitor |
–675 5G>4G, rs1799768 |
4G |
4G/4G |
Гомозигота по аллелю риска Risk allele homozygote |
-
1 See " Book" section below)Bartleby.com: Gray's Anatomy, Plate 576, Public Domain. URL: https:// commons.wikimedia.org/w/index.php?curid=538673 (дата обращения 30.07.2024 г.).
Таблица 2
Table 2 Профиль генетического исследования спортсмена
«Агрегационные факторы системы свертывания крови» («ТРОМБО-скрин»), предназначенный для выявления полиморфизмов в генах, кодирующих агрегационные факторы системы свертывания крови, связанные с функционированием тромбоцитов
THROMBO-screen genetic panel: analysis of polymorphisms in genes encoding platelet aggregation factors
Ингибитор активатора плазминогена-1 (PAI-1) является одним из основных регуляторных компонентов антисвертывающей системы крови. Полиморфизм 4G(-675)5G (rs1799768) представляет собой мутацию, приводящую к увеличению активности гена (аллель риска 4G). При этом происходит увеличение скорости адгезии тромбоцитов и одновременно блокировка фибринолиза, что приводит к повышенному риску тромбозов вследствие гиперагрегации тромбоцитов [20]. У гомозиготных носителей мутации выявлена резистентность к терапии аспирином, а также повышенный риск тромбозов, сосудистых патологий и инфаркта миокарда [4, 6].
Ген GP1BA кодирует аминокислотную последовательность 1β-субъединицы тромбоцитарного гликопротеина, за счет которого происходит взаимодействие тромбоцитов с повреждённой сосудистой стенкой и образование конгломерата. Наличие в гене GP1BA полиморфизма T145M C>T характеризуется повышенной агрегацией тромбоцитов, последнее особенно актуально для пораженных атеросклерозом сосудов [5]. Риск тромбоза
коронарных сосудов у носителей аллеля Т возрастает в 3,5 раза по сравнению с обладателями генотипа дикого типа [5].
Выявление у спортсмена нескольких генетических факторов риска развития тромбозов актуально не только для самого спортсмена, но и для врача клуба, за который выступает спортсмен, и тренерского штаба в планировании тренировочного процесса, участия в соревнованиях и отслеживании состояния здоровья спортсмена.
Заключение. Генетическое обследование выявило высокий риск тромбоза и связанных с ним осложнений, обусловленных повышенной активностью плазменных факторов свертывания крови у футболиста. Генетическая предрасположенность к повышенной свертываемости крови может привести к тромбозу с симптомами, схожими с травмой и ее последствиями (отек, боль и т. д.), что требует дифференциальной диагностики. У спортсмена с тромбофилией особое внимание следует уделять профилактике смертельно опасных тромбоэмболических осложнений во время тренировочного процесса и соревнований в неблагоприятных условиях внешней среды.


