Клинический случай развития острого инфаркта миокарда при микрососудистой стенокардии
Автор: Минюк Ю. И., Салиева Е. В., Тамоян З. С., Урманова Ю. Р., Таипова Л. У., Хасанов А. Х.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Клинический случай
Статья в выпуске: 1, 2020 года.
Бесплатный доступ
Цель работы. Описать клинический случай коронарной отягощенности без стенозирующего поражения магистральных ветвей венечных артерий у больного микрососудистой стенокардией с последующим развитием инфаркта миокарда с формированием ишемического гипокинеза передневерхушечной области левого желудочка при отсутствии повышенных уровней сывороточных маркеров некроза миокарда.Материалы и методы. За основу исследования взят единичный клинический случай. Объектом исследования является пациент, у которого были жалобы на давящие боли с локализацией за грудиной и иррадиацией в левую руку, сопровождающиеся смешанной одышкой, возникшие в покое, слабо купирующиеся короткодействующими нитратами и наркотическими анальгетиками, общей резкой слабостью. При первичном осмотре состояние больного средней степени тяжести, сознание ясное, положение активное, кожные покровы и видимые слизистые чистые, обычной окраски. Больному была проведена оценка лабораторных показателей, ЭКГ, эхо-кардиография (ЭХО-КГ), рентгенография органов грудной клетки (ОГК), коронароангиография (КАГ) с последующим переводом в отделение неотложной кардиологии.Результаты...
Микрососудистая стенокардия, микрососудистая дисфункция, коронарный синдром, коронарная артерия, коагуляционная нестабильность системы гемостаза
Короткий адрес: https://sciup.org/143171847
IDR: 143171847 | DOI: 10.24411/2076-4766-2020-10006
Текст научной статьи Клинический случай развития острого инфаркта миокарда при микрососудистой стенокардии
Наиболее распространенной причиной развития ИБС и, соответственно, ишемии миокарда считается коронарный атеросклероз с различной степенью обструкции, вплоть до окклюзий, питающих миокард сосудов, имеющий грозные осложнения (коронарный тромбоз, сердечная недостаточность, внезапная смерть). Тем не менее, по разным данным, примерно у половины пациентов со стабильной стенокардией, которым проводится диагностическая коронарная ангиография (КАГ), и у 10–20% пациентов с острым коронарным синдромом выявляются неизмененные или малоизмененные (менее 50% сужения просвета сосуда) коронарные артерии [1-4].
В одном из исследований у 44,5% из 925 пациентов, направленных на плановую диагностическую КАГ, были выявлены неизмененные или малоизмененные коронарные артерии [1, 4]. Согласно данным W.L. Proudfit et al., у 20% пациентов, которым была выполнена КАГ при болях в груди, обнаруживались нормальные коронарные артерии [1, 5]. Еще в одном исследовании у 14,6% пациентов, которым была выполнена КАГ при наличии болевого синдрома в груди и подозрении на поражение коронарных артерий, также не было выявлено их изменений [1, 6]. Следует отметить, что у пациентов с болями в груди и без предварительного установления ишемии миокарда обнаруженные при КАГ неизмененные коронарные артерии исключают диагноз микрососудистой стенокардии (МСС), а само инвазивное обследование может оказаться малообоснованным в отсутствие других данных и факторов риска.
Указанное состояние впервые было описано примерно 40 лет назад H.G. Kemp et al. и получило название «кардиальный синдром Х» (КСХ) [1, 7]. Наряду с этим термином в последующем использовались и многие другие определения, такие как синдром Х, болезнь малых сосудов, стенокардия с поражением сосудов малого диаметра, синдром Джорлина–Лайкоффа, необструктивная болезнь коронарных артерий, а в последние годы наибольшее распространение получил термин МСС. Следует напомнить, что термин МСС был первоначально предложен R.O. Cannon, S.E. Epstein еще в 1988 г. для обозначения миокардиальной ишемии, возникшей не вследствие обструктивных изменений коронарного русла, а в связи с микрососудистыми аномалиями [1, 8]. В российских и европейских рекомендациях по стабильной ИБС предлагается в подобных случаях использовать термин МСС [1, 2, 9], который и употребляется наиболее часто в последнее время, в том числе в клинической практике. Его популяризация, возможно, связана еще и с тем, что у многих из таких пациентов клинические симптомы могут быть, как предполагают эксперты, следствием микрососудистой дисфункции (МСД) коронарного русла, которая чаще всего и описывается в указанных случаях [10-12].
Также предполагается, что МСС может возникать в результате функциональной или структурной дисфункции коронарной микроциркуляции при специфических заболеваниях сердца и сосудов, например, при кардиомиопатии, сочетаться с ИБС на фоне коронарного атеросклероза (рис.1) или при системных заболеваниях, например, в связи с аутоиммунными заболеваниями, коллагеновыми заболеваниями, артериальной гипертонией, и в таких случаях она определяется как вторичная МСС [13-15]. Однако в большинстве случаев MСС развивается вследствие изолированной коронарной МСД, которая является единственным или преобладающим механизмом, ответственным за возникновение эпизодов стенокардии или ишемии миокарда. Такая МСС определяется как первичная [13, 14].
Совсем недавно группа COVADIS предложила диагностические критерии для определения МСС в виде триады признаков [1, 10, 14]:
-
1) боль в груди (стенокардия), в основном при нагрузке (иногда также в состоянии покоя);
-
2) ишемические изменения на электрокардиограмме (ЭКГ) (депрессия сегмента ST) во время нагрузочного теста или других неинвазивных тестов на выявление ишемии миокарда;
-
3) нормальные или малоизмененные коронарные артерии при КАГ.
Не всегда МCС клинически представляет собой стабильную стенокардию, возникающую при напряжении. У некоторых пациентов заболевание может манифестировать в форме острого коронарного синдрома с выраженными и длительными болями в грудной клетке и изменениями реполяризации на ЭКГ, иногда также с повышенными уровнями сывороточных маркеров некроза миокарда, что обусловливает определение этого конкретного состояния как нестабильной (или острой) МCС с развитием инфаркта миокарда (ИМ) [1, 13, 14].
Таким образом, учитывая актуальность проблем, связанных с развитием инфаркта миокарда при микрососудистом поражении коронарных артерий и манифестации острого коронарного синдрома, мы в качестве клинического примера приводим историю болезни пациента 55 лет, проходивший обследование и лечение в отделении неотложной кардиологии Больницы скорой медицинской помощи г. Уфы.
МАТЕРИАЛЫ И МЕТОДЫ
Пациент Е., 55 лет, доставлен 8 февраля 2019 года в приемное отделение больницы скорой медицинской помощи (БСМП) г. Уфы экстренно бригадой СМП с жалобами на давящие боли с локализацией за грудиной и иррадиацией в левую руку, сопровождающиеся смешанной одышкой, возникшие в покое, слабо купирующиеся короткодействующими нитратами и наркотическими анальгетиками, общей резкой слабостью с диагнозом:
Основной: ИБС. Острый крупноочаговый инфаркт миокарда переднеперегородочной стенки левого желудочка от 03.02.2019 г. Рецидив от 08.02.2019 г. ТКАГ 08.02.2019 г.
Осложнения: ХСН I. ФК III.
Из анамнеза известно, что ИБС выявлена впервые, больным себя считает с 03.02.2019 г., когда на фоне относительного благополучия появились давящие загрудинные боли в ночные часы, сопровождавшиеся одышкой, усиливающиеся при физической нагрузке, за медицинской помощью не обращался, самостоятельно лекарства не принимал. Повторный приступ с более интенсивной загрудинной болью зафиксирован 08.02.2019 г., вызвал СМП, доставлен в БСМП с диагнозом: острый коронарный синдром.
Коронарная микроциркуляция
Эпикардиальные коронарные артерии
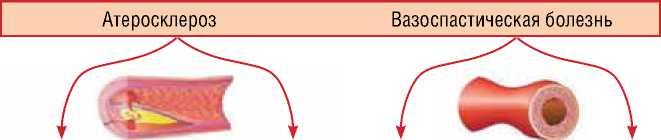
Микроваскулярная дисфункция
Стабильная бляшка
Нестабильная Фокальный / преходящий Стойкий бляшка вазоспазм вазоспазм

I
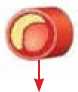
Отрыв бляшки
Восстановление резервного коронарного кровотока
Стенокардия Принцметала
Инфаркт миокарда
Влияние физиологии коронарного кровотока и кровотока миокарда на субъектов с факторами риска

Ишемия потребления ± стенокардия
Тромбоз
Острый коронарный синдром / ИМ
Способствует ишемии миокарда при ИБС и кардиомиопатии
Вызывает тяжелую острую ишемию такоцубо
Эти три механизма могут сочетаться
Коронарная МСД - современные представления
Из анамнеза жизни, пациент курит с 35 лет, индекс курения пациента 10 пачка/лет. Имеет место, отягощенный по сердечно-сосудистым заболеваниям семейный анамнез.
При первичном осмотре кардиолога состояние больного средней степени тяжести, сознание ясное, положение активное, кожные покровы и видимые слизистые физиологического окраски, чистые. Аускультативно над всей поверхностью легочной ткани везикулярное дыхание, хрипов нет. ЧД 18 в минуту. При исследовании сердечно-сосудистой системы тоны сердца ритмичные, приглушены. Перкуторно границы сердца расширены влево +1 см. АД 120/70 мм рт. ст. на обеих руках. ЧСС 70 в минуту, пульс 70 в минуту, удовлетворительных свойств.
Со стороны ЖКТ: живот обычной формы, в акте дыхания участвует, пальпаторно мягкий, безболезненный. Печень, селезенка не увеличена. Больному в экстренном порядке была проведена оценка лабораторных данных, коронароангиогра-фия (КАГ), электрокардиография (ЭКГ), ЭХО-кардиография (ЭХО-КГ) с последующим переводом в отделение неотложной кардиологии (ОНК).
В ОНК больному проводилась терапия антиангинальными препаратами (раствор изокета 0,1% – 10,0 на 200 мл 0,9% физиологического раствора внутривенно капельно под контролем АД), дезагрегантами (аспирин (0,5 гр.) внутрь по % таблетки 1 раз на ночь, брилинта (90 мг) – 2 таблетки 1 раз в сутки, гиполипидемическая терапия (аторвастатин 40 мг) 1 таблетку 1 раз в сутки), гипотензивными препаратами (лизиноприл 10 мг/сутки), антикоагулянтами прямого действия (клексан 0,4 подкожно 2 раза в сутки), бета-адреноблокаторами (метопролол 50 мг ^ таблетки 2 раза в сутки).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При обследовании в общем анализе крови выявлено повышение уровня лейкоцитов до 9,5 х 109/л, биохимический скрининг липидов, кардиоспецифических ферментов и общий анализ мочи не выявил отклонений от нормы. Коагулограмма выявила повышение уровня фибриногена до 4,3 г/л, АЧТВ до 35,8 сек., РФМК до 5,5 x 10 '2 г/л.
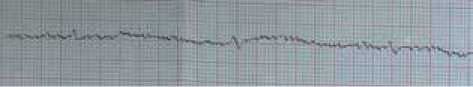
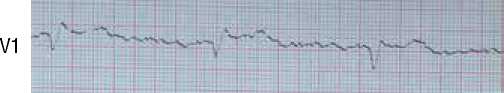
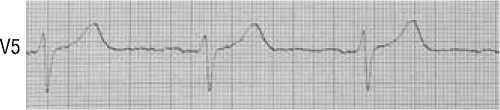
По данным ЭКГ – трансмуральные изменения (рис. 2) передневерхушечной области левого желудочка с подъемом сегмента ST во V1, V2, V5 отведениях и высоким остроконечным зубцом Т в отведениях V3, V4. Незначительное смещение сегмента ST во II, III, AVF отведениях свидетельствует о спазме заднебоковых сегментов коронарных артерии.
При ЭХО-КГ выявлено уплотнение стенок аорты (табл. 1), митральная недостаточность I-II степени с признаками диастолической дисфункции левого желудочка I типа на фоне гипокинеза передне-перегородочной области левого желудочка. В результате проведенной коронарной ангиографии (табл. 2) окклюзионной патологии и гемодинамически значимых стенозов в коронарных артериях не выявлено. Стеноз 11 сегмента левой коронарной артерии не более 10%. Умеренная извитость коронарных артерий.
За время наблюдения в ОНК состояние больного стабилизировалось, признаки коронарной недостаточности купированы, гемодинамика и дыхание стабильны (АД от 120/80 до 110/70 мм.рт.ст., ЧСС от 78 до 58 в мин., ЧД – от 17 до 19 в минуту). Сердечные тоны ритмичны, приглушены. Живот мягкий, безболезнен при пальпации. Диурез без особенностей. Активно жалоб не предъявлял, пациент был выписан с рекомендациями продолжить лечение брилинтой, аспирином, аторвастатином,
I
II

III
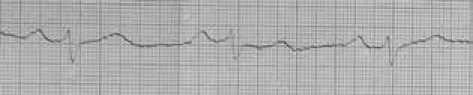
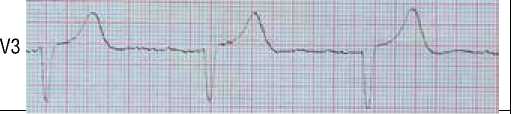
AVR
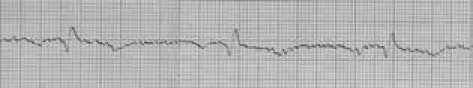
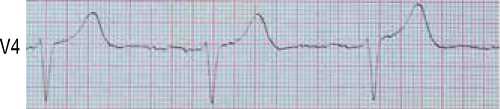
AVL
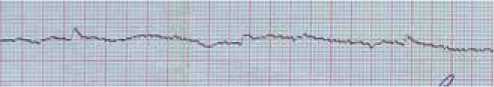
AVF

Таблица 1. Протокол эхокардиографии (А04.10.002)
|
Аорта основ.(мм) |
32 |
КДРЛЖ (см) |
4,5 |
||
|
Аорта восх. (мм) |
26 |
КСР ЛЖ (см) |
3,4 |
||
|
Раскрытие АК (мм) |
кдо (мл) |
92 |
|||
|
ЛП (мм) |
27 |
ксо (мл) |
49 |
||
|
МЖП (мм) |
10 |
УО (мл) |
43 |
||
|
ЗСЛЖ (мм) |
8 |
ФВ % |
46 |
||
|
ПЖ (мм) |
22 |
||||
|
ПП (мм) |
37 |
AS |
24 |
||
|
ЛА (мм) |
|||||
|
Сократительная функция миокарда ЛЖ: снижена. Сегментарная сократимость миокарда нарушена |
|||||
|
сегменты |
переднеперегородочный |
перегородочный |
передний боковой |
нижний |
задний |
|
базальные |
|||||
|
средние |
гипокинез |
гипокинез |
|||
|
апикальные |
акинез |
гипокинез гипокинез |
|||
|
Показатели |
АК |
МК |
ТК |
ЛК |
|
|
Створки |
|||||
|
Фиброзное кольцо |
|||||
|
S,CM2 |
|||||
|
Пиковый градиент, мм.рт.ст. |
3,8 |
||||
|
Средний градиент, мм.рт.ст. |
|||||
|
Регургитация Площадь ( % ) \ степень (+) |
1-2+ |
1+ |
|||
|
Нижняя полая вена не расширена 15мм, на вдохе спадается более 50%. Жидкость в полости перикарда не обнаружена. Жидкость в плевральной полости не обнаружена. Расчетное систолическое давление в правом желудочке: 21 мм.рт.ст. Признаки диастолической дисфункции ЛЖ выявлены I тип. Уплотнение стенок аорты. |
|||||
Таблица 2. Протокол коронароангиографии (А06.10.006)
После обработки операционного поля под местной анестезией Sol. Novocaini 0,25%-20,0 мл, произведена пункция правой бедренной артерии.
-
1) Коронароангиография:
Диагностическими коронарными катетерами JL 4.0 5F и JR 4.0 5F произведено канюлирование и контрастирование коронарных артерий.
На коронарографии: Тип кровоснабжения - правый.
Из устья ЛКА контрастируются ствол ЛКА, ПМЖА, ОА и их ветви.
Ствол ЛКА диаметром до 3,8 мм с четкими неровными контурами, просвет не изменен. ПМЖА диаметром до 3,0 мм, с четкими неровными контурами, просвет не изменен. Кровоток TIMI III. ОА до 1,8 мм с четкими неровными контурами, стеноз в 11 сегменте не более 10%. Кровоток TIMI III.
Из устья ПКА контрастируются собственно ПКА, СА, КА, ВОК, ЗБА и ЗМЖА. Диаметр артерии до 3,2 мм, с четкими неровными контурами, просвет не изменен. Кровоток TIMI III.
Заключение : Окклюзионной патологии и гемодинамически значимых стенозов в коронарных артериях не выявлено. Стенозы коронарных артерий не более 10%. Умеренная извитость коронарных артерий.
бета-блокаторами, ингибиторами АПФ по тем же схемам с дальнейшим наблюдением у кардиолога по месту жительства, с контролем лабораторно-инструментальных показателей, ограничением физической активности, соблюдением диеты.
Результаты представленного наблюдения за пациентом ИМ с МСС на фоне непораженных крупных коронарных артерий показали, что при рецидиве острого коронарного синдрома выраженными длительными загрудинными болями с иррадиацией в левую руку, сопровождающиеся смешанной одышкой, возникшие в покое, слабо купирующиеся короткодействующими нитратами и наркотическими анальгетиками, сопряжено с характерными крупноочаговыми изменениями на ЭКГ, но без повышенных уровней сывороточных маркеров некроза миокарда. Следует отметить, что, хотя коронарные артерии остаются «чистыми», с клинической точки зрения самочувствие пациентов из-за болевого синдрома является неудовлетворительным, а качество жизни низким [1].
По результатам 20-летнего наблюдения, проведенного в Дании и включавшего 17 435 больных с неизмененными коронарными артериями и с необструктивным диффузным поражением коронарных артерий со стенокардией, в этих группах было выявлено 52 и 85% повышение риска крупных сердечно-сосудистых событий (сердечно-сосудистая смертность, госпитализация по поводу ИМ, сердечной недостаточности, инсульта) соответственно и 29 и 52% повышение риска общей смертности соответственно без существенных различий по половому признаку [16]. Ухудшение сердечной функции в исследованиях описывалось довольно редко [17].
Вместе с тем в последнее время МСС уже не рассматривается как абсолютно доброкачественное состояние. Было установлено, что частота сердечно-сосудистых событий близка или даже сопоставима с прогнозом при обструктивных изменениях коронарного русла. В одном из исследований в группе пациентов с МСС и исходной ПЗВД плечевой артерии <4,7% был отмечен достоверно более высокий риск сердечно-сосудистых осложнений в сравнении с группой с ПЗВД >4,7% (p<0,05) на протяжении 9–18 лет наблюдения [18].
Учитывая актуальность этой проблемы, необходимо отметить, что в последние годы необструктивной ИБС уделяется всё больше внимания, и для практического кардиолога важно уметь распознать и правильно квалифицировать таких пациентов, даже в отсутствие стенозирующих просвет коронарных артерий атером, и проводить лечение на основе имеющихся симптомов [1].
ВЫВОДЫ
В представленном клиническом случае был описан пример развития ИМ при микрососудистом поражения коронарных артерий у больного манифестацией острого коронарного синдрома с выраженными длительными загрудинными болями и изменениями реполяризации на ЭКГ, а также без повышенных уровней сывороточных маркеров некроза миокарда, что, вероятно, обусловливает определение этого состояния как нестабильной (или острой) микрососудистой дисфункции с развитием инфаркта миокарда.
В развитии заболевания могут принимать участие самые разные патофизиологические механизмы. Новые данные способствовали улучшению понимания дисфункции коронарных сосудов и результирующей ишемии миокарда, которые характеризуют МСД у пациентов с МСС. Несмотря на то, что ряд препаратов, включая антиангинальные, могут облегчать симптомы, у многих пациентов сохраняется клиническая симптоматика, плохое качество жизни, и лечение остается сложной задачей. Прогноз у больных с МСС, по последним данным, не такой благоприятный, как считалось ранее, что делает актуальным поиск новых методов диагностики и лечения.
Список литературы Клинический случай развития острого инфаркта миокарда при микрососудистой стенокардии
- Карпов Ю.А., Соболева Г.Н., Ерпылова Е.А. 2018. Микрососудистая стенокардия: вопросы диагностики и лечения 2019 г.: научный обзор. Атмосфера. Новости кардиологии, 4(4), 16-27.
- Montalescot, G., Sechtem, U., Achenbach, S. 2013. 2013 ESC guidelines on the management of stable coronary artery disease: the task force on the management of stable coronary artery disease of the European Society of Cardiology. European Heart Journal, 34(38): 2949-3003.
- Humphries, K.H., Pu, A., Gao, M., Carere, R.G., Pilote, L. 2008. Angina with "normal" coronary arteries: sex differences in outcomes. American Heart Journal, 155(2): 375-381.
- Ouellette, M., Löffler, A.I., Beller, G.A., Workman, V.K., Holland, E., Bourque, J.M. 2018. Clinical characteristics, sex differences, and outcomes in patients with normal or near normal coronary arteries, non-obstructive or obstructive coronary artery disease. Journal of American Heart Association, 7(10): 1-13.
- Proudfit, W.L., Shirey, E.K., Sones, F.M.Jr. 1966. Selective cine coronary arteriography. Correlation with clinical findings in 1,000 patients. Circulation, 33(6): 901-910.
- Sandler, K.M., McNaughton, C.D., Presley, M.A., Williams, J.R. 2015. Incidence and management of mild coronary atherosclerotic disease diagnosed with coronary CTA in the emergency department. Emergency Medicine (Los Angeles), 5(6): 283.
- Kemp, H.G., Kronmal, R.A., Vliestra, R.E., Frye, R.L. 1986. Seven-year survival of patients with normal or near normal coronary arteriograms. A CASS registry study. Journal of the American College of Cardiology, 7: 479-483.
- Cannon, R.O., Epstein, S.E. 1988. ‘Microvascular angina' as a cause of chest pain with angiographically normal coronary arteries. The American Journal of Cardiology, 61(15): 1338-1343.
- Клинические рекомендации. Стабильная ишемическая болезнь сердца. 2016. http://cr.rosminzdrav.ru/#!/schema/.
- Lanza, G.A., De Vita, A., Kaski, J.C. 2018. "Primary" microvascular angina: clinical characteristics, pathogenesis and management. Journal of Interventional Cardiology, 13(3): 108-11.
- Crea, F., Camici, P.G., Bairey Merz, C.N. 2014. Coronary microvascular dysfunction: an update. European Heart Journal, 35(17): 1101-1111.
- Сергиенко В.Б., Саютина Е.В., Самойленко Л.Е., Самко А.Н., Першуков И.В., Левицкий И.В., Соболева Г.Н., Карпов Ю.А. 1999. Роль дисфункции эндотелия в развитии ишемии миокарда у больных ишемической болезнью сердца с неизмененными и малоизмененными коронарными артериями. Кардиология, 39(1): 25-30.
- Lanza, G.A., Crea, F. 2010. Primary coronary microvascular dysfunction clinical presentation, pathophysiology, and management. Circulation, 121(21): 2317-2325.
- Villano, A., Lanza, G.A., Crea, F. 2018. Microvascular angina: prevalence, pathophysiology and therapy. Journal of Cardiovascular Medicine (Hagerstown, Md), 19(Suppl 1): e36-9.
- Camici, P.G., Crea, F. 2007. Coronary microvascular dysfunction. The New England Journal of Medicine, 356(8): 830-840.
- Jespersen, L., Hvelplund, A., Abildstrøm, S.Z., Pedersen, F., Galatius, S., Madsen, J.K., Jørgensen, E., Kelbæk, H., Prescott, E. 2012. Stable angina pectoris with no obstructive coronary artery disease is associated with increased risks of major adverse cardiovascular events. European Heart Journal, 33(6): 734-744.
- Kaski, J.C., Elliott, P.M. 1995. Angina pectoris and normal coronary arteriograms: clinical presentation and hemodynamic characteristics. The American Journal of Cardiology, 76(13): 35D-42D.
- Соболева Г.Н., Федулов В.К., Самко А.Н., Левицкий И.В., Рогоза А.Н., Балахонова Т.В., Карпов Ю.А. 2017. Прогностическое значение дисфункции эндотелия коронарных и плечевой артерии, традиционных факторов риска в развитии сердечно-сосудистых осложнений у пациентов с микрососудистой стенокардией. Российский кардиологический журнал, 22(3):54-58.


