Клиническое значение биопсии сигнальных лимфатических узлов с индоцианином зеленым после эффективной неоадъювантной химиотаргетной терапии спорадического раннего HER2-позитивного рака молочной железы
Автор: Титов К.С., Куц И.Н., Карселадзе Д.А., Лебединский И.Н., Лорие З.В., Лебедев С.С., Греков Д.Н.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 1 т.15, 2025 года.
Бесплатный доступ
Рак молочной железы (РМЖ), согласно данным Международного агентства по изучению рака GLOBOCAN (Cancer Today), занимает первое место в структуре смертности от онкологических заболеваний среди женщин. В последние десятилетия в лечении РМЖ устойчиво наметился тренд на минимизацию объёмов радикального хирургического лечения с целью улучшения качества жизни пациентов и соблюдения принципов онкологической адекватности. Биопсия сигнальных лимфоузлов (БСЛУ) является альтернативой расширенной аксиллярной лимфодиссекции у пациентов с клинически не поражёнными метастазами регионарными лимфоузлами (cN0), что позволяет избегать пациенткам таких грозных и нередко инвалидизирующих осложнений лимфодиссекции, как длительная послеоперационная лимфорея с лимфатическим отёком верхней конечности (лимфостаз). Благодаря эффективной неоадъювантной лекарственной терапии (НАТ) в сочетании с БСЛУ, которая наиболее эффективна у HER2-позитивных опухолей, количество пациенток, перенёсших органосохранное хирургическое лечение, неуклонно увеличивается. Мировые тенденции идут дальше, и в ряде исследований уже произведена попытка отказаться от выполнения БСЛУ у некоторых категорий пациенток с ранним РМЖ. В настоящей статье проанализирован опыт и результаты выполнения и значение биопсии сигнальных лимфатических узлов флуоресцентным методом с ICG после проведения эффективной неоадъювантной химиотаргетной терапии (НАХТТ) у пациенток с ранним спорадическим HER2-позитивным раком молочной железы в Онкологическом центре ММНКЦ им. С.П. Боткина ДЗМ.
Биопсия сигнального лимфатического узла [d016207], her2-позитивный рак молочной железы [d019275], индоцианин зеленый [d000077598], неоадъювантная терапия [d009367], комбинированные протоколы противоопухолевой химиотерапии [d000971], противоопухолевые препараты [d000970], таргетная молекулярная терапия [d018417], молекулярная таргетная терапия [d057285], раннее выявление рака [d064042], рецептор erbb-2 (her2) [d049109], метастазирование в лимфатические узлы [d014057], безрецидивная выживаемость [d018770]
Короткий адрес: https://sciup.org/143184382
IDR: 143184382 | УДК: 618.19-006.6-033.2-076:615.277.3:615.28:615.849.19 | DOI: 10.20340/vmi-rvz.2025.1.CLIN.5
Текст научной статьи Клиническое значение биопсии сигнальных лимфатических узлов с индоцианином зеленым после эффективной неоадъювантной химиотаргетной терапии спорадического раннего HER2-позитивного рака молочной железы
Рак молочной железы (РМЖ) является одним из самых распространённых онкологических заболеваний в мире. Согласно данным Международного агентства по изучению рака GLOBOCAN (Cancer Today), он занимает первое место в структуре смертности от онкологических заболеваний среди женщин. Абсолютное число выявленного РМЖ во всём мире в 2022 году достигает 2,5 миллионов с количеством летальных исходов более 600 тысяч [1].
Радикальная хирургическая операция продолжает оставаться основным методом лечения РМЖ, и она показана на разных этапах всем пациентам с I-III стадиями заболевания. Эволюция хирургических подходов устойчиво движется к минимизации объёмов оперативного вмешательства, определена возможность и доказана радикальность проведения органосохранных оперативных вмешательств при раннем и местно-распространённом раке молочной железы [2]. Начало этому положил Б. Фишер с публикацией своего научного исследования, сравнивающего общую выживаемость пациенток после радикальной мастэктомии с аксиллярной лимфодиссек-цией и с биопсией сигнальных лимфоузлов (БСЛУ). Это исследование показало, что выживаемость дан- ных групп пациенток одинаковая и при отсутствии метастатического поражения лимфатических узлов (рN0) составляет 25% и 26% соответственно. По показаниям, при раннем РМЖ, БСЛУ является альтернативой расширенной аксиллярной лимфодиссекции и должна применяться согласно международным и российским клиническим рекомендациям [2, 4].
Отдельно в успех органосохранного хирургического лечения внесла свой вклад неоадъювантная лекарственная терапия (НАТ). Первоначально, НАТ ограничивалась применением у пациенток с местнораспространённой стадией заболевания, однако по мере накопления опыта стала использоваться и при раннем раке молочной железы (рРМЖ). Так, рандомизированное исследование, проводимое в Royal Marsden Hospital, продемонстрировало целесообразность проведения НАТ для деэскалации объёма хирургического лечения. У пациенток, перенёсших НАТ, в 2 раза чаще выполнялась резекция молочной железы, чем у пациенток без НАТ, при том, что частота локо-регионарных рецидивов была низкой и сопоставимой в обеих группах [5]. Исследование GANEA2, проводимое во Франции и опубликованное в 2019 году, продемонстрировало безопасность выполнения БСЛУ у пациенток с клиническим стату- сом N0 после проведения НАТ. В данное исследование было включено 419 пациенток, и показатели 3-летней общей выживаемости (ОВ) и выживаемости без прогрессирования (ВБП) составили 97,2% и 97,8% соответственно, что даёт понимание о нецелесообразности проведения аксиллярной лимфодис-секции (ЛАЭ) [6]. Схожие данные были опубликованы группой японских учёных, продемонстрировавших результаты комплексного подхода в лечении пациенток с рРМЖ с клиническим статусом N0, прошедших НАТ на первом этапе лечения. В контрольную группу вошли пациентки, которым было выполнено хирургическое лечение. Показатели 5-летней ВБП составили 96,1% с НАТ и 97,5% без НАТ, а показатели ОВ составили 99,3% и 98,9% соответственно. В данном исследовании интересным был тот факт, что пациентки с HER2-позитивным статусом в 1,5 раза чаще получали НАТ на первом этапе, чем пациентки с изначальным хирургическим лечением [7]. Эти результаты более широко раскрыла другая группа японских учёных, опубликовавших данные исследования NCDB (National Cancer Data Base), в которое было включено более 20 000 пациенток старше 18 лет, страдающих ранним РМЖ и получивших НАТ на первом этапе лечения. Среди них было около 5,7 тысяч больных с HER2-позитивными опухолями, 3,6 тысяч имели люминальный, а 2,1 тысяч нелюминальный подтип опухоли. Среди этих пациенток наблюдался наиболее высокий уровень достижения полного патоморфологического ответа (pCR) в сравнении с HER2-негативными опухолями, а уровень pCR самый высокий у нелюминальных HER2-позитивных опухолях и составил 39,6%, далее следует тройной негативный подтип с 26,5%, HER2-позитивные люминальный – 22,5% и люминальный подтипы – 8,1%. Высокий уровень pCR на НАТ у
HER2-позитивных опухолей авторы связывают с проведением двойной блокады таргетными препаратами (трастузумаб + пертузумаб). Интересным оказался поданализ, сравнивающий ОВ у пациенток с ранним РМЖ c N0 и N1. Пациенты поделились практически поровну: N0 – 57,5% и N1 – 42,5%, и особых отличий в ОВ среди двух групп получено не было [8, 9].
Данные выводы послужили основанием для оценки эффективности БСЛУ флуоресцентным методом с ICG после проведения эффективной неоадъювантной химиотаргетной терапии (НАХТТ) у пациенток спорадическим ранним HER2-позитивным раком молочной железы.
Цель исследования – определение клинического значения и диагностической ценности БСЛУ флуоресцентным методом с ICG у пациенток с ранним HER2-позитивным раком молочной железы после НАХТТ.
Объект и методы
В период с 01.02.2021 г. по 01.11.2024 г. в исследование было включено 74 пациентки с ранним HER2-позитивным РМЖ (IA, IIA, IIB стадии) с клинически не поражёнными метастазами лимфатическими узлами (сN0). Всем пациентам выполняли радикальную резекцию молочной железы с БСЛУ флуоресцентным методом с индоцианином зелёным (ICG) в Онкологическом центре ММНКЦ им. С.П. Боткина ДЗМ.
Средний возраст пациенток составил 58,6 года (Ме 60). Распределение по возрастным группам представлено на рис. 1.
Среди всех 74 пациенток было зафиксировано 56 (75,7%) с люминальным HER2-позитивным и 18 (24,3%) с нелюминальным HER2-позитивным подтипом.
Самой частой была IA стадия заболевания, все пациентки распределились по следующим образом (рис. 2).
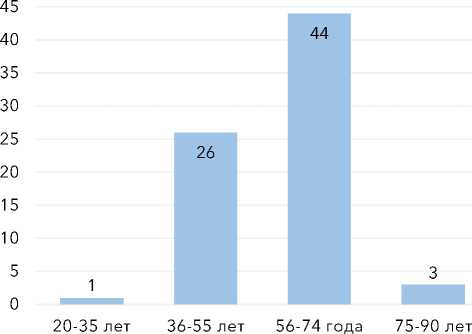
Количество пациенток в данной возрастной группе
Рисунок 1. Распределение пациенток по возрастным группам Figure 1. Distribution of patients by age group
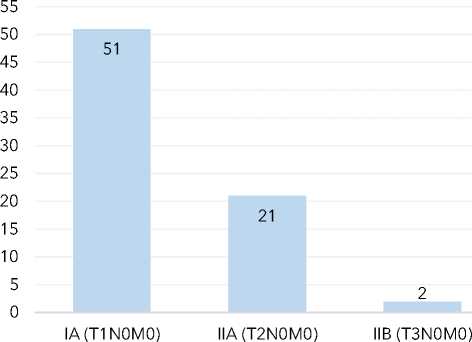
Количество пациенток в зависимости от стадии заболевания
Рисунок 2. Распределение пациенток по стадиям заболевания
Figure 2. Distribution of patients by stages of the disease
НАХТТ была проведена 30 (40,5%) пациенткам, у 19 (63,3%) пациенток был зафиксирован полный ответ, частичный ответ отмечен в 6 (20%) случаях, а стабилизация установлена у 5 (16,7%) пациенток. Прогрессирования заболевания на фоне НАХТТ зафиксировано не было. Применяемые схемы и завершённость назначенных курсов приведены в таблице 1.
Таблица 1. Схемы НАХТТ, количество пациенток, получивших конкретную схему, завершенность НАХТТ в %
Table 1. Neoadjuvant treatment regimen, the number of patients who received a specific regimen, the completion of the prescribed regimen in%
|
Схема |
Число пациенток, получающих схему |
Количество пациенток / завершённость НАХТТ (%) |
|
17 – 100% |
||
|
DCHP |
20 |
1 – 83% |
|
1 – 66% |
||
|
1 – 50% |
||
|
4 – 100% |
||
|
DCH |
6 |
1 – 83% |
|
1 – 50% |
||
|
P+H |
4 |
4 – 100% |
Под контролем экзоскопа эндоскопической стойки отслеживается путь (трасса) индоцианина зелёного по лимфатическим сосудам к сигнальным лимфатическим узлам (рис. 4).
В зоне регионарного лимфооттока в аксиллярной области на стороне поражения выполняется разрез (2 см), а также доступ с выделением регионарной
Выполнение БСЛУ флуоресцентным методом с ICG
На первом этапе над пальпируемой опухолью молочной железы или по периферии ареолы (универсальный подход) внутрикожно в 2–3 точки (из расчёта 50/50) вводится 1,0 мл индоцианина зелёного (5 мг/мл) (рис. 3).
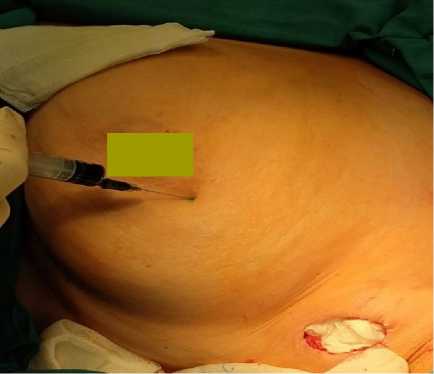
Рисунок 3. Параареолярное внутрикожное введение индоцианина зеленого (ICG)
Figure 3. Paraareolar intradermal administration of indocyanin green (ICG)
клетчатки, в которой определяются сигнальные лимфатические узлы (ЛУ) по своему характерному яркому флуоресцентному зеленому свечению (рис. 4). Далее проводится удаление 1–3 сигнальных ЛУ в составе клетчатки, материал отправляется на срочное патоморфологическое исследование вместе с удаляемым сектором молочной железы (оценка состояния краев резекции) (рис. 5).
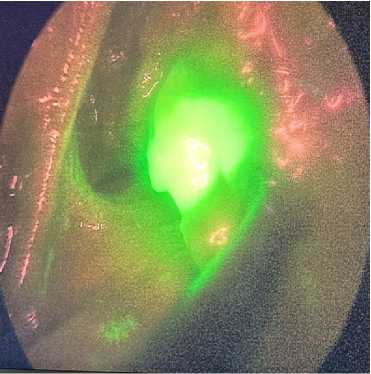
Рисунок 4. Обнаружение сигнальныхо лимфоузлов при помощи флуоресцентного метода с индоцианином зеленым (ICG) Figure 4. Detection of a signal lymph node using a fluorescent method with (ICG)
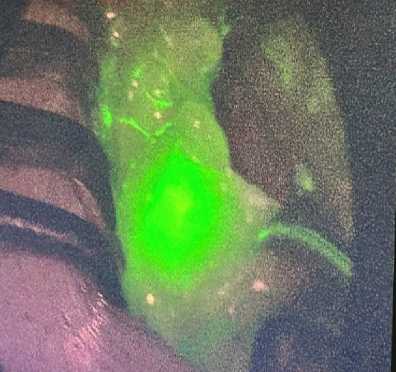
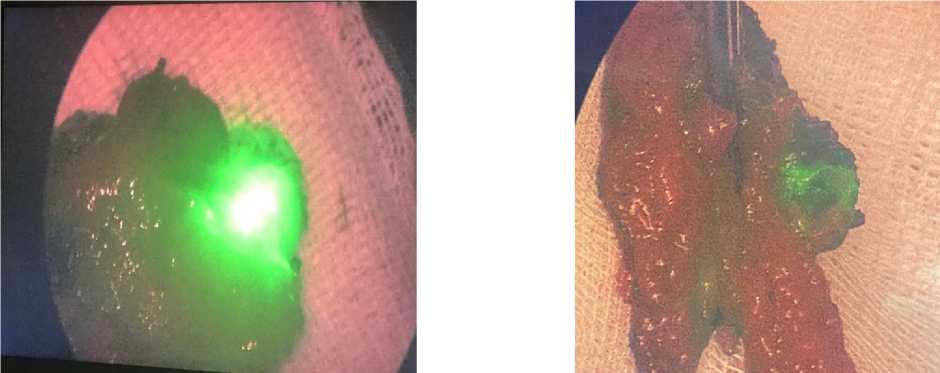
Рисунок 5. Удаленные сигнальные лимфоузелы в составе клетчатки подмышечной области на стороне РМЖ Figure 5. Remote signal lymph node in the fiber ofthe axillary region on the side of disease
Результаты
У пациенток с ранним РМЖ чувствительность БСЛУ флуоресцентным методом с ICG составила 100%, сигнальный лимфоузел был выявлен во всех 74 случаях как по данным срочного, так и по данным планового патоморфологических исследований. Чувствительность БСЛУ флуоресцентным методом с ICG в нашем исследовании оказалась сопоставима с результатами многоцентровых международных исследований с радиоизотопным и флуоресцентным методами БСЛУ [10–12].
Всего было выделено 229 сигнальных лимфоузлов, что в среднем составило 3,09 (Ме 3) в каждом случае. У 6 (8,1%) пациенток по данным срочного па-томорфологического исследования и у 8 (10,8%) по данным планового заключения обнаружены метастазы в СЛУ. При детальном, подгрупповом анализе обнаружено, что метастазы в СЛУ определялись в большинстве случаев у пациенток без НАХТТ. Так, среди 44 пациенток, не получивших НАХТТ, метастатическое поражение СЛУ выявлено у 6 (13,6%), что сопоставимо с данными мировых исследований [13].
Однако частота метастатического поражения СЛУ у пациенток, перенёсших на первым этапе комплексного лечения эффективную НАХТТ, была в 2 раза ниже и составила 2 (6,6%) случая на 30 пациенток.
Обсуждение
Метастазы в СЛУ обнаружены у 8 (10,8%) пациенток, что немного ниже частоты поражения в многоцентровых исследованиях [13]. Подобный результат нами объясняется проведением двухкратного УЗИ аксиллярных областей (1-е УЗИ выполняется в ЦАОП и 2-е экспертное УЗИ в условиях онкохирургического стационара за день до операции). При УЗ патологических изменениях со стороны лимфатических узлов, подозрительных на наличие в них метастазов, паци- енткам под УЗИ навигацией проводилась тонкоигольная аспирационная биопсия (ТИАБ) или толстоигольная биопсия (CORE-биопсия) лимфоузла с цитологическим или гистологическим исследованиями. В таких случаях операция переносилась до получения патоморфологического заключения. В тех случаях, когда по заключению цитолога или патологоанатома в лимфоузле(ах) были обнаружены метастазы РМЖ, пациентке проводилась аксиллярная лимфодиссекция. Представленные нами результаты могут изменить подход к дооперационному этапу диагностики и способствовать открытию кабинетов экспертного УЗИ в онкохирургических стационарах маммологического профиля.
Существуют неоднозначные данные, говорящие об эффективности проведения НАХТТ на первом этапе комплексного лечения пациенток с ранним HER2-позитивным РМЖ клинически без метастатического поражения регионарных лимфоузлов. Частота метастатического поражения СЛУ у данной группы пациенток после эффективной НАХТТ составила всего 6,6%, что в 2 раза ниже, чем у пациенток, не прошедших НАХТТ. В связи с чем ставится под сомнение необходимость выполнения БСЛУ с клинически с N0 статусом после НАХТТ в пользу наблюдения, поскольку показатели выживаемости без прогрессирования и общей выживаемости были сопоставимы, а число осложнений в 2 раза выше при проведении хирургического лечения с БСЛУ [14].
В связи с вышесказанным мы считаем, что существует необходимость ранжирования пациенток на группы в зависимости от риска поражения регионарных лимфатических узлов с последующим персонализированным подходом в тактике лечения этих больных.
Выводы
Использование БСЛУ флуоресцентным методом с ICG после проведения эффективной неоадъювантной химиотаргетной терапии (с полным или частичным ответами) у пациенток спорадическим ранним HER2-позитивным раком молочной железы в Онко- логическом центре ММНКЦ им. С.П. Боткина показало высокую чувствительность данного диагностического метода, а также необходимость в дальнейшем изучении данной проблематики, поскольку всё же не до конца остаётся ясным необходимость выполнения БСЛУ у данной группы пациенток после эффективной НАХТТ.


