Клиническое значение цистатина С и TGF-pi в оценке почечной функции при хирургическом лечении почечно-клеточного рака
Автор: Тарасенко А.И., Россоловский А.Н., Березинец О.Л., Дурнов Д.А., Чехонацкая М.Л., Лойко В.С., Бобылев Д.А., Маслякова Г.Н.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Урология
Статья в выпуске: 3 т.16, 2020 года.
Бесплатный доступ
Цель: оценка возможности использования цистатина С и TGF-p в качестве прогностических маркера ухудшения функции почек и неблагоприятных онкологических результатов хирургического лечения почечно-клеточного рака (ПКР). Материал и методы. Обследованы 60 пациентов с ПКР Пациенты разделены на 3 группы: после нефрэктомии (1-я группа); после лапароскопической нефрэктомии (2-я группа); после лапароскопической резекции опухоли (3-я группа). Всем больным перед операцией 7-10-е сутки, через 1-3 года послеоперационного наблюдения методом твердофазного ИФА произведено исследование концентраций в сыворотке крови цистатина С и TGF-р. Результаты. У большинства больных в группах выявлено достоверное снижение скорости клубочковой фильтрации (СКФ) по сравнению с контролем, и через три года после нефрэктомии большинство пациентов имели ХБП С3а-стадию. Содержание цистатина С во всех группах больных ПКР имело статистически значимое повышение по сравнению с контролем (2664, 3103 и 2709 нг/мл в 1, 2 и 3-й группах против 143 нг/мл соответственно) (р
Биомолекулярные маркеры, почечно-клеточный рак, функция почек, хроническая болезнь почек, цистатин с
Короткий адрес: https://sciup.org/149135598
IDR: 149135598 | УДК: 616.61-006.6-008.1-091.8-089:577.2]
Текст научной статьи Клиническое значение цистатина С и TGF-pi в оценке почечной функции при хирургическом лечении почечно-клеточного рака
1Введение. Несмотря на значительный прогресс в направлении лекарственного и комбинированного лечения онкоурологических заболеваний, основным методом лечения ПКР остается хирургическое вмешательство. При отсутствии ограничений, связанных со стадией заболевания и особенностями гистологической характеристики опухоли, при которых резекция почки при ПКР может представлять повышенный онкологический риск или вероятность хирургических осложнений, предпочтение отдается малоинвазивной нефронсберегающей хирургии (Nephron sparing surgery (NSS)) [1].
Кроме того, согласно клиническим рекомендациям Европейской и Американской ассоциаций урологов, при размере опухоли до 4см выполнение резекции почки обязательно, при размере в пределах 4–7 см — предпочтительно [2]. При этом и резекция и нефрэктомия при ПКР связаны с потерей массы действующих нефронов, сопровождающейся снижением СКФ, что может привести к развитию ХБП [3].
Проведенные за последнее десятилетие исследования указывают на то, что при наличии технической возможности, резекция почки обеспечивает эквивалентные нефрэктомии онкологические результаты, максимально сохраняя при этом функцию почек [3–5]. Кроме того, в ряде исследований доказано преимущество резекции почки по сравнению с радикальной нефрэктомией, не только для улучшения послеоперационной функции почек, но и общей выживаемости [5, 6]. Вместе с тем все еще существуют противоречия относительно преимуществ резекции почки с точки зрения канцерспецифической выживаемости больных ПКР, включая единственное рандомизированное клиническое исследование, сравнивающее два вышеуказанных вмешательства [7]. В то же время в данном исследовании не оценивалась почечная функция и ее влияние на сердечно-сосудистый риск и общую выживаемость.
В исследовании D.A. Cozzi с соавт. доказано, что потеря значительного объема функционирующей паренхимы почек связана с повышенным риском клинически значимого ухудшения почечной функции, даже у здоровых пациентов в результате донорской нефрэктомии [8]. Это согласуется с гипотезой Бреннера, которая обосновывает развитие компенсаторной гиперфильтрации сохранившихся нефронов, а также сопутствующей протеинурии и артериальной гипертензии в ответ на потерю части функциональных почечных единиц. Возникающие при этом изменения в почке, вторичные по отношению к функциональной нагрузке, могут инициировать как острую почечную дисфункцию, так и приводить к непрерывно прогрессирующему почечному повреждению на фоне имеющейся ХБП и дальнейшим неблагоприятным последствиям, которые часто становятся очевидными только через десятилетия после односторонней нефрэктомии [3].
Одним из основных направлений развития современной биомедицины, позволяющих объективировать показания к различным видам оперативного лечения, является поиск универсальных биомаркеров, позволяющих определить оптимальный баланс между онкологической безопасностью и сохранением функции почки. Несмотря на многочисленные исследования, на настоящий момент нет достоверного предиктора прогноза при ПКР, поэтому поиск новых значимых прогностических маркеров данного забо-
левания является актуальной задачей [9]. В настоящее время пристальное внимание исследователей уделяется участию матриксных металлопротеиназ в опухолевом росте, а также оценке функции почек на основании определения концентрации в сыворотке крови цистатина С.
Широко экспрессируемый в жидкостных средах организма цистатин С представляет собой секретируемый ингибитор цистеиновой протеазы. Циста-тин С свободно фильтруется клубочками, в связи с чем в основном используется как маркер для оценки функции почек из-за его относительно небольшой молекулярной массы и легкого обнаружения. Тем не менее последние данные свидетельствуют о том, что цистатин С напрямую связан со многими патологическими процессами через различные механизмы. Кроме того, цистатин С может предотвращать прогрессирование опухоли путем ингибирования активности семейства лизосомальных цистеиновых катепсинов. Доказано, что снижение уровня сывороточного цистатина С коррелирует с увеличением метастазов различных опухолей [10]. Кроме того, локальная сверхэкспрессия цистатина С в микроокружении ткани хозяина может привести к успешному снижению метастазирования посредством ингибирования цистеинового катепсина в экспериментальной модели опухоли [11]. Таким образом, колебания уровня цистатина С могут иметь серьезные клинические последствия, а не просто являться отражением функционального состояния почек.
Как известно, почечный фиброз является исходом многочисленных прогрессирующих заболеваний почек, а трансформирующий фактор роста-в (TGF-^) играет важную роль в его развитии, регулируя синтез белков матрикса, ингибируя деградацию матрикса и изменяя межклеточное взаимодействие [12]. Нарушение экспрессии генов, связанных с внеклеточным матриксом и адгезией, может быть универсальным признаком прогрессирования рака, в том числе ПКР. В исследовании J. Bogusiawska и соавт., показано, что TGF—р способствует измененной экспрессии внеклеточного матрикса и генов, связанных с адгезией [13].
В то же время известно, что на ранних стадиях TGF—P подавляет пролиферацию клеток и способствует дифференцировке нормальных клеток и некоторых опухолей, таким образом выступая в качестве фактора супрессии опухолей. Однако при запущенном раке он усугубляет прогрессирование опухоли и метастазирование, тем самым действуя как онкогенный фактор [14].
Цель: оценка возможности использования циста-тина С и TGF-^ в качестве прогностического маркера ухудшения функции почек и неблагоприятных онкологических результатов хирургического лечения ПКР.
Материалы и методы . В исследование проспективно включены медицинские данные 60 больных раком почки c T1-3N0M0, получавших хирургическое лечение в клинике урологии Клинической больницы имени С. Р. Миротворцева Саратовского ГМУ с 2016 по 2019 г.
Основной группой являлись 20 (33,3%) пациентов, подвергнутых резекции почки по элективным показаниям, с опухолями почечной паренхимы, локализация и размеры которых определяли техническую сложность органосохраняющих вмешательств и соответствовали нефрометрическому индексу 4–6 баллов по шкале Padua (Padua Prediction Score for Risk of VTE) и/или 4-9 баллов по шкале RENAL ((R) adius (максимальный диаметр опухоли), (E) xophytic/endophytic (экзофитный или эндофитный рост опухоли), (N) earness (близость расположения опухоли к собирательной системе почки или ее сину- су), (A) nterior (a)/posterior (p)/not anterior or posterior (x) (расположение опухоли по передней, задней или не по передней или задней поверхности почки) и (L) ocation (расположение опухоли по отношению к полюсной линии)). Вторую группу (сравнения) составили 20 (33,3%) больных, которым выполнена радикальная нефрэктомия люмботомическим доступом. В 3-ю группу (сравнения) вошли 20 пациентов, которым была выполнена радикальная нефрэктомия лапароскопическим доступом. Выявленные опухоли почек у пациентов 2-й и 3-й групп соответствовали нефрометрическому индексу 4–8 баллов по шкале Padua и/или 6-11 баллов по шкале RENAL.
Медиана возраста 60 больных, вошедших в исследование, составила 57,8 (41-77) года. Соотношение мужчин и женщин — 1,2:1. При обследовании у всех пациентов были диагностированы опухоли почечной паренхимы (справа — 37 (61,6%), слева — 23 (38,4%)). В 1-й группе превалировали новообразования среднего сегмента (34 (56,7%)), опухоли верхнего и нижнего полюсов почки имелись в 14 (23,3%) и 12 (20%) наблюдениях соответственно. Пациентам, которым выполняли резекцию почки, большинство опухолей выходило за полюсную линию (12 (60%)), в том числе более чем на 50% (5 (25%)). Медиана диаметра опухолевых очагов составила 3,41 (2,0–5,2) см.
Среди больных 1-й группы категория со стадией Т1а диагностирована у 14 (70%), сТ1Ь — у 6 (30%) пациентов. Регионарных и отдаленных метастазов не выявлено ни у одного больного.
Во 2-й и 3-й группах также преобладали новообразования среднего сегмента (48 (80%)), опухоли верхнего и нижнего полюсов почки наблюдались в 8 (13,3%) и 4 (6,7%) случаев соответственно. У пациентов, которым выполняли нефрэктомию, большинство опухолей располагалось интрапаренхиматозно, в непосредственной близости от магистральных сосудов. Медиана диаметра опухолевых очагов составила 4,64 (от 3,0 — до 7,7) см.
Категория больных со стадией T1 составила 41 (68,2%) человек, с Т2-стадией — 11 (18,2%), стадия Т3 диагностирована у 8 (13,6%) пациентов. Регионарных и отдаленных метастазов не выявлено ни у одного больного.
Исходную функцию почек оценивали у всех больных, пациентам в предоперационном периоде определяли уровень сывороточного креатинина (сКр) и выполняли динамическую нефросцинтиграфию (ДНСГ) с раздельным аппаратным расчетом нормализованной с учетом поверхности тела СКФ.
Кроме того, всем пациентам в ранний (7-10 сутки) и средне-отдаленный периоды (через 1–3 года) методом твердофазного ИФА произведено исследование концентрации в сыворотке крови цистатина С и TGF-^ с использованием коммерческих наборов реагентов (производитель BioVendor (Чехия)).
Всем пациентам основной группы выполнили лапароскопическую резекцию/энуклеацию почки. В че тырех (20%) случаях резекционный этап производили без пережатия почечных сосудов, в 16 (60%) — в условиях тепловой ишемии почечной паренхимы (путем временного пережатия почечной артерии), медиана длительности которой составила 21 мин (10–32) мин. Энуклеация выполнена в 6 (30%), резекция — в 14 (70%) случаях. Резекция элементов собирательной системы потребовалась в ходе четырех (20%) операций. Для осуществления гемостаза формировали гемостатические швы, при необходимости дополнительно использовали электрокоагуляцию и тканевой герметик. Вскрытые элементы собирательной системы герметично ушивали.
Всем пациентам групп сравнения (2-я и 3-я группы) выполнена радикальная нефрэктомия (открытая — 20, лапароскопическая — 20). У пациентов, которым было выполнено органоуносящее оперативное лечение, чаще всего опухоли почки характеризовались преимущественно эндофитным (15 (37,5%)) или полностью эндофитным ростом (17 (42,5%)). Опухолевая инвазия собирательной системы заподозрена у 12 (30%) больных. При этом ни у одного пациента после хирургического лечения не было радиологически определяемых опухолевых очагов. Дополнительное противоопухолевое лечение не применялось ни в одном наблюдении. Осложнения по классификации Clavien — Dindo не превышали I класс во всех группах.
Степень дифференцировки опухоли (Fuhrman grade) установлена у всех больных раком почки: G1– 27 (45%), G2-24 (40%), G3-3 (5%), G4-6 (10%).
Пациенты, подвергнутые радикальной нефрэктомии (люмботомическим или лапароскопическим доступом), и группа резекции почки были сопоставимы по полу, возрасту, частоте выявления сопутствующих заболеваний, потенциально влияющих на почечную функцию, операционному риску, стороне поражения, стадии рака почки и исходной СКФ ( р >0,05 для всех) (табл. 1).
Для математического и статистического анализа полученных результатов использовались пакеты компьютерных программ Statistica v6.0 (StatSoft Inc.), SPSS 19.0 for Windows (SPSS Inc.), Microsoft Office Excel. Рассчитывали медиану и квартильный диапазон (25%; 75%). Различия в клинических данных и клинические переменные сравнивали с помощью ранговых корреляций Спирмена и t -критерия. Различия считали значимыми при р <0,05.
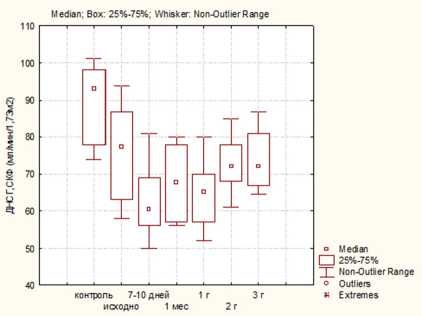
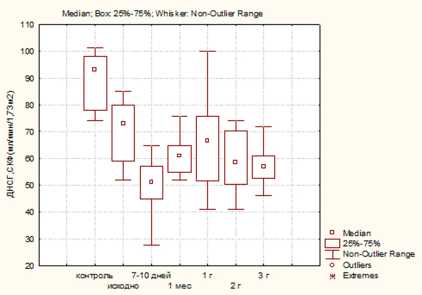
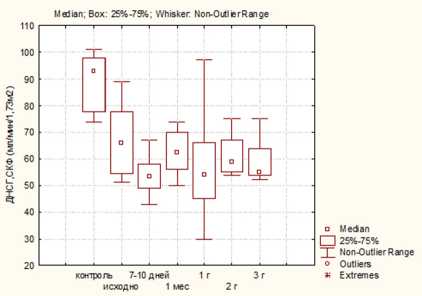
Результаты. Выполняемая всем пациентам исходная оценка функции почек на дооперационном этапе с применением ДНСГ не выявила существенных различий между группами больных ( р ≥0,05). Наряду с этим у большинства больных в группах выявлено достоверное снижение СКФ по сравнению с контролем. Так, медиана СКФ составила 76, 66 и 77 ммоль/л в 1, 2 и 3-й группах соответственно и 93 ммоль/л — в группе контроля ( р <0,05) (рис. 1)
В ранний послеоперационный период отмечается дальнейшее снижение СКФ также во всех группах,
Таблица 1
Клиническая характеристика исследуемых групп больных
|
Группы больных |
Пол |
Средний возраст, лет |
СКФ, мл/мин/1,73 м2 |
Оценка по шкале Padua, балл |
|
|
муж. |
жен. |
||||
|
Резекция почки лапароскопическим доступом |
11 |
9 |
52,6 |
76 |
4–5 |
|
Нефрэктомия лапароскопическим доступом |
12 |
8 |
64,3 |
66 |
5–8 |
|
Открытая нефрэктомия |
13 |
7 |
58,6 |
77 |
4–8 |
а)
а)
б)
б)
в)
Рис. 1. Динамическая ангионефросцинтиграфия с определением скорости клубочковой фильтрации при различных видах оперативного лечения почечно-клеточного рака.
Определение скорости клубочковой фильтрации: а — после лапароскопической резекции; б — после лапароскопической нефрэктомии; в — после открытой нефрэктомии
в)
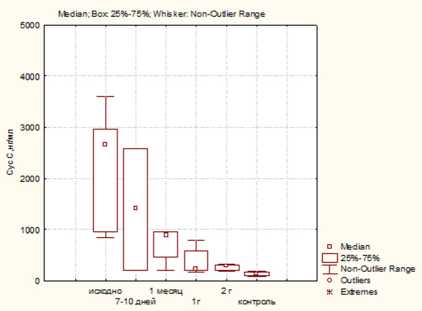
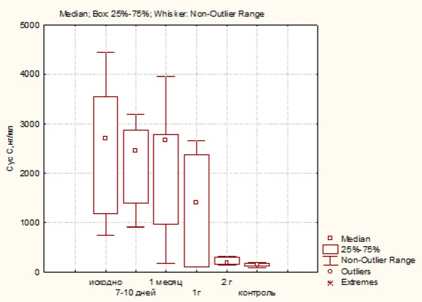
Рис. 2. Динамика цистатина С в группах больных ПКР в различные сроки послеоперационного периода определение цистатина С:
а — после лапароскопической резекции (ЛР); б — после лапароскопической нефрэктомии (ЛН); в — после открытой нефрэктомии (ОН)
максимально выраженное у пациентов 3-й группы. При этом стабилизация функции наиболее быстро отмечалась у больных после лапароскопической резекции (ЛР). Вместе с тем через три года после вмешательства достоверно более высокие значения также были выявлены у пациентов после ЛР ( р ≤0,05). Как видно из рис. 1, медиана СКФ-ДНСГ через три года после вмешательства составила 72, 57 и 54 ммоль/л в 1, 2 и 3-й группах соответственно.
Таким образом, через три года после нефрэктомии большинство пациентов имели ХБП С3а-стадии, что свидетельствует о высокой вероятности сердечно-сосудистых событий у данных пациентов в средне-отдаленном периоде.
Содержание цистатина С во всех группах больных ПКР имело статистически значимое повышение по сравнению с контролем (2664, 3103 и 2709 нг/мл в 1,2 и 3-й группах против 143 нг/мл соответственно) ( p ≤0,05). При этом в ранний послеоперационный период и в последующем отмечается постепенное снижение уровней цистатина С во всех группах, в то же время после ЛР отмечается наиболее быстрое снижение показателя и уже через год после операции его значения сопоставимы с контрольными. После нефрэктомии концентрация цистатина С в сыворотке крови сохраняется высокой и более года после операции, а через два года его значения сопоставимы с группой контроля (рис. 2).
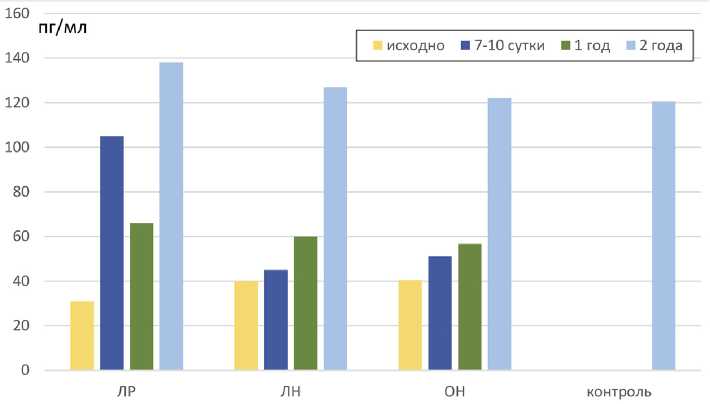
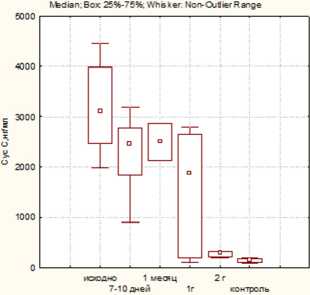
Рис. 3. Динамика TGF-^ в группах больных почечно-клеточным раком в различные сроки послеоперационного периода: после лапароскопической резекции (ЛР); лапароскопической нефрэктомии (ЛН); «открытой» нефрэктомии (ОН)
При этом обращает на себя внимание отсутствие четкой зависимости между концентрацией цистатина С в сыворотке крови и СКФ у больных ПКР. Кроме того, имеется обратная корреляция между размерами опухоли и величиной цистатина С ( r =0,6; р ≤0,05).
Значения TGF-^ в сыворотке крови исходно во всех группах больных были сопоставимы и не превышали контрольные значения (рис. 3). В ранний послеоперационный период отмечался наиболее значимый прирост данного показателя у больных 1-й группы ( p ≥0,05), который в последующем (через два года наблюдения) сохранялся, но также не имел статистически значимых различий по сравнению с контролем.
Обсуждение . Хотя резекция почки, несомненно, приводит к сохранению значительной массы действующих нефронов и более высокой послеоперационной функции почек в среднем, все еще существуют противоречия относительно преимуществ данного объема оперативного вмешательства с точки зрения результатов выживания. Так, и резекция и нефрэктомия при ПКР приводят к определенному функциональному дефициту и хирургической травме с немедленной активацией механизмов прогрессирования нефросклероза, что служит морфологическим проявлением почечного повреждения. Почечное повреждение после хирургического лечения ПКР, как правило, сопровождается острым нарушением функции почек/почки в ранний послеоперационный период, а впоследствии может привести к формированию ХБП, сопровождающейся развитием атрофических и склеротических процессов в паренхиме и строме [15].
Немаловажное значение для принятия решения относительно объема оперативного лечения имеет исходная функция почек у больного ПКР. В проведенном исследовании у большинства больных ПКР в группах выявлено достоверное снижение СКФ по сравнению с контролем. Однако СКФ<60 мл/мин на 1,73 м2 выявлялась у незначительного числа больных 2-й и 3-й групп. Учитывая, что потеря части действующей паренхимы почки в результате хирургического вмешательства должно рассматриваться как фактор риска ухудшения функции почек с течением времени, проведенная работа является весьма актуальной в эпоху роста ХБП и должна способство- вать привлечению внимания к оценке функции почек у больных ПКР как в ранний послеоперационный, так и в средне-отдаленный периоды. Известно, что инцидентная ХБП, определяемая как СКФ<60 мл/мин на 1,73 м2, сохраняющаяся в течение трех месяцев или более, имеет клиническое значение независимо от основной причины ее возникновения [3].
В последних рекомендациях международной организации, занимающейся проблемами ХБП и ее исходов во всем мире (Kidney Disease: Improving Global Outcomes (KDIGO)), подчеркивается, что не все ХБП одинаковы и что ХБП следует определять не только по расчетной СКФ, но также по этиологии и степени альбуминурии. При этом ХБП, возникающая в первую очередь за счет хирургического удаления нефронов — так называемая «хирургическая» ХБП, может иметь лучший прогноз, чем ХБП вследствие непрерывно прогрессирующего ХБП любой другой этиологии [16]. Аргумент, который часто приводится для сведения к минимуму риска развития ХБП после нефрэктомии, заключается в том, что нет убедительных доказательств последующего снижения СКФ (прогрессирующей ХБП) у пациентов с «хирургической» ХБП. В проведенном исследовании продемонстрировано, что в ранний послеоперационный период отмечается дальнейшее постепенное снижение СКФ во всех группах пациентов, максимально выраженное у больных 3-й группы. Потеря части действующей паренхимы почки в результате хирургического вмешательства должна рассматриваться как фактор риска ухудшения функции почек с течением времени. В данной работе проводилось наблюдение за пациентами не только в ранний послеоперационный период, но и на протяжении трех лет после вмешательства. Через три года после вмешательства медиана СКФ-ДНСГ у исследованных больных составила 72, 57 и 54 ммоль/л в 1, 2 и 3-й группах соответственно. Таким образом, в данной работе доказано, что у большей части пациентов с ПКР, даже не имеющих исходно значимого снижения СКФ на доопера-ционном этапе, происходит развитие и дальнейшее прогрессирование «хирургической» ХБП через три года после оперативного лечения.
Ряд фундаментальных исследований подтверждают мнение о том, что ХБП, развившаяся у больных ПКР после нефрэктомии, связана с большим ри- ском смертности по сравнению с пациентами после операции, имеющими СКФ> 60 мл/мин на 1,73м2. В частности, на основании исследования, проведенного в Кливлендской клинике и включившегое 4246 пациентов с ПКР, доказано, что если оперативное вмешательство при ПКР может привести к развитию «хирургической» ХБП, то, вероятно, лучше выбрать хирургический подход, который сохранит новую исходную СКФ на относительно высоком уровне, т. е. более 45 мл/мин/1,73 м2, если это возможно [17].
Наряду с этим резекция почки обеспечивает специфическую выживаемость при раке, эквивалентную радикальной нефрэктомии, и технически осуществима как минимум у 50% пациентов с опухолями c T1b. При этом сохранение почечной функции было значительно лучше у пациентов с резекцией почки [1]. Эти данные согласуются с результатами проведенного исследования. В данной работе у пациентов 1-й группы после лапароскопической резекции отмечалась достаточно быстрая стабилизация функции почки и ее последующее сохранение через три года после операции.
Несмотря на то, что многие пациенты, имеющие ХБП после оперативного лечения ПКР, не будут иметь дальнейшего значительного снижения СКФ, сохраняя стабильную функцию почек на протяжении длительного времени, данные пациенты имеют более высокие показатели смертности и риск сердечно-сосудистых заболеваний по сравнению с пациентами без ХБП [3]. Потому важно соотносить послеоперационную СКФ с тяжелыми клиническими конечными точками. Как видно из проведенного исследования, через три года после нефрэктомии большинство пациентов 2-й и 3-й групп имели нарушение функции почек, соответствующее ХБП С3а, что свидетельствует о высокой вероятности сердечно-сосудистых событий у данных пациентов в средне-отдаленный период после операции.
Несмотря на то, что считается доказанной тесная связь концентрации цистатина С в сыворотке крови с СКФ (обратная корреляция), в проведенном исследовании не получено четкой зависимости между данными величинами. Значительное повышение концентрации цистатина С у больных ПКР в данном случае обусловлено другими механизмами. В частности, повышение циркулирующего цистатина С может быть обусловлено активацией провоспалительных механизмов в послеоперационный период. Кроме того, как известно, высокие уровни цистатина С противодействуют передаче сигналов TGF-^, замедляя раковую инвазию, опухолевый рост и метастазирование [18, 19].
В проведенном исследовании концентрации TGF-^ были сопоставимы в группах и не превышали референсные значения, в связи с чем не отмечено четкой взаимосвязи между данными показателями. Отсутствие значимого повышения уровня TGF-^ может служить благоприятным прогностическим признаком в отношении канцерспецифической выживаемости. При этом нарушение экспрессии генов, участвующих в адгезии и ремоделировании внеклеточного матрикса, коррелирует с плохой выживаемостью при ПКР [13].
Учитывая, что локальная сверхэкспрессия циста-тина С может привести к успешному снижению метастазирования в экспериментальной модели опухоли, более высокие исходные значения цистатина С, сохраняющиеся через год после операции, полученные в исследовании у больных 2-й и 3-й групп, вероятно, обусловлены необходимостью высокой противоопухолевой активности данного маркера у больных ПКР [11]. Подобная находка должна обращать внимание клиницистов в плане дальнейшего более интенсивного наблюдения за больными, имеющими высокие уровни данного маркера в отдаленный послеоперационный период. Кроме того, у пациентов после нефрэктомии отмечалось более значимое снижение функции почек и низкие показатели СКФ через три года после лечения, что также может приводить к повышению цистатина С как маркера почечного повреждения.
Таким образом, почечная травма, возникающая при резекции почки, менее выражена, по сравнению с нефрэктомией, независимо от вида доступа, и в последующем не приводит к развитию нефрофиброза в оперированной почке. Низкие значения TGF-^ в сыворотке крови обследованных больных также демонстрируют низкий риск дальнейшего прогрессирования опухолевого процесса и метастазирования у пациентов во всех группах.
Что касается результатов единственного рандомизированного исследования EORTC для доказательства того, что ХБП после хирургического сокращения массы нефрона имеет меньшее клиническое значение, чем ХБП по другим причинам [7], то проведенная работа также опровергает полученные в ней результаты и подтверждает отсутствие убедительной доказательной базы.
В данной работе обоснована необходимость проведения дальнейших исследований, учитывающих, помимо стандартных параметров, возраст пациента и исходную функцию почек, а также поиск дальнейших показателей, позволяющих индивидуализировать подход к хирургическому лечению больных ПКР
Заключение. У большей части пациентов с ПКР, даже не имеющих исходно клинически значимой ХБП, в послеоперационный период происходит инициация и дальнейшее прогрессирование «хирургической» ХБП, сохраняющиеся через три года после оперативного лечения, менее выраженное у больных после лапароскопической резекции почки.
В функциональном отношении нефронсберега-ющая хирургия предпочтительнее радикальной нефрэктомии. Однако для оценки канцер- и кардио-специфической выживаемости при различных видах хирургического вмешательства требуется более длительное наблюдение.
Цистатин С, являющийся признанным маркером почечной дисфункции, может рассматриваться в качестве предиктора высокой противоопухолевой активности у больных ПКР и требует более пристального наблюдения в отдаленный послеоперационный период.
Оценка уровня TGF-^ в сыворотке крови не продемонстрировала значимых изменений в зависимости от вида и объема оперативного лечения, а также стадии опухолевого процесса, в связи с чем его использование у пациентов ПКР не имеет клинического значения.
Определение показаний к резекции почки при наличии опухоли стадии T2 будет более обосновано при детальном изучении исходного функционального состояния почечной паренхимы.
Список литературы Клиническое значение цистатина С и TGF-pi в оценке почечной функции при хирургическом лечении почечно-клеточного рака
- Liu X, Huang X, Zhao P, Zhang P. Survival benefit of nephron-sparing surgery for patients with pT1b renal cell carcinoma: A population-based study. Oncol Lett 2020; 19 (1): 498-504.
- Campbell S, Uzzo RG, Allaf ME, et al. Renal mass and localized renal cancer: AUA guideline. J Urol 2017; 198 (3): 520-9.
- Ellis RJ. Chronic kidney disease after nephrectomy: a clinically-significant entity? Transl Androl Urol 2019; 8 (2): S 166-S174.
- Patel HD, Pierorazio PM, Johnson MH. Renal Functional Outcomes after Surgery, Ablation, and Active Surveillance of Localized Renal Tumors: A Systematic Review and Meta-Analysis. Clin J Am Soc Nephrol 2017; 12 (7): 1057-69.
- Mir MC, Derweesh I, Porpiglia F. Partial Nephrectomy Versus Radical Nephrectomy for Clinical T1b and T2 Renal Tumors: A Systematic Review and Meta-analysis of Comparative Studies. Eur Urol 2017; 71 (4): 606-17.
- Kim SP, Thompson RH, Boorjian SA, et al. Comparative effectiveness for survival and renal function of partial and radical nephrectomy for localized renal tumors: a systematic review and meta-analysis. J Urol 2012; (188): 51-7.
- Van Poppel H, Da Pozzo L, Albrecht W, et al. A prospective, randomised EORTC intergroup phase 3 study comparing the oncologic outcome of elective nephron-sparing surgery and radical nephrectomy for low-stage renal cell carcinoma. Eur Urol 2011; (59): 543-52.
- Cozzi DA, Ceccanti S, Cozzi F. Renal function up to the 5th decade of life after nephrectomy in childhood: a literature review. Nephrology 2018; (23): 397-404.
- Cherdantseva TM, Bobrov IP, Varlamov SV, et al. Prognostic value of matrix metalloproteinase 9 in renal cell carcinoma. Cancer Urology 2018; 14 (3): 17-24. Russian (Чер-данцева Т. М., Бобров И. П., Варламов С. В. и др. Прогностическое значение исследования матриксной металлопротеиназы-9 при почечно-клеточном раке. Онкоурология 2018; 14 (3): 17-24).
- Kolwijck E, Kos J, Obermajer N, et al. The balance between extracellular cathepsins and cystatin C is of importance for ovarian cancer. Eur J Clin Invest 2010; (40): 591-9.
- Xu Y, Ding Y, Li X, Wu X. Cystatin C is a disease-associated protein subject to multiple regulation. Immunol Cell Biol 2015; 93 (5): 442-51.
- Isaka Y. Targeting TGF-p Signaling in Kidney Fibrosis. Int J Mol Sci 2018; 19 (9): 2532.
- Bogusiawska J, Rodzik K, Popiawski P. TGF-P1 targets a microRNA network that regulates cellular adhesion and migration in renal cancer. Cancer Lett 2018; (412): 155-69.
- Ning J, Zhao Y, Ye Y. Opposing roles and potential antagonistic mechanism between TGF-p and BMP pathways: Implications for cancer progression. E Bio Medicine 2019; (41): 702-10.
- Tarasenko AI, Rossolovsky AN, Berezinets OL, et al. Biomarkers of renal damage and immunohistochemical detection of oncogenesis in the surgical treatment of renal cell carcinoma. Saratov Journal of Medical Scientific Research 2018; 14 (3): 420-6. Russian (Тарасенко А. И., Россоловский А. Н., Берези-нец О. Л. и др. Экспрессия биомаркеров почечного повреждения и иммуногистохимическая детекция онкогенеза при хирургическом лечении почечно-клеточного рака. Саратовский научно-медицинский журнал 2018; 14 (3): 420-6).
- Lane BR, Demirjian S, Derweesh IH, et al. Survival and functional stability in chronic kidney disease due to surgical removal of nephrons: importance of the new baseline glomerular filtration rate. Eur Urol 2015; (68): 996-1003.
- Wu J, Suk-Ouichai C, Dong W, et al. Analysis of survival for patients with chronic kidney disease primarily related to renal cancer surgery. BJU Int 2018; (121): 93-100.
- Sokol JP, Schiemann WP. Cystatin C antagonizes transforming growth factor beta signaling in normal and cancer cells. Mol Cancer Res 2004; 2 (3): 183-95.
- Jakos T, Pislar A, Jewett A, Kos J. Cysteine Cathepsins in Tumor-Associated Immune Cells. Front Immunol 2019; (10): 2037.


