Клинико-фармакологические особенности лекарственных взаимодействий опиоидов у пациентов с хроническим болевым синдромом в практической онкологии
Автор: Боброва Ольга Петровна, Шнайдер Наталья Алексеевна, Зырянов Сергей Кенсаринович, Дыхно Юрий Александрович, Петрова Марина Михайловна, Насырова Регина Фаритовна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 6 т.17, 2018 года.
Бесплатный доступ
Цель исследования - анализ отечественной и зарубежной литературы о влиянии лекарственных взаимодействий опиоидов на индивидуальный выбор схем анальгетической терапии в онкологии. материал и методы. Поиск источников производился в системах PubMed, Scopus, Web of Science, E-library. Результаты. В обзоре показано клиническое значение фармакокинетических взаимодействий опиоидов с другими лекарственными средствами в рамках анальгетической терапии хронического болевого синдрома в онкологии. Освещаются вопросы индивидуального выбора анальгетиков разных групп в условиях коморбидности и сопутствующей лекарственной терапии с целью обеспечения эффективности/безопасности стратегии лечения, влияющей на качество жизни пациентов со злокачественными новообразованиями. заключение. Комплексная оценка факторов у пациентов, получающих опиоидные анальгетики, является предиктором эффективной и безопасной анальгетической терапии.
Лекарственные взаимодействия, опиоиды, хронический болевой синдром, коморбидность, злокачественные новообразования, анальгетики, лекарственная терапия, антидепрессанты, тамоксифен, антимикотики
Короткий адрес: https://sciup.org/140254221
IDR: 140254221 | УДК: 616-006:616-009.7-08-06:615.212.7 | DOI: 10.21294/1814-4861-2018-17-6-114-122
Текст обзорной статьи Клинико-фармакологические особенности лекарственных взаимодействий опиоидов у пациентов с хроническим болевым синдромом в практической онкологии
Многокомпонентный характер анальгетической терапии у пациентов с хроническим болевым синдромом (ХБС) онкологического генеза, согласно анальгетической лестнице ВОЗ, как правило, предопределяет риск лекарственных взаимодействий (ЛВД) как между анальгетиками и адъювантами, так и с лекарственными средствами (ЛС), назначенными для коррекции коморбидной патологии [1]. Доля пациентов, получающих опиоидную терапию, подвергающихся ЛВД, составляет 27–58 % [2], при этом ЛВД является причиной смерти примерно у 4 % больных с онкопатологией [3]. Однако точная распространенность ЛВД среди больных со злокачественными новообразованиями (ЗНО) неизвестна из-за разных схем и методов существующих исследований и популяций. ЛВД составляют значительную причину заболеваемости и смертности во всем мире, поскольку они могут приводить к снижению/инактивации терапевтического эффекта ЛС или усилению их токсичности, нарушая приверженность терапии [2, 3]. Медикосоциальный характер ХБС и его масштабность с учетом имеющихся прогнозов по нарастанию частоты ЗНО в России и мире [4], необходимая длительность приема анальгетиков, отсутствие ре-
комендаций и стандартов медицинской помощи по персонализированному выбору опиоидов в условиях онкологического заболевания предопределили проведение данного исследования.
Цель исследования – анализ отечественной и зарубежной литературы о влиянии фармакокинетических лекарственных взаимодействий опиоидов на индивидуальный выбор эффективных и безопасных схем анальгетической терапии в онкологии.
Материал и методы
Проведен поиск русско- и англоязычных статей в научных базах PubMed, Scopus, Web of Science, E-library по ключевым словам: опиоиды, лекарственные взаимодействия, фармакокинетика, хронический болевой синдром, онкология, персонализация, обзор литературы, opioids, druginteractions, pharmacokinetics, chronic pain syndrome, oncology, personalization, literature review.
Результаты и обсуждение
Охарактеризовано 18 семейств цитохрома Р-450(CYP) [5], являющихся основными ферментами биотрансформации и катализирующих, как правило, первую фазу метаболических превращений ЛС [5]. Ведущую роль в метаболизме
|
Ферменты биотрансформации опиоидов |
таблица 1 |
|||||
|
МНН |
CYP2D6 |
CYP3А4 |
CYP2В6 |
CYP2С8 |
UGT2B7 |
UGT1A1 |
|
Бупренорфин |
+ |
+ |
++ |
|||
|
Фентанил |
+ |
++ |
||||
|
Оксикодон |
Активация |
++ |
+ |
|||
|
Тапентадол |
+ |
++ |
||||
|
Трамадол Морфин |
Активация |
++ |
+ |
++ |
+ |
|
Примечание: МНН – международное непатентованное наименование; ++ – основной путь метаболизма; + – альтернативный путь метаболизма.
таблица 2
Субстраты, индукторы и ингибиторы ферментов CYP2d6 и CYP3a4 [12, 13] с модификацией о.П. Бобровой и соавт. [10]
|
Субстраты |
Ингибиторы |
Индукторы |
|
Антиаритмические: флекаинид, лидокаин, мекси- |
CYP2D6 Антиаритмические: амиодарон, |
Рифампицин |
|
летин, пропафенон |
хинидин |
дексаметазон |
|
Антипсихотики: галоперидол, перфеназин, рисперидон, тиоридазин, зуклопентиксол Антидепрессанты: венлафаксин, дулоксетин, флуоксетин, флувоксамин Трициклические антидепрессанты: амитриптилин, кломипрамин, дезипрамин, доксепин, имипрамин, нортриптилин, сертралин Блокаторы Н1 гистаминовых рецепторов : метоклопрамид, тамоксифен, фенформин, дифенгидрамин, лоратадин Бета-адреноблокаторы : карведилол, метопролол, пропранолол, тимолол, алпренолол, небиволол Другие ЛС: амфетамин, хлофенирамин, декстрометорфан, золпидем Таргетные ЛС: гефитиниб, иматиниб |
Антипсихотики: галоперидол, хлорпромазин Антидепрессанты: циталопрам, эс-циталопрам, флуоксетин, пароксетин, сертралин, дулоксетин Трициклические антидепрессанты: кломипрамин Блокаторы Н2 гистаминовых рецепторов : ранитидин, циметидин Блокаторы Н1 гистаминовых рецепторов : хлорфенирамин Другие ЛС: целекоксиб, доксорубицин, ритонавир, тербинафин CYP3А4 |
Антагонисты кальциевых каналов: амлодипин, дилтиазем, фелодипин, никардипин, нифедипин, верапамил
Статины: аторвастатин, ловастатин, симвастатин Статины: симвастатин
Статины: аторвастатин, ловастатин, симвастатин, флувастатин
Сердечно-сосудистые ЛС: амиодарон, дигоксин, Антиаритмики: амиодарон, хинидин ивабрадин, варфарин, клопидогрель, дронедарон, прасугрел
Ингибиторы фосфодиэстеразы: силденафил, Ингибиторы фосфодиэстеразы: тадалафил, бензодиазепины, алпразолам, клоназе- тадалафил пам, мидазолам, триазолам, диазепам, лоразепам
Психоактивные ЛС: бромкриптин, карбамазепин, галоперидол, рисперидон, вальпроаты, венлафаксин, циталопрам, флуоксетин
Снотворные: золпидем, зопиклон, диазепам Антибиотики: азитромицин, кларитромицин, эритромицин, олеандомицин
Противогрибковые: итраконазол, кетоконазол, тербинафин
Химиопрепараты: циклофосфамид, доцетаксел, доксорубицин, этопозид, гефитиниб, ифосфамид, паклитаксел, винбластин, винкристин, иматиниб, эрлотиниб, метотрексат, винорельбин, паклитаксел Гормональные ЛС: тамоксифен, эстрадиол, лево-норгестрол, тестостерон, фулвестрант, дексаметазон, преднизолон, анастразол
Другие: гранисетрон, глибенкламид, финастерид, галантамин, лансопразол, лоперамид, лоратадин, ондансетрон, репаглинид, тамсулозин, трописе-трон, лапатиниб, трастузумаб
Психоактивные ЛС: клоназепам, флуоксетин, флувоксамин, галоперидол, нортриптилин, сертралин
Психоактивные ЛС: фенобарбитал, антиконвульсанты, карбабазепин, окскарбамазе-пин, фенитоин, вальпроаты, кофеин
Антибиотики: ципрофлоксацин, кларитромицин, эритромицин, джоза-мицин, норфлоксацин, олеандомицин, рокситромицин, телитромицин Противогрибковые: клотримазол, флуконазол, итраконазол, миконазол, вориконазол
Химиопрепараты: иматиниб, иринотекан
ГормональныеЛС: тамоксифен, левоноргестрол, этинилэстрадиол, ралоксифен
Другие: циметидин, дисульфирам, метилпреднизолон, бергамот (грейпфрутовый сок)
таблица 3
Изоферменты цитохрома р 450, участвующие в метаболизме антидепрессантов [20]
Известно, что метаболизм опиоидов в печени представлен двумя фазами [6]. Методу конъюгации (глюкуронирования) – ІІ фаза метаболизма с участием фермента уридиндифосфатглюкуро-нозилтрансферазы (UGT) – подвержены морфин, бупренорфин и тапентадол, имеющие наименьший потенциал ЛВД [9]. Однако морфин, бупренорфин и тапентадол, подвергающиеся в основном глюку-ронированию, сохраняют риск фармакодинамических взаимодействий с адъювантными ЛС [10], что необходимо учитывать в клинической практике.
Паллиативное лечение онкологических пациентов, как правило, значимо повышает риск ЛВД, приводящих к изменению эффективности и/или токсичности опиоидной терапии [11]. Известно, что многие ЛС являются ингибиторами или индукторами изоферментов CYP2D6 и CYP3A4, характеризуясь сильным или слабым влиянием на метаболизм (табл. 2).
Блокирование метаболизма CYP2D6 и CYP3A4 приводит к возрастанию концентрации опиоидов, вызывая токсичность [14], и, наоборот, активация метаболизма вышеупомянутых изоферментов приводит к снижению терапевтического эффекта, так как пациент приобретает фенотипический статус, соответствующий измененному метаболизму. Блокада CYP2D6 хинидином изменяет фармакокинетические параметры оксиморфона и нороксиморфона, уменьшая активность на 40 и 80 % соответственно [15]. Активность CYP3A в результате ЛВД может варьировать в 400 раз [16]. Учитывая риск ЛВД, необходимо помнить, что тамоксифен, диклофенак, налоксон, карбамазепин, трициклические антидепрессанты (ТЦА) и
бензодиазепины являются ингибиторами UGT2B7, что может привести к повышенной опиоидной чувствительности и реализации нежелательных побочных реакций (НПР) [17].
Морфин не обладает фармакокинетическими ЛВД с габапентином, тогда как AUC габапентина значительно (на 44,4 %) увеличилась в результате фармакодинамического взаимовлияния [18].
Лекарственные взаимодействия опиоидов с антипсихотиками
Известно, что изоферменты CYP2D6, CYP1A2 и CYP3A4 играют ведущую роль в метаболизме антипсихотиков, входящих в состав комплексной анальгетической терапии ХБС [19]. Хотя изофермент CYP2D6 в центральной нервной системе максимально экпрессируется в мозжечке, а изофермент CYP3А4 – в нейронах мозжечка, стриатума, гиппокампа, базальных ганглиев и коры лобной доли больших полушарий головного мозга [20], печеночное содержание этих изоферментов играет основную роль в метаболизме ЛС, включая опиоиды и антидепрессанты [21] (табл. 3). Антидепрессанты венлафаксин, пароксетин, флуоксетин, сертралин ингибируют изофермент CYP2D6 [21], флувоксамин ингибирует CYP1A2.
Одновременное применение антидепрессантов в программах комплексной анальгетической терапии с опиоидами-пролекарствами (трамадол, кодеин, оксикодон) с превалирующим CYP2D6-метаболизмом может приводить к развитию НПР за счет избыточного накопления ЛС в крови при достижении насыщения изоферментов метаболизма через 4–5 периодов полувыведения последних [6], при применении опиоидов (морфин, фентанил, та-пентадол) – к неэффективности анальгезии соответственно. Использование селективных ингибиторов обратного захвата серотонина (СИОЗС) (например, пароксетина, венлафаксина) с трамадолом способствует реализации серотонинового синдрома за счет более высоких уровней (+) энантиомера трамадола, связанного с серотонинергической активностью [22], что необходимо учитывать при проведении комбинированной анальгетической терапии в клинической онкологии. Необходимо учитывать, что ингибиторы изофермента CYP2D6 (антидепрессанты и другие ЛС) также при взаимо-
действии с субстратами способствуют повышению активности последних (табл. 2, 3), предопределяя развитие НПР.
Барбитураты и антиконвульсанты (карбамазепин, окскарбазепин, фенитоин) представляют собой индукторы изофермента CYP3A4 [23], и при их совместном назначении вместе с препаратами CYP3A4-ассоциированного метаболизма (галоперидол, клозапин, кветиапин) приводят к субтерапевтической концентрации субстратов, что требует коррекции дозового режима. Кроме того, показано, что изофермент CYP2C19 участвует в метаболизме диазепама, а изофермент CYP3A4 – в метаболизме альпразолама, клоназепама, мидазолама и триазолама [23], что может требовать учета субстратной активности в условиях коморбидной патологии.
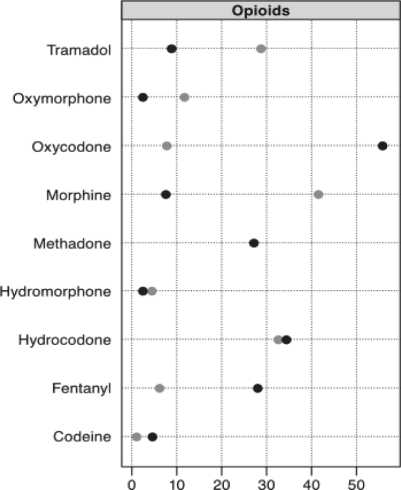
Кроме антидепрессантов субстратами, ингибиторами изоферментов цитохрома P450 являются некоторые сердечно-сосудистые ЛС, антибиотики, антимикотики, противовирусные и многие другие, что необходимо учитывать при определении объема терапии в условиях коморбидности. В зарубежном ретроспективном когортном исследовании, выполненном в 2008–10 гг. с включением 57 752 больных с ХБС, проанализирован отпуск опиоидов по результатам коммерческих заявок и электронных баз и показано, что частота фармакокинетических ЛВД составляет 5,7 % случаев (3 302 чел.). Расходы, связанные с терапией последствий ЛВД за 90-дневный период лечения опиоидами, составили $ 3 366 против $ 2 757 при отсутствии ЛВД с разницей в $609 в мес. Среди наблюдаемых пациентов 97,7 % имели ЛВД, из них 83,3 % – за счет ингибирования изофермента CYP3A4, 11,9 % – за счет ингибирования изофермента CYP2D6, 57,3 % – за счет индукции изофермента CYP 3A4 [24]. Частота ЛВД у оксикодона составляла 57,3 %, у фентанила – 32,9 %, у метадона – 18,3 %, у кодеина – 1,8 %. Частота ЛВД у ЛС по сопутствующей терапии составляла 34,5 % у флуконазола, 14 % – у дилтиазема, 11,4 % – у кларитромицина, 10,9 % – у верапамила (рис. 1). Время реализации CYP-ассоциированного ЛВД при 90-дневном наблюдении составило 25,4 дня
(18,6; 2,4 и 4,8 дня для ингибирования 3А, индукции 3А и ингибирования 2D6 соответственно). Структура наиболее частых ЛВД представлена на рис. 2 [24].
Пищевые лекарственные взаимодействия опиоидов
Способностью влиять на активность системы цитохромов Р450 обладают и продукты питания, а также никотин и другие вещества. Соединения, содержащиеся в соках, могут обеспечивать фармакокинетические взаимодействия с опиоидами, благодаря влиянию на скорость метаболических превращений ферментов биотрансформации, активность транспортеров [25]. Показано, что грейпфрутовый, клюквенный, сок помеллы, лайма и карамболя снижает активность изофермента CYP3A4. Причем минимальное влияние на CYP3A4 грейпфрутового сока показано при одновременном применении фентанила [26]. Также грейпфрутовый сок ингибирует гликопротеин Р, ОАТР-А, ОАТР-В и ОАТР-С [26]. Блокирование изофермента CYP3A4 также может быть вызвано чесноком и компонентами нефильтрованного кофе, кафетолом, зверобоем [26]. Влияние соков на активность изофермента CYP2D6 остается малоизученным.
Лекарственные взаимодействия опиоидов с тамоксифеном
Известно, что тамоксифен метаболизируется преимущественно CYP2D6- и CYP3A-зависимыми путями до 4-гидрокси-тамоксифена и эндоксифена, имеющих активность, в 30–100 раз большую, за счет плотности связывания с рецепторами эстрогенов, которая в 100 раз выше, чем у тамоксифена [27]. Блокирование изофермента CYP2D6 повышает риск рецидива гормонпозитивного рака молочной железы за счет блокирования образования метаболитов, что требует назначения альтернативной терапии ингибиторами ароматазы вместо тамоксифена. Совместное применение тамоксифена и СИОЗС также снижает эффективность противоопухолевой терапии за счет ингибирования изофермента CYP2D6 антидепрессантом [27].
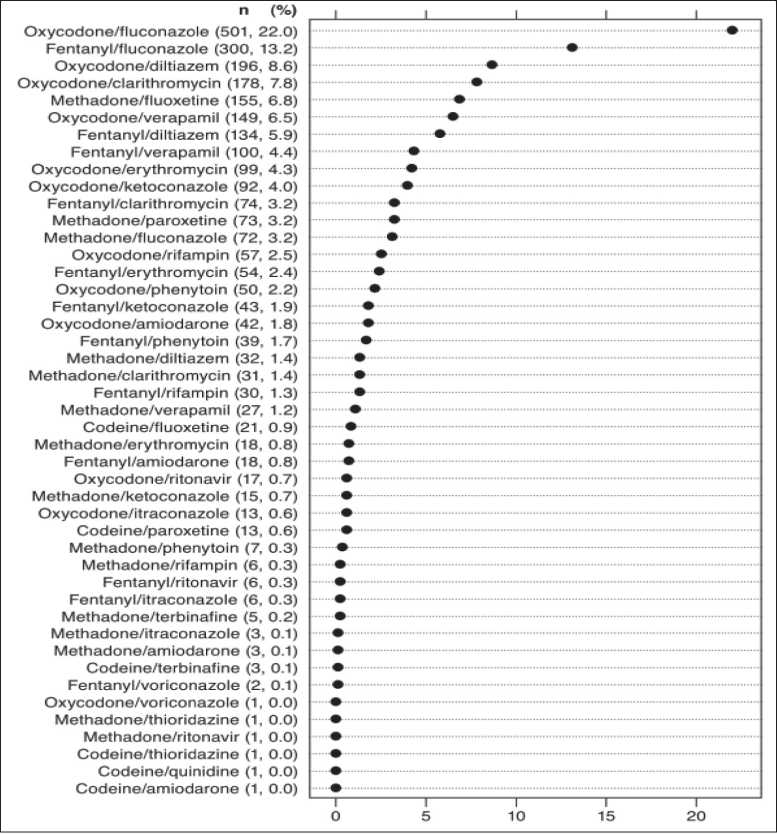
Рис. 1. Частота лекарственных взаимодействий опиоидов [24]
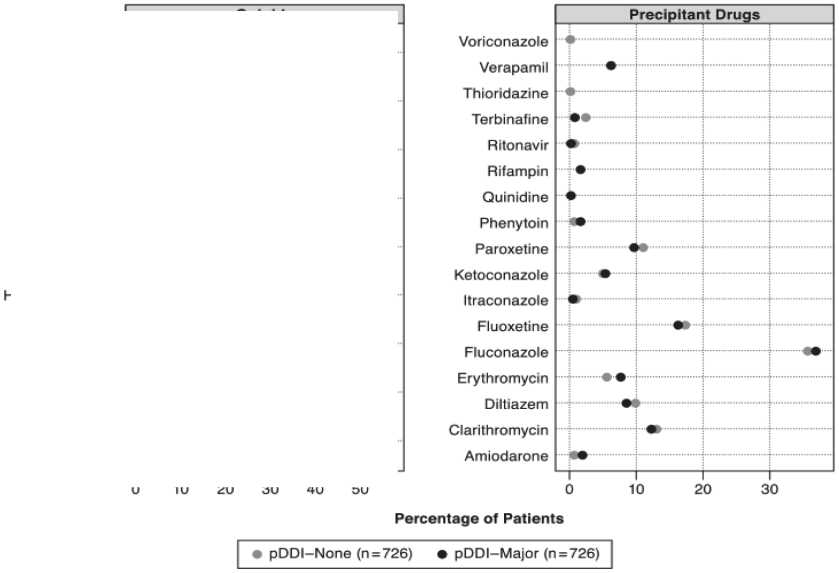
Рис. 2. Структура наиболее частых лекарственных взаимодействий опиоидов (результаты когортного исследования) [24]
Лекарственные взаимодействия опиоидов с антимикотиками
В многочисленных исследованиях показано различающееся влияние противогрибковых средств на фармакокинетические параметры опиоидов у здоровых добровольцев [28]. В частности, у здоровых добровольцев мужчин увеличивалась площадь под фармакокинетической кривой (AUC) бупренорфина при сопутствующей терапии вориконазолом и позаконазолом [28]; у фентанила в комбинации с вориконазолом показано снижение плазменного клиренса на 23 % и 16 % соответственно; у морфина сульфата в комбинации с итраконазолом продемонстрировано увеличение концентрации в плазме морфина на 28 %; оксикодон в комбинации с вориконазолом увеличивал AUC0-∞ в 3,6 раза соответственно за счет метаболического шунта. Основным механизмом влияния антимикотиков на фармакокинетику опиоидов является ингибирование гликопротеина P. Однако кетоконазол усиливает болеутоляющее действие и НПР (например, тошноту, сонливость и зуд) у оксикодона. Итраконазол существенно не влияет на уровень глюкуронидов M3G и M6G и фармакодинамические эффекты морфина. Поэтому следует проявлять осторожность, особенно у пациентов, получающих кетоконазол, вориконазол или флуконазол во время длительного лечения фентанилом, чтобы избежать респираторных депрессий, вызванных повышенной концентрацией фентанила [29].
Взаимодействие трамадола с противогрибковыми агентами тербинафином (ингибитор CYP2D6) и итраконазолом (ингибитор CYP3A4) у здоровых людей приводило к увеличению AUC0-∞, Cмах и периода полувыведения орального трамадола 50 мг на 115, 53 и 48 % соответственно. Напротив, итраконазол оказывал незначительное влияние на фармакокинетику трамадола [28].
Ингибирование изофермента CYP3A кетоконазолом у пациентов с ХБС уменьшает фармакокинетические параметры оксикодона и метаболитов
Список литературы Клинико-фармакологические особенности лекарственных взаимодействий опиоидов у пациентов с хроническим болевым синдромом в практической онкологии
- Summers K.H., Puenpatom R.A., Rajan N., Ben-Joseph R., Ohsfeldt R. Economic impact of potential drug - drug interactions in opioid analgesics. J Med Econ. 2011; 14 (4): 390-96. DOI: 10.3111/13696998.2011
- van Leeuwen R.W.F., Swart E.L., Boven E., Boom F.A., Schuitenmaker M.G., Hugtenburg J.G. Potential drug interactions in cancer therapy: a prevalence study using an advanced screening method. Ann Oncol. 2011 Oct; 22 (10): 2334-41. DOI: 10.1093/annonc/mdq761
- Buajordet I., Ebbesen J., Erikssen J., Brørs O., Hilberg T. Fatal adverse drug events: the paradox of drug treatment. J Intern Med. 2001; 250: 327-341.
- Siegel R., Ma J., Zou Z., Jemal A. Cancer statistics. CA Cancer J Clin. 2014 Jan-Feb; 64 (1): 9-29. DOI: 10.3322/caac.21208
- Kapur B.M., Lala P.K., Shaw J.L. Pharmacogenetics of chronic pain management. Clin Biochem. 2014 Sep; 47 (13-14): 1169-87. DOI: 10.1016/j.clinbiochem.2014.05.065


