Клинико-гемодинамический профиль и нейрогуморальные показатели у больных идиопатической легочной гипертензией в зависимости от результатов острой фармакологической пробы
Автор: Парамонов В.М., Мартынюк Т.В., Дадачева З.Х., Данилов Н.М., Масенко В.П., Чазова И.Е.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2016 года.
Бесплатный доступ
Цель: оценить клинико-гемодинамические профиль, ней-рогуморальные показатели у пациентов с ИЛГ в зависимости от сохранности резерва вазореактивности легочных артерий. Материал и методы: в исследование был включен 131 больной ИЛГ (средний возраст 32,4±3,2 год). Всем больным проводилось рутинное лабораторное обследование (общий и биохимический анализы крови, коагулограмма), тест 6-минутной ходьбы (Т6МХ), трансторакальная ЭхоКГ, рентгенография органов грудной клетки, катетеризация правых отделов сердца (КПОС) с острой фармакологической пробой (ОФП) с использованием одного или двух вазодилататоров (ВД). С целью исследования нейрогуморального статуса проводился анализ уровня 6-кето-ПгF1β, NO, ЭТ-1, норадреналина, адреналина, NT-proANP, NT-proBNP (НУП), активность ренина, AII, альдостерона (РААС). Результаты: были установлены значительные отличия кли-нико-гемодинамического профиля и нейрогуморальных показателей у больных ИЛГ в зависимости от наличия (ОФП+) и отсутствия (ОФП-) резерва вазореактивности легочных артерий (ЛА). Все больные ФК IV и наибольшее количество пациентов с ФК III относились к группе с ОФП-, когда существенно большее число больных с ФК I и II относилось к ОФП+. При проведении Т6МХ больные ИЛГ с сохранным резервом вазо-дилатации дистанция была существенно больше при меньшей выраженности одышки, чем больные из группы ОФП-. В группе с ОФП- был определен больший уровень систолического давления в легочной артерии (СДЛА). При сравнении данных КПОС все гемодинамические показатели в группах значительно различались, прогностически лучшие данные отмечены группе с ОФП+. По данным рентгенографии органов грудной клетки группа с ОФП- имела достоверно больший КТИ. При сравнительной оценке показателей нейрогумораль-ного статуса, РААС, НУП и АРП независимо от результата ОФП обнаруживались значительные отклонения в группах. Заключение: у группы пациентов с ОФП+ по сравнению с группой с ОФП- отмечен более сохранный клинико-гемо-динамический и функциональный статус. Для больных ИЛГ с ОФП- в отличие от ОФП+ характерны изменения нейрогу-морального профиля в виде дефицита простациклина (ПЦ) и оксида азота (NO), активации РААС и НУП.
Идиопатическая лёгочная гипертензия, острая фармакологическая проба, катетеризация правых отделов сердца, нейрогуморальные показатели
Короткий адрес: https://sciup.org/14342808
IDR: 14342808
Текст научной статьи Клинико-гемодинамический профиль и нейрогуморальные показатели у больных идиопатической легочной гипертензией в зависимости от результатов острой фармакологической пробы
|
Сведения об авторах: |
|
|
Мартынюк Тамила Витальевна |
д.м.н., руководитель лаборатории легочной гипертензии ИКК им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ, тел.: 8-495-414-64-50 |
|
Чазова Ирина Евгеньевна |
член-корр. РАН, профессор, и.о. генерального директора ФГБУ РКНПК Минздрава РФ, директор ИКК им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ, руководитель отдела гипертонии, тел.: 8-495-414-63-05 |
|
Масенко Валерий Павлович |
д.м.н., профессор, руководитель отдела нейрогуморальных и иммунологических исследований ИКК им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ, тел.: 8-495-414-64-56 |
|
Данилов Николай Михайлович |
к.м.н., старший научный сотрудник отдела гипертонии ИКК им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ, тел.: 8-495-414-68-34 |
|
Дадачева Заира Хаджимурадовна |
аспирант отдела гипертонии ИКК им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ, тел.: 8-495-414-60-03 |
|
Автор, ответственный за связь с редакцией: Парамонов Виталий Михайлович |
аспирант отдела гипертонии ИКК им. А.Л. Мясникова ФГБУ РКНПК Минздрава РФ, тел.: 8-495-414-60-03, paramonov.v.m@mail.ru , 121552, г. Москва, ул. 3-я Черепковская, 15 а |
Легочная гипертензия (ЛГ) – это группа заболеваний, при которых отмечается прогрессирующее повышение легочного сосудистого сопротивления (ЛСС) и давления в легочной артерии (ДЛА), приводящее к дилатации правых отделов сердца, развитию и декомпенсации правожелудочковой сердечной недостаточности и преждевременной гибели пациентов.
В Российских рекомендациях по диагностике и лечению легочной гипертензии (2007 г.) диагноз ЛГ устанавливается при уровне среднего давления в легочной артерии (ДЛАср.) >25 мм рт. ст. в покое и >30 мм рт. ст. при физической нагрузке, подтвержденный данными катетеризации правых отделов сердца (КПОС). С 2013 г. критерий повышения ДЛАср. при физической нагрузке исключен из рекомендации. Для здоровых людей уровень ДЛА ср. составляет в среднем 14±3 мм рт. ст. и не превышает 20 мм рт. ст. [1]
В 1951 г. под термином «первичная ЛГ» (ПЛГ) подразумевалась ЛГ неизвестной этиологии, являясь диагнозом «исключения» [2]. В 2003 г. на III Всемирном симпозиуме, посвященном проблеме ЛГ, термин "ПЛГ" был заменен на термин "идиопатическая легочная гипертензия" (ИЛГ). ИЛГ – это клиническое состояние, характеризующееся прекапиллярной формой легочной гипертензии (ЛАГ) при отсутствии других причин повышения ДЛА: заболевания легких, хронической тромбоэмболии легочной артерии, наследуемыми формами ЛАГ; ЛАГ, возникшую на фоне приема лекарственных препаратов или на фоне воздействия токсинов; ЛАГ, развившуюся вследствие наличия системных заболеваний соединительной ткани (СЗСТ), портальной гипертензии, ВИЧ-инфекции, врожденных пороков сердца (ВПС) (системно-легочных шунтов) и др.
С целью подтверждения диагноза ИЛГ, оценки тяжести течения заболевания, определения прогноза всем пациентам с ЛАГ показано проведение КПОС. Критериями постановки диагноза являются: ДЛАср. более 25 мм рт. ст. в покое, давление заклинивания (ДЗЛА) менее 15 мм рт. ст., ЛСС более 3 мм рт. ст./л/мин. (единицы Вуда). После верификации диагноза показано проведение острых фармакологических проб (ОФП) для решения вопроса о выборе ЛАГ специфической терапии. При проведении ОФП используются вазодилататоры короткого действия, влияющие на малый круг кровообращения: простагландин Е1 (ПГ Е1) и ингаляционный оксид азота. Способ введения ПГ Е1 внутривенный в стартовой дозе 5 нг/кг/мин. до достижения лечебной дозы 30 нг/кг/мин. длительностью до 40 минут. Оксид азота применяется в виде ингаляций со скоростью от 20 до 40 ppm (частиц на миллион в газовой смеси) длительность до 5 минут. Критериями положительной пробы считаются следующие показатели: снижение ДЛАср. Не менее чем на 10 мм рт. ст. с достижением абсолютного значения ниже 40 мм рт. ст. с увеличением или отсутствием динамики сердечного выброса (СВ) [3]. При достижении критериев положительной ОФП возможно назначение пациентам препаратов из группы блокаторов кальциевых каналов с возможностью достижения стойкого клинического эффекта; у пациентов из группы ОФП- клинический эффект не достигается, а прогноз выживаемости намного ниже.
Цель: провести сравнительный анализ клинико-гемодинамических параметров, нейрогуморальных показателей у пациентов с ИЛГ в зависимости от результата ОФП.
В данное исследование был включен 131 пациент с верифицированным диагнозом ИЛГ, средний возраст больных составил 32,4±3,2 год. После проведения КПОС с ОФП все больные были разделены на 2 группы в зависимости от наличия и отсутствия запаса вазореактивности легочных артерий. Достоверной разницы по возрасту, времени до верификации диагноза от появления симптомов, длительности течения болезни и ИМТ в группах с ОФП- и ОФП+ не отмечалось, в отличие от данных Sitbon O, который указывал на более молодой возраст больных с ОФП+ [4].
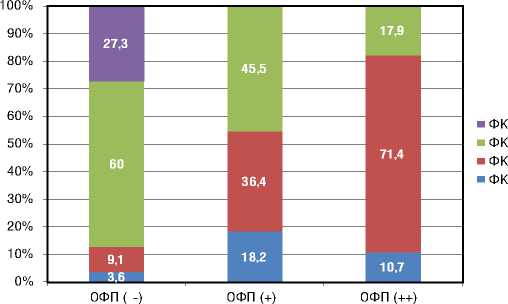
Отсутствие резерва вазореактивности ЛА чаще отмечалось у больных ИЛГ мужского пола (80%) по сравнению с женщинами (57,6%) (p=0,049). Более частая ОФП- у мужчин также отмечается в других исследованиях, в которых было выявлено, что больные ИЛГ мужского пола имели худшую выживаемость по сравнению с женщинами [5, 6, 7]. При анализе данных Т6МХ у пациентов с ОФП+ отмечалась достоверно большая Д6МХ (433,94±77,89м) по сравнению с пациентами с ОФП- (320,04±108,19м) и сопровождалось менее выраженной одышкой по шкале Борга (2,59±1,46 и 4,25±1,86 балл, соответственно). Наибольшее количество больных с ФК I и II относились к группе с ОФП+, при том что к ФК III относилось большее количество пациентов из группы ОФП-, а ФК IV имели только пациенты с отсутствием резерва вазореактивности.
Характеристики с достоверными различиями между группами суммированы в таблице 1.
При выполнении корреляционного анализа была выявлена отрицательная корреляционная взаимосвязь между ФК и Д6МХ (r=-0,766; р=0,004). В литературе имеются указания на более сохранный функциональный статус (ФК, Д6МХ), менее выраженные нарушения гемодинамики у больных с ОФП+ [8,9].
При сопоставлении 2 групп по ЧСС в покое у пациентов с ОФП+ составляло 77,51±8,92 уд/мин. По сравнению с пациентами с ОФП- (86,19±12,55 уд/мин.). В тоже время отмечалась разница САД и ДАД в группах: САД (97,3±9,1 и 93,2±13,1 мм рт. ст., р>0,05 ) и ДАД (73,9±5,8 и 69,1±15,0 мм рт. ст., р>0,05), соответственно.
94 больным проводилось ОФП с поочередным применением 2 ВД ингаляционного NO и в/в ПГ Е1, по результатам которой пациенты были разделены на 3 группы: ОФП-, ОФП+, ОФП++ (достижение критериев положительной ОФП с поочередным применением NO и в/в ПГ Е1). При сравнении групп наиболее благоприятный клинико-функциональный статус отмечался в группе ОФП++, к ФК II относилось 71,4% больных, и наименьшее количество пациентов к ФК III (17,9%). Более детальные данные отражены в графике (рис. 1).
Таблица 1. Показатели клинико-гемодинамического статуса у больных ИЛГ в зависимости от результата ОФП
|
Параметры |
Больные с ИЛГ |
Р |
|
|
Группа ОФП- (n= 80) |
Группа ОФП+ (n=51) |
||
|
Возраст, годы |
36,46±11,55 |
33,94±9,48 |
>0,05 |
|
Пол, м/ж (n, %) |
16/ 64 20%/ 80% |
4/ 47 7,8%/ 92,2% |
0,049 |
|
Длительность периода от дебюта симптомов до верификации ИЛГ, годы |
2,78±1,58 |
2,51±1,85 |
>0,05 |
|
Индекс массы тела, кг/м2 |
24,61±5,47 |
23,99±3,75 |
>0,05 |
|
ФК I/ II/ III/ IV (n, %) |
2 2,5%/8 10%/ 49 61,3%/ 21 26,3% |
5 9,8%/ 34 66,7%/12 23,5%/ 0 0% |
<0,000001 |
|
Д6МХ, м |
320,04±108,19 |
433,94±77,89 |
0,0000001 |
|
Индекс по Боргу, баллы |
4,25±1,86 |
2,59±1,46 |
0,0000005 |
|
ЧСС, уд/мин. |
86,19±12,55 |
77,51±8,92 |
0,00003 |
|
Рентгенография органов грудной клетки: КТИ, % |
52,92±5,28 |
50,39±3,42 |
0,006 |
|
ЭхоКГ: |
|||
|
ПЗРПЖ, см |
4,29±0,92 |
3,64±0,75 |
0,00005 |
|
Толщина передней стенки ПЖ, см |
0,78±0,19 |
0,71±0,18 |
0,04 |
|
КДРЛЖ, см |
3,73±0,51 |
4,37±0,39 |
0,0000001 |
|
СДЛА, мм рт. ст. |
102,11±25,99 |
80,14±22,25 |
0,000003 |
|
КПОС: |
|||
|
СДЛА, мм рт. ст. |
101,41±24,88 |
80,14±15,53 |
0,000001 |
|
ДДЛА, мм рт. ст. |
47,17±14,34 |
34,41±8,79 |
0,0000002 |
|
ДЛАср, мм рт. ст. |
66,21±17,99 |
51,22±9,05 |
0,0000008 |
|
ДППср., мм рт. ст. |
11,07±5,23 |
5,98±3,16 |
0,0000004 |
|
ДЗЛА, мм рт. ст. |
7,78±3,73 |
5,43±2,75 |
0,0001 |
|
СВ, л/мин |
3,11±0,86 |
4,13±1,05 |
0,0000005 |
|
СИ, л/мин/м2 |
1,85±0,46 |
2,46±0,57 |
0,0000001 |
|
УО, мл |
41,71±14,27 |
59,14±15,86 |
0,0000008 |
|
ЛСС, дин x сек x см-5 |
1439,94±667,16 |
935,51±479,55 |
0,000008 |
|
SaO2/ SvO2, % |
93,63±5,99/ 58,31±9,34 |
97,09±2,55/ 67,62±7,93 |
0,0001 |
Рисунок 1. Функциональный статус больных с ИЛГ на момент установления диагноза в зависимости от результатов ОФП (n+94)
IV III II
I
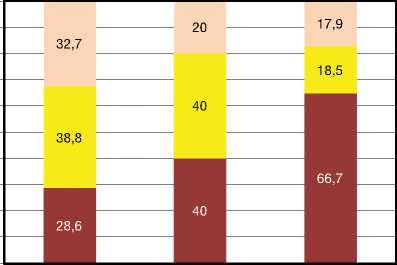
По результатам рентгенографии органов грудной клетки в группе с ОФП+ отмечался меньший КТИ (50,39±3,42% по сравнению с 52,92±5,28). При анализе данных ЭхоКГ в группе пациентов с ОФП- отмечалось достоверно более высокие цифры СДЛА, более выраженная дилатация и гипертрофия ПЖ, большее смещение ЛП и ЛЖ (КДР ЛЖ 3,73±0,51 по сравнению с 4,37±0,39см). Данные неинвазивного измерения СДЛА соответствовали результатам КПОС. При проведении КПОС удалось выявить существенные различия между группами с ОФП- и ОФП+ практически по всем измеренным и расчетным показателям (табл. 1). Стоит отметить, что при сравнении степени клапанных регургитаций достоверных различий в группах с ОФП- и ОФП+ выявлено не было. При дополнительном анализе в группе с ОФП++ у наибольшего числа больных (66,7%) отсутствовала регургитация на клапане ЛА, отмечалась значимо меньшая частота регургитации на клапане ЛА 1 и 2 степени по сравнению с группами ОФП- и ОФП+ (рис. 2).
100%
0%
Рисунок 2. Выраженность регургитации на клапане легочной артерии у больных с ИЛГ на момент установления диагноза (n+94)
90%
80%
70%
60%
50%
40%
30%
20%
10%
Степень2
Степень 1
Степень 0
ОФП ( -)
ОФП (+)
ОФП (++)
Также отмечались различия в группах при оценке рутинных лабораторных анализов: общий и биохимический анализы крови и коагуология. Дополнительно результаты лабораторных анализов сравнивались с группой контроля. В общем анализе крови в 2 группах признаки воспаления (лейкоци-тоз/ускорение СОЭ) отсутствовали. Уровни вчСРБ в группах с ОФП- и ОФП+ были в пределах нормальных значений и достоверно не различались: 0,20 [0,1; 0,37] и 0,18 [0,1; 0,34]мг/мл. Достоверное различие отмечалось по уровню гемоглобина и гематокрита, более высокий уровень показателей отмечался в группе ОФП-, что обусловлено более выраженным компенсаторным механизмом, направленным на уменьшение тканевой гипоксии [10]. Также в группе с ОФП- отмечались более выраженные прокоагуляционные изменения по сравнению с группой ОФП+ и группой контроля, выявлялись более высокий уровень тромбоцитов в сочетании с повышенным уровнем Д-димера, фибриногена, а также пониженным уровнем антитромбина III (табл. 2).
В биохимическом анализе крови у пациентов с отсутствием запаса вазореактивности по сравнению с группой с ОФП+ и группой контроля отмечалось значительное повышение уровня печеночных трансаминаз, общего билирубина. Изменения характеризовались застойными явлениями в большом круге кровообращения и, соответственно, нарушением функции печени. Как показатель нарушения метаболизма и окислительного процесса у больных группы ОФП- был повышен уровень мочевой кислоты; как известно, повышение уровня данного фактора ассоциирован с неблагоприятным прогнозом [7].
Показатели нейрогуморального статуса (ТхВ2, норадреналин, NT–proBNP, АII и альдостерон) у всех больных ИЛГ вне зависимости от результата ОФП превышали показатели группы контроля. В группе с отсутствием резерва вазодилатации отмечалось значительное снижение уровня ВД – ПЦ и NO, выраженной активацией РААС, НУП (табл. 3). При сохранном резерве вазодилатации уровень 6-кето-ПГF1 β и NO были в рамках нормальных значений, а уровень АРП в основном не отличался от группы контроля. Концентрация ЭТ-1 в среднем превышала контрольные значения. Дополнительно стоит отметить, что только в группе с ОФП- уровень адреналина был ниже нормы.
Коррелляционный анализ уровня ТхВ2 и 6-кето-ПГF1 β и гемодинамических параметров по данным КПОС (ДППср., СДЛА, ДДЛА, ДЗЛА) показал высокодостоверную положительную взаимосвязь концентраций ТхВ2 с ДППср. (r=0,562, p<0,01); обратная, но недостоверная связь определялась между уровнями 6-кето-ПГF1 β и ДППср. (r=-0,392, p=0,1). Существенных взаимосвязей между уровнями исследуемых вазоактивных медиаторов (ВАМ) и ДЛА не выявлялось.
Анализируя полученные данные можно заключить, что величина ДППср. у больных с ИЛГ достоверно коррелируется с содержанием в периферической крови ТхВ2 и 6-кето-ПГF1 β , а в меньшей степени с уровнем ДЛА. У группы пациентов с отсутствием резерва вазореактивности самый высокий уровень ТхВ2 и наибольший дефицит 6-кето-ПГF1 β был сопоставим с более высокими значениями ДППср. и ДЛА. При отсутствии очевидных взаимосвязей уровней этих ВАМ с ПЗРПЖ в группе с ОФП- выявлялась достоверная обратная корреляционная связь с концентрациями 6-кето-ПГF1 β (r=-0,658, p<0,05).
Как известно, вазоконстрикция и прокоагуляция непосредственно взаимосвязаны с повреждением и дисфункцией эндотелия, о чем свидетельствовали сниженный уровень 6-кето-ПГF1 β у пациентов из группы ОФП-. С целью уточнения коагуляционных нарушений и повышение вазомоторного тонуса дополнительно оценивались показатели уровня антагониста ПЦ тромбоцитарного происхождения – ТхВ2. У пациентов с ИЛГ вне зависимости от результатов ОФП уровни ТхВ2 оказались существенно повышенными, что позволяет предположить значительный вклад активации тромбоцитов как источника образования ТхВ2 в патогенез заболевания. Более выраженный дисбаланс в системе ТхВ2/6-кето-ПГF1 β отме-
ТЕРАПИЯ ЛЕГОЧНОЙ ГИПЕРТЕНЗИИ СЕГОДНЯ И ЗАВТРА

Ji -^
Ревацио силденафила цитрат таблетки 20 мг
Начать и продолжить с уверенностью
Ревацио® эффективен и безопасен у пациентов с легочной гипертензией:14
Повышает переносимость физических нагрузок
Улучшает ФК Л Г13
Повышает выживаемость14
Хорошо переносится1
КРАТКАЯ ИНСТРУКЦИЯ ПО МЕДИЦИНСКОМУ ПРИМЕНЕНИЮ ПРЕПАРАТА РЕВАЦИО -
Торговое название: РЕВАЦИО-Международное непатентованн силденафил.
Лекарственная форма: таблетки, покрытые пленочной оболочкой. Состав: силденафила цитрат (эквивалентно 20 мг силденафила).
Фармакологические свойства: силденафил - мощный селективный ингибитор циклогуанозин монофосфат (цГМФ)-спвцифичвской фосфодиэстеразы-5 (ФДЭ5).
Показания к применению: легочная гипертензия.
Противопоказания: повышенная чувствительность к любому компоненту препарата. Веноокклюзионная болезнь легких. Совместное применение с донаторами оксида азота или нитратами в любой форме. Совместное применение ингибиторов ФДЭ5, включая силденафил, с гипотензивными средствами - стимуляторами гуанилатциклазы. такими как риоцигуат. Совместное применение с мощными ингибиторами изофермента CYP3A4 (в т.н. кетоконазолом, итраконазолом и ритонавиром) (см. раздел -Взаимодействие с другими лекарственными средствами»). Потеря зрения в одном глазу вследствие передней неартериитной ишемической невропатии зрительного нерва, наследственные дегенеративные заболевания сетчатой оболочки глаза (пигментный ретинит). Тяжелое нарушение функции печени (класс С по классификации Чайлд-Пью). Инсульт или инфаркт миокарда в анамнезе. Тяжелая артериальная гипотензия (систолическое АД менее 90 мм рт. ст., диастолическое АД менее 50 мм рт. ст.). Лактазная недостаточность, галактоземия или синдром глюкозо-галактозной мальабсорбции. Возраст до 18 лет.
Применение при беременности и в период лактации: поскольку адекватные контролируемые исследования применения силденафила у беременных не проводились, применять препарат РЕВАЦИО®во время беременности можно только в том случае, если польза для матери превышает потенциальный риск для плода. Неизвестно, выделяется ли силденафил в грудное молоко. При необходимости применения препарата РЕВАЦИО® в период лактации грудное вскармливание следует прекратить. Способ применения и дозы: принимается внутрь, рекомендуемая доза препарата РЕВАЦИО® - 20 мг 3 раза в сутки с интервалом около 6-8 часов независимо от приема пищи. Максимальная рекомен дуемая доза составляет 60 мг. У пожилых пациентов коррекции дозы не требуется. При нарушении функции почек коррекции дозы не требуется, однако при плохой переносимости препарата дозу снижают до 20 мг 2 раза в сутки. При нарушении функции печени коррекция дозы у пациентов с легким или умеренным нарушением функции печени (классы А и В по классификации Чайлд-Пью) не требуется, однако при плохой переносимости препарата дозу снижают до 20 мг 2 раза в сутки. У пациентов с тяжелым нарушением функции печени (класс С по классификации Чайлд-Пью) применение препарата не исследовалось. Комбинированную терапию препаратом РЕВАЦИО® с другими препаратами для лечения легочной гипертензии следует проводить с осторожностью, возможно, может потребоваться коррекция дозы.
Побочное действие: нежелательные явления при терапии препаратом РЕВАЦИО® отмечались у 1% пациентов. Очень частые: головная боль, гиперемия, диарея, диспепсия, боль в конечностях. Частые: воспаление подкожной клетчатки, грипп, неуточненный синусит, неуточненная анемия, задержка жидкости, бессонница, тревожность, неуточненные нарушения зрения, затуманенное зрение, фото-фобия, хроматопсия, цианопсия, воспаление глаз, покраснение глаз, неуточненный ринит, кашель, заложенность носа, неуточненный бронхит, носовое кровотечение, неуточненный гастрит, неуточненный гастроэнтерит, гастроэзофагеальная рефлюксная болезнь, геморроидит, вздутие живота, сухость во рту, алопеция, эритема, ночные поты, миалгия, боль в спине, гинекомастия, лихорадка.
Особые указания: во избежание осложнений применять строго по назначению врача! Эффективность препарата РЕВАЦИО® у пациентов с тяжелой легочной гипертензией (функциональный класс IV) не доказана. Соотношение польза/риск силденафила у пациентов с легочной гипертензией I функционального класса не установлено. Исследования по применению силденафила в лечении вторичной легочной гипертензии, за исключением легочной гипертензии, связанной с заболеваниями соединительной ткани, и резидуальной легочной гипертензии, не проводились.
Перед назначением ознакомьтесь с полной инструкцией по медицинскому применению препарата РЕВАЦИО®, одобренной М3 РФ, регистрационный номер ЛП 000197-270116 от 27.01.2016.
Список литературы Клинико-гемодинамический профиль и нейрогуморальные показатели у больных идиопатической легочной гипертензией в зависимости от результатов острой фармакологической пробы
- Клинические рекомендации по диагностике и лечению легочной гипертензии 2013; 3.
- Dresdale DT, Michtom RF, Schultz M. Recent studies in primary pulmonary hypertension including pharmacodynamics observations on pulmonary vascular resistance. Bull NY Acad Med 1954; 30:195-207.
- Sitbon O, Humbert M, Jais X et al. Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation. 2005; 111:3105-3111.
- Sitbon O. Brenot F. Denjean A, et al. Inhaled nitric oxide as a screening vasodilator agent in primary pulmonary hypertension. A dose-response study and comparison with prostacyclin. Am J Respir Crit Care Med 1995; 151:384-389.
- Rich S, Dantzker DR, Ayres SM et al. Primary pulmonary hypertension: a national prospective study. Ann Intern Med 1987; 107:216-223.
- Jing ZC,Xu X-Q, Han ZY et al. Registry and survival study in Chinese patients with idiopathic and familial pulmonary arterial hypertension. Chest 2007; 132:373-379.
- Galie N, Hoeper MM, Humbert M et al. Guidelines for the diagnosis and treatment of pulmonary hypertension. The task forse for the diagnosis and treatment of pulmonary hypertension of the European Society of Cardiology and the European Respiratory Society, endorsed by the International Society of Heart and Lung Transplantation. Eur Heart J 2009; 30:2493-2537.
- Hambert M, Sitbon O, Yaici A et al. Survival in incident and prevalent cohorts of patients with pulmonary arterial hypertension. Eur Respir J 2010; 36:549-555.
- Frost AE, Badesh DB, Barst RJ et al. The changing picture of patients with pulmonary arterial hypertension in the United States: how REVEAL differs from historic and non-US Contemporary Registries. Chest. 2011; 139:128-137.
- Чазова И.Е., Мартынюк Т.В. Идиопатическая легочная гипертензия. В кн.: Респираторная медицина (2т.)/Под ред. А.Г. Чучалина. -М.: ГЭОТАР-Медиа, 2007.
- Stewart D.J. (1991г.) и Cacoub P. (1993г.) [Stewart DJ, Levy RD, Cernacek P. Increased plasma endothelin-1 in primary pulmonary hypertension: marker or mediator of disease? Ann Intern Med 1991; 114:464-469.
- Cacoub P, Dorent R, et al. Plasma endothelin and pulmonary pressures in patients with congestive heart failure. I.Am Heart J. 1993 Dec;126(6):1484-8.].
- Gali N, Torbicki A, Barst R, Dartevelle P, Haworth S, Higenbottam T, Olschewski H, Peacock A, Pietra G, Rubin LJ, Simonneau G; Guidelines on diagnosis and treatment of pulmonary arterial hypertension. Grupo de Trabajo sobre el diagn stico y tratamiento de la Hipertensi n Arterial Pulmonar de la Sociedad Europea de Cardiolog a. Rev Esp Cardiol. 2005 May;58(5):523-66.
- Nootens M, Kaufmann E, Rector T, et al. Neurohormonal activation in patients with right ventricular failure from pulmonary hypertension: relation to hemodynamic variables and endothelin levels. J Am Coll Cardiol 1995; 26: 15811585.
- Palmer RM, Ferrige AG, Moncada S. Nitric oxide release accounts for the biological activity of endothelium -derived relaxing factors. Nature 1987; 327:524-526.
- D'Alonzo GE, Barst RJ, Ayres SM et al. Survival in patients with primary pulmonary hypertension: results from a national prospective registry. Ann intern Med 1991; 115:343-349.
- McLaughlin VV, Archer SL, Badesch DB, et al. ACCF/AHA 2009 expert consensus document on pulmonary hypertension a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association developed in collaboration with the American College of Chest Physicians; American Thoracic Society, Inc.; and the Pulmonary Hypertension Association. J Am Coll Cardiol. 2009 Apr 28;53(17):1573-619.
- Nootens M, Wolfkiel CJ, Chomka EV, Rich S. Understanding right and left ventricular systolic function and interactions at rest and with exercise in primary pulmonary hypertension. Am J Cardiol. 1995 Feb 15;75(5):374-7.
- Rabinovitch M. Insights into the pathogenesis of primary pulmonary hypertension from animal models. In: Primary pulmonary hypertension./Edit. By Rubin LJ, Rich S. -New York -Basel -Hong Kong, 1997.


