Клинико-иммунопогическая оценка патологических изменений органа зрения у больных с открытоугольной глаукомой
Автор: Малышева Ю.В., Волкова Н.В., Курсакова Ю.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Глазные болезни
Статья в выпуске: 1 т.16, 2020 года.
Бесплатный доступ
Цель: клиническая оценка нейродегенеративных и воспалительных изменений органа зрения и выявление взаимосвязи этих изменений с концентрацией TGF-p и ММР-9 во влаге передней камеры и в слезной жидкости у больных с развитой стадией открытоугольной глаукомы. Материал и методы. Проведено проспективное обследование 26 пациентов с развитой стадией открытоугольной глаукомы и 22 пациентов без изменений гидродинамики глаза с определением концентрации TGF-p и ММР-9 в слезной жидкости и во влаге передней камеры. Результаты. Выявлено статистически значимое снижение концентрации ММР-9 у пациентов с глаукомой в 1,62 раза в слезной жидкости (р
Матриксная металлопротеиназа 9, открытоугольная глаукома, трансформирующий фактор роста р
Короткий адрес: https://sciup.org/149135514
IDR: 149135514 | УДК: 617.7-007.681
Текст научной статьи Клинико-иммунопогическая оценка патологических изменений органа зрения у больных с открытоугольной глаукомой
Введение. Первичная открытоугольная глаукома признана мультифакторным заболеванием, характеризующимся развитием специфической глаукомной нейрооптикопатии вследствие дистрофических изменений в дренажной системе глазного яблока, повышения внутриглазного давления и нарушения регионарной гемодинамики [1].
Кроме того, существуют данные, что програди-ентное течение глаукомного нейродегенеративного процесса может быть обусловлено наличием хронического воспаления, эндотелиальной дисфункции и нарушением метаболизма тканей [2, 3]. Одной из теорий патогенеза открытоугольной глаукомы является иммунологическая, в связи с чем становится акту-
альным изучение цитокинового профиля у пациентов с глаукомой с прицельным исследованием белков, обладающих про- и противовоспалительной, нейродеге-неративной и фиброгенной активностью [3–5].
Проведены исследования, согласно которым в патогенезе избыточного рубцевания после глаукомной хирургии ключевую роль играет нарушение процессов синтеза и деградации коллагена вследствие дисбаланса про- и антивоспалительных цитокинов и протеолитических ферментов, о действии которых существуют лишь отдельные, несистематизированные сведения [4–6]. Доказано участие трансформирующего фактора роста β (TGF-β) и матриксной металлопротеиназы 9 (ММР-9) в процессах регенерации и репарации тканей, которые регулируют синтез и деградацию коллагена, а также процесс фиброзирования в тканях организма [7–10]. Однако значение этих факторов как в патогенезе глаукомы, так и в механизмах неадекватного формирования путей оттока внутриглазной жидкости после антиглауком-ных операций не выяснено.
Цель: клиническая оценка нейродегенеративных и воспалительных изменений органа зрения и выявление взаимосвязи этих изменений с концентрацией TGF-β и ММР-9 во влаге передней камеры и в слезной жидкости у больных с развитой стадией открытоугольной глаукомы.
Материал и методы. Проведено проспективное обследование 48 пациентов офтальмологического профиля. Исследование придерживалось принципов Хельсинкской декларации. Письменное информированное согласие получено от всех пациентов. В основную клиническую группу включены 26 пациентов с развитой стадией первичной открытоугольной глаукомы в возрасте от 50 до 62 лет с суб- и декомпенсированным уровнем внутриглазного давления на максимальном гипотензивном медикаментозном режиме. Контрольную группу составили 22 пациента соответствующего возраста с наличием начальной катаракты без изменений гидродинамики глаза.
Критерием исключения служило наличие системных, аутоиммунных, ревматоидных заболеваний и сахарного диабета.
Все пациенты клинической группы прооперированы методом непроникающей глубокой склерэктомии (НГСЭ). Пациентам контрольной группы выполнена факоэмульсификация катаракты с имплантацией интраокулярной линзы.
Обследование пациентов проводилось в предоперационном периоде с использованием комплекса высокотехнологичных методов диагностики, в их числе: компьютерная периметрия (Octopus-600); исследование офтальмотонуса и вязкоэластических свойств фиброзной оболочки глаза на приборе ORA; оптическая когерентная томография (ОКТ) центральных отделов сетчатки и диска зрительного нерва (Optovue) с определением средней толщины ганглиозного комплекса сетчатки (ГКС) и слоя нервных волокон сетчатки (СНВС), их изменения в верхних и нижних квадрантах; инструментальное исследование эпителия роговицы с определением его толщины в центральной зоне.
Для стандартизации результатов исследования за 48 часов до операции всем пациентам была отменена местная медикаментозная терапия, а за 28 дней все пациенты клинической группы были переведены на единую схему местной медикаментозной терапии (тимолол, бринзоламид/дорзоламид, бри-монидин). Пациенты контрольной группы никаких местных препаратов не использовали.
Оценка степени воспалительной реакции конъюнктивы проводилась на основании данных биомикроскопии в соответствии с разработанной классификацией.
Так, состояние конъюнктивы определялось степенью выраженности сосудистой инъекции, при этом интактная конъюнктива оценивалась в 0 баллов, сосудистая инъекция от слабой степени до выраженной оценивалась от 1 до 3 баллов соответственно.
Штопорообразный ход сосудов и наличие субконъюнктивальных кровоизлияний соответствовали 1 баллу, а сосудистые шунты в верхнем своде — 2 баллам, которые добавляли к исходной классификации.
Слезную жидкость в количестве 100 мкл забирали капиллярным методом из нижнего конъюнктивального свода перед хирургическим лечением. Забор влаги передней камеры в количестве 100 мкл проводился интраоперационно с помощью инсулинового шприца с иглой 30 gauge. Исследование концентрации TGF-β и ММР-9 в слезной жидкости проводили методом ИФА с использованием набора human TGF-β и human ММР-9 ELISA.
Статистический анализ результатов исследования выполнен с помощью пакета современных статистических компьютерных программ Microsoft Office Excel 2007, Statistica 6.0 и MedCalc v. 18.2.1 и включал следующие этапы:
-
1. Дескриптивный анализ (описательная статистика результатов исследований). Показатели групп проверены на нормальное распределение по критерию Колмогорова — Смирнова. Вариационные ряды сравнивались с применением критерия Манна — Уитни. Для групп из описательной статистики просчитывались: медиана (Ме), интерквартильный размах IQR. Выбранный критический уровень значимости равнялся 5% (р<0,05).
-
2. Многофакторный регрессионный анализ (установления причинной связи) использовался для определения значений ряда зависимых переменных по известным значениям других независимых переменных. Статистической оценкой, отражающей характер вхождения зависимых величин в уравнение, служит коэффициент множественной детерминации R2, описывающий степень согласованных изменений зависимой величины уравнения регрессии независимыми величинами.
Результаты. Выявлено, что средняя толщина СНВС перипапиллярной зоны у пациентов клинической группы варьировалась от 62 до 100 μm, составляя в среднем 77,1±17,3 pm, что на 21,1% меньше, чем у лиц группы контроля (р<0,01) (табл. 1).
Сравнительный анализ показателей толщины ганглиозного комплекса сетчатки пациентов обеих групп установил ее статистически значимое снижение при глаукоме в среднем на 20,8% относительно здоровых лиц (р<0,001).
Показатели объема глобальных (GLV) и фокальных потерь (FLV), которые считаются наиболее значимыми критериями повреждения ганглиоцитов, их дендритов и аксонов, при глаукоме были статистически значимо повышены: GLV в 10 раз, а FLV в 30 раз относительно показателей группы контроля (см. табл. 1).
Качественная оценка состояния диска зрительного нерва (ДЗН) показала наличие преимущественного истончения СНВС в верхне- или нижнетемпоральных отделах перипапиллярной сетчатки у 96% больных глаукомой, что соответствовало классификационным критериям развитой стадии заболевания.
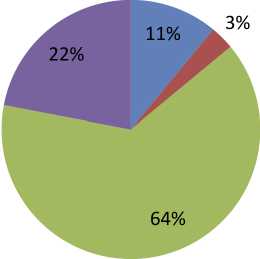
Выявленные периметрические дефекты четко соответствовали структурным изменениям ДЗН и ганглиозного комплекса сетчатки у пациентов клинической группы. Так, у пациентов с преимущественным сегментарным истончением СНВС в нижнетемпоральном отделе (11 %) имелись относительные и абсолютные парацентральные скотомы в верхненосовом квадранте. При значительном истончении СНВС в верхних и нижних отделах перипапиллярной сетчатки у 22% пациентов наблюдалось сужение периферических границ поля зрения до 15–20° от точки фиксации. У большинства пациентов (48%) отмечались аркуатные скотомы в проекции зоны Бьерума в верхней половине поля зрения и в области назальной ступеньки с депрессией более 10 дб. (рис. 1).
Наиболее информативными критериями, отражающими среднюю потерю светочувствительности
Таблица 1
Структурные изменения слоя нервных волокон сетчатки и ганглиозного комплекса сетчатки у больных с открытоугольной глаукомой по данным оптической когерентной томографии
|
Показатель |
ОУГ, n=26 |
Контроль, n=22 |
Манна–Уитни, p |
|
Медиана (IQR) |
Медиана (IQR) |
||
|
Средняя толщина CНВС, µm |
74,0 (64,5–84,0) |
95,5 (93,0–102,0) |
<0,01 |
|
Средняя толщина СНВС в верхнем сегменте, µm |
72,0 (67,0–86,0) |
98,5 (89,0–101,0) |
<0,01 |
|
Средняя толщина СНВС в нижнем сегменте, µm |
69,5 (63,0–84,0) |
99,0 (90,0–104,0) |
<0,001 |
|
Средняя толщина ГКС, µm |
73,2 (70,0–79,9) |
94,2 (92,4–99,7) |
<0,001 |
|
Средняя толщина ГКС в верхнем сегменте, µm |
73,8 (70,7–81,1) |
94,5 (92,9–101,9) |
<0,001 |
|
Средняя толщина ГКС в нижнем сегменте, µm |
72,8 (66,9–79,1) |
96,04 (94,2–99,7) |
<0,001 |
|
Объем глобальных потерь (GLV), % |
22,2 (14,9–26,6) |
2,4 (0,4–3,2) |
<0,001 |
|
Объем фокальных потерь (FLV), % |
3,9 (3,6–6,2) |
0,2 (0,1–0,2) |
<0,01 |
П р и м е ч а н и е : СНВС — слой нервных волокон сетчатки; ГКС — ганглиозный комплекс сетчатки; IQR — интерквартильный размах; ОУГ — открытоугольная глаукома.
и глубину очаговых изменений в поле зрения, являются показатели MD и sLV. У лиц основной клинической группы показатель MD варьировался от 0,5 до 14,1 для области исследования 30° и в среднем составил 6,9±6,1, что значительно превышало данные группы контроля (р<0,01). При исследовании центрального поля зрения в пределах 10° показатель MD основной клинической группы превышал значения здоровых людей более чем в 2,8 раза (р<0,001). Выявлена также значительная вариабельность показателя sLV, отражающего степень и глубину периметрической депрессии, у больных глаукомой от 1,8 до 8,2 для 30° и от 1,1 до 6,7 для 10° исследования.
Исследование уровня внутриглазного давления (ВГД) и характеристик резистентности оболочек глаза показало, что тонометрическое ВГД у больных глаукомой в среднем составило 24,1±3,5 мм рт. ст., что превышало значение группы контроля в 1,3 раза (р<0,001) и соответствовало критериям включения в группу исследования (наличие суб-/декомпенси-рованного ВГД на максимальной гипотензивной медикаментозной терапии). Подобные соотношения сохранялись и при проведении сравнительного анализа роговично компенсированного и истинного внутриглазного давления. Данные показатели у пациен- тов с глаукомой составили 24,3±11,2 и 23,7±9,6 мм рт. ст. и превышали значения группы контроля в 1,54 и 1,52 раза соответственно (р<0,05).
Корнеальный гистерезис, отражающий не только вязкоэластические свойства роговицы, но и их взаимосвязь с индивидуальным уровнем офтальмотонуса, в обеих группах находился в референтных пределах. Однако при глаукоме он был снижен в среднем на 20,8% по сравнению с группой контроля и составил 8,2±1,9. Это свидетельствовало о том, что имеющийся уровень ВГД не являлся толерантным для пациентов основной клинической группы [11]. При этом выявлено, что пациенты основной клинической группы с целью снижения ВГД использовали в среднем 2,9±1,1 препарата длительностью не менее трех лет, что и послужило одним из основных показаний к хирургическому лечению.
Воспалительная реакции конъюнктивы у больных глаукомой, которая оценивалась согласно разработанной шкале, составила в среднем 1,4±1,3 балла, что статистически значимо превышало значения группы контроля (р<0,05). При этом имелись четкие различия качественных характеристик. У пациентов клинической группы в 72% случаев наблюдалась умеренная сосудистая инъекция и фолликулярная
-
■ Верхненазальные скотомы
-
■ Нижненазальные скотомы
-
■ Аркуатные скотомы в зоне Бьерума и в области назальной ступеньки
-
■ Сужение периферических границ до 15-20° с назальной стороны
Рис. 1. Периметрические дефекты у пациентов с глаукомой и их распределение, %
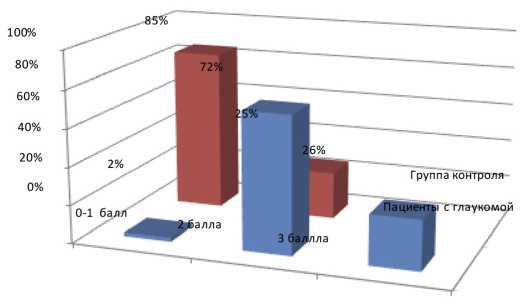
Рис. 2. Распределение пациентов с открытоугольной глаукомой и группы контроля в зависимости от степени воспалительной реакции конъюнктивы (0–3 баллов), % реакция преимущественно нижнего конъюнктивального свода, в 3% — сосудистые шунты бульбарной конъюнктивы в области верхнего свода. В целом при оценке степени выраженности конъюнктивальной реакции от 0 до 3 баллов установлено, что у пациентов с глаукомой преобладала сосудистая реакция в 2 балла (72% случаев). В 26% случаев состояние сосудов конъюнктивы соответствовало 3 баллам, и лишь в 2% наблюдалась слабая степень конъюнктивальной инъекции, оцениваемая в 0–1 балл (рис. 2). У пациентов же контрольной группы в 85% случаев состояние конъюнктивы соответствовало 0–1 баллам, не было выявлено ни одного пациента с суммарной оценкой клинического состояния конъюнктивы свыше 2 баллов.
В то же время при оценке толщины эпителия роговицы у пациентов исследуемых групп значимой разницы не наблюдалось (р>0,05).
Оценка иммунологических показателей позволила получить следующие результаты: концентрация TGF-β в слезной жидкости у пациентов с ОУГ составила 221,3±140,0 пг/мл, во влаге передней камеры 360,9±189,8 пг/мл, в то время как уровень TGF-в в слезной жидкости и во влаге передней камеры пациентов группы контроля оказался ниже чувствительности метода его определения.
Вместе с тем выявлено статистически значимое снижение концентрации ММР-9 у пациентов с глаукомой в 1,6 раза в слезной жидкости (р<0,01) и в 2,17 раза во влаге передней камеры (р<0,05) в сравнении с группой контроля (табл. 2).
С целью дальнейшего выявления взаимозависимости между молекулярными показателями, характеризующими степень выраженности воспалительной реакции и пролиферации у больных глаукомой, и клиническими характеристиками исходного состояния проведен регрессионный анализ. В связи с тем что исходная концентрация TGF-β в исследуемых биологических жидкостях в группе контроля была ниже чувствительности метода определения, а разница ММР-9 в слезе между основной группой и группой контроля была более статистически значима, чем во влаге передней камеры, зависимым критерием выбран уровень ММР-9 слезной жидкости. В качестве независимых критериев определены все остальные показатели, имеющие статистически значимые отличия между двумя группами после проведения дескриптивного анализа (табл. 3).
Результаты регрессионного анализа имели принципиальное отличие у пациентов клинической и контрольной групп.
Установлено, что у больных глаукомой уровень ММР-9 в слезе с высокой степенью статистической значимости определяется степенью воспалительной реакции глазной поверхности. Так, выявлена ста-
Таблица 2
Оценка показателей уровня TGF-β и ММР-9 в слезной жидкости и во влаге передней камеры при открытоугольной глаукоме и в группе контроля
|
Показатель |
ОУГ, n=26 |
Контроль, n=22 |
Манна–Уитни, p |
|
Медиана (IQR) |
Медиана (IQR) |
||
|
ММР-9 в слезе, нг/мл |
2,3 (0,8–24,4) |
21,4 (16,8–24,0) |
<0,01 |
|
TGF-в в слезе, пг/мл |
1,3 (0,0–133,0) |
0 |
<0,001 |
|
ММР-9 во влаге ПК, нг/мл |
0,5 (0,3–0,9) |
1,5 (1,4–1,7) |
<0,05 |
|
TGF-₽ во влаге ПК, пг/мл |
264,0 (15,9–392,0) |
0 |
<0,01 |
П р и м еч а н и е : ОУГ — открытоугольная глаукома; IQR — интерквартильный размах; ПК — передняя камера; TGF-β — трансформирующий фактор роста; ММР-9 — матриксная металлопротеиназа 9.
Таблица 3
Итоги регрессии для зависимой переменной ММР-9 слезы у пациентов с глаукомой R2=0,95, р˂0,009
|
Показатели |
БЕТА |
Станд. ошибка БЕТА |
p |
|
ТСНВ |
3,89 |
0,83 |
0,02 |
|
Состояние конъюнктивы, баллы |
–0,79 |
0,16 |
0,02 |
|
TGF-β в слезе |
–0,92 |
0,11 |
0,004 |
|
ММР-9 во влаге передней камеры |
1,78 |
0,33 |
0,01 |
|
TGF-β во влаге передней камеры |
–0,89 |
0,16 |
0,01 |
|
Толщина эпителия роговицы |
–3,12 |
1,02 |
0,05 |
Примечание: ТСНВ — толщина слоя нервных волокон сетчатки; TGF-β — трансформирующий фактор роста; ММР-9 — матриксная металлопротеиназа 9.
тистически значимая обратная взаимозависимость между ММР-9 слезной жидкости и показателем, характеризующим клиническую картину воспалительной реакции конъюнктивы, что можно объяснить эффекторным действием ММР-9, являющимся антагонистом биологического эффекта TGF-β в умеренных концентрациях.
Кроме того, установлена прямая взаимозависимость концентрации ММР-9 слезной жидкости и ТСНВ, что является важным результатом исследования, так как эти данные могут служить еще одним подтверждением наличия механизмов хронического воспаления в патогенезе открытоугольной глаукомы.
В отличие от клинической группы, у пациентов группы контроля наблюдалась лишь прямая корреляционная взаимосвязь (R2=0,8, р˂0,001) между ММР-9 слезы и толщиной эпителия роговицы, что может быть обусловлено секрецией ММР-9 кератиноцита-ми и клетками эпителия роговицы, а также доказанным стимулирующим влиянием ММР-9 на процессы пролиферации клеток.
Обсуждение. Оценка исходного состояния пациентов клинической группы продемонстрировала наличие дегенеративных изменений зрительного нерва и ганглиозного комплекса сетчатки, патогномоничных для развитой стадии глаукомного процесса. Периметрические дефекты соответствовали структурным изменениям слоя нервных волокон и комплекса ганглиозных клеток сетчатки. Уровень внутриглазного давления, несмотря на максимальную медикаментозную гипотензивную терапию, был декомпенсирован.
Поскольку у больных глаукомой отсутствовали клинические признаки острого экзогенного (бактериального, вирусного и т. д.) воспаления, результаты оценки изменения сосудов конъюнктивы позволяют говорить о наличии у них хронического воспалительного процесса и явлений ишемии, на что указывают изменения калибра, анатомического хода и плотности сосудов, формирование шунтов и кровоизлияний.
В ходе исследования выявлен более низкий уровень содержания ММР-9 во влаге передней камеры и слезной жидкости пациентов клинической группы в сравнении с группой контроля, что может быть обусловлено дисбалансом про- и противовоспалительных биологически активных молекул у пациентов с глаукомой [5, 9]. Так, снижение содержания ММР-9 в биологических жидкостях следует рассматривать как следствие активизации провоспалительного звена, на что также указывает обратная статистически значимая взаимозависимость с TGF-β в слезе и во влаге передней камеры.
Прямая взаимозависимость ММР-9 слезной жидкости и ТСНВ, а также статистически значимая обратная взаимозависимость между ММР-9 слезной жидкости и показателем, характеризующим клиническую картину воспалительной реакции конъюнктивы, может служить подтверждением данных, что TGF-β повышает активность ингибиторов матриксных металлопротеиназ [9].
Заключение. Выявленные в ходе исследования корреляции между степенью выраженности воспа- лительной реакции конъюнктивы, нейродегенера-тивных изменений и содержанием ММР-9 в слезной жидкости и влаге передней камеры могут иметь принципиальное значение в прогнозировании дальнейшего прогрессирования глаукомного процесса и в эффективности хирургического лечения больных с открытоугольной глаукомой.
Список литературы Клинико-иммунопогическая оценка патологических изменений органа зрения у больных с открытоугольной глаукомой
- Flammer J. The vascular concept of glaucoma. Surv Ophthalmol 1994; 38: 3-6; Hayreh SS. Progress in the understanding of the vascularetiology of glaucoma. Curr Opin Ophthalmol 1994; 5: 26-35.
- Kurysheva NI, Marnykh SA, Borzinok SA. Use of physiological reparation regulators in glaucoma surgery: a clinical and immunological study. The Russian Annals of Ophthalmology 2005; 6: 21-5. Russian (Курышева Н. И., Марных С. А., Борзи-нок С. А. Применение физиологических регуляторов репарации в хирургии глаукомы (клинико-иммунологическое исследование). Вестник офтальмологии 2005; 6: 21-5).
- Volkova NV, Shchuko AG, Malysheva JuV, Yuryeva TN. Inadequate reparative regeneration in fistulazing glaucoma surgery. Fyodorov Journal of Ophthalmic Surgery 2014; 3: 60-6. Russian (Волкова Н. В., Щуко А. Г., Малышева Ю. В., Юрьева Т. Н. Неадекватная репаративная регенерация в фисту-лизирующей хирургии глаукомы. Офтальмохирургия 2014; 3: 60-6).
- Chang L, Cheng Q, Lee DA. Basic science and clinical aspects of wound healing in glaucoma filtering surgery. J Ocul Pharmacol Ther 1998; 14: 75-95.
- Chang L, Crowston JG, Cordeiro MF, et al. The role of the immune system in conjunctival wound healing after glaucoma surgery. Surv Ophthtalmol 2000; 45: 49-68.
- Avdeev RV, Aleksandrov AS, Basinskiy AS, et al. Clinical multicenter study of trabeculectomy efficacy. Glaucoma 2013; 2: 53-60. Russian (Авдеев Р. В., Александров А. С., Басин-ский А. С. и др. Клиническое многоцентровое исследование эффективности синусотрабекулэктомии. Глаукома 2013; 2: 53-60).
- Titov VN. The role of macrophages in the formation of inflammation, the effect of interleukin-1, interleukin-6 and the activity of the hypothalamic-pituitary system (literature review). Clinical Laboratory Diagnostics 2003; 12: 3-10. Russian (Титов В. Н. Роль макрофагов в становлении воспаления, действие интерлейкина-1, интерлейкина-6 и активность гипоталамо-гипофизарной системы (обзор литературы). Клиническая лабораторная диагностика 2003; 12: 3-10).
- Reynolds AC, Skuta GL. Clinical perspectives on glaucoma filtrering surgery: Antiproliferative agents. Ophthalmol Clin North Am 2000; 13 (3): 501-15.
- Picht G, Welge-Luessen U, Grehn F, Lutjen-Drecoll E. Transforming growth factor beta 2 levels in the aqueous humor in different types of glaucoma and the relation to filtering bleb development. Graefes Archiv Fur Klinische Und Experimentelle Ophthalmologie 2001; 239 (3): 199-207.
- Zenkel M, Lewczuk P, Junemann A, et al. Proinflammatory cytokines are involved in the initiation of the abnormal matrix process in pseudoexfoliation syndrome glaucoma. Am J Pathology 2010; 176 (6): 2868-79. DOI: 10.2353/ajpath. 2010.090914.
- Volkova NV, Yuryeva TN, Grishhuk AS. Correlation and correction factors for different types of tonometry: Biomechanics and biogeometry of the fibrous membrane of the eye: Report 2. National Journal of Glaucoma 2016; 15 (1): 37-45. Russian (Волкова Н. В., Юрьева Т. Н., Грищук А. С. Корреляция и поправочные коэффициенты при различных видах тонометрии: Биомеханика и биогеометрия фиброзной оболочки глаза: сообщение 2. Национальный журнал глаукома 2016; 15 (1): 37-45).


