Клинико-морфологическая характеристика различных форм ринитов
Автор: Бархина Татьяна Григорьевна, Гусниев Садык Абдурагимович, Гущин Михаил Юрьевич, Утешева Валерия Александровна, Черников Валерий Петрович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.25, 2017 года.
Бесплатный доступ
Правильный диагноз аллергических заболеваний может быть поставлен только после комплексного обследования. Одним из важных диагностических критериев, подтверждающих наличие аллергической патологии верхних дыхательных путей, является указание на наличие эозинофилов в назальном секрете и в клиническом анализе крови. Однако эти показатели должны подтверждаться также клиническими и морфологическими критериями. Цель работы - провести сравнительную клинико-морфологическую оценку различных форм ринитов у пациентов с помощью комплекса методов исследования и дать рекомендации по дифференциальной диагностике ринитов для оптимальных способов их лечения и профилактики. Авторами использованы эпидемиологические, клинические, цитологические и морфологические методы изучения аллергического ринита и других форм ринитов у пациентов различных возрастных групп. Результаты исследования показали, что различные формы ринитов имеют характерные морфологические особенности, выявляющиеся на светооптическом и ультраструктурном уровнях. Полученные результаты по динамике патологического процесса демонстрируют нарушения метаболизма и дизрегуляции клеточно-гуморальных механизмов, что в свою очередь влияет на выраженность жалоб пациентов и состояние факторов иммунитета слизистых оболочек полости носа. Это следует учитывать в клинике при лечении пациентов.
Риниты, слизистая оболочка носа, риноцитограмма, иммуноморфология
Короткий адрес: https://sciup.org/143177169
IDR: 143177169 | DOI: 10.20340/mv-mn.17(25).02.02
Текст научной статьи Клинико-морфологическая характеристика различных форм ринитов
Материалы и методы исследования. В настоящем исследовании использованы ретроспективный анализ медицинской документации, инструментальные методы исследования, аллергологические методы, включающие пробы с различными аллергенами. На все исследования получены соответствующие разрешения локальных этических комитетов учреждений, в которых проводилось исследование, равно как и информированное согласие всех пациентов в соответствии с законодательством РФ. Иммунологические исследования включали использование метода Манчини для определения секреторного иммуноглобулина (sIgA). Цитологические методы исследования включали изучение препаратов назального секрета, окрашенных по Романовскому. Морфологическое исследование соскобов слизистых оболочек полости носа (далее - ССПН) выполнено с помощью световой, электронной сканирующей микроскопии (СЭМ), трансмиссионной электронной микроскопии (ТЭМ). Полутонкие срезы (далее - ПТС) и ультратонкие срезы получены на ультратоме LKB (Швеция); ПТС окрашивали толуидиновым синим. Клеточный материал взят у 15 пациентов с неаллергическим ринитом с эозинофильным синдромом (далее - НАРЭС), у 15 пациентов с АР, у 15 пациентов с полипозным риносинуситом (далее - ПРС) и у 15 пациентов с острым ринитом (далее - ОР). ССПН взяты со слизистой оболочки полости носа в области нижнего края нижней носовой раковины с помощью инструмента Блэксли у пациентов всех групп, кроме группы с ПРС, у пациентов которой соскоб взят с участка с полипозно-измененной слизистой оболочки у основания полипа.
Результаты исследования и обсуждение. Цитологическая картина при различных формах ринитов отличается от нормальной картины не только наличием лейкоцитов в назальном секрете, но и повышенным содержанием эпителия и слизи в мазках, что было выявлено у всех пациентов. Поскольку слизистая оболочка полости носа и вырабатываемый ею назальный секрет являются первым защитным барьером на пути вдыхаемых бактериальных, вирусных и других антигенов, то представленные в препаратах клетки (эозинофилы, нейтрофилы и макрофаги) предстают полуразрушенными, готовыми к дегрануляции и имеют измененную клеточную стенку. Назальная цитология у пациентов исследуемых групп представлена на рисунках 1-а - 1-г. У пациентов с АР и НАРЭС повышено количество эозинофилов в назальном секрете (более 20% клеток в риноцитограмме). Пациенты с ПРС имели слабо выраженную эозинофильную инфильтрацию, не превышающую 20% от общего числа клеток. У пациентов с ОР среднее количество эозинофилов также не превышало 20% от общего числа клеток в риноцитограмме. Наибольшее количество эозинофилов наблюдается у пациентов с АР. У всех пациентов отмечалось повышенное количество слизи, наличие эпителиальных клеток, а также наличие нейтрофильных лейкоцитов и макрофагов в разном процентном соотношении. Нейтрофилы преобладали в группах пациентов с ПРС и ОР. У пациентов с ОР в риноцитограмме представлены единичные нейтрофилы, слизь и эпителиальные клетки. Таким образом, назальная цитология пациентов с АР сходна с таковой при НАРЭС, с преимущественным наличием эозинофилов в назальном секрете (в среднем 53,0±10,6 % клеток). У пациентов с ПРС также наблюдается эозинофильная инфильтрация слизистой оболочки полости носа, не превышающая 12,0±2,7% от общего числа клеток в риноцитограмме. У пациентов с ОР и ПРС эозинофилы в мазке либо отсутствуют, либо представлены единичными клетками. Авторы считают, что эти показатели риноцитограммы важны для дифференциальной диагностики и тактики лечения.
Иммунологическое исследование методом диффузии по Манчини показало, что наиболее информативен показатель содержания β-глобулина – slgA, для которого максимальные значения установлены при НАРЭС (до 800 мкг/мл) и при АР (от 1000 до 1200 мкг/мл). Это наиболее чувствительный тест по сравнению со значениями других иммуноглобулинов. Анализ основных этиологических аллергенов позволил выделить главные критерии отличия разных форм ринитов. При АР наблюдается положительный провокационный тест с аллергеном клеща домашней пыли, в отличие от других форм ринитов. Морфологическое исследование слизистой оболочки полости носа было проведено с целью изучения патогенетических аспектов острого и различных форм хронических ринитов [4, 6-7]. Уточнив механизмы клеточного взаимодействия можно судить о возможных клинических проявлениях патологического процесса, о его сходствах или различиях с аллергическими и неаллергическими видами ринитов. В настоящее время патогенез данных нозологий до конца не изучен, поэтому авторы сочли нужным дать полную картину клеточных взаимодействий, оценив преобладание тех или иных клеток воспаления и иммунокомпетентных клеток в слизистой оболочке полости носа пациентов [4, 8-11]. Следует отметить, что морфологическая характеристика круглогодичного аллергического ринита и сезонного отличается только при электронно-микроскопическом анализе, тогда как световая микроскопия не выявляет существенных различий.
Другие формы ринитов имеют характерные морфологические изменения разной степени выраженности как при световой микроскопии, так и при изучении ПТС ТЭМ. На светооптическом уровне при НАРЭС наблюдаются следующие изменения в слизистой оболочке (СО) носа: прерывистость эпителиального слоя, уплотнение и истончение собственной пластинки слизистой оболочки (далее – СПСО), незначительные изменения подслизистого слоя, функциональная недостаточность желез этого слоя. Сосуды микроциркуляторного русла (далее - МЦР) находятся в различном функциональном состоянии: некоторые из них истончены опустошены, незначительная часть из них с расширенным просветом. В некоторых участках эпителия наблюдается локальная секреция бокаловидных клеток (далее – БК). На ПТС при НАРЭС обнаруживается хаотичное расположение эпителиальных клеток, в некоторых участках с их уплощением. В СПСО наблюдается гетерогенность сосудов МЦР, контуры их демонстрируют чрезвычайную извитость, вокруг сосудов определяется неярко выраженная инфильтрация лимфоцитами (рис. 2-а). Кроме этого, при НАРЭС в сосудах МЦР с расширенным просветом выявляются нити фибрина и непосредственные контакты эритроцитов с эндотелиальными клетками. Наиболее характерные изменения при НАРЭС обнаружены при изучении ультратонких срезов. Выявлены следующие постоянные признаки: наличие интраэпителиальных клеток (лимфоцитов, плазмоцитов), в СПСО - контакты лимфоидных клеток ( рис. 2-б) .
В области контактов фибробластов и макрофагов, особенно при фагоцитозе, наблюдаются процессы формирования коллагеновых фибрилл. Наблюдаются также контакты тучных клеток с фибробластами и макрофагами. Вокруг фибробластов, в которых наблюдается активация внутриклеточных структур, обнаруживается гиперплазия коллагеновых фибрилл. Таким образом, с помощью различных методов анализа получена детальная морфологическая картина НАРЭС. Следует отметить, что морфофункциональные особенности слизистой оболочки полости носа при НАРЭС мы обнаруживали только при ТЭМ. При световой микроскопии картина морфологических изменений при НАРЭС сходна с таковой при АР. При АР изменения слизистой оболочки выявляются как при световой микроскопии, так и при изучении ПТС при электронной микроскопии. Световая микроскопия выявила в некоторых участках прерывистость эпителия (рис. 3-а), значительную гипертрофию и гиперплазию БК, выраженную их экструзию.
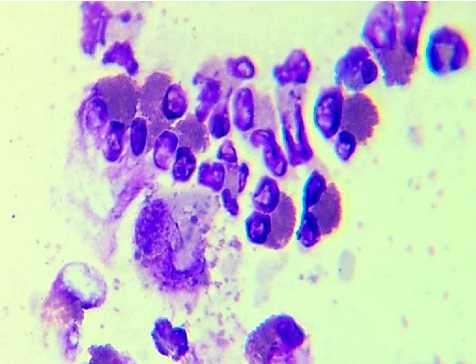
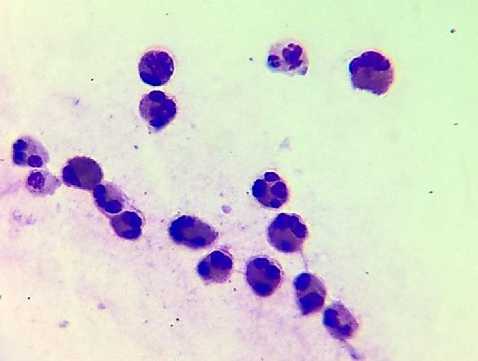
1-а
1-б
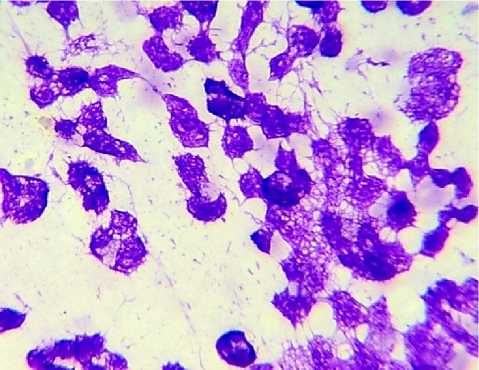
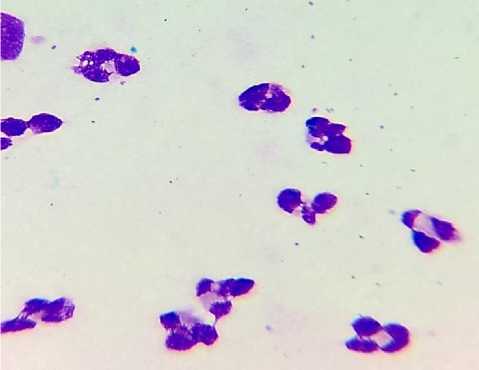
1-в
1-г
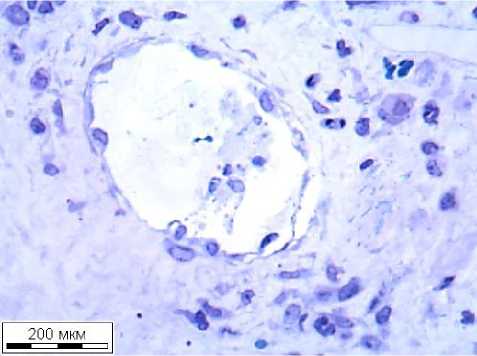
Рис. 1. Цитограммы назального секрета. а - АР; б - НАРЭС; в - ПРС; г - ОР. Окраска по Романовскому. Ув.: х1000
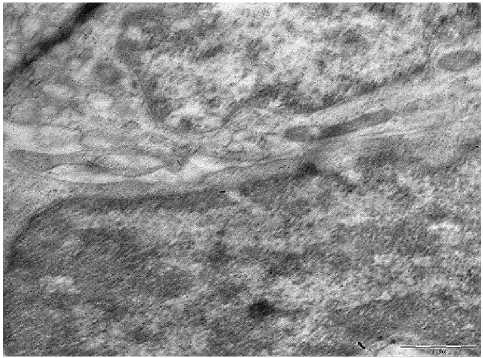
2-а
2-б
Рис. 2. А - НАРЭС, полутонкий срез, световая микроскопия. Окраска толуидиновым синим. Ув.: х960; б - ТЭМ. Контакт лимфоцита и плазмоцита. Ув.: х10000.
При ТЭМ препаратов пациентов с АР обнаруживаются значительные расширения межклеточных пространств, отёк с образованием различной формы и протяженности межклеточных отростков, часто вычурных очертаний. В этих расширенных промежутках встречаются интраэпителиальные клетки, в основном тромбоциты (рис. 3-б), реже фибробласты. В эпителиальных клетках при АР обнаруживаются изменения цистерн гранулярного эндоплазматического ретикулума и гиперплазия элементов комплекса Гольджи.
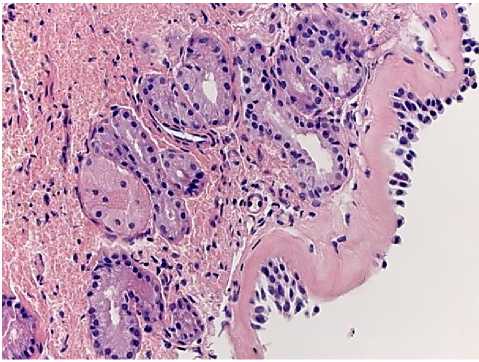
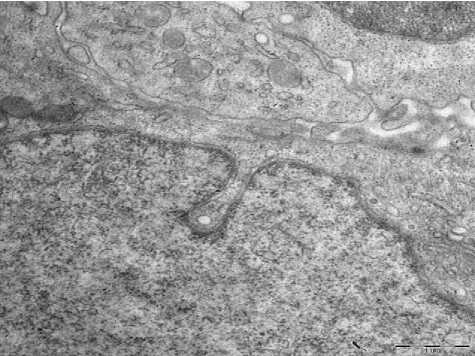
3-а
3-б
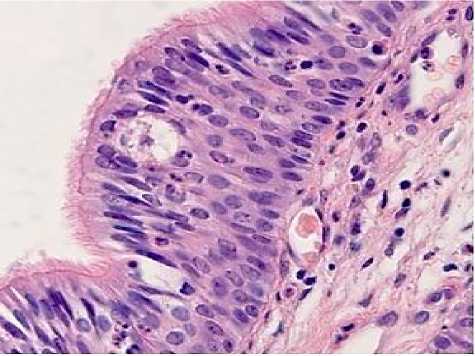
Рис. 3. А - АР. Световая микроскопия. Окраска гематоксилин и эозин. Ув.: х 400; б - ТЭМ. Интраэпителиальный тромбоцит. Ув: х12000.
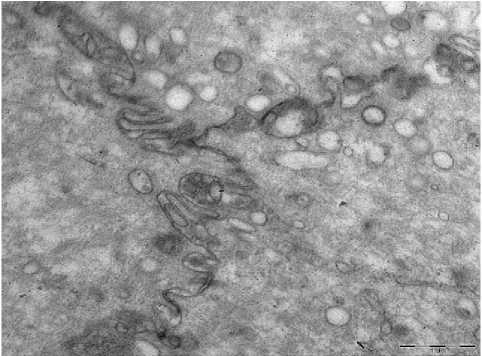
4-а
4-б
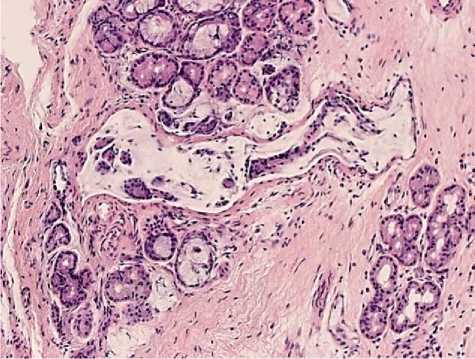
Рис. 4. А - ПРС. Световая микроскопия. Ув.: х600; б - ТЭМ. Буллёзные расширения интердигитаций. Ув.: х10000.
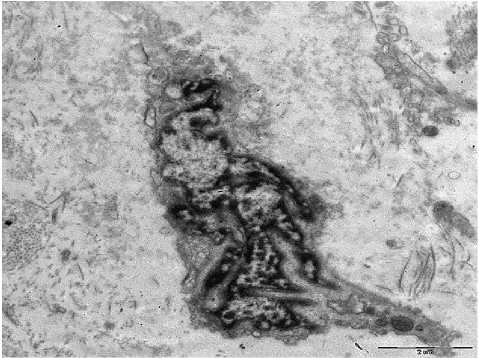
5-а
5-б
Рис. 5 . А - ОР. Световая микроскопия. Ув.: х200; б - ТЭМ. СПСО. Нарушения структуры ядра фибробласта. Ув.: х8000.
В собственной пластинке слизистой оболочки встречаются макрофаги с наличием фагосом и цитофагосом, которые в отдельных случаях могут путем экзоцитоза выделяться в межклеточное пространство. При ПРС полипозная ткань состоит из повреждённого эпителия, расположенного на утолщенной базальной мембране, и отёчной стромы, содержащей небольшое количество желёз и сосудов. При изучении образцов с ПРС выявляется резкая везикуляция в эпителиальных клетках, иногда с образованием вакуолей, которые могут преобразовываться в большие полости. Этот процесс может распространяться и на участки СПСО. При световой микроскопии важным является также истончение СО с преобладанием секреторных элементов и наличием псевдоэрозий в эпителии и в СПСО (рис. 4-а). При ТЭМ обнаружены следующие ультраструктурные изменения: эпителиальные клетки, в основном реснитчатые, соединяются с помощью интердигитаций с многочисленными отростками и с буллезными выпячиваниями (рис. 4-б), БК - в умеренном секреторном процессе. В ряде клеток наблюдаются изменения в ядрах и ядрышках - инвагинации ядерной оболочки, расширения или сужения перинуклеарного пространства, гомогенность эу- и гетерохроматина, фрагментация ядрышка. Интраэпителиальные клетки немногочисленны и представляют собой лимфоциты, редко плазмоциты. В СПСО наблюдается резкая гиперплазия и гипертрофия коллагеновых фибрилл в области фибробластов и отдельных макрофагов.
При ОР, особенно с явлениями нарушений в сосудах разного калибра, на световом и электронно-оптическом уровне отмечаются не столь выраженные изменения, как при НАРЭС, АР и ПРС. Эпителий в этих случаях не имеет грубых изменений, особенно в соотношении популяций реснитчатых и БК, нет участков десквамации или деструкции эпителиальных клеток. Основные изменения наблюдаются в СПСО и подслизистой основе (рис. 5-а). В основном изменения обусловлены уменьшением числа БК в эпителии, слабой секреторной активностью слизистых и серозных желез, что клинически проявляется у данной группы пациентов менее выраженными жалобами на ринорею по сравнению с пациентами с другими формами ринитов. При ТЭМ ультраструктурные изменения сосредоточены в периваскулярных и перикапиллярных пространствах и связаны с повреждением в фибробластах и фиброцитах, особенно в ядрах этих клеток (рис. 5-б).
Таким образом, морфологическая картина слизистой оболочки полости носа при световой микроскопии у пациентов с НАРЭС и АР имеет сходные черты. У пациентов с НАРЭС и АР имеются изменения в эпителии, выражающиеся в нарушении соотношения реснитчатых и БК. В реснитчатых клетках при НАРЭС, также как при АР, наблюдаются процессы деструкции во всех частях клетки: дезорганизация ресничек, их сглаживание, расширение межклеточных пространств и изменение конфигурации клеток. При АР большое число БК располагалось около базальной мембраны, а в апикальной части эпителия обнаруживались БК в стадии экструзии. У многих пациентов обнаруживается интенсивная экструзия секрета, вплоть до полной его эвакуации. Поэтому можно констатировать, что при АР процессы секреции преобладают в большей степени, чем при других формах ринитов.
Отличия морфологической картины НАРЭС от других форм ринитов, в том числе и от АР, выявляются при ТЭМ. Одним из главных морфологических критериев НАРЭС является наличие иммунных интраэпителиальных клеток -лимфоцитов и плазмоцитов, в отличие от АР, для которого более характерно внедрение в эпителиальный пласт тромбоцитов, реже лимфоцитов, в сочетании с разнообразными дефектами в системе микроциркуляции. При этом важной деталью является синхронность изменений эпителиальных клеток и клеток СПСО, выявляемых при световой и электронной микроскопии. Как было указано выше, при НАРЭС и АР наблюдаются изменения клеток эпителия и СПСО, но более выраженные изменения клеток, проявляющиеся в ультраструктурных изменениях ядер, отмечены в группе пациентов с ПРС и ОР. Во многих клетках у пациентов с ПРС ядро с одним или несколькими локальными расширениями перинуклеарного пространства занимает значительную часть цитоплазмы. Нарушение взаимоотношения ядра и других клеточных структур свидетельствует о нарушении функции всей клетки, выражающейся в её слабой активности и недостаточном выполнении клеточной функции. При ПРС характерными морфологическими признаками являются прерывистость нормального реснитчатого эпителия с чередованием участков эрозий, микроэрозий и псевдоэрозий, а иногда и сквамозной метаплазией эпителия.
Обращают на себя внимание и ультраструктурные изменения эндотелиоцитов кровеносных сосудов при всех изученных нозологиях, а именно при НАРЭС, АР и, в меньшей степени, при ОР. Эндотелиальные клетки на ультраструктурном уровне выглядят резко истонченными, часто бесструктурными. С точки зрения ультраструктурных изменений, важными как в патогенетическом, так и в клеточно-биологическом плане, являются взаимоотношения клеток со структурами кровеносных капилляров (субэндотелиальной зоной, эндотелиальными клетками, перикапиллярным пространством). Важной особенностью является просветление гиалоплазмы этих клеток в сочетании с деструктивными изменениями органелл, ответственных за белковое и энергетическое снабжение клетки. Данные изменения более выражены в группах пациентов с НАРЭС и АР. Следует отметить, что в группе пациентов с ОР отмечаются минимальные структурные изменения. По сравнению с АР и НАРЭС, при ПРС и ОР определяется различной степени выраженности отёк цитоплазмы эндотелиальных клеток с её везикуляцией. В таких клетках наблюдается нередко и отёк ядра с локальным расширением перинуклеарного пространства, в некоторых - явления клазматоза и микроклазматоза. Кровеносные капилляры повреждены на всех уровнях, начиная с субэндотелиальной зоны, в виде резких изменений в эндотелиоцитах, сопровождающихся отёком, появлением участков бесструктурных эндотелиальных клеток с деградацией органелл, усилением проницаемости мембран, иногда с их деструкцией. Встречаются участки с резким уплощением эндотелиальных клеток, нередко с их истончением и наличием деструктивных изменений ядер и органелл, что приводит, как известно, к нарушению трофики ткани в сочетании с гипоксией [3, 6,12-14].
Описанные изменения в клетках эпителия и в системе микроциркуляции, а также во взаимоотношении клеток и сосудов микроциркуляторного русла приводят к нарушению функции слизистой оболочки полости носа, снижению скорости мукоцилиарного транспорта и, как следствие, возникновению жалоб пациентов [6-7, 9, 12, 15]. Нельзя забывать о том, что АР часто может являться предшественником БА, хотя другие формы ринитов тоже могут способствовать ее возникновению, но в меньшей степени. При начинающейся БА, когда клинические проявления ещё не выражены, обнаруживаются морфологические изменения в эпителии слизистой оболочки носа, характерные для АР. Кроме этого, выявленные изменения эритроцитов при присоединении других форм патологии и осложнений основного заболевания свидетельствуют о повышенном гемолизе, который усугубляет уже имеющуюся гипоксию тканей, что в целом приводит к развитию системной дыхательной недостаточности и толерантности к проводимой противоастматической терапии [7, 14-15]. Эти изменения наряду с иммунологическими нарушениями клеток лейкоцитарного ряда создают картину морфофункциональных перестроек не только аллергологического, но и гематологического характера, ведущих к значительным деструкциям в органах и тканях. Следует также отметить, что тромбоциты, как клетки-мишени второго порядка, могут стимулировать секрецию биологически активных веществ по IgE опосредованному механизму. Иными словами, тромбоциты при данной патологии влияют на динамику изменений с двух сторон [13].
Нами оценивалось морфофункциональное состояние СО полости носа у пациентов указанных групп с целью изучения сравнительных патогенетических аспектов разных форм ринитов и дебюта БА. В последние десятилетия выявлена тенденция к увеличению частоты ринитов, в том числе АР и НАРЭС, которые имеют ярко выраженные клиникоморфологические особенности, но различные тактики лечения пациентов. В развитии АР важную роль играют процессы цито-рецепции аллергенов, гиперчувствительности, развивающейся гиперреактивности дыхательных путей и морфологические изменения, выявляемые в различных клетках их слизистой оболочки [5, 8, 10, 13-14, 16]. Если рассматривать процессы, происходящие в СО носа при световой микроскопии, то можно констатировать, что изменения в эпителии и СПСО при НАРЭС и АР не очень выражены, в отличие от ПРС и ОР. На светооптическом уровне изменения при НАРЭС, так же как и при АР выражаются в изменении соотношения реснитчатых и БК, истончении СПСО. В реснитчатых клетках наблюдаются процессы деструкции, сглаживания, десквамации и дезорганизация ресничек, что указывает на изменение их функции, а именно замедление мукоцилиарного транспорта. У пациентов всех сравниваемых групп отмечаются изменения в системе МЦР, что позволяет констатировать нарушение его проницаемости с последующим выходом из сосудистого русла иммунокомпетентных клеток. Одним из главных морфологических критериев НАРЭС при изучении его патогенеза является наличие интраэпителиальных иммунных клеток - лимфоцитов и плазмоцитов, в отличие от АР, для которого более характерно внедрение лимфоцитов и тромбоцитов в сочетании в разнообразными дефектами в системе микроциркуляции. Наличие лимфоцитов и плазмоцитов в СО полости носа указывает на напряжение механизмов местной иммунной защиты. Как известно, плазматические клетки секретируют IgA, препятствующие прикреплению антигенов к эпителию. При НАРЭС и АР наличие иммунокомпетентных клеток и продукция ими медиаторов воспаления, запуск цитохимических и иммунологический процессов в СО полости носа наиболее значительны, нежели у пациентов с другими формами ринитов, что, возможно, обуславливает более выраженные жалобы этих пациентов на ринорею и назальную обструкцию, а также большее повышение иммуноглобулинов в назальном секрете, по сравнению с другими пациентами. Следует также учитывать и то обстоятельство, что на патоморфоз аллергических заболеваний в современных условиях могут влиять не только химическая природа аллергенов, но и их физические характеристики. Так, например, показано, что физиологический морфогенез может модулироваться физическими параметрами соответствующих раздражителей [17].
Заключение. Проведённое исследование показало, что различные формы ринитов характеризуются особенностями, выявляемыми на светооптическом и ультраструктурном уровнях, они проявляются ультраструктурными изменениями в эпителиоцитах, клетках СПСО и кровеносных сосудах микроциркуляторного русла. Эти изменения в динамике патологического процесса могут приводить к нарушению метаболизма, дизрегуляции клеточно-гуморальных механизмов, что в свою очередь влияет на выраженность жалоб пациентов и состояние иммунитета слизистых оболочек полости носа, в особенности при присутствии в них иммунокомпетентных клеток, способных вырабатывать иммуноглобулины и медиаторы воспаления. Нами получены данные о выраженных изменениях структуры и функции мерцательного эпителия слизистой оболочки носа и при БА в сочетании с АР. Совместное использование методов ТЭМ и СЭМ слизистых оболочек носа и бронхов при АР и БА даёт полную картину динамики изменений различных клеточных популяций. Морфологическая и биохимическая составляющая динамики изменений МЦК характеризуется повреждениями ресничек и нарушением соотношения реснитчатых и БК слизистых оболочек дыхательных путей, которые оцениваются как следствие аллергического воспаления, вызванного продолжительным воздействием специфических аллергенов и других ксенобиотиков. Длительное течение воспаления и мукоцилиарная недостаточность приводят к необратимым морфофункциональным изменениям, характеризующимся резким утолщением базальной мембраны и склерозом стенки носа и бронхов. Описанные изменения способствуют формированию бронхообструктивного синдрома с нарушением бронхиальной проходимости за счет спазма гладкой мускулатуры, воспалительного отека слизистой оболочки бронхов, изменением состава бронхиального секрета в сочетании с мукоцилиарной недостаточностью, приводящих к развитию тяжёлых форм БА. Выявленные морфологические нарушения в слизистых оболочках верхних отделов дыхательной системы являются принципиально новыми научными результатами, обосновывающими концепцию об общих механизмах повреждения слизистых оболочек органов дыхательной системы при аллергической патологии. Морфологические изменения в верхних дыхательных путях при бронхиальной астме, которым предшествовали какие-либо формы ринитов, в особенности АР, свидетельствуют об утяжелении патологического процесса, ведущего к значительным морфофункциональным перестройкам как в дыхательной системе, так и в системе микроциркуляции, с преобладанием гипоксического компонента во всех звеньях изучаемых структур.
Список литературы Клинико-морфологическая характеристика различных форм ринитов
- Богова А.В., Ильина Н.И., Лусс Л.В. Тенденции в изучении эпидемиологии аллергических заболеваний в России за последние 10 лет. Российский аллергологический журнал. 2008;6:С. 3-13.
- Курбачева О.М., Швец С.М. Интраназальные кортикостероиды в лечении аллергического ринита. Российский аллергологический журнал. 2015;6:72-79.
- Гущин М.Ю., Голованова В.Е., Бархина Т.Г., Польнер С.А. Морфологические изменения слизистых оболочек полости носа при аллергическом рините и бронхиальной астме. Доктор.ру. 2011;3:22-27.
- Гущин И.С. Патофизиология аллергии. Российская ринология. 2004;1:6-22.
- Федоскова Т.Г., Свистушкин В.М., Шевчик Е.А. Аллергический ринит - сезонная беда, межсезонная проблема. Российский аллергологический журнал. 2016;2:С. 36-43.
- Гусниев С.А., Гущин М.Ю., Бархина Т.Г., Польнер С.А. Клинико-морфологические особенности ринитов. Ульяновский медико-биологический журнал. 2016;4:28-29.
- Бархина Т.Г., Гущин М.Ю., Гусниев С.А., Польнер С.А. Клинико-морфологические характеристики изучения ринитов и бронхиальной астмы. Российский иммунологический журнал. 2016;10(4):415-416.
- Хаитов Р.М., Ильина Н.И. Аллергология и иммунология. Национальное руководство. Краткое издание.- Москва; 2012. 640с.
- Bozzo C, Fenu G, Stomeo F et al. Cytomorphologic and ultrastructural study of nasal mucosa by means of brushing: a comparison between asymptomatic and rhinitic subjects. Rhinology. 2005;43:261-265.
- Kirtsreesakul V, Somjareonwattana P, Ruttanaphol S. The correlation between nasal symptom and mucociliary clearance in allergic rhinitis. Laryngoscope. 2009 Aug;119(8):1458-1462.
- Kramer MF, Jordan TR, Klemens C, Hilgert E, Hempel JM, Pfrogner E, Rasp G. Factors contributing to nasal allergic late phase eosinophilia. Am J Otolaryngol. 2006 May-Jun;27(3):190-199.
- Геренг Е.А., Суходоло И.В., Плешко Р.И. и др. Ультраструктурные характеристики капилляров слизистой оболочки бронхов при различных клинических фенотипах тяжелой бронхиальной астмы. Бюллетень Сибирского отделения РАМН. 2010.30(6):105-109.
- Бархина Т.Г. Утешева В.А., Гущин М.Ю., Юдина Е.Б., Хайруллин Р.М. Эозинофилиты: морфологические аспекты диагностики (обзор)//Морфологические ведомости.- 2015.-№2.- С. 7-14.
- Li J, Zhang Y& Zhang L. Discovering susceptibility genes for allergic rhinitis and allergy using a genome-wide association study strategy. Current Opinion in Allergy and Clinical Immunology. 2015;15(1):33-40.
- Бархина Т.Г., Миславский О.В., Гущин М.Ю. Ультраструктурные изменения элементов периферической крови больных бронхиальной астмой и в эксперименте. XIX Российский симпозиум по растровой электронной микроскопии. Материалы симпозиума. Москва; 2015. C. 323-324.
- Бархина Т.Г., Гущин М.Ю., Гусниев С.А., Польнер С.А., Хайруллин Р.М. Роль макро- и микроэлементов в этиологии и развитии аллергических заболеваний дыхательных путей (обзорная статья)// Морфологические ведомости.- 2016.-Том 24.-№3.- С. 99-106.
- Дрождина Е.П., Сыч В.Ф., Хайруллин Р.М., Слесарев С.М. О влиянии длительного потребления диспергированной пищи на морфогенез мышечной оболочки ободочной кишки белых крыс// Морфологические ведомости.- 2006.- № 1-2.- С. 21-23.


