Клинико-морфологическая оценка репаративной регенерации костной ткани глазницы при использовании полимерных имплантатов в эксперименте
Автор: Орлинская Наталья Юрьевна, Хомутинникова Нина Евгеньевна, Цыбусов Сергей Николаевич, Дурново Евгения Аленксандровна, Мишина Наталья Васильевна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.23, 2015 года.
Бесплатный доступ
Представлены результаты экспериментального исследования регенерации костной ткани глазницы кролика после моделирования перелома нижней стенки орбиты и пластики дефекта полимерным имплантатом. Морфологическая оценка периодов регенерации кости глазницы кролика (на 7, 14, 30, 90 и 180 сутки после операции) при использовании полимерного имплантата характеризовалась отсутствием воспалительного процесса и грубого фиброза в зоне травмы. Реакции тканей на инороднее тело (полимерный имплантат) не выявлено. Остеоинтеграция в зоне перелома проходила с формированием остеоидной ткани, которая дифференцировалась в костную ткань, не проходя хрящевой стадии. Отсутствие патологических процессов в зоне регенерации кости орбиты при использовании полимерного имплантата, позволяет рекомендовать применять имплантаты «Реперен» для реконструкции нижней стенки глазницы в клинической практике.
Орбита, регенерация кости, полимерный имплантант, пластика нижней стенки глазницы
Короткий адрес: https://sciup.org/143177033
IDR: 143177033
Текст научной статьи Клинико-морфологическая оценка репаративной регенерации костной ткани глазницы при использовании полимерных имплантатов в эксперименте
Введение. Посттравматические дефекты и деформации стенок глазницы представляют собой одно из самых частых поражений при повреждениях костей верхней и средней зон лицевого скелета. Переломы глазницы могут вызвать целый ряд функциональных и косметических расстройств. В зависимости от объема и степени костных разрушений основной клинической симптоматикой повреждения могут стать нарушение контуров лица, диплопия, гипо- и энофтальм, косоглазие, контрактура глазного яблока, слезотечение или дакриоцистит [1].
Основными этапами в комплексе лечебных мероприятий у больных с повреждениями костей лица и стенок глазницы традиционно считаются репозиция и прочная фиксация костных фрагментов в правильном анатомическом положении. Однако достаточно часто при мелкооскольчатых переломах орбиты репозиция и фиксация костных фрагментов являются сложными завершающими этапами ее восстановления. Если не проводить пластику нижней стенки глазницы, то в отдаленном периоде формирующиеся рубцы приводят к вторичной деформации, развитию гипофтальма и энофтальма. У больных с посттравматическими деформациями скулоглазничной области из-за рубцовых изменений и дефектов кости в области стенок орбиты идеальным будет сочетание традиционного остеосинтеза костей лица и пластики орбиты имплантатом[2].
Морфологические исследования по этому вопросу очень редки. Развитие репаративной регенерации кости заключается в образовании в области повреждения остеобластической грану- ляционной ткани, клетки которой дифференцируются в хрящевые, что дает начало образования хрящевой периостальной мозоли, которая со временем сменяется костной. Однако, в области орбиты регенерация может проходить и без образования хряща. Гистологическое изучение процесса образования костной мозоли показывает, что со 2-го дня на месте перелома начинается пролиферация клеток со стороны камбиального слоя. К 3—4-му дню имеется уже большое количество эмбриональных клеток, молодых, вновь образованных сосудов и остеобластов. Эти остеобласты и являются главными клетками, образующими новую костную (остеоидную) ткань. Костеобразование может идти двояко: путем непосредственного развития костной мозоли из указанной эмбриональной (остеоидной) ткани или путем предварительного образования хряща (волокнистого, гиалинового типа). Чем совершеннее репозиция отломков и иммобилизация поврежденной кости, тем больше данных за развитие костной мозоли без предварительного образования хряща [3, 4].
Двоякий механизм костеобразования может быть объяснен следующим образом: 1) если эмбриональная ткань во время развития мозоли находится в условиях полного покоя, то она дифференцируется прямо в костную ткань, не проходя хрящевой стадии; 2) если же при образовании мозоли эмбриональная ткань подвергается раздражению извне или со стороны костных отломков, то костеобразовательный процесс в мозоли идет всегда с образованием большего или меньшего количества хрящевой ткани [5, 6].
Цель исследования - изучить безопасность и эффективность использования имплантанта для пластики посттравматических дефектов нижней стенки глазницы in vivo после его имплантации экспериментальным животным.
Для достижения поставленной цели решены следующие задачи: дана оценка особенностей репаративной регенерации костной ткани в зоне посттравматического дефекта нижней стенки глазницы в эксперименте на кроликах. Проведен морфологический анализ регенераторных процессов, происходящих в зоне локализации имплантанта на тканевом уровне в разные сроки послеоперационного периода (на 7, 14, 30, 90 и 180 сутки после операции) у кроликов.
Материал и методы исследования. Для проведения оперативного этапа исследования использовался имплантат для пластики посттравматических дефектов и деформаций нижней стенки глазницы производства НПП «Репер-НН» (Россия, Нижний Новгород), который выполнен из пространственно-сшитого полимера, полученного путем фотополимеризации олигомеров метакрилового ряда. Использование имплантата проводилось в соответствии с "Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ" (Москва, 2005 г.) и действующим законодательством РФ.
Материал твердый, непрозрачный (окрашен в синий или белый цвет) и имеет температуру стеклования от 50 до 800 °С, что позволяет моделировать трансплантат при опускании его, например, в горячую воду с температурой от 50 до 800 °С. Температура стеклования этого материала много выше температуры тела человека, что гарантирует сохранение физико-механических свойств имплантанта при имплантации, а именно материал остается прочным и при фиксации не прорезывается и не разрывается. Непрозрачная окраска эндопротеза позволяет быть визуализируемым для хирурга во время операции.
Эксперимент был выполнен на базе Центрального научно-исследовательской лаборатории Нижегородской государственной медицинской академии в соответствии с Руководством по экспериментальному изучению новых фармакологических веществ (Москва, 2005 г.) и действующим законодательством РФ («Правила гуманного обращения с лабораторными животными», методические указания МЗ РФ «Деонтология медико-биологического эксперимента»). Для экспериментального этапа исследования использовались кролики-самцы (n=48) линии «Вистар» ГУ НЦБМТ РАМН массой 3500-4500 г. Сроки послеоперационного контроля разделены на три периода: I группа до 3 суток (n=12), II группа 7-14 суток после имплантации (n=13), III группа 14-33 суток после имплантации (n=13), IY группа- 78-90 суток после имплантации (n=10). Данные сроки были выбраны с учетом продолжительности асептического воспаления в области имплантатов, развития репаративных процессов, формирования соединительной ткани и развития полноценного послеоперационного рубца. Была также выделена контрольная группа (n=7), которым моделировался перелом нижней стенки орбиты, внедрение имплантанта не проводилось. В течение каждого из этих периодов наблюдения контролировали особенности поведения, объём потребления пищи и воды и массу тела животных.
Премедикация животных осуществлялась реланиумом в/в в дозе 2,5 мг/кг. Затем вводили нембуталовый наркоз (30 мг/кг, в/в). Кожу в области операционного поля обрабатывали раствором спирта 70%. На оперативном этапе эксперимента каждому животному был выполнен трансконъюнктивальный разрез с рассечением латерального угла глаза (по типу кантотомии), затем скелетирован верхний край лицевой дуги и нижней стенки орбиты. Линейный перелом лицевого гребня и нижней стенки орбиты получен с помощью долота, затем проведена имплантация полимерного материала «Реперен» в область перелома лицевой дуги и нижней стенки орбиты. Рана ушивалась трансконьюнктивальным швом с фиксацией на коже – пролен 5-0 (рис. 1).
Выведение животных из эксперимента проводили с помощью летальной инъекции нембутала 150 мг/кг. Далее определялось местоположение области операции и проводился забор фрагментов тканей из зон имплантации вместе с исследуемым материалом.
Материал (фрагменты тканей из зон имплантации) подлежал фиксации в 10% формалине при температуре 37 °С в течение 24 часов. Затем подвергался обезвоживанию в спиртах восходящей концетрации начиная с 70 °С и до абсолютного, подвергался декальцинации. После помещения в ксилол подвергался заливке в парафин. Далее срезы толщиной в 5 мкм окрашивали гематокси-лин-эозином.
Для морфометрической обработки получен-ногго материала использовался микроскоп Никон 1001, объектив х90, х40, х15, окуляр 15. Для компьютерного анализа гистологических препаратов использовалась система анализа изображений, состоящая из микроскопа проходящего света «ECLIPS» (Nikon, Germany), компьютера Pentium IV IBM, цветной цифровой видеокамеры DS, блока управления DS-U1 (Nikon, Germany) и программного обеспечения ФСТ-2U. С помощью системы анализа изображений была создана графическая база данных из адекватных для изучения гистологических препаратов, проведена компьютерная морфометрия структурных компонентов
Критериями для оценки реакций костной ткани на введение имплантата были:
-
1 - характер и интенсивность воспалительной реакции в области внедрения импланта;
-
2 - выраженность процессов посттравматической реакции костной ткани в виде ее резорбции;
-
3 - скорость и выраженность новообразования и вторичной перестройки костного вещества вокруг имплантанта.
Результаты исследования и их обсуждение. Животные 1-й группы на следующий день после операции были активны и от еды не отказывались. У них наблюдался незначительный отек в подглазничной области, линия швов была чистой, швы состоятельные. При микроскопическом исследовании отмечается преобладание некробиотических процессов в области ввдения имплантата, ядра не окрашиваются, в щелях между имплантом и костным ложем очаги кровоизлияний, слабая воспалительная инфильтрация (рис. 2). Пролиферация клеток периоста с небольшими полями остеогенной фиброретикулярной ткани.
Во второй группе исследования (n=13), животные были активные. В послеоперационном периоде отмечался незначительный отек в подглазничной области, который к 7-му дню купировался, линия швов была чистой, рана зажила первичным натяжением.
При морфологическом исследовании материала воспалительная реакция очень слабо выражена, представлена единичными клетками, умеренное полнокровие мелких сосудов. Контуры в зоне имплантата неровные, ядра остеоцитов окрашены слабо, по краю костного препарата периостальное костеобразование в виде сети примитивных балочек из сетчатоволокнистой ткани. В прилегающих к имплантату мягких тканях отмечается пролиферация клеток перемизия, которые в виде широких пучков располагаются между сохранившимися мышечными пучками (рис. 3).
В третьей группе исследования (n=13), животные после операции были активные. Отек после операции быстро купировался, рана зажила первичным натяжением, швы сняты на 7-е сутки.
При морфологическом исследовании в области имплантата костная ткань с узкими сосудистыми каналами, рядом расположена новообразованная костная ткань с широкими сосудистыми каналами. Ядра хорошо прокрашены (рис. 4).
В четвертой группе (n=10), животные были достаточно активные. Отмечалась прибавка в весе до 500 г. Послеоперационый рубец был не заметен. Нарушений движения глаза на стороне операции не отмечалось.
При морфологическом исследовании зрелая костная ткань с хорошо прокрашенными ядрами, в области имплантата разнонаправленные волокна, плотно прилегающие друг к другу (рис. 5).
В контрольной группе (n=7) показатели морфологические показатели репаративной регенерации были аналогичными экспериментальным.
В результате проведенного хирургического лечения в раннем послеоперационном периоде все животные были активными, от пищи не отказывались. Послеоперационный отек достаточно быстро купировался, гематом и отека конъюнктивы не наблюдалось. Линия швов на коже была чистой. Операционные раны у всех животных зажили первично, швы сняты на 7-е сутки. Нарушения зрения, а также, энофтальма и гипофтальма у животных не отмечено, как в раннем, так и отдаленном периоде (90-180 суток после операции). Воспалительных явлений в зоне имплантации «Реперен», а именно, нижней стенки глазницы не отмечено ни у одного животного. Гибели животных в результате хирургического вмешательства не наблюдалось.
В ходе морфологического исследования установлено, что процессы репаративной регенерации костной ткани в зоне локализации
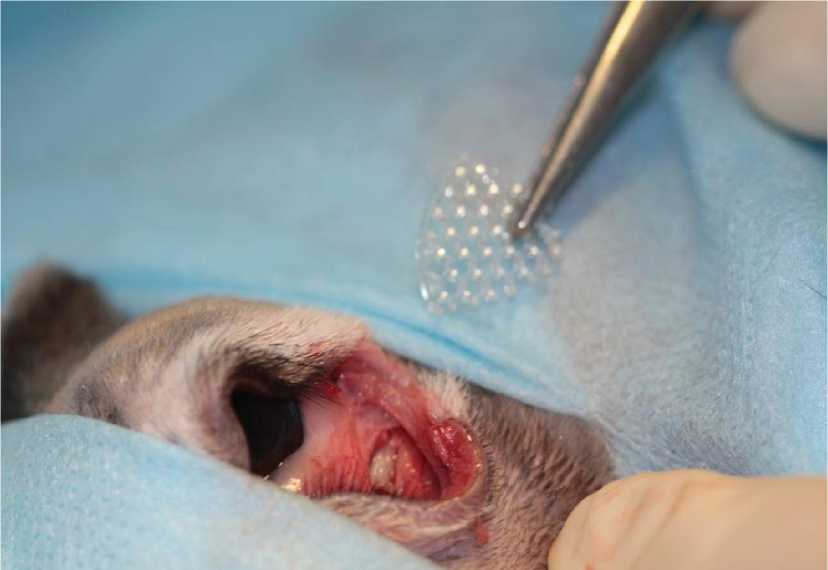
Рис. 1. Имплантация полимерного имплантанта «Реперен» в зону перелома лицевого гребня и нижней стенки глазницы кролика.
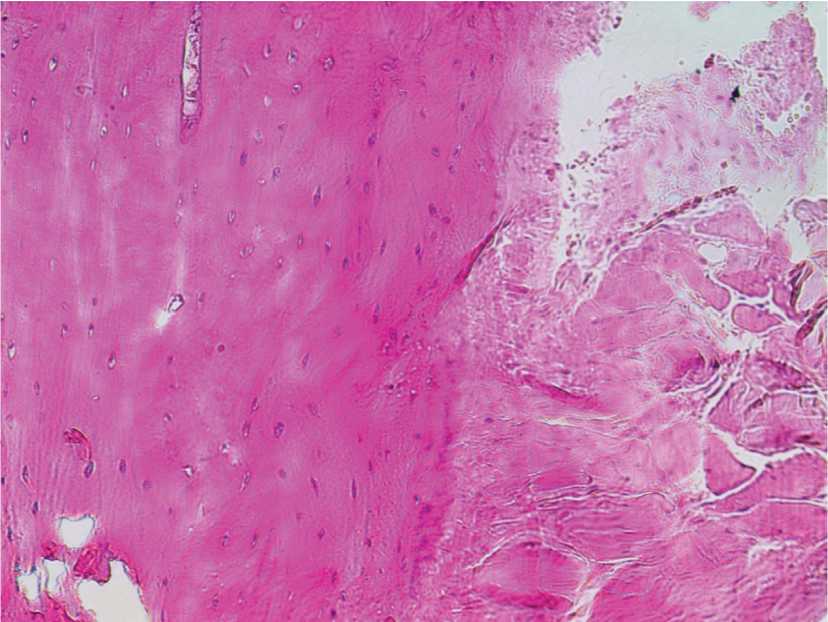
Рис. 2. Гистоструктура имплантационной зоны кролика 1-й группы. Окраска гематоксилином и эозином. Ув. 400.
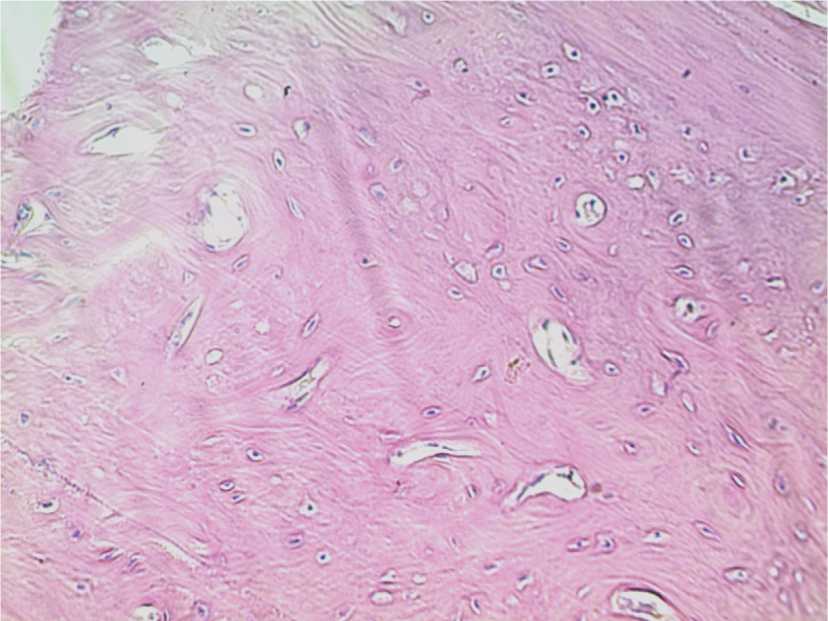
Рис. 3. Гистоструктура имплантационной зоны кролика 2-й группы. 11-е сутки после операции. Окраска гематоксилином и эозином. Ув. 400.
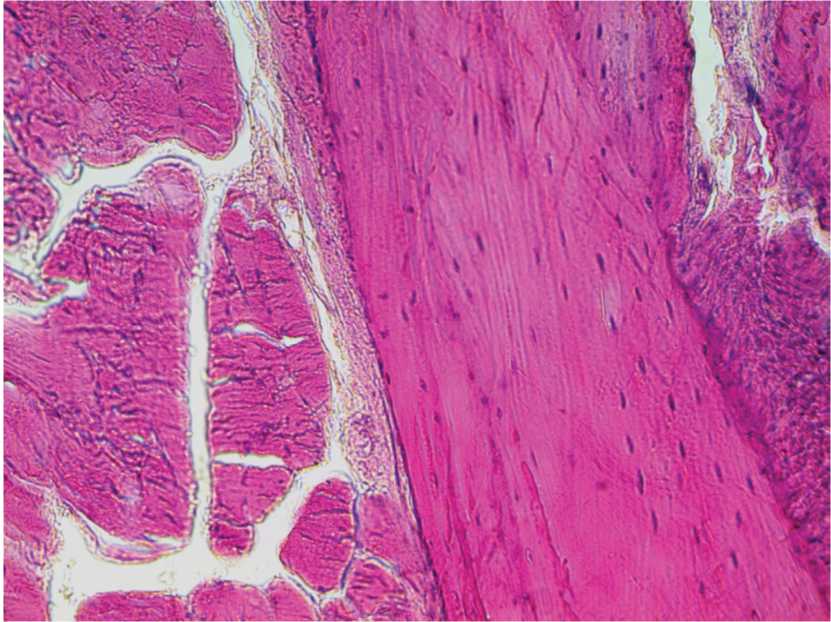
Рис. 4. Гистоструктура имплантационной зоны кролика 3-й группы. 30-е сутки после операции. Окраска гематоксилин и эозином. Ув. 400.
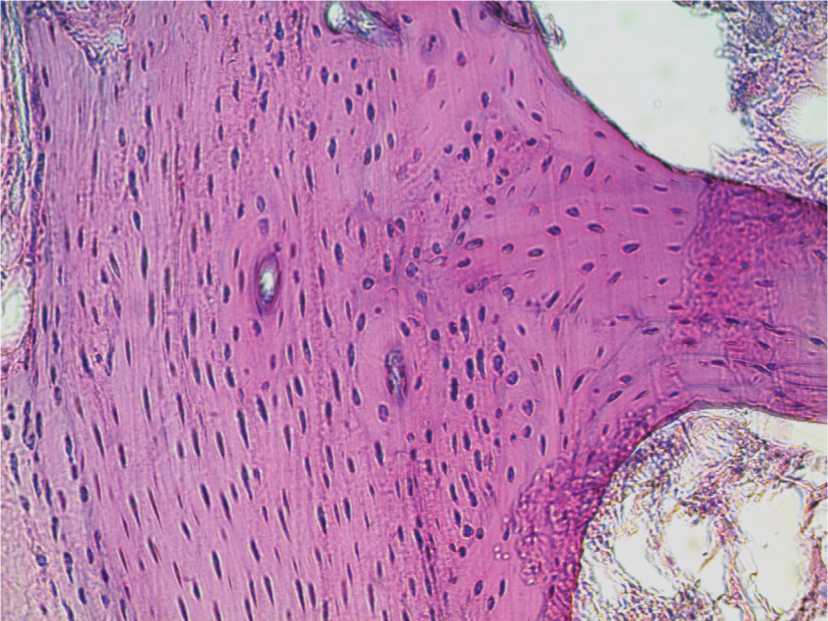
Рис. 5. Гистоструктура имплантационной зоны кролика 4-й группы. 80-е сутки после операции. Окраска гематоксилином и эозином. Ув. 400.
имплантата проходят аналогично регенерации костной ткани в контрольной группе. Воспаление выражено минимально в сроках от 1 до 7 суток. Реакции ткани на инороднее тело и образования гранулем типа инородных тел не отмечено. Начало костеобразования в экспериментальной группе, так же как и в контрольной начинается в группе исследования на 14-33-е сутки после оперативного вмешательства. В ходе исследования отмечено, что эмбриональная ткань во время регенерации и развития мозоли дифференцируется прямо в костную ткань, не проходя хрящевой стадии. Формирование зрелой кости и в контрольной и в экспериментальной группе отмечается в группе на 78-90 сутки после операции.
Выводы.
-
1) При оценке особенностей репаративной регенерации костной ткани в зоне посттравматического дефекта нижней стенки глазницы в эксперименте на кроликах обнаружено отсутствие как экссудативной, так и продуктивной воспалительной реакции в зоне имплантации.
-
2) При морфологическом анализе регенераторных процессов кролика, происходящих в зоне локализации имплантата на тканевом уровне в разные сроки послеоперационного периода не
отмечено реакции тканей на имплат в виде грубого фиброза.
-
3) Эмбриональная ткань во время развития костной мозоли диференцируется прямо в костную ткань, не проходя хрящевой стадии, что говорит о том, что она находится в условиях полного покоя, а мембрана «Репрен» не оказывает на нее раздражающего воздействия.
-
4) На основании проведенных экспериментальных исследований можно рекомендовать использование полимерных имплантатов «Реперен» для реконструкции нижней стенки глазницы в клинической практике .
Список литературы Клинико-морфологическая оценка репаративной регенерации костной ткани глазницы при использовании полимерных имплантатов в эксперименте
- Орбитальные переломы: руководство для врачей/ В.П.Николаенко, Ю.С. Астахов. - СПб.: ЭкоВектор, 2012г.- 436с.
- Митрошенков П.Н. Реконструктивная хирургия тотальных и субтотальных дефектов верхней, средней и нижней зон лицевого скелета: руководство для врачей/ П.Н. Митрошенков. -СПб.:Синтез Бук, 2010. -416 с.: 335
- Регенерация и пересадка. костей. Т.П.Виноградова, Г.И. Лаврищева. М. «Медицина», 1974. 246 с.
- Алещенко И.Е., Кошацки К.Г., Матыцин О.М., Ельцин А. Г. Биоим-плантаты TUTOPLAST современное решение проблем восстановления костной ткани// Клиническая стоматоло-гия.-2002.-№4. -С.52-56.
- Потемина Т.Е., Шевченко Е.А., Курылев В.В., Кондюров И.М., Успенская О.А., Бахметьев О.А. Современные особенности этиопатогенеза воспалительных заболеваний ротовой полости и вирусно- бактериальная биота урогенитального тракта. Медицинский альманах. 2012. № 3. С. 70-72.
- Гололобов, В.Г. Посттравматическая регенерация костной ткани. Современный взгляд на проблему/В.Г. Гололобов//Фундаментальные и прикладные проблемы гистологии. Гистогенез и регенерация тканей: труды ВМедА. СПб.: ВМедА, 2004. - Т. 257. - С. 94-109.


