Клинико-морфологические параллели послеоперационного ремоделирования левого желудочка.
Автор: Казаков Виталий Анатольевич, Шипулин Владимир Митрофанович, Лежнев Александр Александрович, Козлов Борис Николаевич, Кривощеков Евгений Владимирович, Суходоло Ирина Владимировна, Гутор Сергей Сергеевич
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ишемическая болезнь сердца
Статья в выпуске: 4 т.13, 2009 года.
Бесплатный доступ
Комплексное хирургическое лечение с постинфарктным ремоделированием левого желудочка (ЛЖ) в последние годы рассматривается как альтернатива трансплантации сердца. Однако, по данным литературы, в 12-25 % случаев после таких оперативных вмешательств размеры камер сердца и показатели гемодинамики имеют тенденцию к возвращению к своим дооперационным значениям, а иногда даже превышают их. Вопрос дооперационного прогнозирования отдаленных результатов оперативного лечения остается пока без ответа. Целью нашего исследования было ретроспективное определение взаимосвязей функциональной морфологии миокарда с исходом хирургического лечения больных с постинфарктным ремоделированием ЛЖ, перенесших комплексное хирургическое лечение. Обследованы 48 больных с крупноочаговым инфарктом миокарда и систолической дисфункцией ЛЖ с конечно-диастолическим коэффициентом (КДК) ЛЖ более 100 мл/м2. В зависимости от отдаленных результатов оперативного лечения все больные были разделены на две группы: 1-ю группу составили 36 больных, у которых КЭД был ниже дооперационных значений, а 2-ю группу составили 12 больных с повторным ремоделированием, у которых КЭД через год достигал дооперационные значения или даже превышали их. При ретроспективном сравнении исходных клинических показателей достоверной разницы в данных дооперационного обследования и в спектре методов оперативного лечения не выявлено. В то же время признаки миокардита в сочетании с выраженным фиброзом (паренхиматозно-стромальное соотношение 1,6) миокарда ЛЖ являются факторами, обусловливающими неблагоприятные отдаленные результаты хирургического лечения больных с ишемической кардиомиопатией.
Ишемическая кардиомиопатия, постинфарктное ремоделирование сердца, морфологические предикторы, миокардит
Короткий адрес: https://sciup.org/142233515
IDR: 142233515 | УДК: 616.124.2-005.8-091.8
Текст краткого сообщения Клинико-морфологические параллели послеоперационного ремоделирования левого желудочка.
Операции коронарного шунтирования, коррекции объема левого желудочка (ЛЖ) и митральной регургитации получили широкое распространение в качестве комплексного хирургического лечения пациентов с постинфарктным ремоделированием сердца [2–5, 9, 10]. Однако, по данным мировой л итературы, в 12–25% случаев после подобных хирургических вмешательств размеры камер сердца и показатели гемодинамики вновь достигают дооперационного уровня, а иногда даже превышают таковые [2, 4, 5, 9, 10]. Вопрос о доопераци-онном прогнозировании отдаленных резул ьтатов оперативного лечения до сих пор открыт.
В качестве возможных дооперационных параметров, сопряженных с риском послеоперационного прогрессирования ремоделирования ЛЖ рассматривались: дооперационные размеры ЛЖ [2], характер движения его сте нки [4], повышенное давление в правых отделах сердца [10], количество жизнеспособного м иокарда [7], наличие митральной регургитации [2]. В качестве возможных факторов риска ряд авторов оценивал морфофункциональное состояние миокарда ЛЖ по данным интраоперационных биопсий. Однако результаты этих исследований оказал ись крайне противоречивыми [7, 8]. Тщательный отбор пациентов на основании дооперационного прогнозирования отдаленных результатов хирургического лечения позволит увеличить эффективность данной тактики, повысит качество жизни больных. Кардиохирургам рекомендуется отказаться от стандартной реконструктивной операции в пол ьзу иных вариантов укрепления сердечной стенки или первичной пересадки сердца больным с потенциально плохим дооперационным прогнозом отдаленного послеоперационного периода.
Целью нашего исследования явилось ретроспективное выявление связей функциональной морфологии миокарда с исходами хирургического лечения пациентов с постинфарктным ремоделированием ЛЖ, перенесших комплексное хирургическое лечение.
МАТЕРИАЛ И МЕТОДЫ
Объектом исследования стали 48 больных ишемической кардиомиопатией, которым в условиях искусственного кровообращения были выполнены аортокоронарное шунтирование и хирургическая реконструкция ЛЖ в модификации V. Dor. Клиническими критериями отбора пациентов, включенных в настоящую работу, были следующие параметры: конечно-диастолический индекс (КДИ) ЛЖ>100 мл/м2 поверхности тела, конечно-систолический индекс (КСИ) ЛЖ> 80 мл/м2 поверхности тела, конечно-диастолическое давление ЛЖ>30 мм рт. ст., фракция выброса (ФВ) ЛЖ<40%, наличие участков а- и дискинеза левого желудочка, стенокардия II–IV функционального класса по классификации Канадского общества кардиологов (CCS), недостаточность кровообращения (НК) II–IV функционального класса по NYHA (Нью-Йоркская ассоциация сердца), длительность течения ишемической болезни сердца от 1 года до 10 лет, поражение коронарных артерий – стеноз более 75% передней нисходящей артерии или ствола, или стеноз, превышающий 75% не менее чем в двух коронарных артериях. Отсутствие органического поражения клапанов сердца также входило в клинические критерии отбора пациентов. Полная клиническая характеристика пациентов, включенных в настоящее исследование представлена в табл. 1. Через 12 месяцев после хирургического лечения всем 48 больным (100%) повторно проводился весь комплекс тех же диагностических мероприятий, что и на дооперационном этапе.
У всех пациентов во время оперативного лечения брали биопсию ушка правого предсердия (ПП) и ЛЖ (n=48). Интраоперационные биопсии фиксировали в 10% растворе нейтрального формалина, дегидратировали в этаноле восходящей концентрации и заливали в парафин. Гистологические препараты, окрашенные гематоксилином-эозином, изучались с помощью обычной световой микроскопии. Для количественной характеристики взаимо-
Таблица 1
Клиническая характеристика пациентов, включенных в исследование
РЕЗУЛЬТАТЫ
Оценка результатов хирургического лечения больных ишемической кардиомиопатией позволила разделить всех пациентов на 2 группы: в I группу вошли 36 пациентов, у которых через год после оперативного вмешательства КДИ ЛЖ был ниже дооперационных значений, II группу сформировали 12 больных с повторным ремоделированием ЛЖ, КДИ которых через год был аналогичным или превысил дооперационные показатели (табл. 2). В первой группе через год наблюдалось значительное снижение КДИ ЛЖ: со 144,6±13,8 до 87,3±12,5 мл/ м2. Аналогичное снижение наблюдалось и по показателям КСИ ЛЖ: с 87,3±14,8 до 52,2±15,5 мл/ м2. Вместе с уменьшением объемов полостей сердца наблюдалось увеличение фракции выброса ЛЖ с 33,5±5,8% до 45,8±2%. В I группе функциональный класс сердечной недостаточности уменьшился с 2,6±0,5 до 2,1±0,8. Напротив, во II группе больных отмечено статистически значимое увеличение функционального класса сердечной недостаточности с 2,6±0,8 до 3,3±0,9 до и после операции соответственно. Данные изменения в клиническом статусе сопровождались увеличением КДИ и КСИ ЛЖ с 123,4±10,4 до 129,3±14,5 мл/м2 и с 85,6±10,1 до 86,4±18,1 мл/м2 соответственно (табл. 2). Вместе с тем, во II группе больных, как и в группе I отмечено увеличение фракции выброса ЛЖ через год после проведенного оперативного лечения с 35,3±12,0 до 39,4±3,7%.
Ретроспективный анализ исходной клинической характеристики пациентов, включенных в настоящее исследование, показал, что по основным параметрам, характеризующим прогрессию постинфарктного ремоделирования ЛЖ, таким как КДИ ЛЖ, КСИ ЛЖ, степень сердечной недостаточности, фракция выброса ЛЖ указанные группы больных до операции достоверно друг от друга не различались (табл. 2). В I группе 75% пациентов (n=27) имели в анамнезе 1 инфаркт миокарда, в то время, как во II группе 8 из 12 пациентов (66,6%) имели 2 и более инфаркта миокарда в анамнезе. В обеих группах преобладал III функциональный класс сердечной недостаточности: в I группе в 31 случае (86,1%), во II – в 9 сл учаях (75%). Нарушение углеводного обмена чаще отмечали в I группе больных (10 наблюдений – 27,7%), в то время как во II группе нарушение углеводного обмена набл юдалось всего в 2 случаях (16,6%). 11 пациентов (30,5%) с положительной послеоперационной динамикой не имели митральной регургитации, еще 8 и 17 больных имели I и II степени соответственно. I степень митральной регургитации во II группе отмечали у 2 пациентов, II ст. – у 3, III ст. – у 2, еще у 2 больных наблюдали IV степень митральной регургитации и лишь 3 человека до операции не имели таковой.
В ходе исследования функциональной морфологии интраоперационных биопсий миокарда ЛЖ и ушка ПП повсеместно отмечали запустевание и спазм артериол и мел ких артерий (рис. 1 а ), венозное полнокровие (рис. 1, б ). У всех больных II группы и у 23 из 36 пациентов I группы (63,9%) в строме миокарда ЛЖ обнаруживали смешанный (лимфоцитарно-макрофагальный) инфильтрат (> 14 на мм2 ткани в соответствии с Марбургской классификацией) [10], что квалифицировалось нами как миокардит (рис. 1, в ). Проникновению клеточного воспалительного инфильтрата в строму миокарда предшествует период «краевого стояния» (рис. 1, г ).
Фиброз в миокарде ЛЖ был, как правило, умеренным или незначительным в I группе больных и, преимущественно, выраженным (неблагоприятным) и, в ред ких случаях, умеренным во II группе больных. В половине случаев среди больных I группы и в 100% случаях у больных II группы инфильтрация носила очаговый характер, реже – диффузный или сливной. Кроме того, у 7 пациентов с повторной дилатацией ЛЖ (58,3%) и у 11 больных с благоприятным отдаленным результатом оперативного лечения (30,5%) идентичный характер ин-фил ьтрата находили и в миокарде ушка ПП. При этом фиброз был на 1–2 степени ниже по той же классификации, чем в миокарде ЛЖ [11].
Морфометрические показатели миокарда ЛЖ и ушка ПП представлены в табл. 3. Статистический анализ полученных морфометрических данных показал, что паренхиматозно-стромальное отношение, трофический индекс в миокарде ушка ПП и ЛЖ у пациентов с повторным ремодел ированием достоверно ниже подобных показателей в миокарде пациентов с удовлетворительным эффектом от оперативного лечения. Напротив, зона перикапиллярной диффузии и индекс Керногана миокарда ушка ПП и ЛЖ были достоверно выше во II группе больных. Достоверной разницы между группами по диаметру кардиомиоцитов, как в миокарде ушка ПП, так и в миокарде ЛЖ не отмечено.
ОБСУЖДЕНИЕ
В ходе оценки результатов комплексного хирургического лечения ишемического ремоделиования ЛЖ мы получили в 25% случаев повторное увеличение размеров полости ЛЖ до исходных, предшествующих операции значений и увеличение функционального класса сердечной недостаточнос-
Таблица 2
Показатели внутрисердечной гемодинамики и функциональный класс сердечной недостаточности в контрольные сроки наблюдения
|
Показатель |
Группа I, n=36 |
Группа II, n=12 |
||
|
до операции |
1 год после операции |
до операции |
1 год после операции |
|
|
КДИ ЛЖ |
144,6±13,8 |
87,3±12,5* |
123,4±10,4 |
129,3±14,5* |
|
КСИ ЛЖ |
87,3±14,8 |
52,2±15,5# |
85,6±10,1 |
86,4±18,1# |
|
ФВ ЛЖ |
33,5±5,8 |
45,8±2,0** |
35,3±12,0 |
39,4±3,7** |
|
ФК NYHA |
2,6±0,5 |
2,1±0,8## |
2,6±0,8 |
3,3±0,9## |
* p=0,023, #p=0,018, ** p=0,037, ## р=0,006
Таблица 3
Паренхиматозно-стромальное отношение (ПСО), трофический индекс (ТИ), зона перикапиллярной диффузии (ЗПкД), индекс Керногана (ИнК) и диаметр кардиомиоцитов (Д КМЦ ) миокарда ЛЖ и ушка ПП у больных ишемической кардиомиопатией с разными отдаленными результатами хирургического лечения, критерий Ван-дер-Вардена
|
I группа (n=36) II группа (n=12) ПП ЛЖ ПП ЛЖ |
|
|
ПСО ТИ ЗПкД, мкм ИнК Д КМЦ , мкм |
2,40±0,35* 2,10±0,30** 2,27±0,43* 1,32±0,37** 0,0485±0,0184* 0,0284±0,0131** 0,0262±0,0089* 0,0087±0,0039** 292,7±30,4* 504,2±58,1** 600,6±64,5* 1295,8±87,1** 1,62±0,42* 1,56±0,33** 1,82±0,32* 1,84±0,22** 14,1±2,3 26,9±3,1 14,1±2,6 26,1±3,3 |
*, ** p<0,05 - достоверность различий между группами
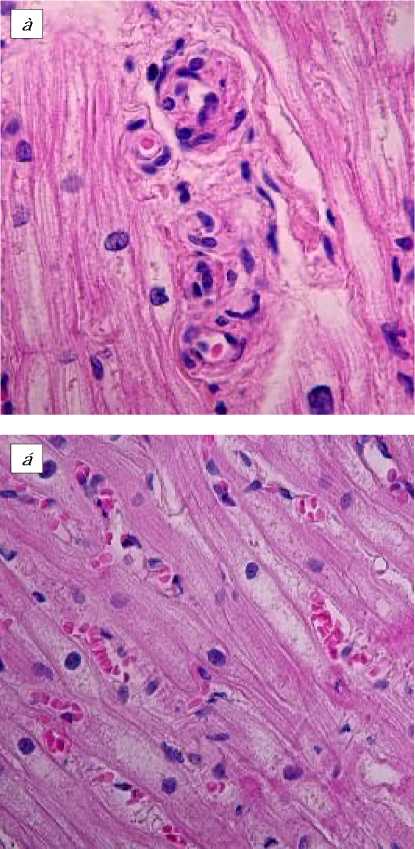
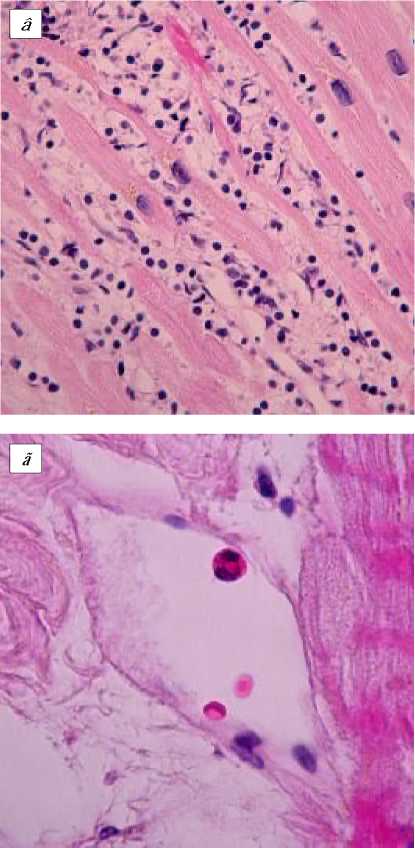
Миокард ЛЖ больных ишемической кардиомиопатией: а - спазм артериол; б - венозное полнокровие; в - смешанный воспалительный инфильтрат в миокардиальной строме; г - краевое стояние эозинофила. Окр. гематоксилином и эозином. Ув. 600 ( а ), 400 ( б, в ), 850 ( г ).
ти, что расценивается нами как неудовлетворительный эффект от оперативного лечения. Количество пациентов с подобным эффектом соизмеримо с данными, представленными другими исследователями [2].
Феномен увеличения фракции выброса, несмотря на клиническое ухудшение состояния после хирургического ремоделирования полости ЛЖ достаточно хорошо описан в литературе. Предполагается, что в его основе лежит преимущественное уменьшение диастолического размера при неизменном конечно-систолическом, что приводит к математическому увеличению фракции выброса левого желудочка [6].
Разделив группы на основании отдаленных результатов хирургического лечения и ретроспективно сравнив исходные клинические данные пациентов, мы не обнаружили каких-либо достоверных клинических или эхокардиографических факторов риска подобного течения послеоперационного периода. Описанные некоторыми авторами факторы риска неблагоприятного результата хирургического лечения пациентов с постинфарктным ремоделированием (такие как показатели среднего давления в правом желудочке [2], объемы полости левого желудочка [3]) не нашли в нашем исследовании своего подтверждения.
Проведение клинико-морфологических параллелей послеоперационного ремоделирования ЛЖ позволило нам выявить морфологические предикторы (предвестники) неблагоприятных результатов хирургического лечения. Таковыми стали: наличие признаков миокардита в сочетании с выраженным фиброзом (паренхиматозно-стромальное отноше-ние<1,6), низким трофическим индексом (<0,010) и высокими значениями зоны перикапиллярной диффузии (>1000 мкм) и индекса Керногана (>1,5) миокарда ЛЖ по данным интраоперационных био- псий. При этом наличие признаков миокард ита в миокарде ушка правого предсердия в 100% случаев указывает на присутствие воспалительной инфильтрации и в миокарде левого желудочка, что также может быть принято за морфологический фактор риска.
Раскрытие механизмов прогрессирования сердечной недостаточности после коррекции внутрисердечной и коронарной гемодинамики позволило бы сузить показания для проведения подобных сложных хирургических вмешательств, поскольку общепринятые методы хирургического лечения не всегда приводят к обратному развитию этого патологического процесса. Найденные нами изменения функциональной морфологии миокарда ЛЖ и ушка ПП являются лишь частными проявлениями этого процесса. При этом остается не ясным как на основании клинических и инструментальных данных оценить о степень выраженности подобных морфофункциональных изменений в каждом конкретном клиническом случае.
ВЫВОДЫ
-
1. У каждого четвертого пациента комплексное хирургическое лечение постинфарктного ремоделирования левого желудочка малоэффективно.
-
2. Наличие воспалительной инфильтрации миокардиальной стромы в сочетании с выраженным фиброзом, низким трофическим индексом и высокими значениями индекса Керногана и зоны перикапиллярной диффузии миокарда левого желудочка являются морфологическими предикторами риска послеоперационного ремодел ирования сердца у больных с ишемической дисфункцией миокарда.
Патологическое повреждение миокарда, рефрактерное к хирургическому воздействию, носит системный характер. Однотипные изменения на-бл юдаются как в ушке правого предсердия, так и в миокарде левого желудочка.
Список литературы Клинико-морфологические параллели послеоперационного ремоделирования левого желудочка.
- Автандилов Г.Г. Медицинская морфометрия / Г.Г. Автандилов. М.: Медицина, 1990. 384 с.
- Braun J., Bax J.J., Versteegh M.I. et al. // Eur. J. Cardiothorac. Surg. 2005. V. 27. P. 53.
- Dor V., Sabatier M., Di Donato M. et al. // J. Thorac. Cardiovasc. Surg. 1998. V. 116. P. 9.
- Dor V. // Semin. Thorac. Cardiovasc. Surg. 1997. V. 9. P. 30.
- Di Donato M., Sabatier M., Dor V. et al. // J. Thorac. Cardiovasc. Surg. 2001. V. 121. P. 91-96.


