Клинико-морфологическое исследование миелофиброза при хроническом миелолейкозе
Автор: Долгих Татьяна Юрьевна, Качесов Игорь Викторович, Марченко Андрей Анатольевич, Домникова Наталья Петровна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 (72), 2015 года.
Бесплатный доступ
Проведено клинико-морфологическое исследование пациентов с хроническим миелолейкозом. Распространенность миелофиброза в трепанобиоптатах изучена с помощью разработанной компьютерной программы анализа изображений. Установлено, что миелофиброз развивается у половины обследованных пациентов. Начальный и выраженный миелофиброз встречаются примерно с одинаковой частотой, а их сочетание наблюдается чаще. В фазе акселерации и фазе бластного криза миелофиброз встречается чаще, чем в хронической фазе. В хронической фазе обнаружена прямая корреляция между относительной площадью фиброзной ткани при начальном миелофиброзе и выраженном миелофиброзе и числом мегакариоцитов, числом карликовых мегакариоцитов в трепанобиоптате. В фазе акселерации и фазе бластного криза относительная площадь фиброзной ткани при начальном и выраженном миелофиброзе прямо коррелирует с процентным содержанием бластов в миелограмме, процентным содержанием бластов в трепанобиоптате подвздошной кости и процентным содержанием бластов в периферической крови. Вне зависимости от фазы хронического миелолейкоза распространенность как начального, так и выраженного миелофиброза прямо коррелирует с продолжительностью заболевания. Наличие выраженного миелофиброза вне зависимости от фазы хронического миелолейкоза ассоциировано с применением химиотерапии. Начальный миелофиброз с фактом применения химиотерапии не связан. Возраст и пол не являются факторами, взаимосвязанными с миелофиброзом.
Хронический миелолейкоз, хроническая фаза, фаза акселерации и фаза бластного криза, миелофиброз, относительная площадь фиброзной ткани
Короткий адрес: https://sciup.org/14056597
IDR: 14056597 | УДК: 616-006.448-06:616.155.194.76
Текст научной статьи Клинико-морфологическое исследование миелофиброза при хроническом миелолейкозе
В настоящее время во всем мире сохраняется тенденция к увеличению заболеваемости гемобластозами, в том числе и хроническим миелолейкозом (ХМЛ). Ежегодная заболеваемость ХМЛ варьирует от 0,6 до 1,9 случая на 100 000 населения [1]. Важное значение для диагностики и установления клинической фазы ХМЛ имеет гистологическое исследование костного мозга, которое позволяет оценить степень выраженности фиброзной ткани и наличие скоплений бластных клеток, что может быть ранним проявлением прогрессирующей фазы заболевания и бластного криза [2]. Повышенное количество ретикулиновых волокон, выявляемых методом серебрения, в момент установления диагноза определяется у 40 % больных. Увеличение количества ретикулиновых волокон в костном мозге коррелирует с увеличением количества мегакариоцитов, выраженностью спленомегалии и анемии [10]. Однако морфологическое исследование костного мозга не включается в прогностическую систему, так как основное внимание сфокусировано на гематологических параметрах [11]. В то же время, как считают некоторые исследователи, гистологические характеристики являются важными прогностическими признаками в прогрессировании хронической фазы ХМЛ [12].
По одним данным, развитие миелофиброза (МФ) снижает риск развития бластного криза и ассоциировано с большей продолжительностью жизни [6]. Другие авторы считают, что у пациентов с большей плотностью ретикулиновых волокон восстановление кроветворения в период после трансплантации костного мозга протекает хуже, чем у больных с меньшим уровнем аналогичных показателей [12]. Таким образом, информация о прогностической значимости МФ противоречива. В частности, остается неясным: влияет ли объем опухолевой массы в костном мозге, гистологический подтип опухолевого поражения на распространённость МФ при ХМЛ. Вопрос о влиянии современной химиотерапии на МФ при этом заболевании также недостаточно освещен.
Цель исследования – изучить патоморфоло-гические особенности МФ при ХМЛ и оценить влияние опухолевого поражения костного мозга и химиотерапии (ХТ) на его выраженность.
Материал и методы
Обследовано 88 больных ХМЛ, из них 52 мужчины и 36 женщин, в возрасте от 16 до 82 лет (средний возраст – 55,8 ± 1,9 года), находившихся на лечении в ГБУЗ НСО «Государственная Новоси- бирская областная клиническая больница» с 2006 по 2013 г. Исследование проведено с соблюдением «Этических принципов проведения научных медицинских исследований с участием человека» и в соответствии с «Правилами клинической практики в Российской Федерации».
Хроническая фаза ХМЛ встречалась в 60 % случаев. Фазу акселерации и фазу бластного криза рассматривали в совокупности, в эту группу были включены 40 % пациентов. Дебют заболевания наблюдался в 47 % случаев, ответ на химиотерапию (оптимальный или субоптимальный) – в 22 %, рецидив – в 31 %. Одну линию химиотерапии (гидроксикарбамид + интерферон альфа-2β) получили 55 % больных, две (гидроксикарбамид + интерферон альфа-2β, иматиниб) – 45 % пациентов. Верификацию диагноза ХМЛ, определение фазы заболевания, оценку результатов терапии осуществляли согласно стандартным критериям [4, 5].
Степень МФ устанавливалась согласно шкале Европейского консенсуса [12]. Автоматизированное морфометрическое исследование МФ проводили с использованием программы анализа изображений AxioVision 4.6, камеры Axio Cam, микроскопа Zeiss, компьютера. На парафиновых срезах трепанобиоптатов подвздошной кости, толщиной 4 мкм, импрегнированных серебром по методу Гомори и окрашенных по методу ван Гизона при ×200, измеряли абсолютную площадь фиброзной ткани. Абсолютную площадь гемопоэтической и опухолевой ткани измеряли в срезах, окрашенных гематоксилином и эозином. Изучали все костномозговые полости одного среза, что соответствовало 5–7 полям зрения микроскопа и 20–30 полям зрения камеры (в зависимости от размера среза). Площадь одного поля зрения камеры составляла 364 000 мкм2 (0,7 мм2). Подсчитывали суммарную абсолютную площадь фиброзной ткани в пределах одного среза, а также суммарную абсолютную площадь гемопоэтической и опухолевой ткани. Относительную площадь фиброзной и опухолевой ткани (S отн.фибр.тк. и S отн.опух.тк. ) вычисляли по формулам, описанн. ым. р. анее [. 3].. .
Материалом для цитологического исследования служили мазки периферической крови и аспиратов костного мозга, окрашенные по методу Романовского – Гимзы.
Статистическую обработку результатов проводили с помощью программы SPSS (версия 17.0). Результаты представлены в виде M ± σ, где М – среднее арифметическое значение, σ – стандартное отклонение. Проверку соответствия выборок анализируемых данных по Sотн.фибр.тк. и Sотн.опух.тк. нормальному закону распределения проводили по критерию Шапиро – Уилка. Сравнения средних значений различных выборок производили с помощью U-теста по методу Манна и Уитни (непараметрический тест). Связь между двумя переменными определяли с помощью коэффициентов корреля- ции Пирсона и Спирмана. Для однофакторного и многофакторного анализа использовали модель логистической регрессии. Критериями достоверности считали значения вероятности ошибки р<0,05 и отношения шансов (OR)>1,0.
Результаты и обсуждение
Характеристика МФ в дебюте и рецидиве заболевания
Частота МФ при ХМЛ составила 50 %. При этом у пациентов в фазе акселерации и фазе бластного криза МФ встречался чаще, чем у пациентов в хронической фазе ХМЛ (соответственно в 79 и 46 %) (рис. 1). Как начальный, так и выраженный МФ в хронической фазе, а также в фазе акселерации и фазе бластного криза наблюдались практически с одинаковой частотой – 30 % (рис. 2). Чаще определялось сочетание начального и выраженного МФ: в 40 % случаев у пациентов в хронической фазе и в 46 % случаев у пациентов в фазе акселерации и фазе бластного криза. У пациентов как в хронической фазе, так и в фазе акселерации и фазе бластного криза Sотн.фибр.тк. при выраженном МФ оказалась больше Sотн.фибр.тк. при начальном МФ (p<0,001) (табл. 1). В фа.зе а.кс. елерации и фазе бластного криза S при выраженном МФ отн.фибр.тк.
достоверно (р12<0,001) превысила аналогичный показатель в хронической фазе.
Проанализирована взаимосвязь МФ и опухолевой ткани. Относительная площадь опухолевой ткани у пациентов в хронической фазе МФ составила 60,7 ± 18,8 % и не отличалась от аналогичного показателя у пациентов в фазе акселерации и фазе бластного криза (59,0 ± 18,7 %). У пациентов в хронической фазе ХМЛ гранулоцитарный подтип опухолевой инфильтрации костного мозга наблюдался в 2 раза чаще, чем гранулоцитарно-мегакариоцитарный – 69 % против 31 %.
При гранулоцитарном подтипе опухолевой инфильтрации костного мозга у пациентов в хронической фазе заболевания S при начальном МФ отн.фибр.тк.
и Sотн.фибр.тк. при выраженном МФ не различались, а при гранулоцитарно-мегакариоцитарном подтипе Sотн.фибр.тк. при выраженном МФ превысила Sотн.фибр.тк. при. нач. а.льном МФ (р<0,001) (табл. 2). У пацие. нто. в.
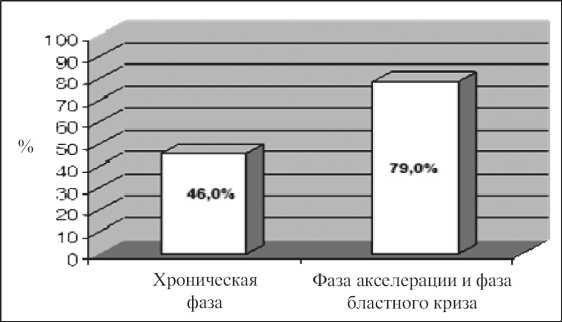
Рис. 1. Частота МФ при ХМЛ в хронической фазе, фазе акселерации и фазе бластного криза
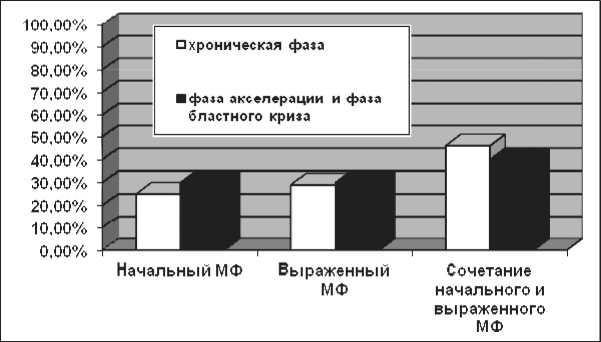
Рис. 2. Структура МФ в хронической фазе, а также фазе акселерации и фазе бластного криза
с гранулоцитарно-мегакриоцитарным подтипом Sотн.фибр.тк. при выраженном МФ превысила анало-гич.ный. .показатель у больных гранулоцитарным подтипом (р=0,006 и р=0,017 соответственно).
В хроническую фазу ХМЛ, независимо от подтипа опухолевой инфильтрации костного мозга, обнаружена прямая корреляция между Sотн.фибр.тк. при начальном МФ и числом мегакариоцитов в трепанобиоптате подвздошной кости (r=0,619, р=0,032), между Sотн.фибр.тк. при начальном МФ и числом карликовых .мег. ак. ариоцитов в трепано- биоптате подвздошной кости (r=0,703, р=0,016), между Sотн.фибр.тк. при выраженном МФ и числом мегакариоц. ито. в. в трепанобиоптате подвздошной кости (r=0,517, р=0,006), между Sотн.фибр.тк. при выраженном МФ и числом карликовых м. ега. к.ариоцитов (r=0,643, р=0,014) в трепанобиоптате подвздошной кости.
В хронической фазе ХМЛ, независимо от подтипа опухолевой инфильтрации костного мозга у пациентов с дизмегакариоцитопоэзом, Sотн.фибр.тк. при начальном МФ и Sотнфибртк при выражен. ном. .МФ таблица 1
относительная площадь фиброзной ткани в трепанобиоптатах в хронической фазе, фазе акселерации и фазе бластного криза у пациентов с хМЛ
|
Фаза |
S отн.фибр.тк. при начальном МФ |
S отн.фибр.тк. при выраженном МФ |
|
Хроническая (n=28) |
17,7 ± 22,9 |
30,7 ± 32,6* |
|
Акселерации и бластного криза (n=11) |
18,8 ± 28,7 |
39,2 ± 40,5# |
|
р |
р1,2=0,650 |
р1,2<0,001 |
Примечание: * – различия статистически значимы по сравнению с показателем в хронической фазе при начальном МФ (р<0,001); # – различия статистически значимы по сравнению с показателем в фазе акселерации и фазе бластного криза при начальном МФ (p<0,001).
таблица 2
относительная площадь фиброзной ткани в трепанобиоптатах при гранулоцитарном и гранулоцитарно-мегакариоцитарном подтипах хМЛ в хронической фазе заболевания
|
Тип ХМЛ |
S отн.фибр.тк. при начальном МФ |
S отн.фибр.тк. при выраженном МФ |
|
Гранулоцитарный (n=31) |
5,8 ± 14,2 |
5,9 ± 15,2 |
|
Гранулоцитарно-мегакариоцитарный (n=14) |
11,3 ± 24,4 |
30,5 ± 41,5* |
|
р |
р1,2=0,310 |
р1,2=0,006 |
Примечание: * – различия статистически значимы по сравнению с показателем при начальном МФ при гранулоцитарно-мегакариоцитарном типе (р<0,001).
таблица 3
относительная площадь фиброзной ткани в трепанобиоптатах при наличии и отсутствии дизмегакариоцитопоэза у пациентов в хронической фазе хМЛ
В фазе акселерации и фазе бластного криза Sотн.фибр.тк. при выраженном МФ (21,4 ± 32,1 %) знач. им.о .больше (р=0,006), чем при начальном МФ (13,0 ± 23,4 %). При выраженном и при начальном МФ уровни Sотн.фибр.тк. прямо коррелировали с процентным содер.жан. и. ем бластов в миелограмме (r=0,414, p=0,014 и r=0,314, p=0,040 соответственно), в трепанобиоптатах подвздошной кости (r=0,311, p=0,046 и r=0,531, p=0,021 соответственно) и в периферической крови (r=0,437, p=0,025 и r=0,697, p=0,007).
Продолжительность заболевания с момента появления первых симптомов до момента постановки диагноза составила 7,5 ± 3,2 мес. Независимо от фазы ХМЛ обнаружена прямая корреляция между продолжительностью заболевания с момента появления первых жалоб до момента постановки диагноза и Sотн.фибр.тк. при начальном МФ (р=0,009, r=0,873), а так. же. п. родолжительностью заболевания и Sотн.фибр.тк. при выраженном МФ (р=0,015, r=0,702). На.чал.ьн. ый МФ ассоциирован с продолжительностью болезни более 4 мес (р=0,018, OR 59,13, 95 % CI 7,58 – 274,15), выраженный МФ – c продолжительностью ХМЛ более 7 мес (р=0,008, OR 85,09, 95 % CI 10,19 – 379,72).
Характеристика МФ у пациентов, ответивших на химиотерапию (оптимальный или субоптимальный ответ)
Группу пациентов, ответивших на лечение (оптимальный, субоптимальный ответ), составили 19 человек. Все пациенты получили две линии химиотерапии: гидроксикарбамид + интерферон альфа-2β, иматиниб.
Семь (54 %) человек из группы больных, у которых МФ отсутствовал на фоне проведенного лечения, не имели МФ изначально до химиотерапии. У 5 (38 %) человек присутствовал начальный МФ, у 1 (8 %) больного – выраженный (МФ-2). У пациентов, ответивших на химиотерапию, Sотн.фибр.тк. при выраженном МФ (20,1 ± 33,6 %) оказалась. зн.ач. имо больше, чем при начальном МФ (3,5 ± 8,6 %). У
13 (68 %) больных МФ отсутствовал. Наличие МФ отмечено у 6 (32 %) пациентов. Сочетание начального и выраженного МФ наблюдалось в 4 (21 %), только выраженный МФ – в 2 (11 %) случаях.
У пациентов, ответивших на ХТ, Sотн.фибр.тк. оценена в сравнении с Sотн.фибр.тк. у пациентов. в д.е.бюте и рецидиве заболевани. я. О. б. наружено, что самый большой уровень Sотн.фибр.тк. при начальном МФ отмечался у пациентов .с ре. ц.идивом ХМЛ (табл. 4). Значения Sотн.фибр.тк. при выраженном МФ у пациентов с рецидив. ом.Х.МЛ и у больных, ответивших на химиотерапию, значимо выше, чем у пациентов в дебюте заболевания.
Многофакторный анализ показал ассоциацию начального МФ в хронической фазе ХМЛ с такими факторами, как дизмегакариоцитопоэз (р=0,032, OR 69,43, 95 % CI 2,18 – 306,40) и гранулоцитарно-мегакариоцитарный тип опухолевого поражения костного мозга (р=0,046, OR 70,42, 95 % CI 3,99 – 215,18), выраженного МФ, с аналогичными факторами (р=0,006, OR 50,13, 95 % CI 4,85 – 372,10 и р=0,002, OR 16,32, 95 % CI 5,12 – 118,12 соответственно), а также с проводимой химиотерапией (гидроксикарбамид + интерферон альфа-2β, иматиниб).
Проведение многофакторного анализа обнаружило ассоциацию в фазе акселерации и фазе бластного криза начального МФ с числом незрелых клеток миелоидного ряда в трепанобиоптате подвздошной кости – 30 % и более, выраженного МФ – с числом незрелых клеток миелоидного ряда – 55 % и более.
Частота МФ при ХМЛ в нашем исследовании оказалась выше, чем в других работах [10]. Это связано с тем, что мы применяли иную методику оценки МФ. Помимо общепринятой шкалы Европейского консенсуса нами использована программа для морфометрического анализа изображений. Во внимание принимались не только срезы тре-панобиоптатов, по всей площади представленные фиброзными волокнами, но и те срезы, в которых наряду с участками, занятыми фиброзной тканью, отмечались поля костного мозга, свободные от ретикулиновых и коллагеновых волокон.
таблица 4
относительная площадь опухолевой и фиброзной ткани у пациентов в дебюте, рецидиве хМЛ и при ответе на химиотерапию
|
Фаза заболевания |
S отн.опух.тк. |
Sотн.фибр.тк. при начальном МФ |
Sотнфибртк при выраженном ... МФ |
|
Дебют (n=50) |
62,2 ± 15,8 |
7,1 ± 15,4 |
14,8 ± 27,4* |
|
Ответ на ХТ (n=13) |
0 |
3,5 ± 8,6 |
20,1 ± 33,6** |
|
Рецидив (n=19) |
54,4 ± 25,8 |
19,0 ± 30,8 |
22,6 ± 35,7 |
|
р |
р12<0,001 р1,3<0,001 р2,3<0,001 |
р12<0,001 р1,,3<0,001 |
Примечание: * – различия статистически значимы по сравнению с показателями у больных ХМЛ с дебютом заболевания при начальном МФ (р<0,001); ** – различия статистически значимы по сравнению с показателями у пациентов с ответом на ХТ при МФ-2 (p<0,001).
Заключение
При ХМЛ миелофиброз встречается чаще в фазе акселерации и фазе бластного криза, чем в хронической фазе заболевания. В фазе акселерации и фазе бластного криза распространенность как начального, так и выраженного МФ прямо коррелирует с числом бластов как в костном мозге, так и в периферической крови. Проведение многофакторного анализа обнаружило ассоциацию в фазе акселерации и фазе бластного криза начального МФ с числом незрелых клеток миелоидного ряда в трепанобиоптате подвздошной кости – 30 % и более, выраженного МФ – с числом незрелых клеток миелоидного ряда – 55 % и более. Независимо от фазы ХМЛ распространенность как начального, так и выраженного МФ прямо коррелирует с продолжительностью заболевания. Эти факты объясняются тем, что естественное течение ХМЛ сопровождается увеличением содержания фиброзных волокон в костном мозге. Степень МФ отражает один из этапов развития, на котором было выявлено заболевание [8].
Распространенность выраженного МФ при гранулоцитарно-мегакариоцитарном подтипе выше, чем при гранулоцитарном подтипе. Независимо от подтипа опухолевого поражения костного мозга имеется прямая корреляция между распространенностью как начального, так и выраженного МФ и числом мегакариоцитов в трепанобиоптате подвздошной кости. При гранулоцитарном подтипе прямая корреляция наблюдается между распространенностью как начального, так и выраженного МФ и числом карликовых мегакариоцитов. Распространенность начального и выраженного МФ у па- циентов с дизмегакариоцитопоэзом больше, чем у пациентов без дизмегакариоцитопоэза. Многофакторный анализ выявил ассоциацию в хронической фазе ХМЛ как начального, так и выраженного МФ с такими факторами, как дизмегакариоцитопоэз и гранулоцитарно-мегакариоцитарный тип опухолевого поражения костного мозга.
Список литературы Клинико-морфологическое исследование миелофиброза при хроническом миелолейкозе
- Абдулкадыров К.М., Ломаиа И.Г., Шуваев В.А., Абдулкадырова А.С., Лазорко Н.С., Мартынкевич И.С., Никулина Т.С., Удальева В.Ю., Усачева Е.И., Зотова И.И., Головченко Р.А., Фоминых М.С., Иванова М.О., Мачюлайтене Е.Р., Позняк Е.И., Ильина Н.В., Карягина Е.В., Романова Е.Г., Холопова И.В., Сбитякова Е.Г., Шнейдер Т.В., Зарицкий А.Ю. Заболеваемость и распространённость хроническим миелолейкозом за 2006-2011 в Санкт-Петербурге и Ленинградской области//Вестник гематологии. 2013. Т. IX, № 2. С. 7-8.
- Домникова Н.П., Непомнящих Г.И., Айдагулова С.В., Бакарев М.А., Долгих Т.Ю., Качесов И.В., Петрусенко Е.Е. Морфометрический анализ трепанобиоптатов при агрессивных и индолентных неходжкинских лимфомах//Бюллетень экспериментальной биологии и медицины. 2011. Т. 151, № 6. С. 713-717.
- Дьячкова Ю.А., Долгих Т.Ю., Домникова Н.П. Клинико-патоморфологическое исследование миелофиброза при множественной миеломе//Сибирский онкологический журнал. 2014. № 3. С. 34-38.
- Программное лечение заболеваний системы крови/Под ред. В.Г. Савченко. М., 2012. Т. II. 1056 с.
- Baccarani M., Cortes J., Pane F., Niederwieser D., Saglio G., Apperley J., Cervantes F., Deininger M., Gratwohl A., Guilhot F., Hochhaus A., Horowitz M., Hughes T., Kantarjian H., Larson R., Radich J., Simonsson B., Silver R.T., Goldman J., Hehlmann R. Chronic myeloid leukemia: an update of concepts and management recommendations of European Leukemia//J. Clin. Oncol. 2009. Vol. 27 (35). P. 6041-6051 DOI: 10.1200/JCO.2009.25.0779
- Burkhardt R., Jaeger K., Kettner J., Helmer G. Chronic myeloproliferative disorders: prognostic importance of new working classification//J. Clin. Pathol. 1990. Vol. 43 (5). P. 357-364.
- Castro-Malaspina H. Pathogenesis of myelofibrosis: role of ineffective megakaryopoiesis and megakaryocyte components//Prog. Clin. Biol. Res. 1984. Vol. 154. P. 427-454.
- Clough V., Geary G.C., Hashmi K., Davson J., Knowlson T. Myelofibrosis in chronic granulocytic leukemia//Br. J. Haematol. 1979. Vol. 42. P. 515-526.
- Hasford J., Pfirrmann M., Hehlmann R. Allan N.C., Baccarani M., Kluin-Nelemans J.C., Alimena G., Steegmann J.L., Ansari H. A new prognostic score for survival of patients with chronic myeloid leukemia treated with interferon alfa: Writing Committee for the Collaborative CML Prognostic Factors Project Group//J. Natl. Cancer Inst. 1998. Vol. 90 (11). P. 850-858.
- Lazzarino M., Morra E., Castello A., Inverardi D., Coci A., Pagnucco G., Magrini U., Zei G., Bernasconi C. Myelofibrosis in chronic granulocytic leukemia: clinicopathological correlation and prognostic significance//Br. J. Haematol. 1986. Vol. 64 (2). P. 227-240.
- The Italian Cooperative Study Group on Chronic Myeloid Leukaemia. Confirmation and improvement of Sokal's prognostic classification of Ph+ chronic myeloid leukemia: The value of early evaluation of the course of the disease//Ann. Hematol. 1991. Vol. 63 (6). P. 307-314.
- Thiele J., Kvasnicka H.M., Schmitt-Graeff A., Spohr M., Diehl V., Zankovich R., Niederle N., Leder L.D. Effects of interferon and hydroxyurea on bone marrow fibrosis in chronic myelogenous leukaemia: A comparative retrospective multicentre histological and clinical study//Br. J. Haematol. 2000. Vol. 108 (1). P. 64-71.


