Когерентные отношения ритмов ээг при смене функциональных состояний у взрослых с локально обусловленной эпилепсией
Автор: Гребенюк Олег Валерьевич, Алифирова Валентина Михайловна, Светлик Михаил Васильевич
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Эпилептология
Статья в выпуске: 5 (80), 2013 года.
Бесплатный доступ
Обследованы 150 пациентов с локально обусловленной эпилепсией, принимающих противоэпилептические препараты. Из них 72 человека с резистентной формой заболевания (группа А) и 78 человек, контролирующих эпилептические приступы (группа Б). В группу сравнения вошли 70 пациентов с редкими эпилептическими приступами без приема антиконвульсантов (группа В). Исследовали межполушарную когерентность в состоянии сна, бодрствования и при функциональных нагрузках. В группах А и В наблюдалось нарастание межполушарной когерентности в диапазоне p-ритма при когнитивной активации. В группе Б наблюдались нарастание межполушарной когерентности в диапазоне A-ритма при гипервентиляции и снижение в диапазоне P-ритма при когнитивной активации. Динамика межполушарной когерентности наблюдалась в лобных зонах, наиболее зависящих от координирующих влияний срединных структур мозга.
Резистентная локально обусловленная эпилепсия, ритмы ээг, когерентность, функциональные нагрузки
Короткий адрес: https://sciup.org/14295677
IDR: 14295677 | УДК: 616.853.5:616-072.7
Текст научной статьи Когерентные отношения ритмов ээг при смене функциональных состояний у взрослых с локально обусловленной эпилепсией
Алифирова Валентина Михайловна – зав. каф. неврологии и нейрохирургии, д.м.н., проф.
Светлик Михаил Васильевич – ст. преподаватель кафедры медицинской и биологической кибернетики, к.б.н.
патологических процессов в мозге [7]. Во взрослом возрасте преобладают локально обусловленные формы эпилепсии (ЛОЭ), достигая 80 % от общего числа эпилепсий [8].
ЛОЭ является динамическим процессом, характеризующимся экспансией патологических нейронных сетей с вовлечением интактных нейронных популяций, что сопровождается нейродинамическими перестройками, изменением биоэлектрической активности головного мозга и морфологическими нарушениями по мере развития заболевания [15]. Клинически эпилептический процесс характеризуется возникновением парциальных приступов, среди которых наиболее драматическими являются вторично-генерализованные судорожные припадки (ВГСП), возникающие при распространении возбуждения на оба полушария мозга. Основным методом лечения ЛОЭ является применение противоэпилептических препаратов (ПЭП), предотвращающих развитие приступов. Ведущим параклиническим методом оценки эффективности проводимой терапии ПЭП при ЛОЭ является метод электроэнцефалографии (ЭЭГ), позволяющий регистрировать динамику патологической активности в различных функциональных состояниях (ФС) [10, 14; 28]. В настоящее время методом ЭЭГ могут быть выделены следующие ФС: стадии расслабленного и активного бодрствования, медленного и быстрого сна, характеризующиеся соответствующими визуальными паттернами и реорганизацией спектрально-когерентных показателей мозговых ритмов [3; 13]. Когерентный анализ спектральных характеристик ЭЭГ рассматривается как мера функциональных связей и степени синхронизации региональной активности в коре головного мозга [6] и является методом, информативным для оценки ФС головного мозга, как в норме, так и при патологии [29].
У пациентов с ЛОЭ когерентность возрастает в иктальный период между участками коры головного мозга, вовлеченными в генерацию и распространение эпилептической активности, выявленное глубинными электродами [24]. При регистрации поверхностными электродами у больных с активной ЛОЭ в межприступный период снижается внутриполушарная когерентность со стороны эпилептического очага, тогда как в ремиссии этот показатель возрастает [20]. У пациентов с посттравматической ЛОЭ выявляется снижение межполушарной когерентности во всех диапазонах спектра по сравнению со здоровыми, что связано с нарушением интегративных процессов обеспечивающих корково-подкорковые взаимодействия при этом заболевании [18].
Межполушарная когерентность является показателем интенсивности интегративных процессов между гомологичными участками коры и снижается при различных патологических процессах в мозге, протекающих с вовлечением синхронизирующих структур лимбико-ретикулярного комплекса [4].
Поскольку генерализация патологической активности при ВГСП осуществляется с вовлечением срединных структур [11], можно предполагать, что течение патологического процесса при ЛОЭ приведет к системной перестройке интегративного взаимодействия на различных уровнях центральной нервной системы, что в интериктальный период может быть оценено при исследовании динамики межполушарной когерентности в различных ФС.
В настоящей работе проведено изучение динамики межполушарных когерентных отношений у пациентов с локально обусловленной эпилепсией с различным ответом на антиконвульсанты в ФС активного, расслабленного бодрствования и сна.
Материалы и методы. В исследуемую группу вошли 150 пациентов с симптоматической и вероятно-симптоматической ЛОЭ лобно-височной локализации в возрасте от 16 до 65 лет с длительностью заболевания не менее 2 лет. Из них 67 женщин и 83 мужчины. Средний возраст составил 30,97±11,55 и 30,17±12,83 года. У 72 пациентов с ВГСП была диагностирована резистентная форма заболевания (группа А), у 78 – медикаментозная ремиссия сроком от 6 месяцев (группа Б). Исследуемые группы не различались по полу и возрасту.
Диагноз ЛОЭ базировался на определении заболевания, сформулированном последней ревизией Международной Противоэпилептиче-ской Лиги [25; 26].
В качестве группы сравнения были отобраны 70 человек с редкими судорожными приступами, не принимающие ПЭП (группа В).
Всем обследованным проводили мониторирование ЭЭГ в интериктальный период в ФС бодрствования и физиологического сна в дневное время. В качестве нагрузки применяли депривацию ночного сна. Мониторирование ЭЭГ проводили по протоколу, включающему последовательную смену ФС: РБ – 3 минуты, АБ (КА, ГВ – 3 минуты), ФМС.
Мониторинг ЭЭГ проводился на аппарате «Нейрон-Спектр-4ВП» фирмы «Нейрософт».
В качестве материала для когерентного анализа использовали участки ЭЭГ, лишенные артефактов в период расслабленного бодрствования (РБ), активного бодрствования (АБ) и во 2—3 стадию фазы медленного сна (ФМС) непосредственно перед наступлением ∆-сна. В связи с тем, что при проведении пробы с засыпанием в дневное время физиологический сон возникает не у всех обследуемых [27]. Для анализа отбирали фрагменты ЭЭГ, отвечающие следующему условию: преобладание суммарного индекса ∆-ритма в ФС сна по сравне- нию с ФС бодрствования. В качестве нагрузочных тестов в ФС АБ использовали гипервентиляционную нагрузку (ГВ) и когнитивную активацию (КА). КА проводили методом когнитивных вызванных потенциалов Р300 с использованием аудиальных стимулов (парадигма odd ball) по стандартной методике [9].
Математическая обработка включала в себя этап нахождения индексов ЭЭГ и когерентных отношений в диапазонах ∆, Θ, α, и β стандартными методами. Проводили поиск статистических различий между сформированными группами в исследуемых ФС, сравнение полученных данных. Для сокращения количества расчетов и предотвращения возникновения ошибки второго рода исследовали когерентности между отведениями F3, F4, T5 и T6, отражающими активность в соответствующих зонах мозга.
Для оценки динамики активности мозга в группах рассчитывали интегральные значения показателей коэффициентов когерентности в последовательных ФС по формуле:
S = £1 ■ Ai - где
i
S – динамика активности мозга в группе, i – номер ФС, Аi – значение коэффициента когерентности в ФС. ФС проводились по порядку от 1 до 4 в следующей последовательности: РБ, КА, ГВ, ФМС.
Статистическую обработку результатов проводили непараметрическими методами Краскала-Уолиса, Манна-Уитни, Фридмана, Вилкоксона. Динамику ЭЭГ в ФС оценивали методами дисперсионного анализа для повторных многофакторных наблюдений с использованием пакета Statistica 6.0. Проверку распределений признаков проводили с использованием критерия Шапиро-Вилка, Колмогорова-Смирнова. За достоверный принимали уровень значимости р<0,05.
Результаты. На первом этапе работы оценивали достоверность различий коэффициентов межполушарной когерентности в исследуемых группах. В ФС РБ у пациентов из группы Б наблюдалось устойчивое повышение коэффициентов когерентности между парами отведений F3, F4 в диапазоне β-ритма по сравнению с группами А и В (табл. 1). В свою очередь у пациентов из группы А наблюдалось достоверное снижение показателей когерентности в отведениях F3-F4 в диапазонах α- и Θ-ритмов по сравнению с группами Б и В соответственно.
Оценивая значения уровней достоверности различий показателей когерентности в сравниваемых ФС, можно отметить, что большинство выявленных различий, несмотря на четкость клинических параметров дифференцировки сравниваемых групп, имело низкую достоверность в связи с большой дисперсией в группах, вероятно обусловленной индивидуальными особенностями нейродинамики (табл. 2).
Таблица 1
Достоверные различия показателей когерентности в сравниваемых группах в состоянии расслабленного бодрствован
|
А&Б |
А&В |
Б&В |
||||
|
12 34 |
12 34 |
12 34 |
||||
|
Показатели когерентности в сравниваемых группах |
||||||
|
Отведения |
Ритм |
Группа А |
Группа Б |
Группа В |
||
|
(1 Qu; Me; 2 Qu) |
||||||
|
F3-F4 |
teta |
0,54; 0,74; 0,92 |
0,51; 0,75; 0,89 |
0,62; 0,81; 0,9 |
||
|
F3-F4 |
alfa |
0,5; 0,71; 0,86 |
0,65; 0,79; 0,9 |
0,5; 0,75; 0,88 |
||
|
F3-F4 |
beta |
0,53; 0,75; 0,82 |
0,63; 0,82; 0,90 |
0,68; 0,75; 0,86 |
||
|
F3-T6 |
beta |
0,33; 0,41; 0,56 |
0,32; 0,51; 0,60 |
0,35; 0,49; 0,60 |
||
|
F4-T5 |
beta |
0,34; 0,46; 0,60 |
0,42; 0,54; 0,67 |
0,35; 0,52; 0,62 |
||
|
T5-T6 |
beta |
0,34; 0,49; 0,62 |
0,4; 0,49; 0,64 |
0,33; 0,43; 0,57 |
||
Здесь и в таблице 3 отведения маркированы: F3 – 1; F4 – 2; T5 – 3; T6 – 4. Достоверные различия в полосе:
∆-ритма
Θ-ритма
Примечание. 1 Qu – первый квартиль; Me – медиана;
2 Qu – второй квартиль.
Таблица 2
Уровни достоверности различий коэффициентов когерентности в сравниваемых ФС
|
Отведения |
Ритм |
Значимость |
Отведения |
Ритм |
Значимость |
|
РБ А&Б |
ГВ А&Б |
||||
|
F3-F4 |
alfa |
0,0473 |
F3-F4 |
beta |
0,0151 |
|
F3-F4 |
beta |
0,0047 |
ГВ А&В |
||
|
F3-T6 |
beta |
0,0009 |
F3-T5 |
teta |
0,0345 |
|
F4-T5 |
beta |
0,0129 |
F3-T6 |
teta |
0,0345 |
|
РБ А&В |
F3-T6 |
beta |
0,0124 |
||
|
F3-F4 |
teta |
0,0231 |
F4-T5 |
beta |
0,0435 |
|
РБ Б&В |
ГВ Б&В |
||||
|
F3-F4 |
beta |
0,0333 |
F4-T5 |
beta |
0,0483 |
|
F3-T6 |
beta |
0,0234 |
ФМС А&Б |
||
|
T5-T6 |
beta |
0,0495 |
F3-T5 |
alfa |
0,0453 |
|
КА А&Б |
ФМС А&В |
||||
|
F3-T6 |
teta |
0,0072 |
F3-F4 |
beta |
0,0147 |
|
КА Б&В |
ФМС Б&В |
||||
|
F3-T6 |
teta |
0,0189 |
F4-T5 |
alfa |
0,0419 |
β-ритма
При этом количественно преобладали лобные и диагональные пары по отношению к гомологичным теменным отведениям.
Рассматривая общепринятую в нейрофизиологии практику смены ФС как способ оценки реактивности мозга, мы полагали, что проводимые последовательно функциональные пробы отражают динамику рассчитываемых показателей ЭЭГ. Для реализации гипотезы проводили сравнение отношений коэффициентов когерентности в исследуемых состояниях к ФС РБ (табл. 3).
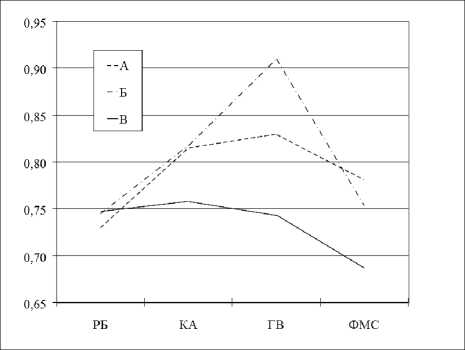
В группе Б наблюдалось достоверное изменение межполушарных взаимосвязей в полосе ∆-ритма, характеризующее нарастание активации в этом диапазоне в ФС АБ (рис. 1), особенно при ГВ по сравнению с КА (Wilcoxon Matched Pairs Test, p=0,029).
У пациентов из групп А и В выявлялась достоверная динамика коэффициентов когерентности в отведениях F3-F4 в β-диапазоне (табл. 3).
Таблица 3
Достоверные различия между отношениями коэффициентов когерентности в исследуемых состояниях к функциональному состоянию
Рисунок 1. Динамика коэффициентов когерентности в дельта-диапазоне в отведениях F3-F4 при последовательной смене функциональных состояний в исследуемых группах
|
Отведения |
F3-F4 |
Отведения |
F3-F4 |
Отведения |
F3-F4 |
|
Ритм |
Delta |
Ритм |
Delta |
Ритм |
Delta |
|
Значимость |
0,83822 |
Значимость |
0,0467 |
Значимость |
0,62270 |
|
отнКог |
Mean±SD |
отнКог |
Mean±SD |
отнКог |
Mean±SD |
|
КА/РБ |
1±0,63 |
КА/РБ |
0,9±0,32 |
КА/РБ |
0,88±0,4 |
|
ГВ/РБ |
0,99±0,33 |
ГВ/РБ |
1,03±0,38 |
ГВ/РБ |
0,92±0,33 |
|
ФМС/РБ |
0,97±0,57 |
ФМС/РБ |
0,95±0,27 |
ФМС/РБ |
0,84±0,38 |
|
Отведения |
F3-F4 |
Отведения |
F3-F4 |
Отведения |
F3-F4 |
|
Ритм |
Beta |
Ритм |
Beta |
Ритм |
Beta |
|
Значимость |
0,01144 |
Значимость |
0,77880 |
Значимость |
0,00001 |
|
отнКог |
Mean±SD |
отнКог |
Mean±SD |
отнКог |
Mean±SD |
|
КА/РБ |
1,03±0,19 |
КА/РБ |
0,95±0,16 |
КА/РБ |
1,04±0,21 |
|
ГВ/РБ |
0,97±0,15 |
ГВ/РБ |
0,98±0,16 |
ГВ/РБ |
0,94±0,26 |
|
ФМС/РБ |
0,97±0,16 |
ФМС/РБ |
0,94±0,17 |
ФМС/РБ |
0,89±0,17 |
Примечание. отнКог – Отношение коэффициентов когерентности в сравниваемых ФС.
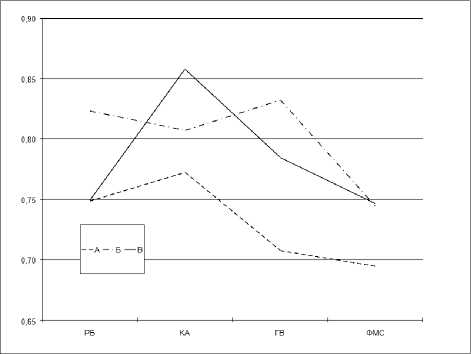
Оценивая кривые в сравниваемых группах, можно видеть, что характер их распределения был аналогичным в группах А и В, т. е. у лиц c генерализованными судорожными приступами независимо от приема ПЭП (рис. 2), однако в группе В наблюдались большие значения и реактивность показателей когерентности по отношению к группе А, что проявлялось большей достоверностью при попарных сравнениях исследуемых параметров (табл. 4).
Таблица 4
Уровни достоверности различий коэффициентов когерентности в сравниваемых ФС в группах лиц с судорожными приступами
|
Сравниваемые ФС |
Значимость |
|
|
Группа А |
Группа В |
|
|
КА ↔ ГВ |
0,044 |
0,002 |
|
КА ↔ ФМС |
0,042 |
0,003 |
Напротив, у пациентов из группы Б наблюдалось уменьшение межполушарной когерентности в β-диапазоне в ФС КА по сравнению с ФС РБ (Wilcoxon Matched Pairs Test, p=0,022).
Обсуждение результатов. Известно, что средний уровень когерентности у здоровых людей характеризуется высокой стабильностью. Когерентные отношения зависят от изменения ФС, реагируют при патологии мозга и в ответ на медикаментозную терапию [21].
Рисунок 2. Динамика коэффициентов когерентности в бета-диапазоне в отведениях F3-F4 при последовательной смене функциональных состояний в исследуемых группах
В ФС бодрствования у пациентов с резистентной ЛОЭ было выявлено снижение межполушарной когерентности в лобных отведениях в диапазонах Θ- и α-ритмов по отношению к группе сравнения и пациентами, контролирующими ВГСП с помощью ПЭП. Полученные данные перекликаются с приводимыми в литературе. Так, у детей раннего возраста с ЛОЭ наблюдается снижение межполушарной когерентности в лобных отведениях, в большей степени при прогрессировании заболевания с задержкой психомоторного развития [2]. В свою очередь, у взрослых нарушение активации фронтальных отделов коры ассоциируется с прогрессированием диффузных органических процессов в мозге [5].
Можно предполагать, что снижение показателей активации в лобных отведениях, выявленное в настоящем исследовании у пациентов с ВГСП, явилось отражением прогрессирования эпилептического процесса на фоне неэффективной терапии ПЭП. Напротив, в группе пациентов с ремиссией ВГСП в лобных отведениях в ФС бодрствования наблюдалось достоверное повышение межполушарной когерентности в диапазоне β-ритма. Полученные данные подтверждают имеющиеся в литературе представления о синергизме процессов саногенеза с восстановлением функциональных взаимосвязей между полушариями при ЛОЭ, что отражает работу антиэпилептической системы, направленной на подавление распространения патологической активности [20].
Известно, что симметричные участки лобных и центральных отделов в большей степени находятся под влиянием синхронизирующих воздействий нижележащих структур головного мозга [23]. Исходя из литературных данных о роли корково-подкорковых взаимоотношений в обеспечении интегративной деятельности головного мозга, моделировали смену функциональных состояний во время регистрации ЭЭГ, предполагая различную динамику коэффициентов межполушарной когерентности в лобных отведениях в зависимости от степени контроля ВГСП.
У пациентов с ремиссией ВГСП наблюдалось достоверное увеличение межполушарной когерентности в полосе ∆-ритма при проведении функциональных нагрузок. Согласно литературным данным, повышенный уровень межполушарной когерентности в диапазоне медленных колебаний при проведении ГВ у здоровых объективно свидетельствует о гиперактивации стволовых структур мозга мезэнцефального и диэнцефального уровней, лимбико-ретикулярного комплекса [22].
В клиническом исследовании [1] показано сезонное снижение межполушарной когерентности в полосе ритмов до 13 Гц при ЛОЭ в зимне-летний период при незначительной динамике исследованных показателей в ответ на ГВ.
Можно предполагать, что повышение когерентности в диапазоне ∆-ритма в группе пациентов с ремиссией ВГСП при ГВ является отражением формирования защитных нейрональных механизмов под воздействием терапии ПЭП.
В исследуемых группах при последовательной смене ФС наблюдалась достоверная динамика показателей когерентности между гомологичными электродами в группах А и В в лобных отведениях в диапазоне β-ритма.
Согласно литературным данным, для активной эпилепсии в ответ на функциональные нагрузки характерно повышение спектральной мощности в диапазоне β-ритма, обусловленное повышенной склонностью к гиперсинхронизации [16].
При этом у здоровых испытуемых в сравнении с РБ ГВ приводит лишь к небольшому увеличению амплитуды основного ритма [11], а КА – к десинхронизации и снижению межполушарной когерентности высокочастотных ритмов [17]. Можно отметить, что у пациентов с ремиссией ВГСП наблюдалось снижение межцентральной когерентности в лобных отведениях в диапазоне β-ритма, что может расцениваться как отражение процессов, ведущих к восстановлению нейродинамики в этой группе.
Выводы. Таким образом, анализируя динамику межполушарных когерентных отношений в группах пациентов с ЛОЭ и в группе лиц с редкими судорожными приступами на модели последовательной смены ФС, можно сделать следующие выводы.
-
1. При последовательной смене функциональных состояний, включающей расслабленное бодрствование, активацию и сон, наблюдалась достоверная динамика в симметричных участках лобных отведений, наиболее зависящих от координирующих влияний срединных структур мозга.
-
2. У пациентов с судорожными приступами независимо от их частоты наблюдались схожие нейродинамические перестройки, проявляющиеся однонаправленной динамикой показателей когерентности (меньше выраженной при приеме ПЭП) в диапазоне β-ритма в лобных отведениях, что, вероятно, обусловливалось формированием устойчивых патологических путей распространения эпилептической активности с вовлечением срединных структур и полушарий мозга, реактивных по отношению к функциональным нагрузкам.
-
3. При эффективной терапии ЛОЭ с редукцией ВГСП наблюдались увеличение межполушарной когерентности в полосе ∆-ритма при гипервентиляции и снижение в полосе β-ритма при когнитивной активации в лобных отведениях, что может рассматриваться как отражение саноге-нетических процессов, направленных на восстановление физиологических корково-подкорковых взаимоотношений под воздействием эффективной терапии ПЭП.


