Количественная лимфосцинтиграфия с 99mTc-технефитом у больных с постмастэктомической лимфедемой верхней конечности
Автор: Сигов М.А., Давыдов Г.А., Пасов В.В., Спиченкова О.Н., Давыдова Е.В., Жигульский А.В., Иванов С.А.
Рубрика: Научные статьи
Статья в выпуске: 1 т.32, 2023 года.
Бесплатный доступ
Исследованы возможности количественной оценки лимфосцинтиграфии (ЛСГ) у 56 пациенток с лимфедемой верхней конечности, развившейся в различные сроки после мастэктомии с лимфодиссекцией подмышечных лимфатических узлов, выполненной по поводу рака молочной железы. ЛСГ выполняли на системах ОФЭКТ/КТ после внутрикожного введения 99mTc-фитата (99mTc-технефит). Скорость выведения 99mTc-технефита из места инъекции в отёчной конечности статистически незначимо превышала аналогичные показатели для здоровой конечности при всех стадиях лимфедемы (процент выведения на 6-8%, скорость выведения на 4-9%). Эти данные указывают на невысокую информативность клиренса 99mTc-технефита для дифференциальной диагностики стадии лимфатического отёка. Наиболее значимые в этом отношении результаты были получены при использовании индекса относительного накопления (ИОН, QAI). Было показано, что во всех отделах отёчной конечности (предплечье, плечо и рука в целом) отмечается значимое различие между показателями ИОН для I, II и III стадии лимфедемы. Однако значительная вариабельность показателей ИОН затрудняет индивидуальную интерпретацию ЛСГ. Полученные данные свидетельствуют о неидентичности клинического и функционального стадирования лимфедемы, а также подтверждают мнение о возможности наличия в отёчной конечности областей с разной стадией нарушения дренажа лимфы. Количественная оценка ЛСГ с использованием показателя ИОН может быть особенно полезной при выборе метода лечения, оценке его эффективности и динамическом наблюдении.
Лимфедема верхних конечностей, рак молочной железы, постмастэктомический синдром, радионуклидная диагностика, лимфосцинтиграфия, наноколлоидные радиофармпрепараты, 99mtc-технефит, 99mtc-фитат, количественная оценка лимфодинамики, индекс асимметрии
Короткий адрес: https://sciup.org/170198092
IDR: 170198092 | УДК: 617.57-005.93-07:073.916 | DOI: 10.21870/0131-3878-2023-32-1-93-107
Текст научной статьи Количественная лимфосцинтиграфия с 99mTc-технефитом у больных с постмастэктомической лимфедемой верхней конечности
Среди женского населения мира рак молочной железы (РМЖ) является наиболее частым онкологическим заболеванием. В России смертность женского населения от РМЖ в структуре злокачественных новообразований находится на первом месте (17%), а в структуре заболеваемости злокачественными новообразованиями составляет 21,1% [1]. Наиболее частым осложнением после радикального хирургического и комбинированного лечения РМЖ является лимфедема верхней конечности. При этом лимфатический отёк может возникнуть как через недели, так и через многие годы после лечения РМЖ [2]. Основными факторами риска возникновения лимфедемы считаются подмышечная лимфодиссекция и облучение подмышечной области. Лимфаденэктомия с пересечением лимфатических коллекторов, а также лучевой фиброз окружающих их тканей ограничивают развитие коллатеральных лимфатических сосудов и способствуют возникновению лимфедемы [3, 4]. Несмотря на наличие различных модифицированных методик мастэктомий, частота лимфедемы верхней конечности на оперированной стороне составляет по данным различных авторов от 10 до 30% у пациентов, подвергшихся оперативному лечению [5].
Сигов М.А.* – м.н.с., Давыдов Г.А. – зав. отд., к.м.н.; Пасов В.В. – в.н.с., д.м.н.; Спиченкова О.Н. – вед. инженер; Давыдова Е.В. – м.н.с.; Жигульский А.В. – клинич. ординатор; Иванов С.А. – директор, чл.-корр. РАН, д.м.н., проф. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Инъекция меченного трейсера с последующим мониторингом используется для изучения лимфатической системы с 1950 г. (Walker L.A.) [6]. В настоящее время лимфосцинтиграфия (ЛСГ) считается «золотым стандартом» для оценки функционального статуса периферической лимфатической системы. Этот неинвазивный метод позволяет визуализировать лимфатические сосуды и лимфатические узлы, а также количественно оценить состояние лимфодинамики. Лимфосцинтиграфия практически не имеет противопоказаний и осложнений, отличается простотой и доступностью, а также может быть выполнена повторно с целью динамического наблюдения за эффективностью лечения. Однако важным ограничением является отсутствие стандартизации метода.
На данный момент существует несколько классификаций степени выраженности лимфос-таза по клиническим критериям, учитывающим различные показатели: длину окружности и объём конечности, состояние кожи и подкожных тканей [5]. Однако они не могут в полной мере отразить состояние лимфатической системы поражённой конечности, поскольку не включают оценку непосредственно лимфодинамики. Протокол ЛСГ в разных диагностических центрах существенно отличается, причём различия касаются практически всех сторон исследования: выбора радиофармпрепарата (РФП), типа и места инъекции, использования динамического и статического исследований и времени их получения [4, 6-8]. Отсутствие общепринятой классификации затрудняет выбор тактики лечения и оценку её эффективности.
Спектр РФП для выполнения ЛСГ довольно разнообразен: от низкодисперсных до крупнодисперсных коллоидных препаратов. Наиболее предпочтительными считаются РФП с размерами коллоидных частиц в диапазоне 50-80 нм. В последние годы в зарубежной и отечественной литературе появились сообщения об успешном использовании крупнодисперсного коллоидного фитата (99mTc-фитат) для проведения ЛСГ при лимфедеме верхних [9, 10] и нижних [11] конечностей. Отечественным аналогом зарубежного 99mTc-фитата является 99mTc-технефит (производитель ООО «Диамед», Москва). Данный препарат отличается большей доступностью по сравнению с относительно дорогостоящими импортными наноколлоидными РФП.
Несмотря на то, что ЛСГ считается ведущим диагностическим тестом в оценке лимфоди-намики, количественные критерии оценки не вполне разработаны и порой противоречивы. При стадировании лимфостаза, основанном на данных ЛСГ, в качестве количественных показателей наиболее часто используются клиренс РФП из места инъекции [12] и показатели асимметрии включения РФП в отёчную конечность (предплечье и плечо) по сравнению с непоражённой стороной – индекс относительного накопления (ИОН), в зарубежной литературе – quantitative asymmetry index (QAI) [13]. Значение клиренса РФП из места инъекции для стадирования лимфедемы по данным различных авторов неоднозначны. Так, по данным Stanton et al. [14] обнаружено, что скорость дренажа из места инъекции коллоидного РФП в отёчной конечности не уступает таковой из контралатеральной непоражённой руки, в отличие от традиционной концепции замедленного лимфатического дренажа из поражённой конечности. Однако, по данным Weissleder H. проведение ЛСГ пациентам с первичной и вторичной лимфедемой с использованием подкожного введения человеческого сывороточного альбумина, меченного 99mТс, диагноз лимфатического отёка был установлен в 70,1% случаев, если использовали одну качественную интерпретацию, в то время, как количественные параметры клиренса выявили нарушенную лимфатическую функцию у всех обследованных пациентов [15]. В последних публикациях отмечается значение индекса асимметрии (QAI) для использования в прогнозировании ответа на лучевую терапию у пациентов с лимфедемой верхних конечностей после лечения РМЖ [16]. По данным Kim et al. (2020) индекс асимметрии (QAI) предплечья руки был значимо выше в группе с лимфедемой умеренной стадии по сравнению с группой лёгкой стадии [16]. Количественная интерпретация, дополняющая качественную, повышает точность сцинтиграфической диагностики. Количественные методы особенно полезны при динамическом наблюдении за состоянием лимфатического дренажа для оценки эффективности хирургического или консервативного лечения, когда имеется необходимость в длительном мониторинге состояния лимфодинамики. Другие количественные методы представлены вычислениями процентного вымывания трейсера в разные моменты времени (обычно 30 и 120 мин) или величиной доли инъецированной активности, транспортируемой в референтную область, обычно в лимфоузел, через определённый промежуток времени [17].
Целью исследования явилось изучение возможностей количественной ЛСГ с использованием отечественного наноколлоидного РФП 99mTc-технефит в диагностике вторичных лимфатических отёков у больных, перенесших операцию по поводу РМЖ с подмышечной лимфодиссекцией.
Материалы и методы
Нами обследовано 57 пациенток в возрасте от 51 до 79 лет (медиана – 63 года) после радикальной мастэктомии с подмышечной лимфодиссекцией, выполненной по поводу РМЖ, у 56 из которых развился лимфатический отёк верхней конечности. Время возникновения отёка после мастэктомии варьировалось в широких пределах (от 0 мес. до 17,5 лет) и составило в среднем 37±36 мес., медиана – 36 мес. (от 2 мес. до 9 лет). Продолжительность лимфедемы отмечалась в среднем 38±55 мес. (M±SD), медиана – 8 мес. (табл. 1). Время обследования после мастэктомии варьировало в широких пределах (от 7 дней до 19 лет) и составило в среднем 60±57 мес. (M±SD), медиана – 42 мес.
Таблица 1
Распределение больных по времени возникновения лимфедемы после мастэктомии и по продолжительности лимфатического отёка
|
Временной интервал (месяцы) |
Количество больных с лимфедемой |
Примечание |
|
|
по времени после мастэктомии |
по длительности отёка |
||
|
0-3 |
6 |
8 |
|
|
4-6 |
3 |
4 |
|
|
7-11 |
3 |
4 |
|
|
12-24 |
4 |
16 |
|
|
25-36 |
5 |
4 |
|
|
37-48 |
7 |
6 |
|
|
49-60 |
8 |
5 |
|
|
61-120 |
12 |
6 |
за 5 лет |
|
>120 |
8 |
3 |
за 9 лет |
|
Всего больных |
56 |
56 |
|
Наиболее часто пациентки обследовались в течение первого года после мастэктомии (21,4%), половина из которых обследована в первые три месяца (рис. 1).
Среди обследованных женщин были пациенты, имеющие в анамнезе: ранее проведённое лимфовенозное шунтирование (4 женщины); перенесшие рожистое воспаление мягких тканей исследуемой конечности (3 женщины). У одной пациентки имелось сочетание лимфовенозного шунтирования и рожистого воспаления.
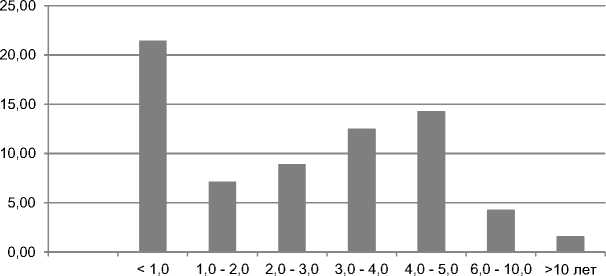
Рис. 1. Процентное распределение сроков обследования больных с лимфедемой верхних конечностей после радикальной мастэктомии.
Для оценки степени выраженности лимфостаза мы использовали трёхстадийную шкалу для клинической классификации лимфедемы конечности, изложенную в Консенсусном документе Международного общества лимфологов [18]. Данный документ предусматривает следующее стадиро-вание лимфедемы. Стадия 0 относится к латентному или субклиническому состоянию, когда отёк не очевиден, несмотря на нарушенный транспорт лимфы, небольшие изменения в составе лимфы и наличие субъективных симптомов. Стадия I соответствует ранней отёчности, которая с возвышением конечности уменьшается. При стадии II одного только поднятия конечности недостаточно для уменьшения лимфедемы и при надавливании на кожу остаётся ямка, с развитием подкожного жира и фиброза «питтинг» исчезает. Стадия III соответствует лимфостатическому элефантиазу (слоновости) и трофическим изменениям кожи. При этом отмечается, что в одной конечности может наблюдаться более одной стадии, что отражает различия в территориях лимфооттока. По стадии лимфатического отёка в соответствии с документом [18] распределение больных было следующим: стадия 0 – 1, стадия 1 – 11, стадия II – 32, стадия III – 13 женщин.
Исследования выполняли на гибридных системах ОФЭКТ/КТ BrightView XCT («Филипс Медикал Системс (Кливленд), Инк», США) и Discovery 670 NM/CT (General Electric Healthcare). Изображение было получено с применением низкоэнергетического коллиматора высокого разрешения (LEHR) с настройкой на энергетический пик 140 кэВ при ширине окна 20%. Пациенткам вводился внутрикожно 99mTc-технефит (производство ООО «Диамед», Москва) активностью 100-185 МБк в объёме 0,4-0,5 мл во второй межпальцевой промежуток обеих кистей.
После введения РФП выполнялась динамическая регистрация миграции препарата из мест инъекции на протяжении обоих конечностей, скорость записи 30 с/кадр в течение 15 мин. Затем производились статические снимки областей интереса по 2 мин/кадр (рис. 2), а также непосредственно мест инъекции (измерение 1).
До начала второго этапа сканирования пациенты выполняли физическую нагрузку в виде активных движений верхними конечностями в течение 25-30 мин. После физической нагрузки пациент укладывался в прежнюю позицию с контролем расстояния до поверхности детекторов. Производилось сканирование мест инъекции (измерение 2), а также повторные статические сцинтиграммы областей интереса конечностей (рис. 3).

Рис. 2. Статические сцинтиграммы первого этапа с зонами интереса.
Рис. 3. Статические сцинтиграммы второго этапа.
На третьем этапе через 1,5-2 ч от момента введения препарата получали отсроченные статические изображения из зон интереса и места инъекции (измерение 3). На всех трёх этапах исследования сохранялась одинаковая укладка пациента и производился контроль расстояния от конечности до поверхности детектора (рис. 4).

Рис. 4. Статические сцинтиграммы третьего этапа с зонами интереса.
При необходимости врачом-радиологом принималось решение о проведении ОФЭКТ/КТ-исследования. Параметры выполнения ОФЭКТ-сканирования: матрица 128x128, угол поворота -6°, время на кадр – 20 сек; с применением низкодозного КТ для коррекции поглощения и локали- зации (рис. 5).
Рис. 5. ОФЭКТ/КТ с зоной интереса.
Исследование было одобрено Этическим комитетом МРНЦ им. А.Ф. Цыба (протокол № 183 от 25 ноября 2016 г.) и все пациенты дали информированное письменное согласие на включение в исследование.
Результаты и обсуждение
Качественные показатели лимфосцинтиграфии
При оценке качественных характеристик ЛСГ отмечено, что наилучшая визуализация лим-фоколлекторов достигается на первых двух этапах исследования, что позволяет оценить их локализацию и проходимость.
Качественным проявлением кожного рефлюкса на сцинтиграммах было возникновение повышенного тканевого фона, который, как правило, наиболее чётко наблюдался на втором, после физической нагрузки, и третьем этапах. На первом этапе интенсивность выхода препарата через стенку капилляра в окружающие ткани достаточно низкая, и его визуализация затруднена наличием лимфоколлекторов, заполненных РФП. В единичных случаях на первом этапе чётко визуализировался повышенный кожный фон при наличии у пациентки высокой степени лимфостаза. Однако наиболее чётко и качественно определение повышенного тканевого фона наблюдалось на третьем этапе исследования, после исчезновения избыточной активности лимфоколлекторов. Именно на третьей «отсроченной» фазе исследования визуально определялась максимальная асимметрия накопления РФП, и это соответствует данным литературы [9, 13]. Функционирующие лимфатические узлы накапливали РФП во всех этапах исследования, но наиболее интенсивное включение препарата наблюдалось на третьем этапе. Весьма чётко они начинали визуализироваться уже на втором этапе. Результаты качественной оценки лимфосцинтиграфии приведены в табл. 2.
В норме усиление тканевого фона конечности не наблюдается. Высокий процент усиления тканевого фона предплечья отмечается во всех остальных стадиях лимфедемы, начиная с первой (90%), и достигает 100% в третьей стадии. В области плеча этот признак встречается реже, составляет около половины от значений в области предплечья и также возрастает с прогрессированием лимфедемы. Однако во всех сочетаниях между первой, второй и третьей стадиями лимфедемы значимого различия в частоте этого признака не отмечено. Статистически значимые различия наблюдались в частоте визуализации подмышечных лимфатических узлов между 1 и 3 стадиями – 69% и 25% соответственно. Это свидетельствует о том, что большая сохранность лимфатических узлов после подмышечной лимфодиссекции способствует меньшему нарушению лимфооттока в конечности. Других значимых различий в частоте качественных сцинтиграфических признаков между I, II и III стадиями лимфатического отёка в нашем наблюдении не отмечалось.
Таблица 2
Качественные показатели лимфосцинтиграфии в отёчных конечностях в зависимости от стадии лимфедемы (процентное распределение)
|
Качественные показатели лимфосцинтиграфии (%) |
M 1 (n=11) |
M 2 (n=32) |
M 3 (n=13) |
m 1 |
m 2 |
m 3 |
t-критерий Стьюдента |
||
|
t 1-2 |
t 1-3 |
t 2-3 |
|||||||
|
Визуализация лим |
оузлов |
||||||||
|
Подмышечные |
69,0 |
45,4 |
25,0 |
13,9 |
11,7 |
13,9 |
1,299 |
2,238* |
1,123 |
|
Плечо |
50,0 |
45,4 |
25,0 |
15,1 |
11,7 |
13,9 |
0,241 |
1,218 |
1,123 |
|
Локтевой сустав |
50,0 |
21,2 |
16,7 |
15,1 |
8,0 |
11,3 |
1,685 |
1,766 |
0,325 |
|
Предплечье |
10,0 |
3,1 |
0,0 |
9,0 |
3,1 |
0,0 |
0,725 |
1,111 |
1,000 |
|
Усиление тканевого фона |
|||||||||
|
Плечо |
30,0 |
51,5 |
61,5 |
13,8 |
12,5 |
21,8 |
1,155 |
1,221 |
0,398 |
|
Предплечье |
90,0 |
93,9 |
100 |
9,0 |
16,9 |
27,7 |
0,204 |
0,343 |
0,188 |
|
Визуализац |
ия лимфоколлектора |
||||||||
|
Плечо |
70,0 |
69,7 |
30,7 |
13,8 |
14,5 |
15,4 |
0,015 |
1,901 |
1,844 |
|
Предплечье |
70,0 |
81,8 |
46,1 |
13,8 |
15,7 |
18,8 |
0,565 |
1,025 |
1,458 |
Примечание: * – значимое различие при р<0,05; M 1 – значение среднего арифметического для стадии I лимфедемы; m 1 – ошибка средней арифметической для стадии I лимфедемы; t 1-2 – критерий Стьюдента в оценке значимости различий между стадиями I и II лимфедемы.
Анализ полученных данных показывает, что качественные показатели ЛСГ обладают ограниченными возможностями в оценке функциональных нарушений лимфодренажа, в том числе дифференциальной диагностике между начальными и более выраженными стадиями отёка.
Количественные показатели лимфосцинтиграфии
Полученные в исследовании данные о скорости выведения 99mTc-технефита из места инъекции в поражённой и контралатеральной конечностях в зависимости от стадии лимфедемы на различных этапах измерения места инъекции: между точками измерения 1 и 2 (период 1-2) и между точками 2 и 3 (период 2-3) представлены в табл. 3-6.
Показано, что различия в скорости выведения 99mTc-технефита из места инъекции в поражённой и контралатеральной руке в течение обоих временных периодов для всех стадий лимфатического отёка были статистически незначимы (табл. 3).
Показано, что скорость выведения 99mTc-технефита из места инъекции в поражённой руке во временном периоде 1-2 была статистически значимо выше, чем в периоде 2-3 для всех трёх стадий лимфатического отёка. Аналогичная закономерность отмечается и для контралатеральной конечности у больных с 1 и 2 стадиями лимфедемы. Вероятно, это связано не столько с самой физической нагрузкой, сколько со снижением скорости выведения РФП из депо с течением времени.
Таблица 3
Скорость выведения 99mTc-технефита из места инъекции в отёчной руке по сравнению с контралатеральной конечностью на различных этапах исследования в зависимости от клинической стадии лимфедемы
|
Стадии лимфедемы |
Отёчная рука (%/мин) |
Контралатеральная рука (%/мин) |
Уровень значимости р |
||
|
M 1 |
SD |
M 1 |
SD |
||
|
Период 1-2 |
|||||
|
1 стадия |
0,631 |
0,578 |
0,754 |
0,201 |
>0,05 |
|
2 стадия |
0,474 |
0,425 |
0,668 |
0,599 |
>0,05 |
|
3 стадия |
0,266 |
0,121 |
0,293 |
0,208 |
>0,05 |
|
Период 2-3 |
|||||
|
1 стадия |
0,211 |
0,196 |
0,187 |
0,142 |
>0,05 |
|
2 стадия |
0,225 |
0,185 |
0,153 |
0,104 |
>0,05 |
|
3 стадия |
0,153 |
0,077 |
0,216 |
0,094 |
>0,05 |
Таблица 4
Скорость выведения 99mTc-технефита из места инъекции в поражённой и контралатеральной руках при одинаковых стадиях лимфедемы в различные временные периоды сканирования
|
Стадия лимфедемы |
Отёчная рука (%/мин) |
Стадия лимфедемы |
Отёчная рука (%/мин) |
Уровень значимости р |
||
|
M 1 |
SD |
M 1 |
SD |
|||
|
Отёчная рука, период 1-2 |
Отёчная рука, период 2-3 |
|||||
|
1 стадия |
0,631 |
0,578 |
1 стадия |
0,211 |
0,196 |
<0,05* |
|
2 стадия |
0,474 |
0,425 |
2 стадия |
0,225 |
0,185 |
<0,001* |
|
3 стадия |
0,266 |
0,121 |
3 стадия |
0,153 |
0,077 |
<0,02* |
|
Контралатеральная рука, период 1-2 |
Контралатеральная рука, период 2-3 |
|||||
|
1 стадия |
0,754 |
0,201 |
1 стадия |
0,187 |
0,142 |
<0,001* |
|
2 стадия |
0,668 |
0,599 |
2 стадия |
0,153 |
0,104 |
<0,001* |
|
3 стадия |
0,293 |
0,208 |
3 стадия |
0,216 |
0,094 |
>0,05 |
Примечание: * – значимое различие при р<0,05.
В поражённой лимфедемой руке во временном периоде 1-2 наблюдается уменьшение скорости выведения РФП из депо при прогрессировании лимфедемы, при этом между стадиями I-III и II-III лимфедемы статистически значимо. Достоверного различия между I и II стадиями лимфедемы не отмечено. На заключительном этапе исследования (период 2-3) различия в скорости выведения РФП из депо были статистически незначимы для всех трёх стадий (табл. 5). Аналогичные изменения отмечены и в контралатеральной конечности (табл. 6).
Таблица 5
Скорость выведения 99mTc-технефита из места инъекции в отёчной руке у больных с лимфедемой в различные периоды сканирования
|
Стадия лимфедемы |
Отёчная рука (%/мин) |
Стадия лимфедемы |
Отёчная рука (%/мин) |
Уровень значимости р |
||
|
M 1 |
SD |
M 1 |
SD |
|||
|
Период 1-2 |
||||||
|
1 стадия |
0,631 |
0,578 |
2 стадия |
0,474 |
0,425 |
>0,05 |
|
1 стадия |
0,631 |
0,578 |
3 стадия |
0,266 |
0,121 |
<0,05* |
|
2 стадия |
0,474 |
0,425 |
3 стадия |
0,266 |
0,121 |
<0,02* |
|
Период 2-3 |
||||||
|
1 стадия |
0,211 |
0,196 |
2 стадия |
0,225 |
0,185 |
>0,05 |
|
1 стадия |
0,211 |
0,196 |
3 стадия |
0,153 |
0,077 |
>0,05 |
|
2 стадия |
0,225 |
0,185 |
3 стадия |
0,153 |
0,077 |
>0,05 |
Примечание: * – значимое различие при р<0,05.
Таблица 6
Скорость выведения 99mTc-технефита из места инъекции в непоражённой руке у больных с лимфедемой в различные периоды сканирования
|
Стадия лимфедемы |
Контралатеральная рука (%/мин) |
Стадия лимфедемы |
Контралатеральная рука (%/мин) |
Уровень значимости p |
||
|
M 1 |
SD |
M 1 |
SD |
|||
|
Период 1-2 |
||||||
|
1 стадия |
0,754 |
0,201 |
2 стадия |
0,668 |
0,599 |
>0,05 |
|
1 стадия |
0,754 |
0,201 |
3 стадия |
0,293 |
0,208 |
<0,05* |
|
2 стадия |
0,668 |
0,599 |
3 стадия |
0,293 |
0,208 |
<0,02* |
|
Период 2-3 |
||||||
|
1 стадия |
0,187 |
0,142 |
2 стадия |
0,153 |
0,104 |
>0,05 |
|
1 стадия |
0,187 |
0,142 |
3 стадия |
0,216 |
0,094 |
>0,05 |
|
2 стадия |
0,153 |
0,104 |
3 стадия |
0,216 |
0,094 |
>0,05 |
Примечание: * – значимое различие при р<0,05.
Скорость выведения 99mTc-технефита из места инъекции в отёчной конечности в среднем несколько превышала аналогичные показатели для здоровой конечности на всех этапах исследования (процент выведения на 6-8%, скорость выведения на 4-9%), однако различия были статистически незначимы. При оценке клиренса 99mTc-технефита из места инъекции выявлена значительная вариабельность показателей выведения РФП. При этом процент выхода РФП из депо в отёчной конечности на всех этапах исследования не коррелировал со стадией лимфедемы. Так, коэффициенты корреляции (r) составили: -0,098, -0,044 и -0,152 для первого, второго и третьего этапов исследования соответственно.
Эти данные указывают на невысокую информативность и неспецифичность показателя клиренса 99mTc-технефита из места инъекции РФП для дифференциальной диагностики клинической стадии лимфатического отёка. Полученные результаты совпадают с данными других исследователей, в том числе при использовании мелкодисперсных наноколлоидных РФП. Эти данные наглядно демонстрируют, что скорость локального дренажа РФП в поражённой руке существенно не отличается от таковой в контралатеральной конечности, что отличается от традиционной концепции блока редуцированного дренажа из всей конечности [4, 14].
Наиболее значимые результаты были достигнуты при использовании индекса относительного накопления (ИОН), синоним – индекс асимметрии (QAI). Так, было показано, что во всех отделах отёчной конечности (предплечье, плечо и рука в целом) отмечается значимое различие между величинами ИОН, более выраженные на заключительном этапе (период 2-3).
Коэффициенты корреляции между клинической стадией лимфедемы и ИОН 99mTc-техне-фита в предплечье и плече конечностей определяли для всех трёх этапов. На первом этапе показатели ИОН поражённой конечности слабо коррелировали со степенью лимфатического отёка. На втором этапе определена их умеренная корреляция (r=0,38), на третьем этапе коэффициент корреляции был наибольшим (r=0,54, p<0,01).
Полученные результаты ИОН демонстрируют значимые различия между различными стадиями лимфедемы во всех отделах конечности: предплечье, плече и руке в целом (за исключением области плеча между 1 и 2 стадиями лимфатического отёка) (табл. 7).
Следует отметить, что при качественной оценке значимого различия между 1 и 2 стадиями лимфедемы не выявлено ни для одного показателя. Статистически значимое различие между начальной и средней выраженности лимфедемы наблюдалось только для отдельных качественных признаков при третьей стадии лимфедемы (слоновости).
Таблица 7
Сравнение показателей индекса асимметрии у больных с односторонним лимфатическим отёком в зависимости от стадии лимфатического отёка
|
Отделы руки |
Первая группа сравнения (стадия) |
n |
M |
SD |
Вторая группа сравнения (стадия) |
n |
M |
SD |
Уровень значимости p |
|
1 |
11 |
1,148 |
0,195 |
2 |
32 |
1,521 |
0,668 |
<0,01* |
|
|
Предплечье |
1 |
11 |
1,148 |
0,195 |
3 |
13 |
3,58 |
2,710 |
<0,01* |
|
2 |
32 |
1,521 |
0,668 |
3 |
13 |
3,58 |
2,710 |
<0,01* |
|
|
1 |
11 |
1,081 |
0,318 |
2 |
32 |
1,150 |
0,510 |
>0,5 |
|
|
Плечо |
1 |
11 |
1,081 |
0,318 |
3 |
13 |
6,033 |
5,263 |
<0,001* |
|
2 |
32 |
1,150 |
0,510 |
3 |
13 |
6,033 |
5,263 |
<0,001* |
|
|
Рука (сумма ИОН) |
1 |
11 |
2,099 |
0,409 |
2 |
32 |
3,367 |
1,623 |
<0,001* |
|
1 |
11 |
2,099 |
0,409 |
3 |
13 |
6,033 |
5,263 |
<0,001* |
|
|
2 |
32 |
3,367 |
1,623 |
3 |
13 |
6,033 |
5,263 |
<0,01* |
Примечание: * – значимое различие при р<0,05.
Вместе с тем, показатели ИОН в каждой стадии лимфедемы варьируются в довольно широком диапазоне. Серединные значения интервала между средними значениями ИОН для I, II и III стадий лимфедемы для руки в целом составили 2,7 и 4,7. Поэтому для функционального ста-дирования лимфедемы по данным ЛСГ были выбраны следующие значения ИОН: первая степень нарушения лимфодинамики (диапазон 1) – ИОН≤2,7, третья степень (диапазон 3) – ИОН≥4,7, вторая степень (диапазон 2) – интервал между этими значениями. Соответственно для предплечья и плеча аналогичные граничные значения ИОН составили половину от вышеуказанных величин, т.е. 1,35 и 2,35.
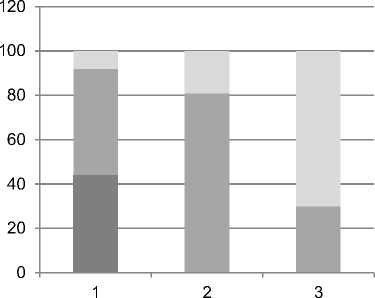
Все 11 пациентов первой стадии лимфедемы имели показатели ИОН для руки в целом, соответствующие первой функциональной степени (т.е. ≤2,7). Из 32 пациентов второй стадии лимфедемы – 53,1% (17/32) имели значения ИОН, соответствовавшие второй, 37,5% (12/32) – первой, а 9,4% (3/32) – третьей функциональной степени лимфедемы. Из 13 пациентов третьей стадии лимфедемы у 53,8% (7/13) значения ИОН соответствовали диапазону значений для третьей степени, 15,4% (2/13) – первой, а 30,8% (4/13) – второй степени лимфедемы. Таким образом, в диапазон 1 по показателю ИОН вошло 25 пациенток, из них 44% (11/25) первой стадии лимфедемы, 48,0% (12/25) – второй стадии и 8,0% (2/25) – третьей стадии. В диапазон 2 вошли 21 пациентка, из них 80,9% (17/21) – второй стадии и 19,1% (4/21) – третьей стадии. В диапазоне 3 было 10 пациенток: 70% (7/10) – третьей, 30% (3/10) – второй стадии (рис. 6, табл. 8).
Это можно объяснить тем, что в отёчной конечности разные области лимфатического дренажа могут соответствовать разным клиническим стадиям лимфедемы [18]. Так, по данным Stanton et al. [14] при связанной с РМЖ лимфедеме отёк руки распределяется неравномерно и некоторые регионы частично или полностью могут быть избавлены от отёка.
Анатомические исследования показали, что лимфодренаж по поверхностной системе лимфатических сосудов верхней конечности осуществляется по двум лимфосомам. Доминирующий лимфосом дренирует лимфу с медиальной поверхности руки в латеральные подмышечные, а в дальнейшем – в подключичные лимфатические узлы. Второй лимфосом осуществляет отведение лимфы от заднелатеральной поверхности плеча к дельтопекторальному, а затем в надключичные лимфатические узлы [19, 20]. Отмечено, что начальные лимфососудистые изменения характеризуются эктазией поверхностных лимфатических сосудов, несостоятельностью их кла- панного аппарата с обратным сбросом лимфы из преколлекторов в лимфатические капилляры (“dermal back flow”). При этом лимфатические сосуды в дистальных отделах верхней конечности часто сохраняются интактными даже при II стадии лимфедемы [19].
ст. 3
ст. 2
ст. 1
Рис. 6. Распределение больных с различной стадией лимфедемы в зависимости от степени нарушений лимфодинамики по данным показателя ИОН (%).
Таблица 8
Сопоставление показателей функциональной стадии лимфедемы по данным лимфосцинтиграфии с клинической стадией лимфатического отёка верхней конечности
|
Стадия лимфедемы |
Количество пациентов |
Функциональная стадия лимфедемы (F) |
||
|
соответствует |
превышает |
снижена |
||
|
I |
11 |
11 |
0 |
0 |
|
II |
32 |
17 |
3 |
12 |
|
III |
13 |
7 |
0 |
6 |
|
Всего |
56 |
35 |
3 |
18 |
Анализ полученных результатов показывает, что функциональная оценка по данным ЛСГ существенно дополняет данные клинического стадирования отёка, характеризуя функциональное состояние лимфотока, позволяет выявить более тонкие изменения лимфодинамики. Учитывая сложный характер лимфодинамических нарушений и вариабельность показателей ЛСГ, последние могут быть особенно важны при выборе консервативного или хирургического лечения, динамическом наблюдении и оценке эффективности проводимого лечения.
Выводы
-
1. Прогрессирование лимфатического отёка сопровождается замедлением выведения 99mTc-технефита из места инъекции.
-
2. Скорость выведения 99mTc-технефита из места инъекции в непоражённой конечности не превышает таковую на отёчной стороне при всех стадиях лимфедемы.
-
3. С прогрессированием лимфедемы отмечается увеличение индекса относительного накопления, что обусловлено замедлением транспорта лимфы в отёчной конечности относительно контралатеральной стороны.
-
4. Индекс относительного накопления при лимфосцинтиграфии с 99mTc-технефитом значимо коррелирует со стадией лимфатического отёка и может быть использован для количественной оценки лимфодинамики у больных с лимфатическим отёком верхней конечности.
Список литературы Количественная лимфосцинтиграфия с 99mTc-технефитом у больных с постмастэктомической лимфедемой верхней конечности
- Состояние онкологической помощи населению России в 2019 году /под ред. А.Д. Каприна, В.В. Старин-ского, А.О. Шахзадовой. М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2020. 238 с.
- De Rezende L.F., Pedras F.V., Ramos C.D., Gurgel M.S.C. Evaluation of lymphatic compensation by lymphoscintigraphy in the postoperative period of breast cancer surgery with axillary dissection //Tumori. 2011. V. 97, N 15. P. 309-3015.
- Мясникова М.О., Седов В.М., Кацев В.М., Дмитриева Л.А., Ермощенкова М.В. Лимфосцинтиграфия в диагностике и прогнозировании постмастэктомического отёка конечности //Вопросы онкологии. 2003. Т. 49, № 1. С. 85-87.
- Szuba A., Pyszel A., Jedzejuk D., Janczak D., Andrzejak B. Presence of functional lymph nodes and lymph drainage within arms and without breast cancer-related lymphedema //Lymphology. 2007. V. 40, N 2. P. 81-86.
- Ермощенкова М.В., Филоненко Е.В., Зикиряходжаев А.Д. Федеральные клинические рекомендации по диагностике и лечению постмастэктомического синдрома //Вестник восстановительной медицины. 2014. № 5. С. 68-84.
- Szuba A., Shin W.S., Strauss H.W., Rockson S. The third circulation: radionuclide lymphoscintigraphy in the evaluation of lymphedema //J. Nucl. Med. 2003. V. 44, N 1. P. 43-57.
- Maccauro M., Villa G., Manzara A., Follacchio G.A., Manca G., Tartaglione G., Chondrogiannis S., Mango L., Rubello D. Lymphoscintigraphy for the evaluation of limb lymphatic flow disorders: report of technical procedural standards from an Italian Nuclear Medicine expert panel //Rev. Esp. Med. Nucl. Imagen. Mol. 2019. V .38, N 5. P. 335-340.
- Villa G., Campisi C.C., Ryan M., Boccardo F., Di Summa P., Frascio M., Sambuseti G., Campisi C. Pro-cedural recommendations for lymphoscintigraphy in the diagnosis of peripheral lymphedema: the Genoa pro-tocol //Nucl. Med. Mol. Imaging. 2019. V. 53, N 1. P. 47-56.
- Yoo J.-N., Cheong Y.-S., Min Y.-S., Lee S.-W., Park H.Y., Jung T.-D. Validity of quantitative lymphoscintig-raphy as a lymphedema assessment tool for patients with breast cancer //Ann. Rehabil. Med. 2015. V. 39, N 6. P. 931-940.
- Сигов М.А., Давыдов Г.А., Пасов В.В., Давыдова Е.В., Иванов С.А., Каприн А.Д. Методика количественной оценки состояния лимфодинамики у больных вторичными лимфатическими отёками верхних конечностей (возникшими после мастэктомии) по данным лимфосцинтиграфии с 99mTc-технефитом //Радиация и риск. 2019. T. 28, № 2. С. 102-111.
- Iimura T., Fukushima Y., Kumita S., Ogawa R., Hyakusoku H. Estimating lymphodynamic conditions and lymphovenous anastomosis efficacy using 99mTc-phytate lymphoscintigraphy with SPECT-CT in patients with lower-limb lymphedema //Plast. Reconstr. Surg. Glob. Open. 2015. V. 3, N 5. P. 1-9.
- Kim P., Lee J.K., Lim O.K., Park H.K., Park K.D. Quantitative lymphoscintigraphy to predict the possibility of lymphedema development after breast cancer surgery: retrospective clinical study //Ann. Rehabil. Med. 2017. V. 41, N 6. P. 1065-1075.
- Fujiwara M., Sawada M., Kasuya A., Matsushita Y., Yamada M., Fukumizu H., Magata Y., Sakahara H. Measurement of cutaneous lymphatic flow rates in patients with skin cancer: area extraction method //J. Dermatol. 2014. V. 41, N 6. P. 498-504.
- Stanton A.V., Modi S., Mellor R.H., Peters A.M., Swensson W.E., Levick J.R., Mortimer P.S. A quantitative lymphoscintigraphic evaluation of lymphatic function in the swollen hands of women with lymphedema follow-ing breast cancer treatment //Clin. Sci. (Lond.). 2006. V.110, N 5. P. 553-561.
- Weissleder H., Weissleder R. Lymphedema: evaluation of qualitative and quantitative lymphoscintigraphy in 238 patients //Radiology. 1988. V. 167, N 3. P. 729-735.
- Kim H., Yoon J.A. The feasibility of quantitative parameters of lymphscitigraphy without significant dermal backflow for the evaluation of lymphedema in post-operative patients with breast cancer //Eur. J. Nucl. Mol. Imaging. 2020. V. 47, N 5. P. 1094-1102.
- Keramida G., Wroe E., Winterman N., Aplin M., Peters A.M. Lymphatic drainage efficiency: a new parameter of lymphatic function //Acta Radiol. 2018. V. 59, N 9. P. 1097-1101.
- The diagnosis and treatment of peripheral lymphedema: 2016 Consensus Document of the International Society of Lymphology //Lymphology. 2016. V. 49, N 4. P. 170-184.
- Курочкина О.С., Байтингер В.Ф., Дудников А.В. Анатомия лимфатического русла верхней конечности: лимфодренаж от верхней конечности в норме и после подмышечной лимфодиссекции //Вопросы реконструктивной и пластической хирургии. 2018. № 2. С.39-48.
- Suami H. Lymphosome concept: anatomical study of the lymphatic system //J. Surg. Oncol. 2017. V. 115, N 1. P. 13-17.


