Количественная оценка изменения уровня экспрессии гена YB-1 при немелкоклеточном раке лёгкого
Автор: Тычко Р.А., Опарина Н.Ю., Зиновьева О.Л., Кропотова Е.С., Зиновьева М.В., Машкова Т.Д., Овчинников Л.П.
Журнал: Труды Московского физико-технического института @trudy-mipt
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.1, 2009 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/142185557
IDR: 142185557
Текст статьи Количественная оценка изменения уровня экспрессии гена YB-1 при немелкоклеточном раке лёгкого
Y-бокс-связывающие белки принадлежат семейству мультифункциональных белков, содержащих высококонсервативный домен холодового шока (CSD) [1, 2]. Эукариотические CSD-содержащие белки (CSD-белки) могут связываться с регуляторными последовательностями, включая
Y-бокс мотив (инвертированный ССААТ-бокс), расположенными в промоторах и энхансерах различных генов. CSD-белки эукариот повышают устойчивость клеток к ионизирующему облучению и ксенобиотикам. Эти белки выполняют плейотропные функции в ядре и цитоплазме [3, 4]. Они активируют или подавляют транскрипцию и трансляцию многих генов, участвующих в клеточном делении, дифференцировке и кодирующих различные защитные белки. CSD-белки эукариот могут участвовать в процессах репарации, репликации и рекомбинации ДНК, сплайсинге и стабилизации мРНК, а также в других процессах [1 – 3].
CSD-белок человека YВ-1 содержит три домена: небольшой А/Р-домен, богатый аланином и пролином, на N-конце, CSD и протяженный С-концевой домен, состоящий из чередующихся кластеров положительно и отрицательно заряженных остатков с размером каждого кластера в 25–30 остатков. CSD YВ-1 почти иденти- чен по аминокислотной последовательности CSD других белков эукариот.
Белок YВ-1 вовлечен в канцерогенез многих тканей [5–7]. YВ-1 рассматривают как наиболее ранний маркер лекарственной устойчивости раковых клеток [3, 5]. В карциномах лёгкого [8], молочной железы [9], простаты [10], толстой кишки [11], а также меланомах [7] содержание белка YВ-1, определённое с помощью иммуногистохимического анализа, возрастает по сравнению с нормальными клетками той же ткани. В различных опухолях часто наблюдают переход белка в ядро, что рассматривают как негативный прогностический фактор [6].
Повышение количества белка YВ-1 в клетках в результате дополнительного синтеза с ДНК введённой плазмиды приводит к онкотрансформации [12]. С другой стороны, этот белок блокирует онкогенную клеточную трансформацию по фосфати-дилинозитол-3-/Akt-киназному сигнальному пути [13, 14]. Подавление синтеза белка YВ-1 у нокаутированных мышей приводит к их постнатальной гибели, хотя эмбриональное развитие проходило нормально [15, 16]. Предполагают, что белок YВ-1 может служить в качестве потенциальной мишени при терапии многих злокачественных новообразований [3, 7].
Переход белка YB-1 из цитоплазмы в ядро рассматривают как перспективный эффективный прогностический маркер немелкоклеточного рака лёгких (НМРЛ) [8, 17]. Однако данные об изменении уровня мРНК YB-1 в опухолевых клетках отсутствуют.
Рак лёгкого остаётся одной из основных причин смерти онкологических больных в мире [18]. Различают две основных формы рака лёгкого: мелкоклеточный (МРЛ) и НМРЛ, составляющих 15 - 20 и 75 – 80% соответственно. К НМРЛ относят плоскоклеточный рак лёгкого (ПРЛ), аденокарциному лёгкого (АКЛ), крупноклеточный рак (КРЛ) и т. п.
В настоящей работе, используя метод ОТ-ПЦР, мы провели анализ содержания мРНК гена YB-1 в 30-ти образцах опухолевых и прилегающих к ним нормальных легочных тканей пациентов с НМРЛ и обнаружили уменьшение количества мРНК YB-1 в более чем половине опухолевых образцов.
ТРУДЫ МФТИ, 2009, Том 1, № 1
III. Экспериментальная часть
-
III.1. Клинические образцы
Анализировали 30 пар (опухоль и условная норма) образцов тканей лёгкого пациентов с НМРЛ (25 пар образцов ПРЛ, 4 пары образцов АКЛ, 1 пару — КРЛ). Образцы получены из коллекции Онкологического научного центра им. Н.Н. Блохина РАМН. За условную норму принимали гистологически нормальные ткани лёгкого, взятые из прилегающей к опухоли ткани ближе к краю резекции. Кроме того, анализировали ткани лёгкого, полученные постмортально от 10-ти человек, не имевших в анамнезе онкологических заболеваний (норма): пять образцов, взятых в центральных областях лёгкого, и пять — в периферических областях. Средний возраст пациентов с НМРЛ, среди которых 29 мужчин и одна женщина, составляет 61 год (диапазон 34–76 лет). Диагноз в каждом случае устанавливали на основании результатов клинического, морфологического, эндоскопического и рентгенологического обследований. I-я стадия заболевания установлена у 6-ти больных, II-я — у 19-ти, III-я — у 6-ти. Признаков отдаленных метастазов не наблюдали ни у одного из пациентов. Никто из пациентов ранее не подвергался лучевой и химиотерапии.
-
III.2. Выделение и очистка РНК из тканей лёгкого человека
Суммарную РНК выделяли из замороженных, измельчённых в жидком азоте образцов опухолевых и нормальных тканей. Очистку РНК проводили стандартным методом с использованием гуанидини-зотиоционата и фенола [19]. Для удаления примесей гликопротеинов, которыми богаты ткани лёгкого, использовали дополнительное осаждение РНК солевым раствором [20]. Затем все препараты РНК очищали дополнительно с помощью набора RNeasy Mini kit (Qiagen) согласно прилагаемому протоколу. Такая процедура очистки РНК позволила эффективно избавиться не только от трудно растворимых осадков гликопротеинов, но и от низкомолекулярных РНК. Качество РНК проверяли электрофорезом в 1% -м агарозном геле в присутствии бромида этидия. Количество РНК определяли на спектрофотометре по поглощению при длине волны 260 нм.
-
III.3. Получение двухцепочечных кДНК
Для построения первых цепей ДНК использовали 1 мкг тотальной РНК, праймеры SMART
-
(5' - AAGCAGTGGTATCAACGCAGAGTACGCrGrGrG - 3')
иCSD
-
(5' - AGCAGTGGTATCAACG
CAGAGTAC(T)зоN_1N - 3')
(Синтол, Россия) и обратную транскриптазу PowerScript (Clontech Laboratories, Inc) [21]. Для построения второй цепи кДНК и амплификации брали 1/10 часть от объёма реакционной смеси. Синтез проводили с помощью ДНК-полимеразы Advantage 2 с праймером
-
5 -AAGCAGTGGTATCAACGCAGAGT-3'
согласно протоколу Advantage 2 PCR kit (Clontech Laboratories, Inc.) в следующем режиме: предварительный прогрев при
-
95 ° C — 1 , 5 мин, далее 95 ° C — 2o с, 65 ° C —
20 с, 72 ° C — 3 мин. Для каждого образца подбирали количество циклов, позволяющих получать одинаковое количество ам-плифицированного материала (15–17 циклов).
-
III.4. Полуколичественный ОТ-ПЦР
Для определения содержания мРНК YB-1 проводили ОТ-ПЦР с праймерами, которые специфичны для конкретных генов. Для амплификации кДНК использовали праймеры, расположенные в разных экзонах гена. Все праймеры подобраны с помощью программы Primer Designer, разработанной в ИМБ РАН. Структура праймеров, расчётная длина продуктов амплификации и условия амплификации приведены в табл. 1. При анализе изменения уровней мРНК использовали 3 пары праймеров для разных участков кДНК.
Образцы кДНК нормировали по контрольному гену GAPDH, кодирующему глицеральдегид-3-фосфат-дегидрогеназу. Для гена «домашнего хозяйства» GAPDH в случае НМРЛ показан наименьший разброс уровней транскрипции в нормальных и опухолевых тканях в сравнении с другими контрольными генами [22].
Таблица 1
Праймеры, использованные в ОТ-ПЦР, длина продуктов ПЦР и условия амплификации
|
Гены |
Праймеры |
Длина продукта ПЦР, п. н. |
Условия амплификации |
|
YB-1 |
F1 5’-gagaggacggcaatgaagaag -3’ R1 5’-tgatggtagagatggtaagccg -3’ F2 5’-accacagtattccaaccctcctg-3’ R2 5’-tgatggtagagatggtaagccg -3’ F3 5’-caacttcaattaccgacgcagacg-3’ R3 5’-gcaagcactttaggtcttcagctc-3’ |
223 390 242 |
94 ° C , 2 мин — 1 цикл 94 ° C , 30 с 1) 30 и 34 цикла 55 ° C , 30 с 2) 33 и 34 цикла 72 ° C , 45 с 3) 32 и 34 цикла 72 ° C , 5 мин — 1 цикл |
|
GAPDH |
F1 5’-ggagtcaacggatttggtc-3’ R1 5’-tgggtggaatcatattggaacat-3’ |
139 |
94 ° C , 2 мин — 1 цикл 94 ° C , 30 с 56 ° C , 30 с 28 и 30 циклов 72 ° C , 30 с 72 ° C , 5 мин — 1 цикл |
Амплификацию проводили в 25 мкл смеси, содержащей: 67 мМ Трис-НСl, pH 8 , 8 , 16 , 6 мМ ( NH 4 ) 2 SO 4 , 0 , 1% T вин-20, 2 , 5 мМ MgCl 2 , 0 , 2 мМ каждого из дНТФ, 0 , 4 мкг кДНК, 0 , 2 мкМ праймера, 2 единицы активности ДНК-полимеразы SmarTaq
(Dialat Ltd., Москва). ПЦР проводили на амплификаторе MasterCycler (Eppendorf AG). Продукты амплификации анализировали в 1,8%-м агарозном геле с 0,5 мкг/мл бромида этидия. Подобраны оптимальные условия ОТ-ПЦР для достижения линей- ной зависимости между числом циклов и количеством продуктов ПЦР. Все реакции амплификации повторяли три раза.
Интенсивность полос после электрофоретического разделения продуктов ПЦР оценивали количественно с помощью программы для денситометрии фотографий GeneProfiler и выражали в виде значений относительной интенсивности.
-
III.5. Количественный ПЦР в реальном времени
Количественный анализ изменения содержания мРНК гена YB-1 проводили методом ПЦР в реальном времени (ПЦР-РВ) на амплификаторе Applied Biosystems 7500 Fast Real-Time PCR System. В качестве контрольного гена выбран ген GAPDH. Праймеры были подобраны с помощью программы PrimerDesigner и проверены на специфичность выравниванием по мРНК и ДНК человека ( http://www.ncbi.nlm.nih.gov/blast/Blast.cgi ?). Последовательности праймеров: к YB-1
5'-CCAggAAgTACCTTCgCAgTgTAg-3'
и
5'-TggTTACggTCTgCTgCATATTTAC - 3';
к GAPDH
5' - ggAgTCAACggATTTggTC - 3'
и
-
5' - TgggTggAATCATATTggAACAT - 3'.
Оптимизированная концентрация праймеров 450 нМ для YB-1 и 350 нМ для GAPDH.
Реакции проводили в объёме 25 мкл в стандартных 96-луночных оптических плашках (MicroAmpTM Fast Optical 96-Well Reaction Plate). Реакционная смесь включала в себя интеркалирую-щий краситель EvaGreenTM (Biotium, Inc. , пассивный краситель ROX, термостабильную реакционную смесь RialityTM [23], содержащей Taq полимеразу, дНТФ, MgCl2, ПЦР-буфер, праймеры и матрицу (ДНК).
EvaGreen — насыщающий флуоресцентный краситель третьего поколения, специфически связывающийся с двухцепочечной ДНК. Этот краситель обладает низкой токсичностью и ингибирует полимеразную цепную реакцию в значительно меньшей степени, чем традиционные красители (такие как SYBR Green), что позволяет использовать краситель в больших концентрациях и получать более высокий флуоресцентный сигнал. Использование насыщающего красителя позволяет также получать более точную информацию о содержании двухцепочечного фрагмента ДНК при данной температуре.
Температурный профиль реакции: 95 ° C — 10 мин; 40 циклов: 95 ° C — 15 с, 60 ° C — 1 мин. Продукты ПЦР проверяли на специфичность методом кривой плавления и электрофоретическим разделением в 1 , 6% агарозном геле.
Для абсолютной оценки содержания мРНК использованы генно-инженерные конструкции (стандарты), содержащие фрагменты последовательностей гено-вYB-1 и GAPDH. Вставки были секвениро-ваны, их нуклеотидные последовательности вставок совпадали с фрагментами аннотированных последовательностей. Для получения линейной формы ДНК конструкцию с фрагментом гена YB-1 провели рестрикцию по EcoRI.
Концентрацию ДНК (в нг / мкл) определяли на спектрофотометре ND1000 (NanoDrop Technologies) и визуально по интенсивности свечения полос при разделении в агарозном геле. В качестве маркера концентрации использовали фрагменты ДНК фага- λ . Используя данные о последовательности конструкций, определили число копий в единице объёма. Каждая плашка содержала образцы с десятикратными разведениями стандартов (от 10 2 до 10 6 копий на реакцию) и отрицательные контроли (образцы без ДНК). Каждый образец был нанесён четыре раза повторно.
Анализ проводили по методу построения калибровочной кривой (зависимости порогового цикла от логарифма концентрации стандарта) с определением эффективности реакции (с помощью программы Applied Biosystems SDS v1.3.1).
-
III .6. Секвенирование продуктов ПЦР
ОТ-ПЦР-фрагменты клонировали в векторе pGEM(RR)-T Easy («Promega»). Их нуклеотидные последовательности определяли с помощью набора реактивов ABI PRISM ® BigDyeTM Terminator с последующим анализом продуктов реакции на автоматическом секвенаторе ДНК ABI PRISM 3100-Avant.
-
IV . Результаты исследования
-
IV .1. Определение количества мРНК гена YB-1 в нормальных тканях лёгкого
Относительно высокий уровень мРНК гена YB-1 выявлен во всех 10-ти исследованных образцах нормальных тканях лёгкого человека (по 5 образцов центральной и периферической локализации) (рис. 1). Сравнимые с нормой количества мРНК эти гены обнаружены также практически во всех образцах условной нормы: мРНК YB-1 (в 97% , 29/30). Сходные результаты получены при использовании всех трёх пар праймеров, подобранных для
ОТ-ПЦР. Уменьшение уровня мРНК гена YB-1 в образцах НМРЛ.
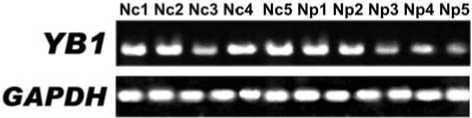
Рис. 1. ОТ-ПЦР анализ содержания мРНК
YB-1 в нормальных легочных тканях центральной (Ncl) и периферической (Npl) локализации. Ген GAPDH использовался в качестве контроля. Продукты ОТ-ПЦР (34-й цикл) электрофоретически разделены в 1 , 8%-м агарозном геле
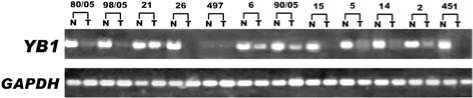
Рис. 2. Сравнительный ОТ-ПЦР анализ изменения уровня мРНК YB-1 в опухолевых
(T) тканях по сравнению с прилежащими нормальными (N) тканями. Ген GAPDH использовался в качестве контроля. Продукты ОТ-ПЦР (34-й цикл) электрофоретически разделены в 1 , 8%-м агарозном геле
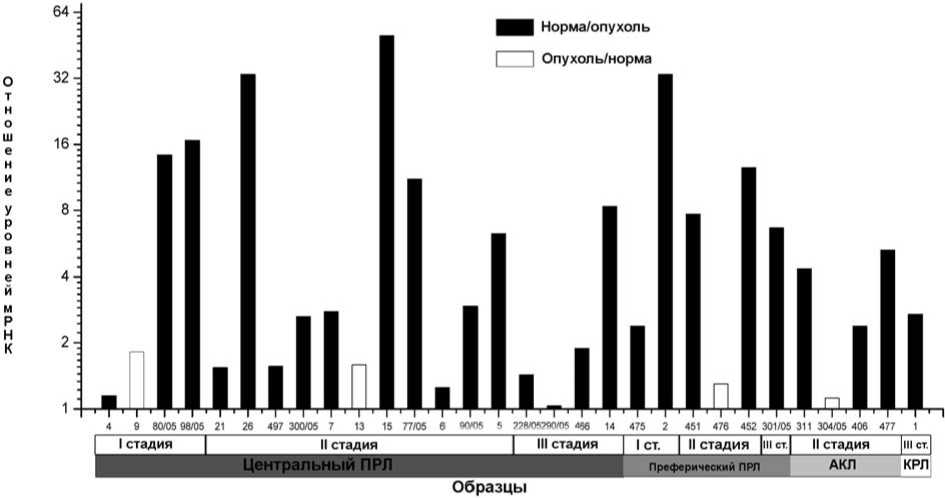
Рис. 3. Количественная оценка изменения уровня мРНК (с помощью ПЦР-РВ) гена YB-1 при НМРЛ по сравнению с нормой. Черным показано снижение содержания мРНК, белым — увеличение (в число раз). Отмечена форма и стадия рака (аденокарцинома лёгкого — «АКЛ» или плоскоклеточный рак лёгкого — «ПРЛ» крупноклеточный рак лёгкого — «КРЛ»), для ПРЛ обозначена локализация опухоли (центральная или периферическая)
С помощью полуколичественного ОТ-ПЦР проведено определение изменения уровня мРНК YB-1 в 12-ти парах образцов легочных тканей пациентов с НМРЛ. В 83% (10/12) образцов ПРЛ (рис. 2) содержание мРНК в опухолях понижено в 3 и более раз по сравнению с условной нормой. В 70% этих образцов (7/10) уровень мРНК YB-1 понижается более чем в 10 раз. В одном образце мРНК YB-1 присутствует в следовых количествах как в условной норме, так и в опухоли. В 2-х образцах содержание мРНК YB-1 в опухолях приблизительно равно её уровню в условной норме.
Затем на более широкой выборке (30 пар образцов) методом ПЦР-РВ была проведена количественная оценка изменения содержания мРНК гена YB-1 (рис. 3). В 67% образцов НМРЛ (20/30) и 64% (16/25) образцов ПРЛ наблюдали значительное (от 2-х до 50-ти раз) снижение уровня мРНК YB-1 по сравнению с нормой. Из них в 50% (10/20) образцов НМРЛ и 52% (10/19) ПРЛ уменьшение составляло 10 и более раз. В 4-х образцах уровень мРНК незначительно понижался (от 1,25 до 2 раз), в 3-х образцах не изменялся и в 3-х образцах незначительно увеличивался (в 1 , 3 , 1 , 6 и 1 , 8 раза).
Связи между изменением уровня мРНК YB-1, гистологическими различиями и стадиями прогрессии опухолей НМРЛ, а также их локализацией, периферической или центральной, не обнаружено (рис. 3).
-
V . Обсуждение результатов
Мы провели сравнительный анализ содержания мРНК YB-1 методом ОТ-ПЦР в нормальных и опухолевых тканях лёгкого. мРНК обнаружена в достаточно высоком количестве во всех образцах нормальных легочных тканей, а также в тканях, прилегающих к опухолевым образцам (рис. 1). Эти результаты согласуются с ранее полученными данными по определению транскрипционного профиля YB-1 [24]. Количество мРНК YB-1 варьирует в разных тканях, например, оно высоко в сердце и поперечно-полосатых мышцах, но меньше в лёгких, почках и печени.
Данные литературы о повышении содержания белка YB-1 при НМРЛ [8] позволяли предполагать и повышение содержания мРНК. Однако значительного увеличения уровня мРНК YB-1 не обнаружено нами ни в одном из опухолевых образцов. В трёх образцах выявлено лишь небольшое повышение уровня мРНК YB-1 (в 1,3, 1,6 и 1,8 раза).
С другой стороны, более чем в половине опухолевых образцов наблюдали заметное снижение количества мРНК YB-1 ( > 2 раз), причём в большинстве этих образцов это снижение превышает 5-кратное. Впервые выявленное в нашей работе
ТРУДЫ МФТИ, 2009, Том 1, № 1 понижение уровня мРНК YB-1 при НМРЛ у человека согласуется с данными по определению количества мРНК YB-1 при АКЛ у мышей. В этой работе методом ПЦР-РВ показано небольшое уменьшение количества мРНК YB-1 ( ∼ в 2 раза) в опухолевых клетках по сравнению с нормой [25]. Понижение уровня мРНК YB-1 также обнаружено с помощью ПЦР-РВ в фибробластах эмбрионов цыплят при онкогенной клеточной трансформации [13]. В то же время при меланоме выявлено повышение количества мРНК YB-1 [26].
С помощью иммуногистохимического окрашивания для нескольких видов злокачественных опухолей показано повышенное содержание белка YB-1 в опухолевых тканях и меньшее или недетектируемое количество в нормальных тканях. Например, при иммуногистохимическом анализе ∼ 200 образцов НМРЛ и прилегающих к опухоли тканей белок YB-1 обнаружен только в опухолях [8]. Содержание мРНК YB-1 в этих неопластических тканях не определяли.
Несоответствие между уровнем транскрипции гена и степенью иммуногистохимического окрашивания продемонстрировано в нескольких работах [27–30]. Например, при злокачественной мезотелиоме с помощью высокочувствительной ОТ-ПЦР мРНК гена c-kit не выявляется даже в опухолевых образцах тканей, для которых показано сильное иммуногистохимическое окрашивание [27]. С помощью ПЦР в реальном времени показано значительное понижение содержания мРНК генов p 53 , BCL-2 и BAX в метастазах в головном мозге при раке молочной железы по сравнению с первичными опухолями. Однако при иммуногистохимическом окрашивании выявлено понижение экспрессии генов p 53 иBCL-2, в то время как экспрессия гена BAX повышена [30].
Отсутствие корреляции между изменением уровня мРНК и соответствующего белка наблюдали в работе [31]. Снижение уровня мРНК гена J-пептида в опухолевых клетках более значительно, чем изменение содержания белка. Авторы объясняют это несоответствие посттранскрипционной регуляцией синтеза J-пептида.
Для многих онкозначимых генов показан важный вклад в регуляцию их активности посттранскрипционного этапа [32].
Для YB-1 показана его способность влиять на функциональную активность [33] и стабильность [34] транслируемых и нетранслируемых мРНК. YB-1 в цитоплазме стабилизирует мРНК, включая собственную, защищая её от нуклеаз [4], однако механизм стабилизации остаётся малоисследованным.
Мы не обнаружили связи между изменением количества мРНК гена YB-1, гистологическими различиями и стадиями прогрессии опухолей, а также их периферической или центральной локализацией. Необходимы дальнейшие исследования для выявления возможной связи между резким понижением уровня мРНК этого гена и другими факторами, например, лекарственной устойчивостью.
Полученные результаты по значительному снижению содержания мРНК в 67% опухолевых образцов позволяют предположить возможное использование гена YB-1 в качестве потенциального маркера НМРЛ.
Авторы благодарят Л.Л. Киселева за поддержку и помощь в работе, а также ценные критические замечания при прочтении рукописи, Е.Д. Свердлова за поддержку и помощь в работе.
Авторы выражают признательность И.Б. Зборовской (Российский онкологический научный центр им. Н.Н. Блохина РАМН) за предоставленные образцы тканей, сотрудникам группы регуляции биосинтеза белка (институт белка Пущино) за предоставление плазмиды, содержащей полноразмерную кДНК гена YB-1, а также С.Г. Малахо (ЦКП «Геном»), А.А. Дмитриева и Г.C. Краснова за помощь при выполнении работы. Секвенирование ДНК проводили в Центре коллективного пользования «Геном» ИМБ РАН , под руководством А.Б. Полтарауса.


