Количественное определение ряда маркеров сыворотки крови без ее предварительного фракционирования с использованием особенностей взаимодействия трипсина с альфа-2-макроглобулином человека методом MALDI-MS
Автор: Протасов А.В., Тараскин А.С., Забродская Я.А., Бубляев Р.А., Новикова Л.Н., Миргородская О.А.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение для биологии и медицины
Статья в выпуске: 2 т.29, 2019 года.
Бесплатный доступ
Концентрация альфа-2-макроглобулина (α2-MG) в сыворотке может значительно варьироваться при ряде заболеваний, поэтому количественное определение этого белка используется в диагностике. Рутинные иммунологические или ферментативные методы определения концентрации α2-MG в сыворотке довольно сложны. Методы требуют специфических антител или измерения скорости гидролиза конкретных субстратов и не отличают свободную форму α2-MG от связанной. Мы предлагаем новый масс-спектрометрический подход для идентификации и количественного определения некоторых биомаркеров сыворотки крови на основе структурно-функциональных характеристик взаимодействия α2-MG с трипсином, характеризующегося отщеплением пептида VGFYESDVMGR. Была разработана методика изотопного обмена (18О) для приготовления внутреннего стандарта, включая прямой изотопный обмен в сыворотке крови. Количественный потенциал предлагаемой методики превращает масс-спектрометрию (MALDI) в подходящий и эффективный инструмент для диагностики воспалительных процессов...
Альфа-2-макроглобулин, количественная масс-спектрометрия, биомаркеры, сывороточный амилоид а, альфа-1-антитрипсин
Короткий адрес: https://sciup.org/142218219
IDR: 142218219 | УДК: 543.51: | DOI: 10.18358/np-29-2-i3043
Текст научной статьи Количественное определение ряда маркеров сыворотки крови без ее предварительного фракционирования с использованием особенностей взаимодействия трипсина с альфа-2-макроглобулином человека методом MALDI-MS
Альфа-2-макроглобулин (α2-МГ) является одним из важнейших белков плазмы крови, выпол- няющий широкий ряд регуляторных и транспортных функций [1–3]. В первую очередь, α2-МГ в плазме крови способен образовывать комплексы с протеазами всех классов. Протеазы в комплексе с α2-МГ изменяют свою каталитическую активность: теряют способность к гидролизу высокомолекулярных белков, но могут сохранять свою активность по отношению к низкомолекулярным субстратам, в том числе к некоторым белкам [4–6]. Так, для трипсина было показано, что в комплексе с α2-МГ он способен к гидролизу сывороточного амилоида A (serum amyloid A, SAA) в сыворотке крови человека, что может быть использовано для диагностики воспалительных процессов [5]. Отмечено, что при ряде заболеваний концентрация α2-МГ в сыворотке крови может существенно меняться [7–9], благодаря чему количественное определение этого белка используется в диагностике.
Традиционно для определения концентрации α2-МГ используются иммунологические или энзиматические методы [10, 11]. Первые требуют наличия специфических антител, вторые — определения скоростей гидролиза специфических субстратов. К тому же в первом случае тестирование не позволяет различать свободную форму α2-МГ от продуктов его взаимодействия, в том числе и с другими протеазами.
Нами предлагается использовать для определения концентрации активного α2-МГ в сыворотке крови человека инструментальный масс-спектрометрический метод (MALDI-MS) в сочетании с изотопно-меченым внутренним стандартом.
В основе предлагаемого подхода используется способность трипсина образовывать комплекс α2-МГ с выделением характерного пептида VGFYESDVMGR [1]. Этот пептид гидролитически отщепляется от зоны приманки (bait region) — от двух из четырех гомологичных цепей α2-МГ, входящих в состав такого комплекса [6]. Благодаря наличию стехиометрического соотношения между количеством выделяющегося пептида и количеством прореагировавшего α2-МГ, концентрация последнего в сыворотке крови может быть определена на основании измерения концентрации данного пептида методом MALDI-MS с использованием изотопно-меченого стандарта. Этому также способствует тот факт, что в норме средняя концентрация α2-МГ в сыворотке крови человека составляет около 2.7·10–6 М, следовательно, образующийся пептид будет уверенно детектироваться масс-спектрометрически. Подходящий для этой цели стандарт может быть приготовлен путем замещения атомов кислорода в составе карбоксильных групп пептида VGFYESDVMGR тяжелым стабильным изотопом 18О [12], причем пептид может быть как искусственно синтезирован, так и получен из сыворотки крови человека после взаимодействия трипсина и α2-МГ.
Успешность предлагаемого метода позволила распространить его шире: в отношении белков, также связывающих трипсин в виде комплексов, но, в отличие от α2-МГ человека, не отщепляющих при этом свободных пептидов. К их числу относятся альфа-1-антитрипсин (α1-АТ), α2-МГ мыши и ряд других белков сыворотки крови. Белки этого типа взаимодействуют с трипсином гораздо медленнее, чем α2-МГ, что делает возможным их количественное определение путем титрования остаточного трипсина, взятого в избытке, той же сывороткой крови человека, в которой концентрация α2-МГ была предварительно определена предлагаемым методом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Сыворотки крови человека
Сыворотки крови человека были любезно предоставлены клиникой пульмонологии ФПО ГБОУ ВПО Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова — д.м.н. проф. В.А. Воиновым, заведующим отделением эфферентных методов лечения.
Получение стандарта из синтетического пептида VGFYESDVMGR
Пептид VGFYESDVMGR синтезирован в ООО "НПФ Верта". Навеску 2.1 мг пептида растворяли в 20 мкл 10 % трифторуксусной кислоты, ТФУ ("Sigma-Aldrich") в H 2 18O (95–98 % 18O, "Cambridge Isotope Laboratories Andover", MA, USA) и инкубировали в твердотельном термостате при 70оС в течение 90 мин для протекания изотопного обмена, после чего высушивали на вакуумном испарителе SpeedVac ("Eppendorf"). Содержимое пробирки растворяли в воде и использовали в качестве стандарта для определения концентрации пептида VGFYESDVMGR в сыворотке крови. Конечная концентрация стандарта составляла 1.8·10–5 M.
Получение стандарта пептида VGFYESDVMGR из сыворотки крови человека
К 10 мкл неразбавленной сыворотки крови человека добавляли 40 мкл модифицированного свиного трипсина ("Promega", Madison, WI, USA) концентрацией 0.05 мг/мл в 50 мM бикарбонатном буфере. Через 3 мин реакцию останавливали добавлением 10 мкл 2% ТФУ. Весь раствор высушивали на вакуумном испарителе SpeedVac и пере-растворяли в 45 мкл Н 2 18О, куда добавляли 5 мкл 100 % ТФУ. Выпавший осадок сывороточных белков отделяли центрифугированием в течение 5 мин на настольной центрифуге-вортексе "Microspin FV-2400" ("Biosan"). Отбирали около 40 мкл надосадочной жидкости, выдерживали ее при 70 оС в течение 90 мин для протекания изотопного обмена. После изотопного обмена пробу высушивали на вакуумном испарителе "SpeedVac" и перерас-творяли в 100 мкл воды.
Определение α2-МГ в сыворотке крови человека
Сыворотку крови человека разбавляли в 25 раз и смешивали в равных объемах с модифицированным свиным трипсином с концентрацией 0.05 мг/мл в 50 мM бикарбонатном буфере. Через 3 мин трипсинолиза при 20оС реакцию останавливали, добавляя равный объем 2 % ТФУ. Концентрацию образовавшегося пептида определяли масс-спектрометрически по изотопному распределению после смешивания анализируемой пробы со стандартом с известной концентрацией, который был получен из синтетического пептида или из сыворотки. Концентрацию α2-МГ рассчитывали из известного соотношения: 2 моля пептида соответствует 1 молю α2-МГ.
Определение относительного содержания SAA в сыворотке крови человека
Сыворотку крови человека разбавляли в 25 раз и смешивали в равных объемах с модифицированным свиным трипсином с концентрацией 0.05 мг/мл в 50 мM бикарбонатном буфере. Через 2 часа трипсинолиза при 20 оС реакцию останавливали, добавляя равный объем 2 % ТФУ. Относительную концентрацию SAA оценивали масс-спектрометрически, сравнивая суммарную интенсивность изотопного распределения триптического пептида с m/z = 1913 с добавленным стандартом пептида VGFYESDVMGR с известной концентрацией. Относительную концентрацию образовавшегося пептида выражали в единицах концентрации стандарта, полагая, что 1 моль пептида с m/z = 1913 соответствует 1 молю SAA.
Масс-спектрометрические измерения и расчеты
Масс-спектры получены с помощью масс-спектрометра Ultraflex II MALDI-ToF/ToF (Bruker Daltonics, Германия), оборудованного Nd-лазером. Точность моноизотопных масс-пиков составляла 25 м.д. На каждый спектр при количественных измерениях приходилось по 4000 импульсов лазера. Для каждой пробы было получено как минимум 4 спектра. Масс-спектры фрагментации пептида получены в тандемном режиме прибора. В этом случае точность измерения моноизотопной массы фрагмента составила 0.5 Да.
Образцы для измерения наносили на мишень со следующими матрицами: α-циано-4-гидрокси-коричная кислота (HCCA) и 2,5-дигидрокси-бензойная кислота (DHB) (Bruker Daltonics, Bremen, Germany).
Для расчета содержания формы 18О в смеси анализируемого образца и полученного изотопо-мера пептида использовано программное обеспечение, описанное в работе [12]. Концентрация пептида рассчитывалась из соотношения площадей ионов, относящихся к анализируемому пептиду и его стандарту, что стало возможно из-за того, что изотопные сигналы исходного пептида и стандарта не перекрывались.
Определение α1-АТ в сыворотке крови человека
К 5 мкл сыворотки крови человека, разбавленной водой в 250 раз, добавляли 5 мкл трипсина с различными концентрациями (0.05, 0.07,
0.125 мг/мл), инкубировали 3 мин при комнатной температуре. После этого к каждому образцу добавляли по 10 мкл неразбавленной сыворотки крови человека и инкубировали 3 мин при комнатной температуре. Реакцию останавливали 20 мкл 2% ТФУ.
Концентрацию образовавшегося пептида VGFYESDVMGR определяли масс-спектрометрически по изотопному распределению после смешивания анализируемой пробы и стандарта с известной концентрацией, который был получен из синтетического пептида. Концентрацию антитрипсина определяли как разницу между добавленным в реакцию трипсином и свободным трипсином, количество которого оценивали по пептиду VGFYESDVMGR из расчета: 1 моль пептида — 1 моль свободного трипсина.
Сыворотки крови мыши
В экспериментах использовали сыворотки крови интактных мышей и мышей, инфицированных вирусом гриппа A/Anhui/1/2013 (H7N9), через 48 ч от начала эксперимента.
Определение α2-МГ в сыворотке крови мыши
Все анализируемые сыворотки крови мышей и сыворотка крови человека с концентрацией 3·10–6 М α2-МГ предварительно были разбавлены водой в 5 раз. Из них были приготовлены смеси объемом 6 мкл с объемными соотношениями сывороток крови человека и мыши как 2:1, 1:1 и 1:2. В указанные смеси было добавлено по 6 мкл трипсина в концентрации 2.1·10–7 М в 50 мМ бикарбо-натном буфере. Через 5 мин реакцию останавливали добавлением равного объема 2%-й ТФУ. Концентрацию образовавшегося пептида определяли масс-спектрометрически по изотопному распределению после смешивания анализируемой пробы и стандарта с концентрацией 1.8·10–5 M, разбавленного в 250 раз, который был получен из синтетического пептида. Расчет проводился с учетом исходного количества пептида без и с добавлением сыворотки мыши из расчета: 2 моля пептида соответствуют 1 молю α2-МГ.
Концентрация α2-МГ мыши рассчитывалась из предположения, что связывание трипсина с α2-МГ
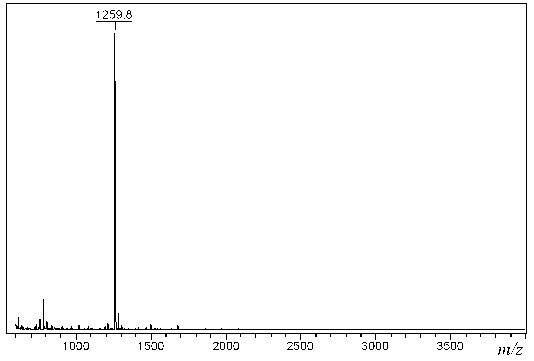
Рис. 1. MALDI-MS сыворотки крови, обработанной трипсином, через 3 мин инкубации человека и мыши пропорционально их концентрациям в смешанных сыворотках крови.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Идентификация триптического пептида α2-МГ в сыворотке крови человека
В основе предлагаемого метода использована особенность взаимодействия трипсина с белками сыворотки крови человека. В зависимости от концентрации вводимого в сыворотку крови трипсина он может находиться в ней в трех возможных состояниях: в виде комплекса с α2-МГ, в виде комплекса с α1-АТ и в свободном виде (в случае, если его концентрация превышает связывающие способности α2-МГ и α1-АТ).
Как было отмечено ранее, при введении трипсина в сыворотку крови он прежде всего взаимодействует с α2-МГ. В результате этого взаимодействия две молекулы трипсина образуют с тетрамером α2-МГ комплекс, от которого затем отщепляются две молекулы характерного пептида VGFYESDVMGR.
На рис. 1 представлены результаты масс-спектрометрического анализа триптических гидролизатов сыворотки крови человека через 3 мин инкубации.
Как видно из рис. 1, в спектре регистрируется интенсивный квазимолекулярный ион с m/z = = 1259.8, который соответствует пептиду VGFYESDVMGR. При этом других ионов в указанном диапазоне за этот же период времени зарегистрировано не было. Следует отметить, что в представленном эксперименте анализируемая сыворотка крови до нанесения на мишень была разбавлена в 100 раз.
На рис. 2 представлен спектр фрагментации зарегистрированного иона, который подтверждает аминокислотную последовательность ожидаемого триптического пептида α2-МГ.
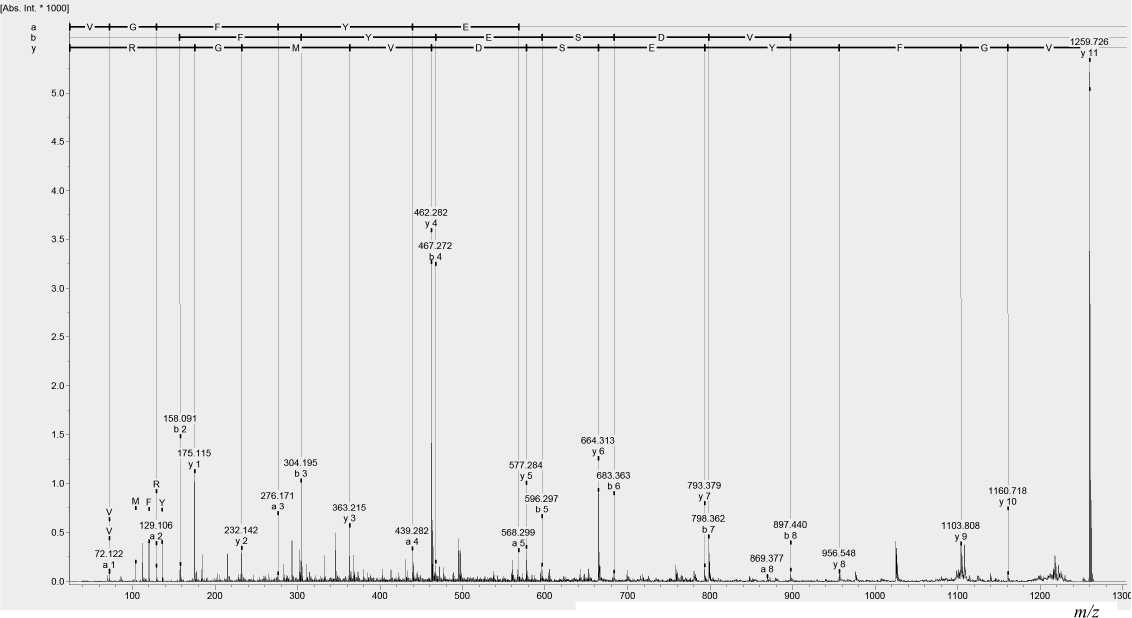
Рис. 2. Спектр фрагментации квазимолекулярного иона с m/z =1259.6. Отмечены соответствия с аминокислотной последовательностью пептида VGFYESDVMGR
Получение стандарта пептида VGFYESDVMGR из синтетического пептида
Для количественного определения характеристического пептида VGFYESDVMGR был получен его синтезированный аналог, из которого путем изотопного обмена 16О на 18О в карбоксильных группах, согласно ранее разработанному нами подходу [13, 14], был приготовлен 18О-меченый стандарт. На рис. 3, а, б, в, представлены фрагменты масс-спектров характеристического пептида (а), изотопно-меченого стандарта на его основе (б) и их смеси (в).
Распределение изотопов в полученном стандарте, вычисленное на основании его спектра (рис. 3, б), представлено в табл. 1.
Из полученных данных следует, что в результате изотопного обмена при наличии в пептиде трех карбоксильных групп наблюдается включение от 3 до 6 атомов 18О.
Следует отметить, что при имеющемся широком распределении изотопных форм в стандарте, они не перекрываются с изотопным распределением исходного пептида. Этот факт позволяет определить соотношение концентраций исходного пептида и его стандарта в смеси по соотношению площадей их изотопных распределений. В случае, когда молярная концентрация стандарта в смеси известна, то из соотношения площадей изотопных распределений пептида и стандарта может быть определена концентрация пептида и, следовательно, α2-МГ в сыворотке крови.
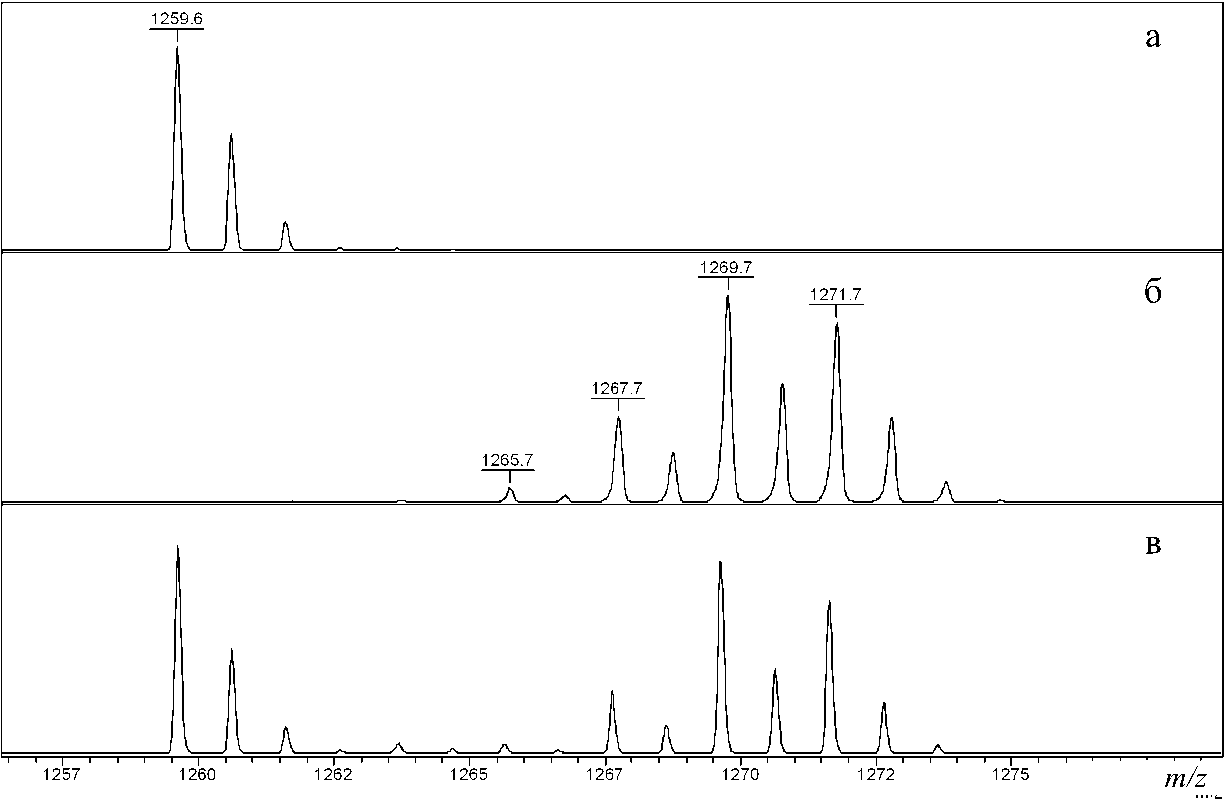
Рис. 3 . Фрагменты MALDI-масс-спектров характеристического пептида
VGFYESDVMGR (а), стандарта (б) и их смеси (в)
Табл. 1 . Распределение изотопов после обмена в пептиде-стандарте
|
Количество обмененных атомов кислорода, % |
Среднее количество включенных атомов 18 О |
||||||
|
18 O 0 |
18 O 1 |
18 O 2 |
18 O 3 |
18 O 4 |
18 O 5 |
18 O 6 |
|
|
0 |
0 |
0 |
4 |
18 |
45 |
33 |
5.1 |
Получение стандарта пептида VGFYESDVMGR из триптического гидролизата сыворотки крови человека
Аналогичным образом в результате изотопного обмена стандарт пептида может быть получен из триптического гидролизата сыворотки крови человека. Масс-спектр пептида из сыворотки крови человека до и после изотопного обмена представлен на рис. 4, а, б, масс-спектры смесей полученного стандарта с двумя разными сыворотками крови человека после обработки трипсином представлены на рис. 4, в, г.
Распределение изотопов в полученном стандарте пептида из сыворотки крови человека, вычисленное на основании его спектра (рис. 4, б), представлено в табл. 2. Обращает на себя внимание, что обмен произошел достаточно глубоко (в среднем замещается около четырех атомов 18О).
Также как и для стандарта из синтетического пептида, спектры исходного пептида и полученного стандарта из сыворотки крови человека не перекрываются
Из представленных данных по использованию стандарта, полученного из сыворотки, мы также видим, что соотношения интенсивностей образовавшегося пептида и стандарта сильно отличаются для сывороток крови здорового донора и пациента с диагностированным заболеванием (ИФА). Таким образом, стандарт пептида, полученный из обработанной трипсином сыворотки крови человека, может быть использован для оценки относительных концентраций α2-МГ.
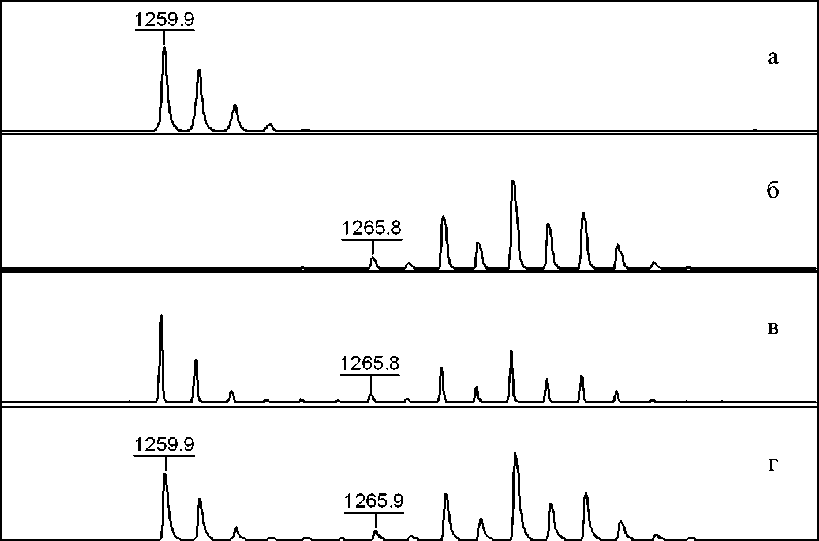
—I—j—i—I—I—I—|—I—I—I—i—j—I—I—I—I—|—I—I—I—i—|—I—i—I—I—|—I—I—i—i—|—i—I—I—I—|—I—i—i—I—I—I—Г 1257 1260 1262 1265 1267 1270 1272 1275 m/z
Рис 4. Фрагмент MALDI-масс-спектра пептида α2-МГ (а), стандарта для данного пептида, полученного после трипсинолиза α2-МГ в сыворотке крови и последующего изотопного обмена (б), смесей пептида в двух триптических гидролизатах сывороток крови человека и стандарта (в — сыворотка крови здорового донора, г — сыворотка крови пациента с идиопатическим фиброзирующим альвеолитом, ИФА)
Табл. 2. Распределение изотопов после обмена в пептиде-стандарте, полученном из сыворотки крови человека
|
Количество обмененных атомов кислорода, % |
Среднее количество включенных атомов 18 О |
||||||
|
18 O 0 |
18 O 1 |
18 O 2 |
18 O 3 |
18 O 4 |
18 O 5 |
18 O 6 |
|
|
0 |
1 |
4 |
17 |
39 |
39 |
0 |
4.1 |
Количество образующегося пептида VGFYESDVMGR в зависимости от концентрации вносимого в сыворотку трипсина
Из серии экспериментов для одной из сывороток крови человека были получены количественные данные по накоплению пептида VGFYESDVMGR в зависимости от концентрации трипсина вплоть до предельных значений. Результаты этого эксперимента представлены на рис. 5.
В целом вид кривой соответствует имеющимся представлениям о насыщающем характере взаимодействия α2-МГ и трипсина, из которого может быть определена концентрация активной формы α2-МГ.
Полученные данные могут быть использованы в трех направлениях. Во-первых, появляется возможность определить абсолютную концентрацию изотопно-меченого стандарта пептида VGFYESDVMGR, полученного из сыворотки крови человека, обработанной трипсином. Для этого достаточно использовать трипсин в ненасыщающей и известной концентрации, которая приведет к соответствующей концентрации пептида.
Из соотношения площадей изотопных распределений этого пептида, концентрация которого соответствует концентрации добавленного трипсина, и стандарта, можно будет определить абсолютную концентрацию изотопно-меченого стандарта пептида VGFYESDVMGR, полученного из сыворотки крови человека.
Во-вторых, при наличии изотопно-меченого стандарта пептида с известной концентрацией, можно определить качество трипсина по его способности взаимодействовать с α2-МГ в сыворотке крови человека. Известно, что трипсин склонен к инактивации из-за автолиза или при его неправильной транспортировке, или хранении. В этом случае также следует обрабатывать сыворотку крови человека трипсином в ненасыщающих концентрациях для определения активных молекул трипсина.
В-третьих, данный подход может быть использован для определения концентрации α1-АТ в сыворотке крови человека. Он основывается на определении концентрации свободного трипсина, добавленного в сыворотку крови в избытке, по сравнению с суммарной ингибиторной активностью α2-МГ и α1-АТ.
Количественное определение α2-МГ в сыворотке крови человека
То обстоятельство, что связывание трипсина в его реакции с α2-МГ протекает со значительно более высокой скоростью, чем его связывание с α1-АТ, позволило разработать простую методику для определения концентрации α2-МГ в сыворотке крови человека. В начале титрования, когда концентрация трипсина еще мала, протекает его связывание исключительно с α2-МГ, в процессе которого выделяется характеристический пептид VGFYESDVMGR. При этом концентрация этого пептида нарастает приблизительно пропорционально количеству добавленного трипсина.
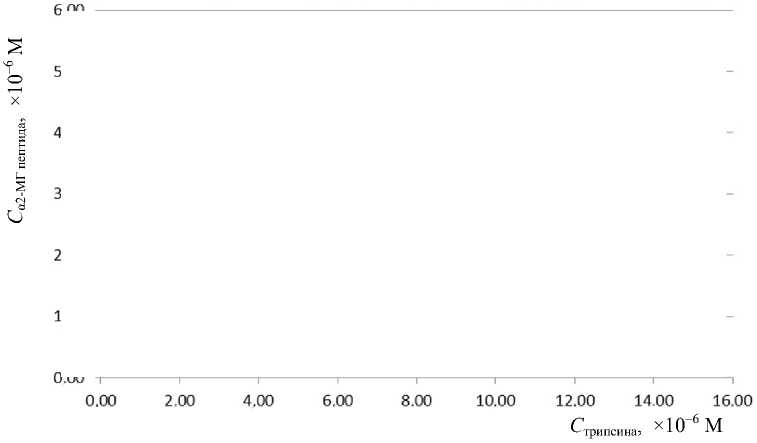
Рис. 5. Концентрация пептида VGFYESDVMGR в сыворотке крови здорового донора в зависимости от концентрации добавленного трипсина
После того как свободный α2-МГ в сыворотке будет исчерпан, нарастание концентрации образующегося характеристического пептида прекратится, и в дальнейшем его концентрация будет оставаться неизменной (см. рис. 5). Момент времени, когда нарастание концентрации характеристического пептида прекращается, соответствует мольному соотношению трипсина к α2-МГ (в пересчете на тетрамер), как 2:1. Тем самым, концентрация α2-МГ может быть определена по точке перелома кривой титрования трипсином.
Измерение концентрации характеристического пептида производится масс-спектрометрически, с использованием в качестве внутреннего стандарта синтетического образца пептида VGFYESDVMGR, обогащенного изотопом 18О. Благодаря этому для титрования могут быть пригодны растворы трипсина, точная концентрация которых заранее неизвестна. Более того, концентрация трипсина в растворе также может быть легко вычислена на основании все той же кривой титрования, т.к. в момент ее перелома мольное соотношение трипсина к α2-МГ известно и составляет 2:1.
Поскольку построение кривой титрования для каждой сыворотки крови человека является весьма трудоемким процессом, то определение концентрации α2-МГ по точке перелома в кривой титрования не может быть широко применено. Однако, при концентрациях трипсина, в 2 раза превышающих концентрацию α2-МГ, фермент будет необратимо и с полной потерей активности ингибироваться α1-АТ. В норме концентрация этого ингибитора в сыворотке крови примерно на порядок превышает концентрацию α2-МГ. Таким образом, концентрация вводимого трипсина, необходимая для его полного взаимодействия с α2-МГ, должна составлять примерно трех-, пятикратный избыток, включая возможность возрастания концентрации α2-МГ при наличии воспалительного процесса. Добавление трипсина в сыворотку крови в таком избытке позволяет точно и за один раз определить концентрацию α2-МГ в сыворотке крови и освобождает от необходимости в построении кривой титрования сыворотки крови трипсином.
Количественное определение α1-АТ в сыворотке крови человека титрованием раствором трипсина
Метод основан на введении в сыворотку избытка трипсина в количестве, достаточном для полного связывания не только α2-МГ, но α1-АТ с последующим определением оставшегося свободным трипсина его взаимодействием с α2-МГ из второй порции сыворотки. При этом концентрация свободного трипсина определяется по при- ращению количества характеристического пептида VGFYESDVMGR между первой и второй инкубациями.
Тактически эксперимент проводится с использованием сыворотки крови с разными разведениями (см. Экспериментальную часть). Первая порция сыворотки имеет в 10 раз более сильное разведение, чем вторая, чтобы трипсин после взаимодействия с α2-МГ и α1-АТ оказался в избытке и частично остался в свободном виде. После 3 мин инкубации в эту смесь добавляют дополнительное количество сыворотки с меньшим разведением. Количество добавленной сыворотки рассчитывается с учетом того, чтобы количество присутствующего в ней α2-МГ было заведомо выше возможной концентрации свободного трипсина в смеси. При этом важно, чтобы в этом соотношении концентрация вновь образованного характеристического пептида находилась на возрастающем линейном участке кривой титрования (см. рис. 5). В таком случае весь свободный трипсин, оставшийся после взаимодействия с α2-МГ и α1-АТ в первой, более разбавленной порции сыворотки крови, прореагирует с α2-МГ из второй, более концентрированной, порции сыворотки крови человека с образованием характеристического пептида VGFYESDVMGR. Измерение концентрации пептида также производится масс-спектрометрически, с использованием в качестве внутреннего стандарта синтетического образца пептида VGFYESDVMGR, обогащенного изотопом 18О.
Примеры анализа сывороток человека: результаты анализа сывороток крови пациентов с диагностированными заболеваниями легких
С использованием разработанных подходов проведен анализ серии сывороток пациентки с диагнозом "экзогенный токсический альвеолит, подострое течение" в период от госпитализации до выписки. Была проанализирована сыворотка в острой фазе заболевания (МОΑ1), в процессе лечения, включающего системные глюкокортикостероиды (начальная доза 20 мг в перерасчете на преднизолон) и три процедуры плазмафереза (МОΑ2–МОА4), а также при выписке (МОА5).
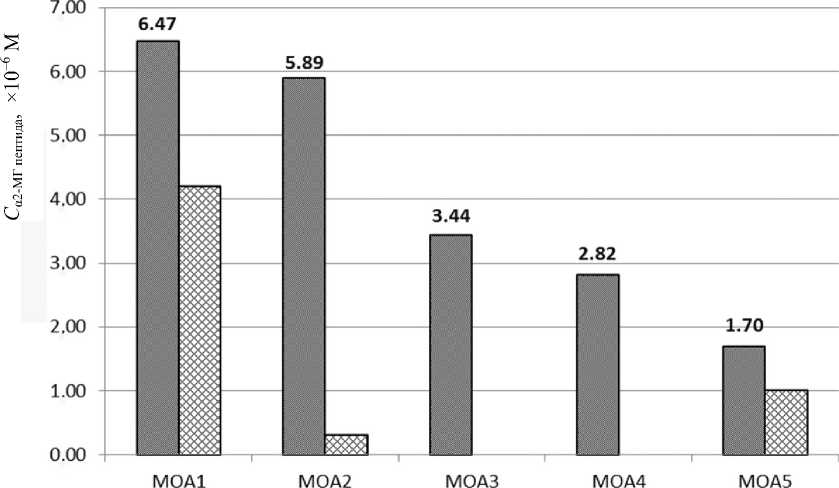
В каждом образце прежде всего была определена концентрация α2-МГ. Результаты определения представлены на рис. 6. На этой же диаграмме дополнительно представлены результаты по определению относительной концентрации SAA. Это стало возможным при MALDI-MS-анализе тех же гидролизатов сывороток крови, но с увеличенным до 2 ч временем инкубации. При наличии в сыворотке крови этого фактора, указывающего
□ α2-МГ
0 SAA
Рис. 6. Результаты масс-спектрометрического анализа сывороток крови пациента в процессе лечения токсического экзогенного альвеолита от острой фазы (МОА1) в течение трех сеансов плазмафереза и приема глюкокортикостероидов (МОА2–МОА4) до выписки (МОА5)
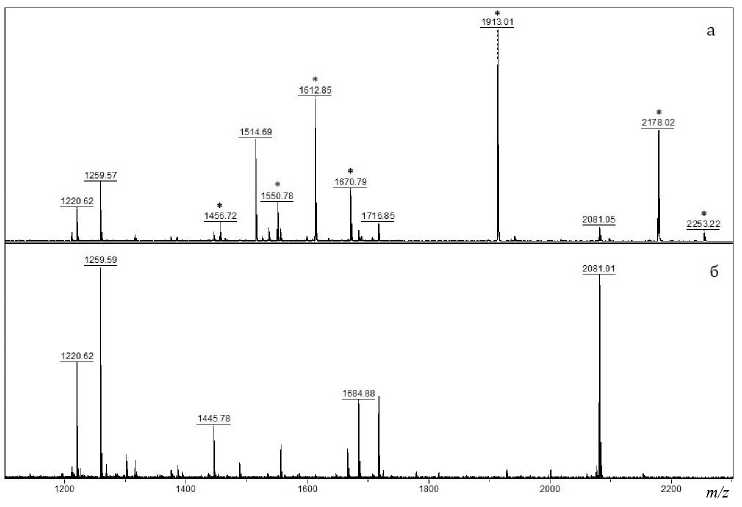
Рис. 7. Фрагмент MALDI-масс-спектра сывороток крови МОА1 (а) и МОА4 (б), обработанных трипсином, через 2 ч инкубации
на воспалительный процесс, регистрируются триптические пептиды SAA, наиболее интенсивным из которых является пептид с m/z = 1913 [5]. На рис. 7 представлены MALDI-масс-спектры сывороток крови МОА1 и МОА4 после обработки трипсином в течение 2 ч.
В спектре сыворотки крови, отобранной в острой фазе заболевания (рис. 7, а) присутствует серия ионов, соответствующих триптическим пептидам SAA (отмечены символом *), в то время как эти ионы отсутствуют в сыворотке МОА4 после двухчасового гидролиза (рис. 7, б). Аналогичным образом были проанализированы остальные сыворотки крови (МОА2, МОА3 и МОА5). Содержание SAA в тех сыворотках крови, где он был зарегистрирован, оценивали по относительной интенсивности иона с m/z =1913, используя в качестве стандарта пептид VGFYESDVMGR, меченный 18O (рис. 6).
Для двух сывороток крови (МОА1 и МОА3) был также определен уровень α1-АТ способом, описанным выше. В табл. 3 представлены результаты данного эксперимента. Трипсин в разбавленную сыворотку крови был добавлен в трех концентрациях (0.05, 0.07, 0.125 мг/мл), однако в первом случае его оказалось недостаточно для преодоления суммарной ингибиторной активности α2-МГ и α1-АТ, поэтому в расчетах использовались только концентрации 0.07 и 0.125 мг/мл, что соответствует 3.0·10–6 и 5.2·10–6 М.
На первом этапе масс-спектрометрически была определена концентрация избыточного трипсина, соответствующая концентрации регистрируемого характеристического пептида VGFYESDVMGR. Зная концентрацию добавленного и избыточного трипсина с учетом всех разбавлений, можно вычислить суммарную ингибиторную активность α2-МГ и α1-АТ или их суммарную концентрацию в сыворотке крови. Поскольку концентрация α2-МГ была измерена в предыдущем эксперименте для двух данных сывороток крови, то легко получить концентрацию α1-АТ, соответствующую (3.3 ± ± 0.1)×10–5 М для МОΑ1 и (4.9 ± 0.4)×10–5 М для МОА3. Принимая во внимание, что нормальный уровень α1-АТ составляет 1.5–3.5 г/л или порядка (2.7–7.0)×10–5 М, то уровень этого белка в сыворотках крови МОА1 и МОА3 находится в норме.
Из представленных результатов можно заключить, что в процессе лечения уровень α2-МГ от повышенного значения, указывающего на наличие воспалительного процесса, приблизился к нормальному, что свидетельствует об успехе проводимых лечебных мероприятий. Одновременно с повышением α2-МГ в острой фазе (МОА1) зафиксировано появление фактора воспаления SAA, от- носительный уровень которого существенно снизился в процессе лечения вплоть до полного исчезновения после третьего плазмафереза, однако был зарегистрирован на следующий день после выписки (возможно, это объясняется присоединением госпитальной инфекции).
Следует отметить, что стандартным масс-спектрометрическим методом, применяемым в данной работе, пептиды SAA при нормальном уровне не регистрируются, поскольку его концентрация оказывается ниже порога чувствительности метода. Таким образом, присутствие в спектрах триптических гидролизатов сывороток крови характерных пептидов SAA указывает на наличие воспалительного процесса. Чем выше в спектре относительная интенсивность ионов, относящихся к SAA, тем больше его концентрация.
На рис. 8 представлены результаты масс-спектрометрического анализа сывороток крови пяти пациентов с интерстициальным заболеванием легких — идиопатическим фиброзирующим альвеолитом (ИФА) с прогрессирующим течением. Как и в предыдущем случае, у этих пациентов был определен уровень α2-МГ, а также была оценена относительная концентрация SAA (при его наличии).
Как следует из представленных данных, у всех пациентов повышен уровень α2-МГ, причем в наиболее тяжелом случае уровень α2-МГ превышает норму более, чем в 5 раз (пациент #4). У двух пациентов (пациенты #1 и #5) регистрируется повышенный уровень SAA, который при ИФА является маркером АА-амилоидоза, развивающегося как осложнение ряда неспецифических заболеваний легких. Известно, что в случае длительно существующего воспалительного процесса макрофаги не в состоянии осуществить полную деградацию SАА, и из его фрагментов в инвагинатах плазматической мембраны амилоидобласта (макрофаги, плазматические и миеломные клетки, фибробласты, эндотелиоциты и др.) происходит сборка фибрилл амилоида, что является серьезным осложнением.
Табл. 3. Определение уровня α1-АТ в сыворотках крови пациента с диагнозом "экзогенный токсический альвеолит"
|
Характеристики сыворотки крови и концентрации добавленного трипсина |
Наименование сыворотки |
|||
|
МОΑ1 |
МОА3 |
|||
|
Концентрация трипсина, ×10 –6 М |
3.0 |
5.2 |
3.0 |
5.2 |
|
Концентрация избыточного трипсина, ×10 –6 М |
1.5 |
3.7 |
1.0 |
3.0 |
|
Суммарная концентрация α2-МГ и α1-АТ, ×10 -6 М |
38.54 |
39.66 |
50.20 |
55.34 |
|
Концентрация α2-МГ, ×10 –6 М |
6.47 |
6.47 |
3.44 |
3.44 |
|
Концентрация α1-АТ, ×10 –6 М |
32.6 ± 0.8 |
32.6 ± 0.8 |
49.3 ± 3.6 |
49.3 ± 3.6 |
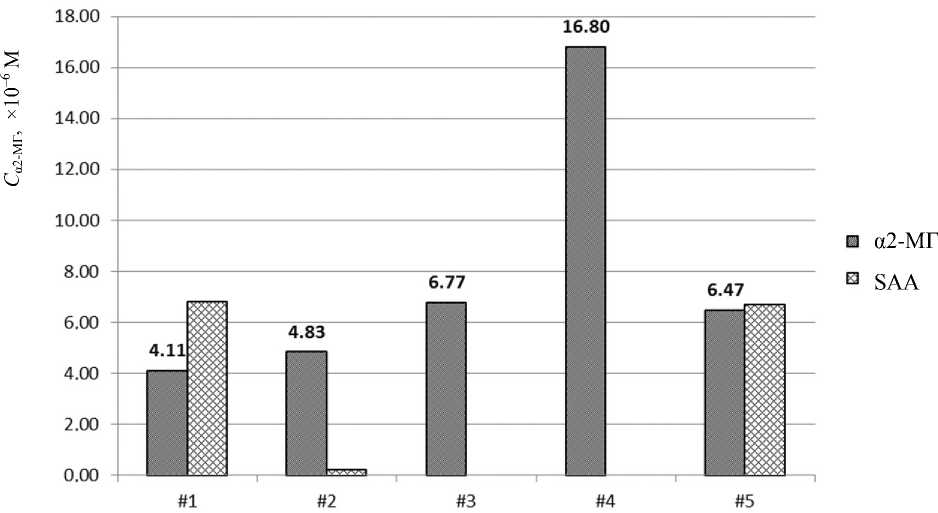
Рис. 8. Результаты масс-спектрометрического анализа сывороток крови пяти пациентов с ИФА
Очевидно, что полученные параметры (уровни α2-МГ и SAA) могут быть использованы при выборе последующего лечения, а их дальнейший контроль позволит корректировать процесс лечения.
Определение концентрации α2-МГ в сыворотке крови мышей
Определение нашим методом концентрации α2-МГ в сыворотке крови мышей представляет собой более сложную задачу, чем определение α2-МГ в сыворотке крови человека, поскольку имеет место существенная разница между продуктами взаимодействия трипсина с обоими видами α2-МГ. В то время как трипсин при взаимодействии с α2-МГ человека отщепляет в эквимолярном соотношении характеристический пептид, концентрацию которого можно измерить методом MALDI-MS с изотопно-меченым стандартом, то при взаимодействии с α2-МГ мыши такого пептида не отщепляется. Это обстоятельство мешает применить в отношении α2-МГ мыши ту же методику определения, что и для α2-МГ человека, тогда как необходимость такого определения весьма велика, поскольку большинство экспериментов, в частности доклинические испытания препаратов, проводятся именно на мышах.
Для этой цели нами предложен метод, основанный на конкуренции взаимодействия трипсина со смесью сывороток крови мыши и человека в условиях недостатка трипсина. Скорость связывания трипсина с α2-МГ на порядок выше скоростей свя- зывания с другими белками плазмы крови. Поскольку тиоэфирные участки в структуре α2-МГ человека и мыши высоко гомологичны, за исключением участка приманки [13], можно ожидать, что в этой ситуации скорость взаимодействия трипсина с α2-МГ обоих видов будет близкой или равной. Здесь мы предлагаем использовать подход, основанный на известном в формальной кинетике методе конкурентных реакций [14]. Для этого трипсин в количестве, меньшем чем α2-MГ человека и мыши, вносится в смесь сывороток крови, и измеряется количество образовавшегося характеристического пептида. Используя разные соотношения сывороток и применяя математический аппарат формальной кинетики, вычисляются отношения констант скоростей и абсолютные концентрации продуктов обеих реакций.
Продемонстрируем предлагаемый подход на примере определения α2-МГ в сыворотке крови мышей в практически важном эксперименте по оценке изменения уровня α2-МГ при инфицировании мышей вирусом гриппа H7N9 и влияния на этот процесс антивирусного препарата "Триазид".
В эксперименте принимали участие четыре группы мышей:
М1 — контрольная группа;
М2 — группа, инфицированная вирусом гриппа;
М3 — контрольная группа, получающая противовирусный препарат;
М4 — группа, инфицированная вирусом гриппа и получающая противовирусный препарат.
Табл. 4. Содержание α2-МГ в сыворотках крови мышей М1–М4
|
Соотношение сывороток крови (мышь : человек) |
Концентрация α2-МГ в сыворотках крови мышей, ×10 –6 M |
|||
|
M1 |
M2 |
M3 |
M4 |
|
|
1:1 |
3.52 |
1.88 |
2.01 |
2.02 |
|
1:2 |
4.59 |
2.54 |
1.99 |
3.41 |
|
2:1 |
4.38 |
2.14 |
2.52 |
2.56 |
|
Средняя величина |
||||
|
4.2 ± 0.6 |
2.2 ± 0.3 |
2.2 ± 0.3 |
2.7 ± 0.7 |
|
Время инкубации от начала инфицирования составляло 48 ч.
Все анализируемые сыворотки крови мышей и сыворотка крови человека с концентрацией 3·10–6 М α2-МГ предварительно были разбавлены водой в 5 раз. Из них были приготовлены смеси объемом по 6 мкл, с объемными соотношениями сывороток крови человека и мыши как 2:1, 1:1 и 1:2. К смесям был добавлен трипсин с концентрацией 2.1·10–7 М в 50 мМ бикарбонатном буфере. Через 5 мин реакцию останавливали добавлением равного объема 2% ТФУ. Для определения концентрации пептида 5 мкл пробы смешивали со стандартом пептида с концентрацией 1.8·10–5 M, разбавленного в 250 раз. Концентрация трипсина была выбрана таким образом, чтобы, с одной стороны, она была меньше известной концентрации α2-МГ человека, с другой стороны, чтобы концентрацию образовавшегося пептида возможно было зарегистрировать масс-спектрометрически.
Следует отметить, что номинальная концентрация трипсина и концентрация активного трипсина не всегда совпадают из-за автолиза фермента в процессе хранения. В связи с этим предварительно была оценена концентрация активного трипсина: к сыворотке крови человека с известной концентрацией α2-МГ (был в недостатке) добавлен трипсин (на линейном участке кривой титрования, рис. 5). По количеству образовавшегося характеристического пептида была определена концентрация активного трипсина в стоковом растворе, которая составила 0.15 мг/мл (или 6.4·10–6 М).
Концентрация α2-МГ мыши рассчитывалась из предположения, что связывание трипсина с α2-МГ человека и мыши пропорционально их концентрациям в смешанных сыворотках крови. Количество трипсина, связавшегося в каждом образце с α2-МГ мыши, вычислялось вычитанием трипсина, связавшегося с α2-МГ человека, из добавленного активного трипсина. Доля трипсина, связавшегося с α2-МГ человека, определялась непосредственно из спектров по количеству образовавшегося характеристического пептида VGFYESDVMGR.
Вычисленные значения из масс-спектрометрических данных для каждого типа сыворотки М1–М4 представлены в табл. 4.
Необходимо отметить, что результаты определения (при разных соотношениях сывороток) α2-МГ в смесях подтверждают предположение о том, что взаимодействие трипсина с α2-МГ пропорционально соотношениям α2-МГ человека и мыши. Таким образом, предлагаемый подход пригоден для определения α2-МГ мыши.
Анализируя полученные данные о концентрации α2-МГ в четырех группах мышей, можно полагать, что инфицирование вирусом гриппа приводило к снижению концентрации α2-МГ, также как и введение самого препарата. Таким образом, поставленная перед нами цель — продемонстрировать возможность применения нашего метода для измерения концентрация α2-МГ у мышей — была достигнута. В дальнейшем полученные данные должны быть проверены на большем количестве животных.
ЗАКЛЮЧЕНИЕ
В настоящей работе предложено два подхода, которые делают MALDI масс-спектрометрию подходящим инструментом для идентификации и количественного определения белков острой фазы воспаления. Во-первых, была показана возможность использования структурно-функциональных свойств анализируемых соединений при определении их концентрации, что позволяет исключить необходимость предварительного фракционирования образцов, т.е. работать с цельной сывороткой крови. Во-вторых, была использована методика изотопного обмена для получения необходимого внутреннего стандарта, в том числе полученного непосредственно в сыворотке крови. Привлекательным в предлагаемом подходе является возможность получения одновременно нескольких параметров (уровней α2-МГ, α1-АТ и SAA) в едином технологическом решении. Является существенным также и то, что количество материала, требуемого для анализа (например, для определения α2-МГ и SAA), весьма мало: необходимый объем сыворотки крови составляет всего порядка 1 мкл. Такое количество материала можно получить, заменив отбор крови из локтевой вены, на отбор крови из пальца.
Следует отметить, что при инкубации трипсина с сывороткой крови человека воспроизводимо появляется ряд других пептидов. Была проведена предварительная идентификация некоторых из этих пептидов. Оказалось, что они также принадлежат к важным маркерным белкам сыворотки крови человека, служащим, в частности, для оценки риска развития сахарного диабета, аллергических реакций и прочее. Данные по идентификации и изучению выявленных пептидов, оценка их диагностического потенциала будут приведены в одной из последующих публикаций.
Список литературы Количественное определение ряда маркеров сыворотки крови без ее предварительного фракционирования с использованием особенностей взаимодействия трипсина с альфа-2-макроглобулином человека методом MALDI-MS
- Sottrup-Jensen L. Alpha-macroglobulins: structure, shape, and mechanism of proteinase complex formation//Journal of Biological Chemistry. 1989. Vol. 264, no. 20. P. 11539-11542.
- Borth W. Alpha 2-macroglobulin, a multifunctional binding protein with targeting characteristics//FASEB Journal. 1992. Vol. 6, no. 15. P. 3345-3353.
- Barrett A.J., Starkey P.M. α2-Macroglobulin with proteinases. Characteristics and specificityof the reaction, and a hypothesis concerning its molecular mechanism//Biochemical Journal. 1973. Vol. 133. P. 709-724.
- Веремеенко K.H., Голобородько О.П., Кизим А.И. Протеолиз в норме и при патологии. Киев: Здоровье, 1988. 200 с.
- Toropygin I.Yu., Mirgorodskaya O.A., Moshkovskii S.A., Serebryakova M.V., Archakov A.I. Controlled trypsinolysis of human cancer and non cancer sera for direct matrix assisted laser desorption/ionization time of flight mass spectrometry//International Journal of Mass Spectrometry. 2012. Vol. 325-327. P. 121-129.
- Rehman A.A., Ahsan H., Khan F.H. α-2-Macroglobulin: a physiological guardian//Journal of Cellular Physiology. 2013. Vol. 228, no. 8. P.1665-1675
- DOI: 10.1002/jcp.24266
- Веремеенко К.Н., Кизим А.И., Досенко В.Е. α2-Макроглобулин: структура, физиологическая роль и клиническое значение//Лаб. диагностика. 2000. № 2. С. 3-9.
- Barrett A.J. α2-Macroglobulin//Methods in Enzymotogy/Lorand L., ed. Academic, New York, 1981. Vol. 80, P. 737-754.
- Swenson R.P., Howard J.B. Structural characterization of human alpha2-macroglobulin subunits//Journal of Biological Chemistry. 1979. Vol. 254, no. 11. P. 4452-4456.
- Ho A.S., Cheng C.C., Lee S.C., Liu M.L., Lee J.Y., Wang W.M., Wang C.C. Novel biomarkers predict liver fibrosis in hepatitis C patients: alpha 2 macroglobulin, vitamin D binding protein and apolipoprotein AI//Journal of Biomedical Science. 2010. 17:58
- DOI: 10.1186/1423-0127-17-58
- Sampsonas F., Karkoulias K., Kaparianos A., Spiropoulos K. Genetics of chronic obstructive pulmonary disease, beyond a1-antitrypsin deficiency//Current Medical Chemistry. 2006. Vol. 13, no. 24. P. 2857-2873.
- Козьмин Ю.П., Манойлов А.В., Серебрякова М.В., Миргородская О.А. Прямое введение изотопов О18 в пептиды и белки для количественного анализа методом масс-спектрометрии//Биоорганическая химия. 2011. Т. 37, № 6. С. 793-806.
- van Leuven F., Torrekens S., Overbergh L., Lorent K., de Strooper B., van den Berghe H. The primary sequence and the subunit structure of mouse alpha-2-macroglobulin, deduced from protein sequencing of the isolated subunits and from molecular cloning of the cDNA//European Journal of Biochemistry. 1992. Vol. 210, no. 1. P. 319-327.
- Пурмаль А.П. Эмпирическая кинетика (формальная феноменологичсекая кинетика). Учебное пособие. Москва: МФТИ, 2000. 80 с.


