Количественные и изотопные эффекты кислорода в нанокристаллических материалах на основе диоксида циркония
Автор: Амосова Х.Б., Борик М.А., Вишнякова М.А., Кулебякин А.В., Ломонова Е.Е., Медведовская Н.И., Устинов В.И., Панов В.А., Щербаков А.В.
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Структура и свойства кристаллических и аморфных веществ
Статья в выпуске: 3, 2007 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14718898
IDR: 14718898
Текст статьи Количественные и изотопные эффекты кислорода в нанокристаллических материалах на основе диоксида циркония
А. В. Щербаков
Кристаллы частично стабилизированного диоксида циркония (ЧСЦ), являющиеся твердыми растворами 2гО? с добавками ¥2ОЭ, представляют собой наноразмерные структуры с доменами, размеры и ориентация которых зависят от состава, режима роста и условий термообработки. Кристаллы ЧСЦ являются перспективными конструкционными материалами, сохраняющими высокие механические характеристики при повышенных температурах в агрессивных средах.
Одной из особенностей материалов на основе диоксида циркония является большая подвижность кислорода уже при небольших температурах (> 300 °C). В ряде работ рассматривались роль кислородных вакансий в материалах на основе ZrO2, возникающих во время их синтеза, влияние кислорода на процессы фазо-образования, а в конечном счете — на свойства кристаллов [1 — 31. Подвижность кислорода в монокристаллических материалах на основе ZrO2 зависит от состава, условий синтеза и термообработки. Этот параметр оказывает сильное влияние на целый ряд характеристик кристаллов при повышенных температурах.
Целью данной работы является изучение особенности перераспределения кислорода в процессе формирования и стабилизации структуры твердых растворов на основе ZrO2, а также влияние высокотемпературного отжига на воздухе и в вакууме на кислородные эффекты в кристаллах.
‘ Работа выполнена при поддержке РФФИ, грант 06-08-0014
Впервые для данного материала применен количественно-изотопный анализ кислорода, основанный на индикаторных свойствах изотопа 18О на уровне его естественной распространенности. Стабильные изотопы кислорода используются в качестве ^меченых атомов», что позволяет идентифицировать источник кислорода и установить особенности его миграции в процессе роста и отжига кристаллов. Исследовались кристаллы в широком диапазоне составов ZrO2 — (0 — 35) мол % Y2O3. Основное внимание было сфокусировано на кристаллах ЧСЦ с концентрацией стабилизирующего оксида иттрия от 2,5 до 4 мол%.
Методом направленной кристаллизации расплава с использованием технологии прямого ВЧ-плавления диэлектриков в холодном контейнере [4] диаметром 130 мм были выращены монокристаллы твердых растворов на основе ZrO2 в широком диапазоне составов. Скорость роста — 10мм/ч. Скорость охлаждения слитка кристаллов до 1000 °C составляла 180 — 200 °C/мин, а далее до температуры 500 °C со средней скоростью 30 ’С/мин, Кристаллы ЧСЦ составов ZrO2 (2,5-4) мол % Y2O3 были выращены направленной кристаллизацией расплава из больших объемов расплава (холодный контейнер диаметром 400 мм) со скоростью 10 мм/ч.
Кристаллы термообрабатывались при температурах 1 600 и 2 100 °C в течение 5 ч в вакууме 1,ЗЗЧ10-2Па (в печи СШВЛ), а также на воздухе при температуре 1 400 °C в течение 20 — 100 ч (в высокотемпературной
В. А. Панов, А. В. Щербаков, 2007
печи НТ 04/16,2). Охлаждение проводилось со скоростью 20—-100 град/час.
Методология кислородных исследований кристаллов ЧСЦ базировалась на отборе кристаллических образцов, их механическом измельчении до размера частиц 70..Л00 мкм, деструкции порошкообразных образцов путем фторирования в вакууме, отборе молекулярного кислорода и масс-спектрометрических измерениях изотопного состава кислорода [5; 6].
По объему выделяемого О2 определяли количество кислорода в исследуемом образце, а по величине 5|3О контролировали соотношение изотопов и их перераспределение при росте кристаллов и последующей термообработке. Главное требование к применяемым методикам — обеспечение полной деструкции вещества и количественного (100 %) отбора кислорода, так как фракционирование кислорода на стадии пробоподготовки может привести к искажению отношений 16О/16О.
Экспериментально подтверждено, что кристаллы на основе ZrO2 относятся к труднораз-лагаемым оксидам. Полная деструкция образцов происходит в вакууме в расплаве комплексных фторидных солей типа KF-C1R (газовая фаза + расплав) при 400 °C в течение 30 мин. При фторировании всех исследуемых образцов было достигнуто количественное (100 %) выделение О2, соответствующее расчетным показателям.
Измерения изотопного состава кислорода в газовой фазе проводили на изотопных масс-спектрометрах МАТ-250 и DELTA с использованием международных изотопных стандартов серии NBS.
Были получены количественные и изотопные характеристики кислорода экспериментальных кристаллов в широком диапазоне составов ZrO2— (0 — 35 мол%) Y2O3 (табл, 1) Количественным анализом кислорода показано, что во всем исследованном диапазоне составов содержание кислорода соответствует формуле ZrM Y*3 O"z2(l5 V°05. Это является прямым подтверждением механизма образования твердых растворов замещения, при котором Y+3 замещает Zr*4 с образованием кислородных вакансий в анионной подрешетке.
Полученные данные (табл. 1) показали изотопно-кислородную идентичность ростовой шихты и расплавного ZrO2 (816О = + 9,8 %о), т. е. при отсутствии стабилизирующего оксида получаемая из расплава фаза является стехиометрической по кислороду и в материале не образуются кислородные вакансии. При введении стабилизатора количество кислорода в кристалле уменьшается по мере увеличения мольной доли Y2O3 (рис. 1). При этом происходит обеднение кислорода кристалла изотопом 1ВО: значение 5JSO уменьшается до + 4,0 %о для кристалла ZrO2 — 35 мол % Y2O3 (рис. 2). Монотонный характер изменения 3[8О нарушается в интервале 2,5-4,0 мол % Y,O3, в пределах которого наблюдается выраженный минимум. Согласно полученным данным, в системе «расплав (ZrO2 + Y2O3) — твердый раствор ZrCVY2O3» достаточно четко прослеживается следующая связь: чем больше образуется кислородных вакансий в анионной подрешетке кристалла, тем меньше в ней удерживается тяжелый изотоп кислорода lsO и тем больше величина отрицательного 318О-сдвига между ростовой шихтой и кристаллом (ДЗсРО изменяется от 0,0%о для чистого ZrO2 до-5,8%о для кристалла с 35 мол % Y2O3). Как известно, чем более упорядоченная кристаллическая структура и чем более сильная химическая связь между кислородом и катионом, тем выше концентрация тяжелого изотопа кислорода 16О в оксиде [7; 8]. Таким образом, и на изотопно-кислородном уровне подтверждается механизм образования твердых растворов замещения.
Характер и величина изменений 8|8О свидетельствуют о том, что при направленной кристаллизации из расплава изотоп 1ЙО преимущественно концентрируется в уходящем кислороде, который в результате катионного замещения Zr+4 на Y+3 становится «лишним» для формирующегося твердого раствора [9].
Таким образом, на стадии кристаллизации твердого раствора химический состав является важнейшим фактором, определяющим подвижность кислорода, количественным выражением которой служат изменения изотопно-кислородной характеристики кристалла.
Более подробно была исследована зависимость изотопного состава кислорода крупных кристаллов ЧСЦ от мольной доли Y2O3 в диапазоне составов ZrO2 — 2,5—4,0 мол % Y2O3. Установлено, что середине диапазона (3,2 мол % Y2O3) соответствует более низкое значение 816О (+ 6,6 %о) по сравнению с нижней и верхней границами (+8,5 %о для 2,8 мол % YSO3 и 8,1
%О для 4,0 мол % Y2O3) (рис. 2). Это свидетельствует об экстремальном характере зависимости 5|аО=/(мол% Y2O3) с выраженным минимумом при 3,2 мол% Y?O3 и о наибольшей подвижности кислорода в кристалле этого состава.
Проведены сравнительные исследования образцов кристаллов ЧСЦ, взятых из разных частей кристаллической були. На количественном и изотопном уровнях оценивалась степень кислородной однородности крупных кристаллов состава ZrO2 — 3 мол% Y,O3 из периферической и центральной зон верхнего, среднего и нижнего сечений блока кристаллов. Установлено, что количество О2, выделенное из всех образцов, отвечает расчетным значениям для твердого раствора данного состава (16 мт — 2,9 см3), а 518О практически остается постоянным по длине и диаметру кристалла (рис. За, 36). Изотопный состав кислорода исследованного кристалла ZrO2 — 3 мал% YaO3 характеризуется значением 5|ВОер = 7,2 ± 0,3 %о, что хорошо согласуется с ранее полученными результатами кислородного изучения экспериментальных кристаллов аналогичного состава. Близкие значения 818О, установленные для разных зон закристаллизованного расплава, свидетельствуют о равновесности изотопно-кис дородного обмена при формировании кристаллической структуры данного химического состава и с достаточной степенью достоверности могут служить характеристикой кристалла в целом.
Были исследованы кислородные эффекты при отжиге (1 000 °C, 8 ч) в вакууме и на воздухе кристаллов, различающихся по химическому и фазовому составу. Предварительная сравнительная оценка показала, что величина кислородных эффектов при отжиге зависит от среды отжига и состава кристалла. При отжиге в вакууме в исследованных образцах наблюдалось уменьшение количества кислорода, сопровождаемое уменьшением значения б18О. Количественные эффекты кислорода связаны с частичным восстановлением диоксида. При этом за счет усиления кислородной нестехио-метрии в анионной подрешетке кристалла наряду с кислородными вакансиями замещения появляются дополнительные кислородные вакансии. Частичное восстановление ZrO2 при отжиге в вакууме, приводящее к усилению кислородной нестехиометрии, сопровождается изо топно-кислородным эффектом, который приводит к еще большему обеднению кристаллической фазы изотопом 1аО. Эта фаза по сравнению с неотожженным кристаллом характеризуется ослаблением химической связи катион — анион и, как следствие, меньшим сродством к изотопу 15О, L ’ - ■ -
При отжиге на воздухе восстанавливалась кислородная стехиометрия исследуемых образцов, а их 3,8О увеличивались до значений порядка + 15 %о за счет изотопно-обменного взаимодействия между кислородом кристалла и атмосферным кислородом (+ 23,5 %). При этом изотопный состав кислорода кристаллов контролировался термодинамическим изотопным эффектом в системе »ZrO21 У2О3-О,атм.» с константой изотопного равновесия 1,0085. В общем о сравнительной подвижности кислорода в кристаллах состава ZH^ ,Y+\O'2M5> можно судить по скорости установления изотопно-кислородного равновесия в системе «Zr+4, Y+3 0 = V° -О, атм.а.
Согласно полученным данным (рис. 4), при отжиге в вакууме и на воздухе тетрагональные кристаллы состава ZrO2 — 3 мол % Y2O3 характеризуются большей подвижностью кис- . лорода по сравнению с моноклинными кристаллами ZrO„ и кубическими кристаллами ZrO, — 35 мол % Y2Or
Проведено сравнительное исследование подвижности кислорода в крупных кристаллах ЧСЦ с содержанием Y2O3 (2,8; 3,2; 3,7 и 4,0 мол%) при отжиге на воздухе (1 400 ТС, 20 ч). Согласно экспериментальным и расчетным данным, глубина слоя, в котором происходили изотопно-обменные процессы, для кристалла с 3,2 мол% У2О3 составляет 20 %, а для кристаллов с 2,8 и 4,0 мол % Y2O3 — 3,7 и 5,5 % соответственно. Следовательно, так же как в экспериментальной серии кристаллов аналогичных составов, наибольшей подвижностью кислорода характеризуется кристалл с содержанием 3,2 мол % Y2O3.
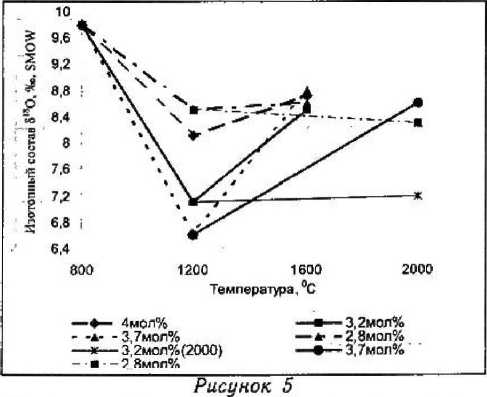
При более высоком отжиге (1 600 °C и 2 100 °C) крупных кристаллов ЧСЦ составов ZrO2 — 2,8; 3,2; 3,7; 4,0 мол % Y2O3 наблюдается потеря кислорода 2 — 3 об% (табл. 2). Наиболее существенные изменения после отжига отмечены в изотопном составе кислорода образцов состава ZrO2 — 3,2; 3,7 мол % Y2O3 (табл. 2), причем при температуре 1 600 °C эти изменения больше, чем при
2 100 °C (рис. 5). Эти особенности перераспределения кислорода при отжиге в вакууме при разных температурах вполне объяснимы с позиций равновесной диаграммы состояния системы ZrO5— Y,O3 [10; 11]. Отжиг кристаллов ЧСЦ при температуре 1600 °C, соответствующей двухфазной области (t + t'). При этой температуре кристаллы имеют нанокри- сталлическую тетрагнальную структуру, сформированную после роста. Температура отжига > 2 ООО “С выше температуры фазового перехода «тетрагональная фаза (t) —» кубическая фаза (с)». При этих температурах кристаллы имеют кубическую структуру, а в зависимости от скорости охлаждения от этих температур формируются фазовый со-
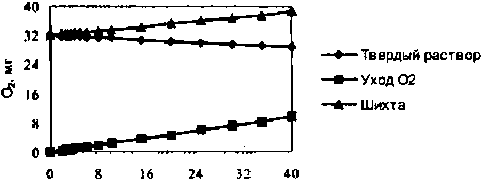
YjOj. моп%
Рисунок 1
Количество кислорода в молярной массе шихты f(lx)ZrO2 + xY2O31 и твердого раствора Zr) xYxO2 ж/г
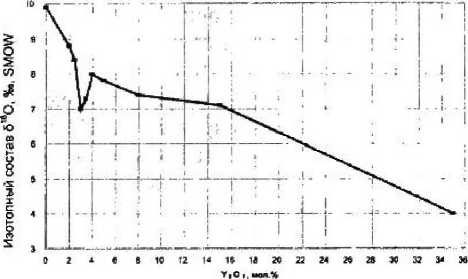
Рисунок 2
Зависимость изотопного состава кислорода кристаллов ЧСЦ от содержания Y2O3
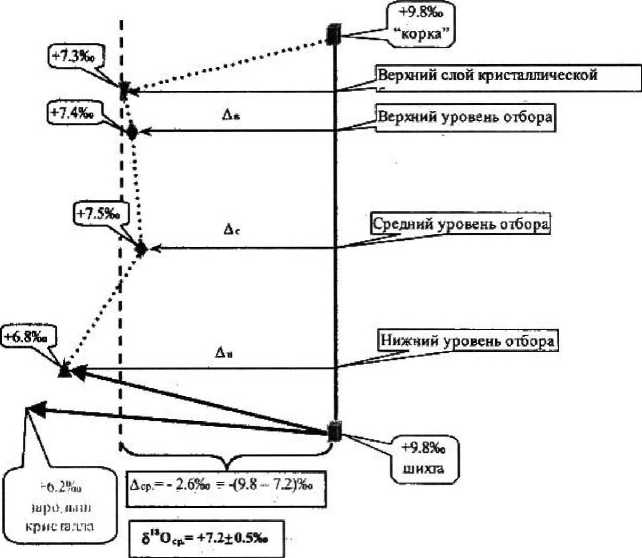
Рисунок 3
Изменения изотопного состава кислорода по диаметру кристалла ZrO - 3 мол% У О на разных уровнях
2 2 3
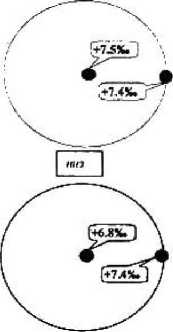
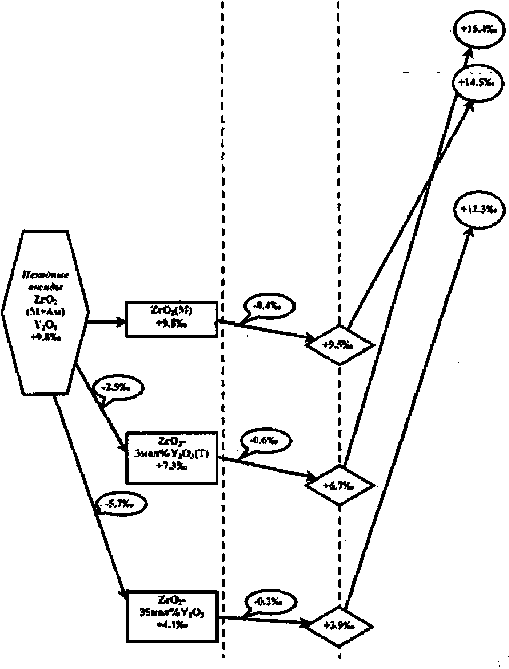
Рисунок 4 Изотопно-кислородные эффекты при кристаллизации и отжиге - кристаллов ЧСЦ
Изотопно-кислородные эффекты, при росте и отжиге в вакууме крупных кристаллов ЧСЦ разного состава
став и микроструктура материала во время отжига.
-Следовательно, в изотопно-кислородном обмене в первом случае (1 600 °C) участвует метастабильная тетрагональная фаза, отличающаяся высокой миграцией структурного кислорода при изменении температуры и парциального давления кислорода среды, а во втором — стабильная кубическая фаза, более устойчивая к изменению РТ-параметров среды. :
Впервые для исследования материалов на основе ZrO2 применен количественный и изотопный анализ кислорода. Разработана методика количественной экстракции О2 из этих материалов с учетом специфики их механических и химических свойств.
С использованием изотопно-кислороднр-го метода экспериментально установлены особенности перераспределения кислорода в процессе формирования и стабилизации структуры твердых растворов замещения Zr+\ Y^O^^V0^ и последующего отжига кристаллов на воздухе и в вакууме. Подтверждено, что подвижность кислорода варьирует в зависимости от химического состава и условий термообработки кристаллов., -. .
Установлено, что фракционирование изотопов кислорода в системе «ZrO2 — О2* обусловлено термодинамическим изотопным эффектом.
Количественные и изотопные эффекты кислорода при росте и отжиге кристаллов в вакууме и на воздухе позволяют идентифицировать источник кислорода, - оценивать подвижность кислорода в анионной подрешетке твердых растворов разного состава, механизм и интенсивность процесса диффузии кислорода из окружающей среды в кристалл. . ...........
Показано, что кристаллы ЧСЦ в диапазоне составов ZrO2 — 2,5—4,0 мол % Y2O3, оптимизированные по механическим параметрам, характеризуются наибольшей подвижностью кислорода при росте и термообработке. Монито-оинг количественного и изотопного перерас-пределения кислорода в кристаллах ЧСЦ на посткристаллизационном этапе позволяет разработать наиболее оптимальные условия синтеза, обеспечивающие стабильность структуры и заданные физико-химические свойства кристаллов.
Таблица I
Количество и изотопный состав кислорода кристаллов в диапазоне составов ZrOi + (0—35) мол% УЮз
|
Количество О2 |
Изотопный состав О2 |
||||
|
Описание образца |
518О, %о, |
518Ощ,%о, |
|||
|
Vpac4„ СМ |
Уэксл,, СМ |
Выход, % |
SMOW |
SMOW |
|
|
Изотопные стандарты |
|||||
|
Стандарт NBS-28 |
3,92 3,92 3,73 3,73 |
3,92 3,93 3,73 3,74 |
100 100 100 100 |
+ 10,0 + 9,9 + 10,1 + 10,0 |
+ 10,0 |
|
Стандарт ST-Q-GIN |
2,74 2,98 2,98 2,98 |
2,74 2,97 2,98 2,98 |
100 100 100 100 |
+ 9,8 + 9,8 + 9,8 + 9,9 |
+ 9,8 |
|
Кристаллы |
|||||
|
Z1O2 |
2,95 2,91 2,98 2,91 |
2,96 2,90 2,98 2,91 |
100 100 100 100 |
+ 9,9 + 9,8 + 10,0 + 9,9 |
+ 9,9 |
|
Z1O2 — 2 мол% Y2O3 |
2,90 |
2,85 |
98 |
+ 8,8 |
|
|
Z1O2 — 2,5 мол% ¥2 Оз |
2,90 2,89 |
2,90 2,90 |
100 100 |
+ 8,5 + 8,3 |
+ 8,4 |
|
Z1O2 — 3,0 мол% Y2O3 |
2,96 3,31 2,89 |
2,96 3,31 2,90 |
100 100 100 |
+ 6,7 + 7,0 + 7,3 |
+ 7,0 |
|
Z1O2 — 3,5 мол% Y2O3 |
2,89 |
2,86 |
99 |
+ 7,3 |
|
|
ZrO2 — 4,0мол% Y2O3 |
2,96 2,89 |
2,96 2,89 |
100 100 |
+ 7,8 + 8,2 |
+ 8,0 |
|
ZrO2- 5,0 мол% Y2O3 |
2,88 2,88 |
2,88 2,88 |
100 100 |
+ 8,0 + 7,6 |
+ 7,8 |
|
Z1O2— 8,0мол% Y2O3 |
2,87 2,87 2,87 2,87 |
2,88 2,85 2,87 2,85 |
100 99 100 99 |
+ 7,6 + 7,2 + 7,3 + 7,4 |
+ 7,4 |
|
Z1O2 - 15,0 мол% Y2O3 |
2,83 2,91 |
2,83 2,92 |
100 100 |
+ 7,2 , +7,0 |
+ 7,1 |
|
ZrO2 - 35,0 мол% Y2O3 |
2,73 2,73 3,19 2,73 |
2,74 2,74 3,19 2,73 |
100 100 100 100 |
+ 3,8 + 4,1 + 4,2 + 3,9 |
+ 4,0 |
Таблица 2
Влияние отжига в вакууме (1600 °C — 5 ч и 2000 “С — 4 ч) на фазовый и изотопно-кислородный состав кристаллов ЧСЦ с содержанием 2,8—4,0 мол% УзОз
|
Обпазец, |
Фазовый |
Количество U2 |
Изотопный состав Ог |
||||
|
условия отжига, УсУ^ч |
состав |
5ISO, %о, |
518О, %о, |
||||
|
Vpac4„ СМ |
¥эксл„ СМ |
Выход, % |
SMOW |
SMOW |
|||
|
Изотопные стандарты |
|||||||
|
Стандарт NBS-28 |
2,98 2,98 |
2,97 2,98 |
100 100 |
+ 10,0 + 10,0 |
+ 10,0 |
||
|
Стандарт ST-Q-GIN |
2,98 2,98 |
2,97 2,98 |
100 100 |
+ 9,8 + 9,8 |
+ 9,8 |
||
|
2Ю? -2,8 мол% Y2O3 |
|||||||
|
Кристалл после роста |
Т, М-слабые следы |
2,89 2,89 |
2,89 2,88 |
100 100 |
+ 8,5 + 8,6 |
+ 8,5' |
|
|
Кристалл после отжига в вакууме, 1600/5 |
2,89 2,89 |
2,84 2,87 |
98 99 |
+ 8,5 + 8,7 |
+ 8,6 |
||
|
Кристалл после отжига в , _________ - Г^/УПП f л |
2,89 2,89 |
2,82 2,81 |
98 98 |
+ 8,2 + 8,3 |
+ 8,3 |
||
|
2Юг - 3,2 мол% ¥2 Оз |
|||||||
|
Кристалл после роста |
Т,М-слабые следы |
2,89 2,89 |
2,88 2,89 |
100 100 |
+ 6,9 + 7,3 |
+ 7,1 |
|
|
Кристалл после отжига в вакууме, 1600/5 |
2,89 2,89 |
2,85 2,86 |
98 99 |
+ 8,7 + 8,3 |
+ 8,5 |
||
|
Кристалл после отжига в вакууме, 2000/4 |
2,89 2,89 |
2,86 2,82 |
99 98 |
+ 6,9 + 7,4 |
+ 7,2 |
||
|
2Юз - 3,7 мол% ¥зОз |
|||||||
|
Кристалл после роста |
2,89 2,89 |
2,88 2,89 |
100 100 |
+ 6,6 + 6,5 |
+ 6,6 |
||
|
Кристалл после отжига в вакууме, 1600/5 |
2,89 2,89 |
2,80 2,79 |
97 97 |
+ 8,5 + 9,1 |
+ 8,8 |
||
|
Кристалл после отжига в вакууме, 2000/4 |
2,89 2,89 |
2,81 2,80 |
97 97 |
+ 8,7 + 8,5 |
+ 8,6 |
||
|
Z1O2 - 4,0 мол% ¥2 Оз |
|||||||
|
Кристалл после роста |
Т |
2,89 2,89 |
2,88 2,85 |
100 100 |
+ 8,0 + 8,3 |
+ 8,1 |
|
|
Кристалл после отжига в вакууме, 1600/5 |
2,89 2,89 |
2,81 2,82 |
98 98 |
+ 8,7 + 8,7 |
+ 8,7 |
||
Список литературы Количественные и изотопные эффекты кислорода в нанокристаллических материалах на основе диоксида циркония
- Александров В. И., Батыгов С. X., Вишнякова М. А., Воронько Ю. К., Калабухова В. Ф., Ломонова Е. Ем Мызина В. Ам Осико В. В. Влияние состава и термообработки на зарядовые состояния собственных и примесных дефектов в твердых растворах//ФТТ. 1984. Т. 26, № 5. С. 1313 -1318.
- Platzer R.t Karapetrova Е., Zacate М. О., Gardner J. A., Sommers J. A., and Evenson W. E. Oxygen Vacancies in Zirconia: Material Science Forum. 1997. Vol. 57. P. 239 -241.
- Hartmanova M., Schneider J., Navratil V., Kundracik FM Schulz H., Lomonova E. E. Correlation between microscopic and macroscopic properties of yttria stabilized zirconia. Solid State Ionics/2000/137. P. 107 113.
- Borik M. A., Lomonova E. E., Osiko V. V., Panov V. A.t Porodinkov О. E., Vishnyakova M. A., Voronko Yu. K.t Voronov V. V. Partially stabilized zirconia single crystals. Novel trends in growth and investigation, Proceedings of the 4th International Conference on Solid State Crystals. A 33. 2004.
- Борщевский Ю. А., Амосова X. Б., Медведовская H. И. Способ выделения кислорода из минералов для изотопного анализа. Авт. свид. СССР. №1 089462. Б. И. № 16. 1984.
- Суховерков В. Ф., Устинов В. И., Гриненко В. А. Способы выделения кислорода из неорганических материалов. Авт. свид. СССР. № 787360. Б. И. № 25. 1982.
- Bideleisen J. Chemistry of isotopes. Scince. 1965. 147:63.
- Хёфс Й. Геохимия стабильных изотопов/Й. Хёфс. М.: Мир. 1983. С. 198.
- Alisin V. V.T Amosova Kh. В., Voitsitskii V. P., Voronov V. V.t Grinenko V. A., Lomonova E. E., Medvedovskaya N. I., Ustinov V. I. Influence of temperature on oxygen redistribution in nanocrystal-zirconia-based materials with nigh mechanical characteristics. Proceeding of the International Conference «Nanocomposites-2004», Space challenges in XXI century. Vol. 2. Novel Materials and Technologies: Nanocomposites. Moscow. TORUS PRESS. 2005. P. 183 -193.
- Stubican V. S., Gorman G. S., Hellman J. R., Senft G. Phase Relationships in Some Zr02 System. P. 96-106 in Advances in Ceramics. Vol. 12. Edited by Claussen N., Ruhle M., and Heuer A. H. The Americfy Ceramics Society. Columbus. OH, 1984.
- Scott H. G. Phase Relationships in the Yttria-rich Part of the Yttria -Zirconia System, J. Mater. Sci. 12. 2. 1977. P. 311 316.


