Колоканцерогенез: онкоиммунология локальных изменений
Автор: Никипелова Елена Алексеевна, Кит Олег Иванович, Шапошников Александр Васильевич, Златник Елена Юрьевна, Новикова Инна Арнольдовна
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 4S1 (21), 2016 года.
Бесплатный доступ
Целью исследования явилось изучение локального иммунитета при раке толстой кишки, аденоматозных полипах и поверхностных хронических колитах для оценки роли иммунокомпетентных клеток и цитокинов в канцерогенезе толстой кишки. Выявлено, что аденокарцинома толстой кишки формируется в условиях локального угнетения эффекторных звеньев специфического иммунитета (цитотоксических CD3+CD8+ и Т-лимфоцитов с рецепторами γβ) на фоне стимуляции клеток врожденной (NK) и адаптивной иммунной системы (CD3+, Т-хелперно-индукторных -CD3+CD4 и Т-лимфоцитов с рецепторами аβ). Развитие тубулярной аденомы толстой кишки происходит на фоне местного нарушения NK и В-клеточных звеньев иммунной системы, и так же, как при раке - стимуляции субпопуляций Т-хелперно-индукторных (CD3+CD4+) и Т-лимфоцитов с рецепторами аβ. При поверхностных хронических колитах слизистая оболочка толстой кишки характеризуется высоким уровнем клеток эффекторного звена иммунитета: натуральных киллеров (NK); цитотоксических (CD3+CD8+) и Т-лимфоцитов с рецепторами γβ; а также цитокинов IL-2, IL-10, IL-8, с параллельным угнетением В-клеточного звена и низкой продукцией провоспалительных цитокинов (TNF-a, IL-1 a, IL-6, IL-1RA). Исследуемые иммунокомпетентные клетки, находящиеся в микроокружении аденокарциномы, не осуществляют барьерную противоопухолевую защиту вследствие угнетения цитотоксических звеньев адаптивной (CD3+CD8+, TCRyô) иммунной системы, а В-лимфоциты являются сдерживающим фактором прогрессии опухоли. Микроокружение тубулярной аденомы осуществляется преимущественно посредством клеток врожденного иммунитета - натуральных киллеров (NK).
Канцерогенез толстой кишки, аденоматозные полипы, поверхностный хронический колит, локальный иммунитет
Короткий адрес: https://sciup.org/140223015
IDR: 140223015 | DOI: 10.18027/2224-5057-2016-4s1-81-86
Текст научной статьи Колоканцерогенез: онкоиммунология локальных изменений
В России колоректальный рак входит в первую десятку злокачественных опухолей, как по заболеваемости, так и по смертности. В общей структуре онкологических заболеваний шестое место занимает ободочная кишка (6,1%), седьмое – прямая кишка (5,2%) [3].
Механизмы возникновения и развития колоректального рака различны. Существуют экзогенные (пища, алкоголь, курение и др.) и эндогенные факторы (сахарный диабет, метаболический синдром, нарушение жирового обмена и др.), влияющие на развитие заболеваний желудочно-кишечного тракта [7, 16]. Кроме того, к факторам возникновения колоректального рака можно отнести и семейную предрасположенность, так называемые наследственные раки, гендерные различия, возрастные изменения, состояние микрофлоры кишечника [4, 3, 10].
Наличие аденом ободочной кишки является одним из самых существенных факторов риска развития рака. Аденоматозные полипы являются весьма распространенной патологией слизистой оболочки кишечника. Несмотря на то обстоятельство, что в экспериментальных условиях показана возможность развития рака толстой кишки на фоне неизмененной слизистой оболочки, подавляющее число как отечественных, так и зарубежных авторов полагают, что рак ободочной кишки в большинстве случаев развивается из аденом [1, 8, 35]. Большинство исследователей полагают, что полипы толстой кишки, особенно множественные, являются предраковым заболеванием, и большая часть карцином проходит стадию железистого полипа. Степень эпителиальной дис- плазии в аденоме обычно позитивно коррелирует с её размерами. Наиболее частыми типами полипов толстой кишки являются: аденоматозные полипы или аденомы; ювенильные полипы; гиперпластические полипы [1, 8].
Аденоматозные полипы представляют наибольшую опасность с точки зрения возможности малигнизации. По морфологическому строению различают три основные группы аденом: тубулярные, тубулярно-ворсинчатые и ворсинчатые аденомы (виллезные опухоли). Последняя разновидность аденом наиболее часто малигнизируется [1, 8].
Хроническое воспаление в той или иной степени выраженности может служить фоном для возникновения колоректального рака [21]. Воспалительные заболевания кишечника делятся на ряд патологических процессов с различной этиологией: язвенный колит, болезнь Крона (БК), недифференцированный колит (НК), занимающий промежуточное положение между язвенным колитом и болезнью Крона [2, 5, 9]. Воспалительные заболевания кишечника вызывают пролиферацию в слизистой оболочке толстой кишки, что ведет к возникновению опухоли. Толстая кишка является онкогенной зоной организма и носителем ряда предопухолевых процессов: микробиота, состав которой меняется, может быть источником воспаления слизистой оболочки; длительные воспалительные хронические заболевания с аутоиммунным деструктивным компонентом (язвенный колит, болезнь Крона); полипозный синдром. Отправной точкой реализации онкоизменений являются эпителиальные клетки слизистой оболочки кишки [12].
Иммунная система желудочно-кишечного тракта (ЖКТ) представлена лимфоидной тканью, ассоциированной с кишечником (GALT-gut associated lymphоid tissue), располагается в трех частях – диффузно распределена по собственной пластинке под кишечным эпителием, в самом эпителии и в организованных лимфоидных фолликулах, таких как пейеровы бляшки. Она находится в самом тесном контакте с громадным потоком микробного и аллергенного материала, поступающего из просвета кишечника, и служит первым барьером на его пути [6, 24].
Ткани колоректального рака человека инфильтрированы различными иммунными/воспалительными клетками. Иммуногистохимические исследования показали, что большое значение имеет число Т-лимфоцитов, инфильтрирующих опухоль, что является прогностическим фактором более длительной выживаемости больных раком толстой кишки [30]. Обычно ткань опухоли толстой кишки инфильтрирована малым количеством Т-лимфоцитов. В-клетки чаще всего наблюдаются в лимфоидных фолликулах [31]. Интраэпителиальные лимфоциты или туморинфильтрирующие лимфоциты – это обычно CD8+ Т-клетки. Число туморин-фильтрирующих интраэпителиальных CD8+ Т-клеток достоверно коррелировало с более длительной выживаемостью [22]. И, напротив, значительное количество CD8+ Т-клеток в строме опухоли и вдоль инвазивного ее края не являлось важным прогностическим фактором выживаемости больных [26]. Полученные результаты позволили предположить, что значение имеет не только, какие иммунокомпетентные клетки присутствуют в опухоли, но и где они расположены. Лимфоцитарный инфильтрат при колоректальном раке почти всегда сопровождается нейтрофильными и макрофагальными клетками.
-
A. C. Diederichsen et al. показали, что низкое соотношение туморинфильтрирующих лимфоцитов CD4+/CD8+, выявленное при цитометрическом анализе, является независимым прогностическим фактором более длительной выживаемости больных [17]. Хотя в их исследованиях точно
не доказывается локализация туморинфильтрирующих лимфоцитов TIL in situ, в нем четко показано, что соотношение CD4+/ CD8+ очень важно и что этот фактор взаимосвязан с ролью CD4+ CD25+ FОXP3+ регуляторных клеток в опухолевой ткани [19,22]. Проанализировав иммунные ответные реакции при колоректальном раке, F. Pages с соавт. провели всесторонний анализ TIL [27]. Они концентрировали свое внимание на ранней метастатической инвазии, которая включала следующие гистологические параметры – сосудистые эмболы (опухолевые клетки, лимфоцитарную инвазию, периневральную инвазию – все эти параметры авторы объединили в понятие VELIPI). На основании анализа 959 больных было показано, что VELIPI является независимым прогностическим фактором. Генетический анализ 75 больных показал, что уровни мРНК гранзима В и гранулизина в CD8+, выше в VELIPI отрицательных опухолях, чем в VELIPI положительных опухолях. Эти авторы выполнили цитометрический анализ 39 больных, с целью дифференцировки между наивными Т-клетками (CD3+CCR7+), Т-клетками памяти (CD45RО+CCR7-CD28+CD27+) и эффекторными клетками памяти (CD45RО+CCR7-CD28-CD27-) в опухолевой ткани. VELIPI отрицательные опухоли содержат высокое число зрелых CD8+ Т-клеток. Более того, было показано, что VELIPI отрицательные опухоли при иммуногистохимическом анализе у 377 больных содержат высокое число CD45RО+ клеток памяти. VELIPI отрицательные опухоли у больных без рецидивов имели достоверное повышение Тh1 медиатора Т-ВЕТ, интерферонрегуляторного фактора-1 и INF- γ по сравнению с VELIPI положительными опухолями у больных с рецидивом. И при регрессионном анализе СОХ было обнаружено, что число CD45+RО+ является независимым прогностическим фактором наряду с классификацией ТNM. Данное исследование подтверждает предположение о том, что иммунологические наблюдения имеют важное прогностическое значение при колоректальном раке [19, 22].
-
J. Galоn et al. показали, что экспрессия рецепторов Тh1 адаптивного иммунитета обратно коррелирует с рецидивом опухоли [18]. Больные CD3cтhigh, CD3iмhigh + CD45RОcтhigh CD45cмhigh имели более длительную безрецидивную выживаемость, в то время как больные с CD3cтlоw, CD3iмlоw + CD45RОcтlоw CD45imlоw имели более низкую выживаемость, что позволяет предположить, что плотность рецепторов иммунных клеток является более значимым прогностическим фактором, чем стадия TNM [26].
Пользуясь высокочувствительным методом, T. Tachibana с соавт. удалось показать, что при колоректальном раке в опухоли уровень NK-T клеток с экспрессией маркера ранней активации CD69+ больше, чем в неизмененной слизистой оболочке кишки [33]. Инфильтрация NK-T положительно коррелировала с меньшим числом метастазов в лимфоузлы, а число NK-T клеток являлось независимым прогностическим фактором для более длительной выживаемости и безрецидивного периода, хотя в их работе не указывается на точную локализацию инфильтрации NK-T клеток в тканях рака ободочной кишки. T. Tsuruyama и F Pagёs et al. показали, что клетки располагаются вдоль инвазивного поля [34, 28].
Известно, что экспрессия МНС I на поверхности клетки является предпосылкой для распознавания Т клеток-мишеней. A. G. Menоn et al. показали, что сниженная экспрессия МНС I, особенно экспрессия HLA-A в опухолевых клетках, коррелировала с более длительной безрецидивной выживаемостью [23]. Авторы показали, что наличие CD8+ и CD57+ клеток является независимым прогностическим фактором более длительной выживаемости в безрецидивном периоде.
Инфильтрация опухоли CD8+ и CD57+ клетками обратно коррелировала с экспрессией HLA-B/C и HLA-A опухолевыми клетками, те же авторы подтвердили, что интраэпителиальных клеток CD56+ было меньше в опухоли, чем инраэ-пителиальных клеток CD8+, и что потеря МНС I в клетках злокачественной опухоли связана с более высоким числом интраэпителиальных клеток CD8+, но не NK клеток с CD56+ [29]. Однако интерпретация этих данных пока еще не совсем ясна. Таким образом, интраэпителиальные Т-клетки CD8+ могут присутствовать, несмотря на снижение экспрессии МНС I раковыми клетками ободочной кишки. И CD8+ и NK-клетки играют важную роль в противоопухолевом иммунитете при колоректальном раке [30].
Дендритные клетки (DK) – это наиболее активные антигенпрезентирующие клетки. Их основные функциональные зоны – это региональные лимфоузлы [11]. Однако DK распределены и в периферических воспалительных тканях. При колоректальных раках зрелые DK распределены вдоль инвазивного края опухоли вместе с Т-клетками [32]. DK имеют важное прогностическое значение. A. R. Dadabayev et al. показали, что DK, экспрессирующие МНС II, в основном распределены в строме опухоли, и их большое содержание в опухоли связанно с более коротким сроком выживаемости [14], однако возможно, что эти DK могут быть незрелыми, поскольку зрелые DK и Т-клетки обычно не находятся в строме опухоли [28], а чрезмерная экспрессия молекул адгезии (ICAM–I) фибробластами в строме может нарушать функции DK.
Было показано, что низкое содержание перитуморальных макрофагов (CD68+) и интраэпителиальных CD8+ Т-клеток обратно взаимосвязано со стадией опухолей [13]. Это может быть следствием подавления системной иммунной супрессии при запущенных стадиях; и наоборот, недостаточная инфильтрация этих клеток может быть причиной метастазов.
Функция макрофагов может быть как противоопухолевой (М1), так и проопухолевой (М2) [20]. Фенотипический переход от M1 до M2 может быть под действием цитокинов, секретируемых опухолевыми клетками и лимфоцитами, так IFN-у стимулирует фенотипическую поляризацию макрофагов в M1, а IL-4, IL-10 и IL-13 в М2 [20].
Таким образом, анализ данных литературы выявил разнонаправленные мнения о роли локального иммунитета в патогенезе рака толстой кишки. Недостаточно данных о роли локального иммунитета в микроокружении опухоли при раке и полипах толстой кишки, и хронических колитах.
ЦЕЛЬ
Изучить локальный иммунитет при раке толстой кишки, аденоматозных полипах и поверхностных хронических колитах и оценить роль иммунокомпетентных клеток и цитокинов в канцерогенезе толстой кишки.
МАТЕРИАЛЫ И МЕТОДЫ
На клиническом материале 200 больных с заболеваниями толстой кишки (113 больных раком толстой кишки, 47 больных аденоматозными полипами толстой кишки, 40 больных поверхностным хроническим колитом) изучены в сравнительном аспекте локальные иммунологические механизмы канцерогенеза толстой кишки. Материалом исследования служили ткань опухоли, а также участки кишки на расстоянии 1–3 см от опухоли – перитумораль-ная зона и 7–10 см от опухоли – линия резекции, взятые интраоперационно. У больных аденоматозными полипами исследовали биопсийный материал ткани полипа, а также слизистую оболочку кишки отступая на 1–3 см и 7–10 см от полипа. При эндоскопическом исследовании проводили забор биопсийного материала больных поверхностным хроническим колитом. Иммунофенотипирование тканевых лимфоцитов (СD3+, СD3+СD4+, СD3+СD8+, CD16+ CD56+, СD19+, Т-лимфоциты с рецепторами сф и уб) оценивали с использованием моноклональных антител методом проточной цитофлюориметрии. Уровень цитокинов (TNF-а, IL-1, IL-2, IL-6, IL-8, IL-10, IL-1RA) определяли иммуноферментным методом. Статистическая обработка результатов исследования проведена с использованием пакета современных компьютерных программ STATISTICA 7.0 (StatSoft Inc., США) и MedCalc (версия 9.3.5.0).
РЕЗУЛЬТАТЫ
Оценка локального иммунного статуса при местно-распространенном раке толстой кишки показала, что содержание Т-хелперно-индукторных лимфоцитов (СD3+СD4+) в ткани опухоли было статистически достоверно выше на 45,0%. Соответственно в 1,8 раза и на 52,0% был выше индекс CD4+/CD8+ по сравнению с показателями условно здоровой ткани и пери-туморальной зоны (р<0,05), но снижено на 19% количество СD8+-клеток и В-лимфоцитов на 22,0% по сравнению с показателями условно здоровой ткани и на 43,0% относительно пери-туморальной зоны (р<0,05) (табл. 1). В перитуморальной зоне, напротив, было отмечено высокое содержание CD19+ клеток (на 36,0%), но также низкое количество цитотоксических клеток (CD8+) (на 19,0%) по сравнению с показателями по линии резекции (р<0,05) (табл. 1). По другим критериям достоверных отличий не обнаружено. Исследования локального иммунного статуса в различных отделах толстой кишки (ободочная (сигмовидная) и прямая) не выявили достоверных отличий.
В целом, местно-распространенный процесс характеризовался высоким содержанием туморинфильтрирующих Т-хел-перно-индукторных лимфоцитов (CD3+CD4+, CD3+CD4+/ CD3+CD8+) и низким эффекторных цитотоксических (CD3+CD8+ и CD19+) клеток. Однако, перитуморальная зона, возможно, сохраняла иммунный барьер за счет повышенного содержания туморассоциированных В (CD19+)-лимфоцитов по сравнению с интактной тканью.
Сравнительный анализ локальных иммунологических показателей у больных II и III стадией рака толстой кишки не выявил существенных различий, что подтверждает однонаправленность локальных иммунных механизмов при местно-распространенном раке.
Иные изменения были при раке толстой кишки с метастазами в печень. В ткани опухоли при местно-распространенном и метастатическом раке толстой кишки изменения были однонаправленные, т.е. процесс характеризовался высоким содержанием туморинфильтрирующих Т-хелперно-индукторных лимфоцитов (CD3+CD4+), но низким – цитотоксических (CD3+CD8+)
|
Таблица 1 . Иммунологические показатели в тканях кишки у больных местнораспространенным, метастатическим раком и полипами толстой кишки, % |
|||||||||
|
Субпопуляция лимфоцитов |
Местно-распространенный рак, n=73 перитумор. линия опухоль зона резекции |
Метастатический n=40 перитумор. опухоль зона |
рак, линия резекции |
полип |
Аденома, n=47 1–3 см от полипа |
7–10 см от полипа |
|||
|
CD3+ |
65,5±2,7 |
52,5±2,0 |
59,1±3,1 |
63,6±3,8 • |
41,1±3,2 |
56,9±3,6 |
77,8±3,4 |
57,6±3,3 * |
70,6±3,6 |
|
CD3+ CD4+ |
35,9±1,7 * |
24,9±1,7 |
24,7±1,5 |
34,2±2,8 * |
25,5±2,9 |
25,9±2,9 |
41,3±2,6*• |
24,9±3,8 |
31,8±3,2 |
|
CD3+ CD8+ |
29,2±1,7 * |
29,1±2,1 * |
36,1±2,5 |
24,0±3,3 |
19,8±2,8 * |
28,2±2,7 |
35,2±2,2 |
32,2±2,9 |
36,5±2,6 |
|
CD16+ CD56+ |
12,3±1,9 |
11,3±2,0 |
10,5±1,5 |
14,1±3,6 *• |
9,3±2,9 |
7,7±2,4 |
9,0±2,3 |
21,5±2,3* |
13,1±1,9 |
|
CD19+ |
18,6±2,0 * |
32,4±2,9 * |
23,7±2,4 |
26,2±2,4 *• |
43,5±3,4 * |
34,1±2,7 |
12,8±3,0 |
20,6±2,0 |
16,8±2,9 |
|
TСRсф |
42,8±5,1 |
31,9±3,6 |
36,1±4,3 |
33,2±4,1 |
32,9±3,9 |
33,6±3,6 |
21,9±2,2 |
17,3±2,1 |
16,3±2,6 |
|
TCRyd |
10,9±1,5 |
9,0±0,98 |
10,8±1,4 |
6,1±1,2 |
5,5±1,3* |
9,1±1,3 |
20,4±2,1 |
17,9±1,9* |
24,5±2,6 |
|
CD4+/ CD8+ |
1,7±0,2 * |
1,12±0,2 |
0,94±0,1 |
1,4±0,1 |
1,4±0,2 |
1,4±0,3 |
1,9±0,5 |
0,9±0,2 |
1,1±0,4 |
Примечание – статистически достоверно относительно линии резекции (7–10 см – условно-здоровая ткань): * – по критерию Стьюдента, р<0,05; • – по Z-критерию, р<0,05
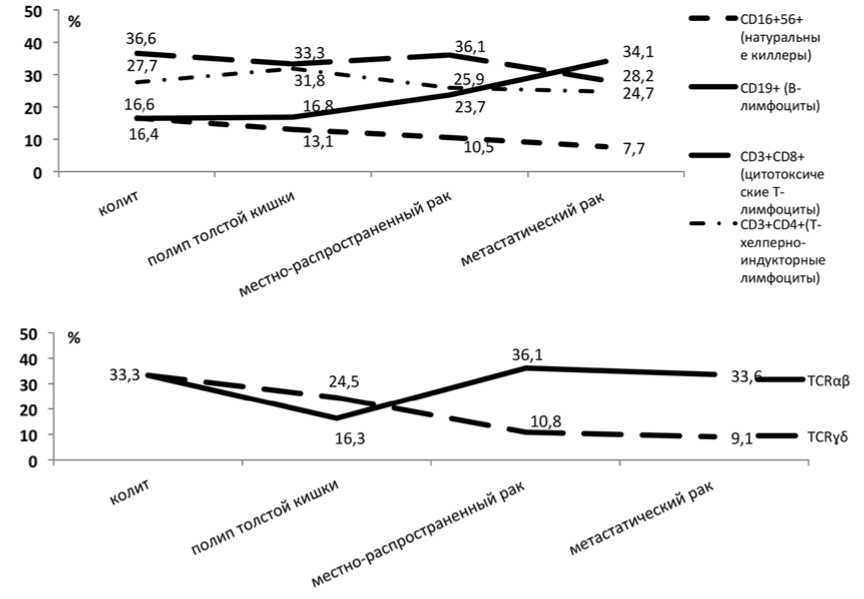
Рис. 1. Уровень субпопуляций лимфоцитов в условно-здоровых зонах
и В(CD19+) клеток. При метастазах отмечен значительно более высокий уровень туморинфильтрирующих натуральных киллеров. Перитуморальная зона характеризовалась сниженным количеством цитотоксических Т- (CD3+CD8+) клеток с рецепторами TCR ydи повышенным – В-клеток (табл. 1).
Оценка локального иммунного статуса аденомы показала однонаправленные изменения, как и при злокачественном процессе, но в отличие от рака в полипе было низкое содержание натуральных киллеров при повышенном уровне CD3+CD8+-лимфоцитов.
Микроокружение аденомы (1–3 см от полипа) характеризовалось, напротив, высоким уровнем NK-клеток (в 2 раза), но низким количеством Т(CD3+)-клеток и лимфоцитов с рецепторами TCR уб (на 18,0 и 27,0% соответственно) (р<0,05) (табл. 1).
Представлялось интересным изучить соотношение «условно-здоровых» тканей в исследуемых группах, т.е. выявить насколько опухолевый процесс затрагивает изменения непосредственно в иммунном микроокружении опухоли в сравнении с отдаленными участками кишки (рис.1).
Таблица 2 .
Уровень цитокинов в тканях кишки при полипах и раке толстой кишки
|
Цитокины |
Аденома, n=47 |
Аденокарцинома, n=113 |
||||
|
полип |
1–3 см |
7–10 см |
опухоль |
перитумор. зона |
линия резекции |
|
|
IL-2 |
34,97±8,01 |
33,4±5,8 1 |
61,5±9,5 |
17,4±3,031 |
6,9±1,56 |
5,34±0,87 |
|
TNF-a |
6,8±1,31 |
5,6±1,2 |
4,49±0,94 |
16,69±1,21 |
11,17±1,5 |
11,98±0,77 |
|
IL-6 |
20,4±8,6 |
24,5±6,9 |
39,24±9,4 |
197,9±25,921 |
72,2±17,32 |
54,41±10,6 |
|
IL-8 |
183,2±43,1 |
166,4±53,7 |
166,04±33,3 |
517,91±27,011 |
239,33±40,9 1 |
126,02±16,9 |
|
IL-10 |
21,6±3,3 |
13,4±2,8 |
17,0±2,8 |
7,56±2,14 |
5,92±1,49 |
8,02±2,72 |
|
IL1a |
44,5±6,0 |
49,4±6,02 |
59,2±8,1 |
268,12±36,51 |
82,24±11,95 |
101,13±14,2 |
|
IL-1RA |
3755,3±268,8 |
2335,3±39,1 |
2881,2±256,0 |
5652,2±258,41 |
3748,9±313,4 |
3774,2±394,8 |
Примечание – отличия статистически достоверны от показателей линии резекции (7–10 см от полипа или опухоли) по критерию Стьюдента, р<0,05
Найдено, что слизистая оболочка толстой кишки при поверхностном хроническом колите характеризовалась высоким уровнем натуральных киллеров, цитотоксических (CD3+CD8+) и Т-лимфоцитов с рецепторами yd, но угнетением В-клеточ-ного звена иммунитета. Обратная тенденция наблюдалась при раках. Полипы занимали промежуточное положение (рис. 1). Представляло особый интерес изучение тканевого цитокинового спектра. Цитокины, как известно, являются главными продуктами иммунокомпетентных клеток, которые, с одной стороны, влияют на функции этих клеток с усилением их противоопухолевой активности, а с другой – стимулируют рост опухоли.
Мы изучили уровень тканевых цитокинов (IL-2, TNF-a, IL-6, IL-8, IL-10, IL-1, IL-1RA) в опухоли и в окружающих тканях (табл. 2).
В основном все изученные цитокины в аденокарциноме имели высокий уровень, кроме IL-10. Так, содержание IL-2, IL-6, IL-8, IL-1a в ткани опухоли было выше в 2–4 раза, чем в перитуморальной зоне и в 3–5 раз по сравнению с зоной резекции. При этом в области линии резекции уровень IL-8 статистически достоверно был ниже в 2 раза по сравнению с перитуморальной зоной (табл. 2).
В полипе, а также вокруг него (1–3 см), снижено содержание IL-2 (на 43,0 и 44,0% соответственно, р<0,05), продуцентами которого являются Т-хелперно-индукторные лимфоциты. Несмотря на их высокое количество в аденоме, эти клетки, по всей вероятности, оказались функционально не состоятельны для реализации специфической иммунной защиты. Кроме того, в аденоме отмечен низкий уровень IL-6 (на 48,0%) и относительно высокий IL-1RA (р<0,05). Отмечено разнонаправленное содержание тканевого IL-10. Так, его уровень в доброкачественной опухоли был выше на 27,0%, а в 1–3 см от неё – ниже на 21,0%. Такая же тенденция наблюдалась и для IL-1RA – в опухоли его было выше на 30,0%, а в прилегающей зоне ниже на 19,0%. Таким образом, в ткани аденомы повышено содержание провоспали-тельных цитокинов (TNF-a, IL-8, IL-10, IL-1RA) (табл. 2).
Найденная прямая корреляционная зависимость между уровнем TNF-a в аденоме и в интактных тканях (r=0,72 по сравнению с 1–3 см, r=0,98 по сравнению 7–10 см, р<0,05) и между «условно здоровыми зонами» (r=0,57, р<0,05), демонстрирует, что продукция TNF- α в ткани аденомы может дистантно влиять на ее микроокружение.
Цитокиновый уровень в условно-здоровых тканях толстой кишки имел более низкие значения за исключением высокого содержания IL-2, IL-10 и IL-8 в слизистой оболочке при колите, продуцентами которых являются Т-лимфоциты, антигенпрезентирующие клетки, а также клетки эпителия кишечника.
ВЫВОДЫ
Таким образом, развитие злокачественного процесса при раке толстой кишки во многом определяется взаимовлиянием пула опухолевых и иммунокомпетентных клеток, продуктов их активности – цитокинов. Локальные иммунологические нарушения в пренеопластических тканях толстой кишки предопределяют патогенетическую инициацию рака толстой кишки. Микроокружение неоплазмы по иммунологическим параметрам является опухолевым полем, способствующим дальнейшему прогрессированию аденокарциномы толстой кишки, а при аденоматозных полипах определяет либо его злокачественную трансформацию, либо служит буферной зоной.
Список литературы Колоканцерогенез: онкоиммунология локальных изменений
- Давыдов, М. И. Онкология: учебник/М. И. Давыдов, Ш. Х. Ганцев.-М.: Геотар-Медиа, 2010.-920 с. 2.
- Ильинская, О. Н. Особенности культивируемой бактериальной микрофлоры кишечника при колоректальном канцерогенезе/О. Н. Ильинская//Креативная хирургия и онкология.-2011.-№ 4.-С. 114-117.
- Каприн, А. Д. Злокачественные новообразования в России в 2014 году (заболеваемость и смертность)/А. Д. Каприн, В. В. Старинский, Г. В. Петрова.-М.: МНИОИ им. П. А. Герцена филиал ФГБУ «НМИРЦ» Минздрава России, 2016.-250с.
- Кит О.И., Геворкян Ю.А., Никипелова Е.А., Франциянц Е.М. и др. Некоторые клинические особенности первичномножественного рака толстой кишки // Современные проблемы науки и образования. - 2013. - № 2. - С. 34. URL: http://www.science-education.ru/108-8681.
- Ривкин, В. Л. Сочетанная колоректальная патология/В. Л. Ривкин//Гастроэнтерология.-2012.-№ 2.-С. 50-51.
- Хаитов, Р. М. Новые данные о строении и функционировании иммунной системы желудочно-кишечного тракта/Р. М. Хаитов, Б. В. Пинегин//Анналы хирургической гепатологии.-2002.-Т. 2, № 2.-С. 105-110.
- Шапошников, А. В. Колоректальный рак. Канцерогенез и онкопревенция/А. В. Шапошников.-М.: Форте принт, 2015.-160 с
- Шелыгин, Ю.А., Молекулярно-генетическое исследование наследственной предрасположенности к разным формам полипоза толстой кишки/Ю. А. Шелыгин., B. Н. Кашников., С. А. Фролов//Колопроктология, научнопрактический журнал.-2013.-№ 1 (43).-С. 9-14
- Andersen, V. Colorectal cancer in patients with inflammatory bowel disease: Can we predict risk?/V. Andersen, Halfvarson, U. Vogel//World. Gastroenterology.-2012.-Vol.18, N31. P. 4091-4094
- Aziz, Q. Gut microbiota and gastrointestinal health: current concept and future directions/Q. Aziz et al.//Neurogastroenterol. Motil.-2013.-Vol.25.-P. 4-15
- Banchereau, J. Dendritic cells as therapeutic vaccines against cancer/J. Banchereau, A. K. Palucka//Nat Rev Immunol.-2005; 5: 296-306.
- Bruin, S. С. The role of clinical, pathological and molecular characteristics in colorectal cancer management / S. С. Bruin // Leiden University Repository.- 2013; 09:26. (// hdl.handle.net)
- Chiba, T. Intraepithelial CD8+ T-cell-count becomes a prognostic factor after a longer follow-up period in human colorectal carcinoma: possible association with suppression of micrometastasis/T. Chiba, H. Ohtani, T. Mizoi, Y. Naito, E. Sato, H. Nagura, A. Ohuchi, K. Ohuchi, K. Shiiba, Y. Kurokawa, S. Satomi//Br J Cancer.-2004; 91: 1711-1717.
- Dadabayev, A. R. Dendritic cells in colorectal cancer correlate with other tumor-infiltrating immune cells/A. R. Dadabayev, M. H. Sandel, A. G. Menon, H. Morreau, C. J. Melief, R. Offringa, S.H.van der Burg, C. Janssen-van Rhijn, N. G. Ensink, R. A. Tollenaar, C.J. van de Velde, P. J. Kuppen//Cancer Immunol Immunother.-2004; 53: 978-986.
- de Visser, K. E. Paradoxical roles of the immune system during cancer development/K.E. de Visser, A. Eichten, L. M. Coussens//Nat Rev Cancer.-2006; 6: 24-37.
- Derry, M. M. Identifying molecular targets of lifestyle modifications in colon cancer prevention/M. M. Derry, K. Raina, C. Agarwal, R. Agarwal//Frontiers in oncology.-2013.-Vol.3, art. 119.
- Diederichsen, A. C. Prognostic value of the CD4+/CD8+ ratio of tumour infiltrating lymphocytes in colorectal cancer and HLA-DR expression on tumour cells/A. C. Diederichsen, J. B. Hjelmborg, P. B. Christensen, J. Zeuthen, C. Fenger//Cancer Immunol Immunother.-2003; 52: 423-428.
- Galon, J. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome/J. Galon, A. Costes, F. Sanchez-Cabo, A. Kirilovsky, B. Mlecnik, C. Lagorce-Pages, M. Tosolini, M. Camus, A. Berger, P. Wind, F. Zinzindohoue, P. Bruneval, P. H. Cugnenc, Z. Trajanoski, W. H. Fridman, F. Pages//Science.-2006; 313: 1960-1964.
- Grizzi, F. Prognostic value of innate and adaptive immunity in colorectal cancer/F. Grizzi, P. Bianchi, A. Malesci, L. Laghi//World J Gastroenterol.-2013 January 14; 19(2) 174-184.
- Mantovani, A. Tumor-associated as prototypic type II polarized phagocyte population: role in tumor progression/A. Mantovani, P. Allavena, A. Sica//Eur. J. Cancer.-2004.-Vol/40, N11.-P. 1660-1667.
- McLean, M. H. The inflammatory microenvironment in colorectal neoplasia/M.H. McLean, G. I. Murray, K. N. Stewart, G. Norrie, C. Mayer, G. L. Hold, J. Thomson, N. Fyfe, M. Hope, N. A. Mowat, J. E. Drew, E. M. El-Omar//PLoS One.-2011; 6: e15366 DOI: 10.1371/journal.pone.0015366]
- Mei, Z. Tumor-infiltrating inflammation and prornosis in colorectal cancer: systematic review and meta-analysis/Z. Mei, Y. Liu, C. Liu, A. Cui, Z. Liang, G. Wang, H. Peng, L. Cui and C. Li//British Journal of Cancer.-2014; 110: 1595-1605.
- Menon, A. G. Down-regulation of HLA-A expression correlates with a better prognosis of colorectal cancer/A. G. Menon, H. Morreau, R. A. Tollenaar, E. Alphenaar, M. Van Puijenbroek, H. Putter, C. M. Janssen-Van Rhijn, C. J. Van De Velde, G. J. Fleuren, P. J. Kuppen//Lab Invest.-2002; 82: 1725-1733.
- Meresse, B. Innate T cell responses in human gut/B. Meresse, N. Cerf-Bensussan//Seminars in Immunology.-2009.-Vol.21.-P. 121-129.
- Nathan, С. Neutrophils and immunity: challenges and opportunities/С. Nathan//Nat Rev Immunol.-2006; 6: 173-182.
- Nosho, K. Tumour-infiltrating T-cell subsets, molecular changes in colorectal cancer, and prognosis: cohort study and literature review/K. Nosho, Y. Baba, N. Tanaka, K. Shima, M. Hayashi, J. A. Meyerhardt, E. Giovannucci, G. Dranoff, C. S. Fuchs, S. Ogino//J Pathol.-2010; 222:350-366 .
- Pages, F. Effector memory T cells, early metastasis, and survival in colorectal cancer/F. Pages, A. Berger, M. Camus, F. Sanchez-Cabo, A. Costes, R. Molidor, B. Mlecnik, A. Kirilovsky, M. Nilsson, D. Damotte, T. Meatchi, P. Bruneval, P. H. Cugnenc, Z. Trajanoski, W. H. Fridman, J. Galon//N Engl J Med.-2005; 353:2654-2666.
- Pagès, F. Immune infiltration in human tumors: a prognostic factor that should not be ignored/F. Pages, J. Galon, M. C. Dieu-Nosjean, E. Tartour, C. Sautès-Fridman, W. H. Fridman//Oncogene.-2010; 29: 1093-1102 .
- Sandel, M. H. Natural killer cells infiltrating colorectal cancer and MHC class I expression/M. H. Sandel, F. M. Speetjens, A. G. Menon, P. A. Albertsson, P. H. Basse, M. Hokland, J. F. Nagelkerke, R. A. Tollenaar, C.J. van de Velde, P. J. Kuppen//Mol Immunol.-2005; 42: 541-546.
- Schreiber, R. D. Cancer immunoediting: integrating immunity's roles in cancer suppression and promotion/R. D. Schreiber, L. J. Old, M. J. Smyth//Science.-2011; 331: 1565-1570.
- Sobin, L. H. Eds. TNMclassification of malignant tumours. 6th ed./L. H. Sobin, Ch. Wittekind -New York (NY): John Wiley & Sons. Inc.; 2002.
- Suzuki, A. Mature dendritic cells make clusters with T cells in the invasive margin of colorectal carcinoma/A. Suzuki, A. Masuda, H. Nagata, S. Kameoka, Y. Kikawada, M. Yamakawa, T. Kasajima//J Pathol.-2002; 196: 37-43.
- Tachibana, T. Increased intratumor Valpha24-positive natural killer T cells: a prognostic factor for primary colorectal carcinomas/T. Tachibana, H. Onodera, T. Tsuruyama, A. Mori, S. Nagayama, H. Hiai, M. Imamura//Clin Cancer Res.-2005; 11: 7322-7327.
- Tsuruyama, T. NKT cell infiltration in human colorectal cancer as a prognostic factor/T. Tsuruyama et al.//95th General Meeting of the Japanese Society of Pathology.-2006.
- Yanhong Shi, Zhenfeng Li, Wei Zheng et al., Changes of immunocytic phenotypes and functions from human colorectal adenomatous stage to cancerous stage: Update/Yanhong Shi, Zhenfeng Li, Wei Zheng et al.//Immunobiology 220 (2015) 1186-1196.


