Комбинация подходов точной массово-временной метки и мечения изотопом кислорода 18O для количественного анализа протеома мочи человека
Автор: Агрон И.А., Автономов Д.М., Кононихин А.С., Попов И.А., Мельник С.А., Мошковский С.А., Николаев Е.Н.
Журнал: Труды Московского физико-технического института @trudy-mipt
Рубрика: Молекулярная и биологическая физика
Статья в выпуске: 3 (11) т.3, 2011 года.
Бесплатный доступ
Масс-спектрометрические методы количественного анализа белков и пептидов преду- сматривают использование изотопных меток. В настоящей работе нами применялась простая и экономичная процедура мечения пептидов протеома мочи человека кисло- родом-18 путем гидролиза в воде H18 2 O. Количественный анализ с использованием 18O совмещали с полученной ранее базой данных точных массово-временных меток протеома мочи человека, что обеспечило высокую информативность метода без по- требности в тандемной масс-спектрометрии. В рамках актуальной задачи поиска и идентификации биомаркеров на основе сравнительного анализа экспрессии раз- личных генов был разработан метод расчета корректного отношения концентраций меченого и немеченого пептидов в биоматериале. Предложен способ коррекции ин- тенсивностей пиков в масс-спектрах, основанный на концепции усредненной (гипоте- тической) аминокислоты «аверагин». Возможность указанного подхода для приме- нения в протеомике продемонстирирована в модельных экспериментах.
Короткий адрес: https://sciup.org/142185772
IDR: 142185772
Текст научной статьи Комбинация подходов точной массово-временной метки и мечения изотопом кислорода 18O для количественного анализа протеома мочи человека
Введение. Для определения содержания различных белков в моче человека, в том числе клинически значимых, в последнее время часто используется протеомный анализ, основанный на масс-спектрометрии [1--4]. Возможность неинвазивного получения биоматериала мочи приводит к тому, что интерес к масс-спектрометрическому анализу ее белковых компонент для поиска биомаркеров заболеваний неуклонно растет [13]. Нами была ранее создана база данных точных массово-временных меток (АМТ) для протеома мочи человека [7]. Ожидаемым продолжением указанной работы является применение такой базы для сравнительного количественного анализа.
При использовании тандемной масс-спектрометрии в стандартных bottom-up или top-down подходах [5] идентификацию пептидов проводят по базе данных, содержащей последовательности белков. В то же время при использовании метода точных массово-временных меток [6] учитываются только точная масса гидролитического пептида белка и время его удержания в хроматографической колонке, а не массы осколков ионов (продуктов фрагментации ионов пептидов в масс-спектрометре). Идентификацию осуществляют по точным молекулярным массам пептидов и значениям времени хроматографического удержания с использованием предварительно созданной базы данных, включающих эти экспериментально определенные параметры. На первом этапе осуществляется наполнение базы данных информацией о протеоме биологического объекта, то есть характеристиками пептидных меток. Далее проводят поиск совпадений значений молекулярной массы и времени удержания в последующих экспериментах с данными, хранящимися в созданной ранее базе АМТ.
В использованной в данной работе базе точных массово-временных меток (AMT-БД), созданной нами по 90 экспериментам, содержатся метки для 1381 протеотипического (уникальных для белков, из которых они происходят) пептида, которые однозначно идентифицируют 437 белков [7].
Изотопные метки для попарного сравнения образцов начали разрабатываться с самого начала применения тандемной хромато-масс-спектрометрии (LC-MS/MS) для задач протеомики [8]. Принцип метода заключается в том, что в результате мечения пептиды в опытном и контрольном образцах дают пики в масс-спектрах, отстоящие друг от друга на несколько единиц массы. Ва- рианты меток конструируют таким образом, чтобы они не влияли на эффективность ионизации и времена хроматографического удержания. По отношению интенсивностей пиков соответствующих пептидов делают вывод об их относительном содержании в образцах.
Разработано несколько коммерчески доступных решений для проведения сравнительного количественного анализа протеомов. Примерами могут служить технологии ICAT (Isotope–Coded Affinity Tag [14] и ICROS (Isotope Coded Reduction Off of Chromatographic Support) [15]), в которых мечение производится по цистеиновому остатку. Более сложным способом является технология iTRAQ (Isobaric Tagging Reagents Amino-reactive Quantification), которая позволяет проводить количественный анализ сразу 4 образцов на уровне MS/MS анализа. Изобарные (имеющие одинаковые массы) метки в iTRAQ связываются с N-концевым остатком пептидной цепи. Одним из методов модификации для количественного анализа является гуанидирование лизинового остатка пептидов [16].
В данной работе для сравнительного количественного анализа протеомов использовано более простое и экономичное C-концевое ферментативное мечение изотопом кислорода 18O. Использование 18O-атома в качестве метки известно еще с работ Спирсона (Spirson) и Риттенберга (Rittenberg) [9], которые исследовали механизм ингибирования продуктов реакции гидролиза амидной связи химотрипсином. Они обнаружили, что инкубация карбобензоксифенилаланина с химотрипсином в H128O приводит к включению изотопа атома кислорода 18 O в карбоксигруппу карбобензоксифенилаланина. При применении 18O/16O изотопного мечения получаются химотриптические пептиды, меченые по С-концу независимо от их аминокислотной последовательности. О.А. Миргородская с соавторами [10] использовали в своих работах протеолитическое расщепление с участием 18O применительно к количественной протеомике. Благодаря ряду преимуществ, такими как несложная химия и сдвиг массы на строго определенную величину, 18 O/16 O изотопное мечение стало популярным методом в количественной протеомике. Однако из-за слишком малой разницы масс между изотопами (всего 2 или 4 Да, рис. 1--2) этот подход применяется в сочетании с масс-спектрометрами сверхвысокого разрешения (порядка 500 000).
mix_1 #6035 RT: 65.31 AV: 1 NL: 1.70E5
T: RMS + p ESI Full ms [350.00-1600.00]
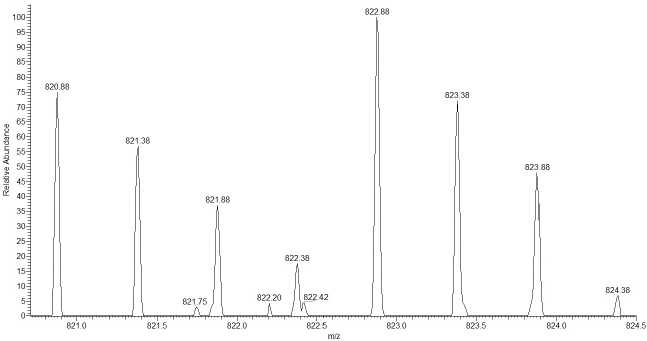
Рис. 1. Изображение в браузере стандартного про- граммного обеспечения XCalibur прибора Thermo
Fisher LTQ-FT наложившихся распределений в
mix3#6488 RT: 66.29 AV: 1 NL: 2.41E6
T: RMS + p ESI Full ms [350.00-1600.00]
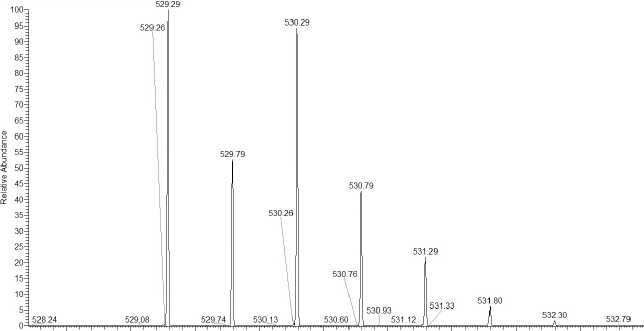
528.5 529.0 529.5 530.0 530.5 531.0 531.5 532.0 532.5
Рис. 2. Изображение в браузере стандартного программного обеспечения XCalibur прибора Thermo Fisher LTQ-FT наложившихся распределений в
спектре, соответствующих немеченому и двукратно меченным пептидам
спектре, соответствующих немеченому, однократно и двукратно меченным пептидам
В самом начале использования этого метода протеолитическое расщепление белков проводили в присутствии H 1 2 8 O [17]. Со временем была разработана оптимизированная процедура, в соответствии с которой протеолиз проводят в обычной воде, а после лиофилизации смесь пептидов растворяют в буфере в H 1 2 8 O [18]. При этом в присутствии трипсина два атома 16 O на С-кон-це пептида замещаются двумя атомами 18 O. Условия для каждого из этапов в данном процессе могут быть оптимизированы независимо друг от друга.
Как сказано выше, для данной работы нами был выбран метод мечения кислородом 18 O в реакции обмена атомов кислорода С-концевой карбоксильной группы пептида в присутствии трипсина. Преимуществами этого подхода являются отсутствие специфичности мечения по аминокислотам, а также одинаковое время удержания в хроматографической колонке меченого и немеченого пептидов. При использовании мечения 18O важным аспектом обработки результатов является коррекция интенсивностей пиков при наложении изотопных распределений. Для этого мы применили модифицированную концепцию виртуальной аминокислоты «аверагин» [11].
В запутанной картине масс-спектра, изобилующего пиками, важно выделить моноизотоп-ный пик, от интенсивности которого следует исходить при всех сравнительных количественных расчетах. Для выделения моноизотопного пика в изотопном распределении пептида на основе статистической оценки встречаемости аминокислот в белковой базе данных группой МакЛафферти была предложена виртуальная аминокислота «аверагин» с брутто-формулой C 4 , 9384 H 7 , 7583 N i , 3577 O i , 4773 S o , 04i7 и молекулярной массой 111 , 1237 [11]. Зная молекулярную массу пептида, можно виртуально сгенерировать аминокислотную последовательность, состоящую только из таких аверагинов, и построить теоретическое изотопное распределение, ошибка вычисления массы моноизотопного иона в котором составит менее 10 миллионных долей относительно реального значения массы молекулы. Определение моноизотопного пика в экспериментально полученном спектре проводят путем поиска наилучшего совпадения его с теоретическим спектром — спектром пептида, состоящего только из аверагинов.
Целью данной работы была разработка метода количественного анализа белков в протеоме мочи, чувствительного и быстрого за счет применения подхода точной массово-временной метки, а также точного за счет внедрения метки 18 O с последующей корректировкой интенсивностей пиков меченых пептидов.
Материалы и методы. Получение образцов мочи
Использовали образцы мочи от 25 мужчин (от 18 до 35 лет). При выборе субъектов исключали пациентов с урогенитальной патологией, патологией почек, артериальной гипертензией, диабетом, с предшествующим лечением диуретиками, избыточным потреблением жидкости. Сбор мочи осуществляли в стерильные полипропиленовые контейнеры.
Получение пептидов, меченных 18 O
Свежесобранную мочу центрифугировали при 1000 g в течение 15 мин при 4 ° C для удаления клеток и кристаллов солей («осветление»), затем осветленную мочу в объеме 15 мл наносили на фильтр Amicon Ultra 3000 MWCO подходящего размера и центрифугировали при 4 ° C в рекомендуемом производителем фильтров режиме (1000 g) до остаточного объема 1 мл (∼ 1 час). Сконцентрированную мочу упаривали при 45 ° C в вакуумном испарителе до сухого остатка, полученный остаток растворяли в 200 мкл буфера для восстановления, содержащем 6 М гуанидинхло-рида, 0 , 5 М Tris-HCl, pH 8 , 5 , 2 , 5 мМ ЭДТА. В пробу добавляли DTT до конечной концентрации 100 мМ, продували пробирку инертным газом и ставили в термостат при 37 ° C на 3 часа.
Образец охлаждали до комнатной температуры и добавляли буфер для алкилирования в количестве 1 / 10 от объема образца, продували пробирку инертным газом и ставили в защищенное от света место на 45 минут. Буфер для алкилирования включал в себя 6 М гуанидинхлорида, 1 , 5 М Tris-HCl, pH 8 , 5 , 2 , 5 мМ ЭДТА и 0 , 55 M свежерастворенного йодацетамида. По окончании алкилирования в пробирку добавляли ледяной ацетон, содержащий 1 % ТФУ, из расчета 4 объема ацетона на 1 объем образца. Пробу оставляли на ночь при — 20 ° C для осаждения белков. Затем образец центрифугировали при 4 ° C в течение 15 мин при 20 000 g, полученный осадок белка промывали избытком ледяного ацетона ( 1 мл) с последующим центрифугированием при тех же режимах. Промывку повторяли второй раз ледяным этанолом. Полученный после последней промывки осадок белка слегка подсушивали на воздухе и растворяли в буфере для трипсинолиза ( 100 мМ бикарбонат аммония, pH 7 , 5 - 8 , 0 ) до концентрации белка 1 мг/мл (~ 800 мкл).
Раствор белка переносили в новую чистую пробирку в необходимом объеме и добавляли трипсин в массовом отношении 1:100 к массе белка. Пробу инкубировали при 37 ° C , через 4 часа добавляли еще одну аликвоту трипсина (1:200 масс./масс.) и оставляли при 37 ° C на ночь. Гидролизат центрифугировали при 20 000 g в течение 20 мин, надосадочную жидкость, содержащую пептиды, отбирали в новую пробирку и при необходимости разделяли на нужное количество аликвот.
Для мечения изотопом кислорода 18 O раствор пептидов сушили в вакуумном испарителе, сухой осадок растворяли в «тяжелой» воде (H28O) до концентрации пептидов 0,5-1 мг/мл pH раствора, медленно доводили до 4,5-5,0 с помощью малого количества 10% раствора уксусной кислоты в «тяжелой» воде. К пробе добавляли аликвоту трипсина в отношении 1:200 по массе, причем маточный раствор трипсина готовили специально для обменной реакции в концентрации 200 нг/мкл в 50 мМ растворе уксусной кислоты в «тяжелой» воде. Обменную реакцию ставили на ночь при 37°C, по окончании которой реакцию не ингибировали. Пробы замораживали при -20°C.
При необходимости получения контроля с одной из аликвот пептидов после трипсинолиза проводили те же манипуляции, что и с подлежащей мечению, с той лишь разницей, что использовали обычную воду.
Во время тестовых экспериментов в пробах был обнаружен эффект обратного обмена: из-за остаточной активности трипсина при смешивании меченого и немеченого образцов происходил обмен кислорода-18 на C-конце на кислород-16, присутствующий в воде, в которой разведены образцы. Для предотвращения обратного обмена (см. рис. 2) добавляли ингибитор AEBSF (10 % об./об.).
Хромато-масс-спектрометрический эксперимент
Для разделения смесей методом жидкостной хроматографии использовали хроматограф Agilent 1100, снабженный колонкой с внутренним диаметром 75 мкм с обращенной фазой Reprosil–Pur C 183 мкм и порами 100 ˚A. В качестве растворителей использовали воду и ацетонитрил (для ВЭЖХ, «Thermo Fisher», США) с линейным градиентом от 10 % -го содержания ацетонитрила до 90 % -го. Масс-спектры измеряли на масс-спектрометре ионного циклотронного резонанса, совмещенном с линейной ионной ловушкой Thermo LTQ-FT (Thermo, США). Измерения масс-спектров проводили в диапазоне масс 300-2000 m / z . Для предотвращения обратного обмена образцы (меченый и контрольный немеченый) смешивали и вводили в хроматограф непосредственно перед экспериментом (это допустимо, поскольку скорость обмена прямой и обратной реакций измеряется часами).
Обработка результатов эксперимента
Выделение моноизотопных пиков однозарядных ионов
Файл масс-хроматограммы, полученной без использования тандемной масс-спектрометрии на приборе ионного циклотронного резонанса, обрабатывали программой Decon2ls [12] для выделения моноизотопных однозарядных ионов пептидов и определения их масс и времен удержания в хроматографической колонке с учетом пиков пептидов, меченных кислородным изотопом 18 O.
После обработки спектров проводили нормировку значений времени удержания по массам пептидов [19]. Также учитывалась последовательность выхода пептидов из колонки.
Поиск по AMT-базе
Далее проводили два цикла поиска по базе точных массово-временных меток: стандартный поиск и поиск по базе с массами, сдвинутыми на 4 Да (удвоенная разница масс между 18 O и 16 O). Под стандартным поиском подразумевается поиск в AMT-базе по сочетанию нормированного времени удержания и массы пептида в хроматограмме без использования тандемной масс-спектрометрии (точность по массам составила 10 миллионных долей, а по значениям времени удержания — 2 % от длительности хроматограммы).
Объединение результатов поиска
Поскольку эффективность ионизации и времена удержания на гидрофобно-обращенной хроматографической колонке меченого и немеченого пептидов одинаковы, то возможно произвести сопоставление обоих результатов поиска по времени удержания и аминокислотной последовательности пептида: по результатам поиска выбирают те пептиды, которые имеют одну и ту же последовательность (идентифицированную по AMT-базе) и одинаковое время удержания на хроматографической колонке.
Корректировка интенсивностей пиков
Малая разница по массам (порядка 2 или 4 Да) между одно- и двукратно меченным и немеченым пептидами создает сложность корректной оценки интенсивностей: изотопные распределения немеченого и одно- и двукратно меченных пептидов накладываются, то есть видимая интенсивность в спектре не соответствует реальной интенсивности моноизотопных пиков одно- и двукратно меченных пептидов (рис. 2).
Для решения этой проблемы была разработана процедура коррекции, основанная на использовании описанной выше теоретической аминокислоты «аверагин» [11], элементный состав которой соответствует усредненному элементному составу всего множества белков в протеоме человека (альтернативным является подход, в котором для каждого пептида в базе точных массовых меток-времен удержания имеется запись, содержащая информацию о распределении интенсивностей пиков изотопных модификаций в масс-спектрах). В принятой нами процедуре для каждого пептида, точнее, его массы, записывается аминокислотная последовательность, состоящая только из аверагинов (C4,9384 H7,7583 N1,3577 O1,4773 S0,0417), то есть приблизительный элементный состав соединения (пептида). По элементному составу можно построить теоретический масс-спектр данного соединения. В расчете учитываются атомы углерода, азота, кислорода и серы. Моделировали спектры, соответствующие трем пептидам (немеченому и двум меченым), за единицу принимали интенсивность моноизотопного пика немеченого пептида и последовательно из интенсивности моноизотопного пика однократно меченого пептида вычитали интенсивность пика немеченого пептида, содержащего два углерода 13C, а затем также вычитали интенсивность однократно меченного пептида, содержащего два углерода 13C, из интенсивности моноизотопного пика двукратно меченного.
Следующая формула описывает корректировку интенсивности пика однократно меченного пептида за счет вычитания из его интенсивности значения интенсивности пика, соответствующего пептиду, содержащему два углерода 13 C:
ab2 = ab2_vis - (ab0/2(mw/111,1237 * 4,9384 + mw/111,1237 * 1,3577/2,97+ +mw/111,1237 * 1,477з/5,5)((mw/111,1237 * 4,9384 + mw/111,1237 * 1,3577/2,97+ +mw/111,1237 * 1,4773/5,5) - 1)(0,0110/0,9890)2), где ab0, ab2 — интенсивности пиков немеченого и меченого пептидов, mw — молекулярная масса пептида, ab2_vis — видимая интенсивность моноизотопного пика однократно меченного пептида; 111,1237 — молекулярная масса аминокислоты аверагин, 4,9384; 1,3577; 1,4773 — количество атомов углерода, азота, кислорода в одной аминокислоте аверагин.
2 , 97 и 5 , 5 — коэффициенты, показывающие, во сколько раз в природе ниже содержание изотопа 15 N и 18 O, чем 13 C.
Выщеописанный подход был выбран по причине того, что использование аминокислоты «аве-рагин» позволяет значительно сократить время обработки спектров (стандартное время обработки 25--30 минут на персональном компьютере, который имеется в научной или клинической лаборатории) для случаев отсутствия пептида в банке данных. Сокращение времени обработки обусловлено тем, что удается избежать использования SQL-запросов SELECT...JOIN (когда запрос JOIN используется для объединения результатов по запросу SELECT из двух сторонних таблиц, каждая из которых содержит до сотни тысяч строк). Также время сокращается на том, что не нужно для каждого пептида строить изотопное распределение как произведение биномиальных распределений. Стоит отметить, что изначально концепция аминокислоты «аверагин» была разработана для деизотопирования больших пептидов и белков, но впоследствии использование данного подхода было расширено [12] (рис. 3, где отражена в том числе погрешность метода).
Аналогичным образом осуществляется коррекция интенсивностей пиков для двукратно меченных пептидов.
Результаты и их обсуждение. В результате исследования была разработана схема для количественного анализа белков протеома мочи, приведенная на рис. 3.
Схема сравнительно-количественного анализа
В качестве стандарта для сравнительно-количественного анализа брали смесь гидролизатов белковых фракций, выделенных из смеси образов мочи, собранных у 25 людей (далее — эталонный образец). Пробоподготовку проводили по одному протоколу для двух аликвот эталонного образца с тем отличием, что один из образцов на последней стадии метили 18 O.
Далее проводили смешивание двух образцов — меченого эталонного образца и немеченого контрольного образца. Затем пробы анализировали на масс-спектрометре ионного циклотронного резонанса с преобразованием Фурье без использования тандемной масс-спетрометрии.
Файлы, содержащие масс-хроматограммы, обрабатывали, выделяя моноизотопные однозарядные пики ионов, и идентифицировали пептиды по AMT-базе, полученной ранее [7]. Вычисляли
8 Молекулярная и биологическая физика ТРУДЫ МФТИ. — 2011. — Том 3, № 3 отношение интенсивностей пиков немеченого пептида и суммы интенсивностей пиков одно- и двукратно меченных пептидов, обнаруженных в одном спектре. Во время мечения возможно встраивание на C-конце пептида (в группу COO-) одного или двух кислородов 18 O в зависимости от pH среды. Несмотря на то, что температура, время и pH в течение пробоподготовки строго контролировались, не удалось достигнуть 100 % эффективности встраивания двух атомов кислорода (рис. 2).
Модельный эксперимент
Для иллюстрации принципиальной работоспособности метода, то есть для определения ошибок метода, диапазона применимости, закономерностей систематического нестопроцентного мечения, был проведен модельный эксперимент на контрольном образце, в рамках которого определены ошибки метода и диапазон применимости, проведена статистическая обработка для определения зависимостей систематического недомечения.
В модельном эксперименте исследовались образцы, представляющие собой смесь двух образцов, один из которых был помечен в присутствии трипсина кислородом-18.
В каждом из трех экспериментов идентифировано более 150 пептидов [7].
После чего для любых двух различных, случайно выбранных и идентичных по условиям экспериментов, пептидов рассчитано отношение интенсивностей пиков, соответствующих немеченым и меченым пептидам. Результаты этого модельного эксперимента продемонстрировали высокую воспроизводимость и низкую ошибку (рис. 4).
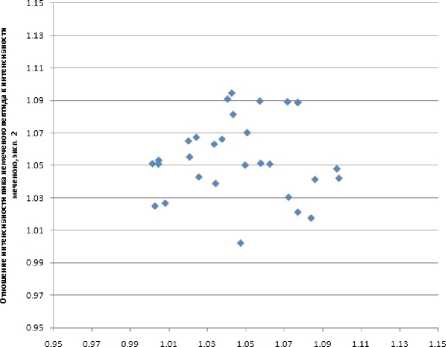
Отношение интенсивности пика немеченого пептида к интенсивности меченого.
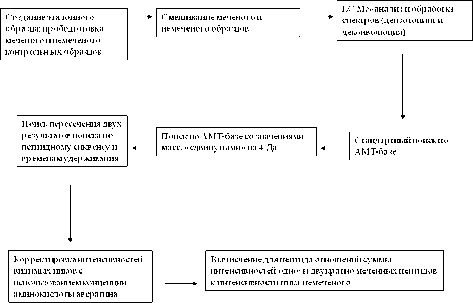
Рис. 3. Разработанная схема эксперимента для ко-
ис. . азраотанная схема эксперимента для ко
Рис. 4. Степень мечения пептидов в двух иден-личественного анализа протеома мочи тичных LC-MS-экспериментах (на каждой оси — отношение немеченого к меченому после корректировки; точка — один и тот же пептид в обоих экспериментах)
Среднее отклонение от единицы (пропорции смешивания меченого и немеченого образцов) составило порядка 4 , 5 % (рис. 4). Эта величина определяет погрешность разработанного метода.
Также в ходе статистической обработки экспериментов было выявлено отсутствие зависимости между степенью мечения и длиной пептида (продукта белкового гидролиза ферментом трипсином), степенью мечения и кислотностью N-концевой аминокислоты (в обоих случаях не выявлено никакой связи этих двух параметров пептидов со степенью мечения; коэффициенты корреляции в обоих случаях около нуля).
Выводы. Разработан высокопроизводительный метод количественного исследования протео-ма мочи с использованием существующей базы данных точных массово-временных меток протео-ма [7] и процедуры мечения изотопом кислорода-18. Разработана методика коррекции интенсивностей в интерферирующих масс-спектрах изотопных кластеров меченых и немеченых пептидов на основе концепции аминокислоты «аверагин». Проведена серия экспериментов по измерению и обработке результатов измерений модельных смесей. Предложен новый способ поиска по базе данных точных массово-временных меток для пептидов, меченных изотопом 18 O, разработана
ТРУДЫ МФТИ. — 2011. — Том 3, № 3 Молекулярная и биологическая физика 9 процедура корректировки интенсивностей пиков меченых пептидов посредством моделирования теоретических изотопных распределений пептидов, состоящих из аминокислот аверагин.
Работа выполнена при поддержке РФФИ (гранты 10-04-13306-РТ_оми, 09-04-00725-а, 09-03-92500-ИК_а; CRDF RUС1-2941-МO-09; Федеральная целевая программа «Научные и научно-педагогические кадры инновационной России» на 2009--2013 годы ГК 14.740.11.0755, 16.740.11.0369; Программа Президиума РАН «Фундаментальные науки — медицине»).
Список литературы Комбинация подходов точной массово-временной метки и мечения изотопом кислорода 18O для количественного анализа протеома мочи человека
- Кнорре Д.Г., Мызина С.Д. Биологическая химия. -М.: Высшая школа, 2003.
- Clarke W., Silverman B.C., Zhang Z., Chan D.W., Klein A.S. and Molmenti E.P. Characterization of Renal Allograft Rejection by Urinary Proteomic Analysis//Ann. Surg. -2003. -V. 237, N 5. -P. 660-665.
- Kageyama S., Isono T., Iwaki H., Wakabayashi Y., Okada Y., Kontani K., Yoshimura K., Terai A., Arai Y. and Yoshiki T. Identification by Proteomic Analysis of Calreticulin as a Marker for Bladder Cancer and Evaluation of the Diagnostic Accuracy of Its Detection in Urine//Clinical Chemistry. -2004. -V. 50. -P. 857-866.
- Rehmana I., Azzouzia A.R., Cattoa J.W.F., Allenb S., Crossc S.S., Feeleyd K., Meuthe M., Hamdya F.C. Proteomic analysis of voided urine after prostatic massage from patients with prostate cancer: a pilot study//Urology. -2004. -V. 64, N 6. -P. 1238-1243.
- Bogdanov B. and Smith R.D. Proteomics by FTICR mass spectrometry: top down and bottom up//Mass Spectrometry Reviews. -2005. -V. 24. -P. 168-200.
- Conrads T.P., Anderson G.A., Veenstra T.D., Pasa_Tolic L. and Smith R.D. Quantitative analysis of bacterial and mammalian proteomes using a combination of cysteine affinity tags and 15N-metabolic labeling//Anal. Chem. -2001. -V. 72. -P. 3349-3354.
- Agron I.A., Avtonomov D.M., Kononikhin A.S., Popov I.A., Moshkovsky S.A., Nikolaev E.N. Accurate mass tag retention time database for urine proteome analysis by chromatography-mass spectrometry//Biochemistry. -2010. -V. 75, N 5. -P. 636-641.
- Kopylov A.T., Zgoda V.G. The methods of quantitative proteomics//Biochemistry. -2008. -V. 2, N 1. -P. 28-46.
- Spirson D.B. and Rittenberg D. Labeling of peptides during hydrolysis//Nature. -1951. -V. 167. -P. 484-487.
- Mirgorodskaya O.A., Kozmin Y.P., Titov M.I., Korner R., Sonksen C.P., and Roepstoroff P. Quantitation of peptides and proteins by matrix-assisted laser desorption/ionization mass spectrometry using 18O-labeled internal standards//Rapid Comm. Mass Spectrom. -2000. -V. 14. -P. 1226-1232.
- Senko M.W., Beu S.C. and Mc Lafferty F.W. Determination of monoisotopic masses and ion populations for large biomolecules from resolved isotopic distributions//Journal of the American Society for Mass Spectrometry. -1995. -V. 6. -P. 229-233.
- Jaitly N., Mayampurath A., Littlefield K., Adkins J.N., Anderson G.A. and Smith R.D. Decon2LS: An open-source software package for automated processing and visualization of high resolution mass spectrometry data//BMC Bioinformatics. -2009. -V. 10. -P. 87.
- Sreekumar A., Poisson L.M., Rajendiran T.M., Khan A.P., Cao Q., Yu J., Laxman B., Mehra R., Lonigro R.J., Li Y., Nyati M.K., Ahsan A., Kalyana-Sundaram S., Han B., Cao X., Byun J., Omenn G.S., Ghosh D., Pennathur S., Alexander D.C., Berger A., Shuster J.R., Wei J.T., Varambally S., Beecher C., Chinnaiyan A.M. Metabolomic profiles delineate potential role for sarcosine in prostate cancer progression//Nature. -2009. -V. 457. -P. 910-914.
- Gygi S.P., Rist B., Gerber S.A., Turecek F., Gelb M.H., Aebersold R. Quantitative analysis of complex protein mixtures using isotope-coded affinity tag//Nat. Biotechnol. -2009. -V. 17. -P. 994-999.
- Shen M., Guo L., Wallace A., Fitzner J., Eisenman J., Jacobson E., Jhonson R.S. Isolation and isotope labeling of cysteine-and methionine-containing tryptic peptides//Mol. Cell. Proteomics. -2003. -V. 2. -P. 315-324.
- Warwood S., Mohammed S., Cristea I.M., Evans C., Whetton A.D., Gaskell S.J. Guanidination chemistry for qualitative and quantitative proteomics//Rapid Comm. Mass Spectrom. -2006. -V. 20. -P. 3245-3256.
- Yao X., Freas A., Ramirez J, Demirev P.A., Fenselau C. Proteolytic 18O labeling for comparative proteomics: model studies with two serotypes of adenovirus//Anal Chem. -2001. -V. 73. -P. 2836-2842.
- Yao X., Afonso C., Fenselau C. Dissection of proteolytic 18O labeling: endoprotease-catalyzed 16O-to-18O exchange of truncated peptide substrates//J. Proteome Res. -2003. -V. 2. -P. 147-152.
- Avtonomov D.M., Agron I.A., Kononikhin A.S., Popov I.A. and Nikolaev E.N. A New Method for Normalization of the Peptide Retention Times in Chromatographic/Mass-Spectrometric Experiments//Russian Journal of Bioorganic Chemistry. -2011. -V. 37, N 2. -P. 146-150.


