Комбинирование трансуретральной резекции и HIFU-аблации простаты при лечении локализованного рака
Автор: Попков В.М., Фомкин Р.Н., Блюмберг Б.И., Шатылко Т.В., Седова Л.н, Абрамова Э.П.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Урология
Статья в выпуске: 3 т.10, 2014 года.
Бесплатный доступ
Цель: оценить результаты лечения пациентов с локализованной формой рака простаты при комбинации трансуретральной резекции (ТУРП) и HIFU-аблации. Материал методы. С февраля 2009 г. по февраль 2014 г. 100 больных с локализованной формой рака простаты были отобраны для проспективного исследования: 26 пациентов вошли в группу HIFU и 74 в группу комбинированного лечения (ТУРП+HIFU). Критериями отбора для HIFU-аблации были локализованный рак простаты, по поводу которого ранее не осуществлялось лечения, и уровень простатоспецифического антигена на момент постановки диагноза 15 нг/мл и менее. Все пациенты, соответствовавшие этим критериям, рассматривались как кандидаты для лечения и включения в анализ. Надир и стабильность PSA, гистологическое заключение, IPSS, качество жизни и осложнения оценивались во время послеоперационного наблюдения. Результаты. Отмечено статистически значимое влияние комбинации ТУР+HIFU на срок трансуретрального дренирования мочевого пузыря (медиана 40 дней против 7 дней), частоту недержания (15,4% против 6,9%), инфекции мочевыводящих путей (47,9% против 11,4%) и изменение IPSS в послеоперационный период (в среднем 8,91 против 3,37). В короткий период наблюдения не фиксировалось значительных изменений по отношению к эффективности: в группе HIFU частота повторных сеансов составила 25%, в группе ТУР/HIFU 4%. Заключение. HIFU-терапия — это современный, минимально инвазивный метод лечения рака простаты. Комбинация трансуретральной резекции и HIFU-аблации существенно снижает частоту осложнений, связанных с лечением. Ведение пациента после комбинированной ТУРП и HIFU-аблации сравнимо с ведением пациента после обычной ТУРП.
Высокоинтенсивный сфокусированный ультразвук (hifu), лечение, простат-специфический антиген, рак простаты, трансуретральная резекция (турп)
Короткий адрес: https://sciup.org/14917983
IDR: 14917983
Текст научной статьи Комбинирование трансуретральной резекции и HIFU-аблации простаты при лечении локализованного рака
-
1Введение. Локализованный рак простаты (РП) диагностируется, как правило, у пожилых пациентов. Эти пациенты часто имеют более или менее выраженную сопутствующую патологию, в том числе и аденому простаты в сочетании со злокачественным поражением этого органа [1]. При выполнении радикальной простатэктомии решаются одновременно две задачи: удаление злокачественной опухоли и устранение риска нарушения мочеиспускания, связанного с гиперплазией простаты [2]. Для менее инвазивных методов лечения, таких, как брахитерапия, пациенты с обструктивными симптомами или ранее подвергшиеся трансуретральной резекции простаты не являются подходящими кандидатами [3]. При рассмотрении для них возможности выполнения аблации опухоли высокоинтенсивным фокусированным ультразвуком без трансуретральной резекции простаты следует учитывать, что пациенты с ин-фравезикальной обструкцией имеют впоследствии существенный риск длительной (более 6 недель) задержки мочеиспускания [4]. При монотерапии HIFU имеется слишком высокая вероятность обструктивных осложнений, вплоть до острой задержки мочи. Инфравезикальная обструкция в ближайший послеоперационный период после HIFU-аблации является непосредственным результатом отека тканей простаты вследствие их коагуляции. После резорбции отека задержка мочеиспускания может продолжиться из-за отхождения тканевого детрита [5]. Чтобы произвести оценку влияния ТУРП, мы выполняли комбинированную ТУР/HIFU пациентам с локализованным раком простаты и сравнивали профиль осложнений в совокупности с эффективностью лечения у них с аналогичной группой пациентов, которым произведена только HIFU-аблация.
Цель исследования: снижение риска пролонгированной HIFU-ассоциированной задержки мочеиспускания с помощью предварительной трансуретральной резекцией простаты в рамках одного сеанса лечения.
Материал и методы . С февраля 2009 г. по февраль 2011 г. 100 больных с локализованной формой рака простаты были отобраны для проспективного исследования: 26 пациентов вошли в группу HIFU и 74 в группу комбинированного лечения (ТУРП+HIFU). У всех больных РП был диагностирован при трансректальной биопсии, как минимум, из 12 точек. Выполнены магниторезонансная томография и остеосцинтиграфия для стадирования и исключения наличия метастазов в кости и лимфатические узлы.
Критериями исключения являлись: ожидаемая продолжительность жизни менее 5 лет, высокий анестезиологический риск (American Society of Anesthesiologists Class >3), Eastern Cooperative Oncology Group (ECOG) — статус (общее состояние) >2, наличие в настоящий момент или в анамнезе колоректального рака или воспалительных заболеваний прямой кишки, предшествующая ампутация прямой кишки, предшествующая брахитерапия, наличие ректальной фистулы в анамнезе. Все пациенты до HIFU не получали гормональную либо лучевую терапию. Риск пациентов был оценен согласно критериям D’Amico et al. и включал в себя дооперационный уровень общего простатоспецифического антигена (ПСА), клиническую стадию и сумму баллов по шкале Глисона [6].
Критериями отбора для HIFU-аблации были локализованный рак простаты, по поводу которого ранее не осуществлялось лечения, и уровень простатоспецифического антигена на момент постановки диагноза 15 нг/мл и менее. Все пациенты, соответствовавшие этим критериями, рассматривались как кандидаты для лечения и включения в анализ.
Надир и стабильность PSA, гистологическое заключение, IPSS, качество жизни и осложнения оценивались во время послеоперационного наблюдения. Пациенты, до HIFU получавшие гормонотерапию на протяжении более 6 месяцев, не были включены в исследование. Во всех сеансах HIFU-аблации использовалась частота 3 МГц и импульсы длительностью 5 секунд. Симптомы со стороны мочеиспускания оценивались с помощью опросника IPSS до лечения и через 3 месяца после него. Во время последующего наблюдения уровень PSA определялся каждые 3 месяца на протяжении первого года, а в последующем каждые 6 месяцев. Уровень PSA считался стабильным при его соответствии определению Штутгарта. Контрольные биопсии выполнялись через 6 и 12 месяцев после лечения, а также в случае повышения уровня PSA. Любой биоптат с обнаруженными в нем после HIFU клетками рака давал основание включить пациента в группу пациентов с положительной биопсией.
HIFU-аблация простаты проводилась на аппарате «Ablatherm Integrated Imaging»® (EDAP TMS, Франция). Эта система включает в себя операционный стол, УЗ-генератор, охлаждающую систему и УЗ-сканер, используемый для сканирования и визуализации опухоли. Энергия фокусированного ультразвука доставляется в ткани с помощью ректального зонда, который содержит визуализирующий и терапевтический волновой преобразователь. Высокоэнергетические ультразвуковые волны проходят через стенку прямой кишки и фокусируются на предста- тельной железе, что приводит к интенсивному нагреву и коагуляции ее ткани в фокальной зоне. Каждый импульс создает участок повреждения, который имеет протяженность от переднего до заднего участка капсулы предстательной железы. Движения ректального зонда позволяют точно локализовать фокус ультразвуковых волн. Они также помогают регулировать глубину участка коагуляции таким образом, чтобы он соответствовал форме предстательной железы. Последовательные импульсы позволяют достичь полной обработки объема простаты при сохранении целостности стенки прямой кишки и других окружающих тканей.
Все процедуры производились под спинальной анестезией. В первую очередь выполнялась трансуретральная резекция простаты, при которой удалялись главным образом передняя и боковые части железы. Качество резекции контролировалось при помощи трансректального ультразвукового исследования. Объем резекции выбирался индивидуально: от «псевдо-ТУР» с созданием канала в простате, что ускоряет восстановление мочеиспускания в послеоперационном периоде, до полноценной ТУРП, адекватной для большой предстательной железы.
Сразу после трансуретральной резекции выполнялась HIFU-аблация простаты. После локализации ткани-мишени с помощью встроенного ультрасонографического датчика определялось три или четыре продольных блока, в зависимости от формы и размера простаты. В каждом блоке оператором назначались зоны обработки, затем под компьютерным контролем послойно происходила их HIFU-аблация от верхушки предстательной железы до шейки мочевого пузыря.
Вся информация о пациентах собрана в базу данных и подвергнута программной статистической обработке. Учитывая ненормальность распределения признаков в выборке, для сравнения данных до и после лечения использовался непараметрический тест Wilcoxon. Во всех статистических анализах p<0,05 использовался для определения статистической значимости. Расчеты производились с использованием пакета прикладных программ Statistica v.6.0 for Windows производства компании «StatSoft», а также приложения Excel Microsoft 0ffice’2011.
Результаты. 100 пациентов соответствовали критериям включения; 26 пациентам выполнена только
HIFU-аблация, 74 пациентам выполнено комбинированное лечение в объеме трансуретральной резекции и HIFU-аблации простаты. Обе группы имели сходный демографический, онкологический и урологический профиль (табл. 1).
Были выделены прогностические подгруппы низкого риска (клиническая стадия T1-T2a, PSA не более 10 нг/мл, сумма баллов Gleason менее 7), промежуточного риска (клиническая стадия T2b, или PSA от 10 до 20 нг/мл, или сумма баллов Gleason, равная 7) и высокого риска (клиническая стадия T2c, или PSA более 20 нг/мл, или сумма баллов Gleason более 7).
Средний период наблюдения составил 18,6 месяца (±2,1) в группе HIFU и 10,1 месяца (±2,2) в группе ТУР+HIFU. В группе пациентов, которым проводилась трансуретральная резекция простаты перед HIFU-аблацией, средняя масса резецированной ткани составила 20,7 (±4,2) г.
При гистологическом исследовании резецированная ткань не содержала злокачественных клеток у 49,6% пациентов. Когда же в ТУР-срезах обнаруживалась карциноматозная ткань, она занимала менее 10% общего резецированного объема в 27,5% случаев, 10-40% объема — в 16,3% случаев, более 40% объема — в оставшихся 4,6%. 100 пациентам было произведено в общей сложности 132 сеанса HIFU в связи с тем, что частота повторных сеансов составила 11,4%: в группе HIFU 25%, в группе ТУР+HIFU 4%.
Надир PSA достигался в обеих группах в среднем через 15 недель после лечения. В группе HIFU средний уровень надира PSA составлял 0,78 нг/мл (±1,1), со следующим распределением: 1-й квартиль — 0,00 нг/мл, медиана — 0,00 нг/мл, 3-й квартиль — 0,3 нг/ мл. В группе ТУРП+HIFU средний надир PSA составлял 0,56 нг/мл (±0,9) со сходным распределением: 1-й квартиль — 0,00 нг/мл, медиана — 0,00 нг/мл, 3-й квартиль — 0,1 нг/мл. Параметрический t-тест значимости различий между двумя группами не подтвердил (p>0,05).
Контрольные биопсии были негативными у 87,7% пациентов в группе HIFU и у 81,6% в группе ТУРП+HIFU (тест хи-квадрат, p>0,05). При рассмотрении разницы по контрольным биопсиям и частоте повторных сеансов между двумя группами оценивалась также частота негативных биопсий после первого сеанса HIFU-аблации (табл. 2); она со-
Таблица 1
Характеристика пациентов
|
Изучаемые показатели |
HIFU, n=26 |
ТУР/HIFU, n=74 |
|
|
Средний возраст |
66,4 (±7,6) |
68,7 (±6,8) |
|
|
Средний объем простаты |
34,2 (±6,8) |
38,5 (±9,8) |
|
|
Средний начальный уровень PSA |
9,3 (±3,2) |
8,4 (±3,4) |
|
|
Среднее количество положительных биоптатов |
2,5 (±1,3) / 6 |
2,2 (±1,3) / 6 |
|
|
2–6 |
69,8% |
74,3% |
|
|
Баллы Gleason |
7 |
26,0% |
21,7% |
|
8–10 |
4,2% |
4,0% |
|
|
Низкий |
38,5% |
40,6% |
|
|
Группа онкологического риска |
Промежуточный |
57,3% |
54,3% |
|
Высокий |
4,2% |
5,1% |
|
|
Средний IPSS |
8,54 |
8,96 |
|
|
Среднее качество жизни |
4,1 |
4,0 |
|
Таблица 2
Результаты биопсии после первой HIFU-аблации и на момент последнего контрольного посещения (включая повторные сеансы HIFU)
На момент последнего контрольного обследования оценивалась стабильность PSA по критерию Штутгарта (ПСА превышает 1 нг/мл и более по сравнению с минимальным уровнем после лечения) или при его приросте на 0,75 нг/мл и более в течение года по рекомендации Европейской ассоциации урологов [10]. Продемонстрирована стабильность этого показателя у 84,2% пациентов в группе HIFU и 80% в группе ТУРП+HIFU (p>0,05). Из-за отмеченной разницы в послеоперационном наблюдении между двумя группами анализ PSA-стабильности также представлен в виде кривых выживаемости по Каплану — Мейеру (рисунок).
Шесть (6,3%) пациентов в группе HIFU и пять (2,9%) пациентов в группе ТУРП+HIFU получали адъювантную терапию по поводу рака предстательной железы. Три пациента получали гормональную терапию и три пациента перенесли радикальную операцию в
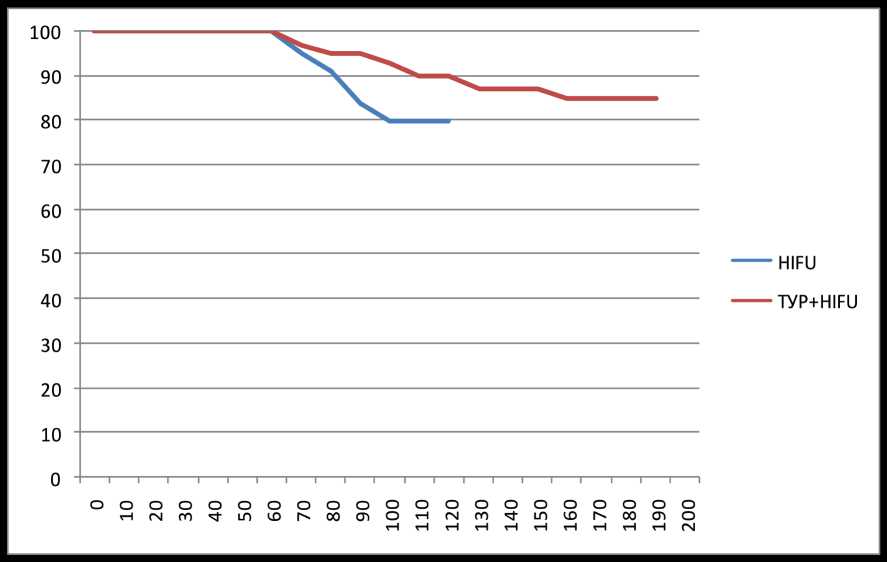
Стабильность PSA по критерию Штутгарта, %
Таблица 3
Частота и характер послеоперационных осложнений в группах сравнения
Побочные эффекты, наиболее часто отмечающиеся после HIFU: инфравезикальная обструкция, инфекция мочевыводящих путей и симптомы недержания мочи. Встречаемость всех осложнений представлена в табл. 3.
После HIFU-аблации время дренирования мочевого пузыря составило в среднем 14,1 (±3,4) дня, медиана — 14,0 дня. При комбинированном проведении трансуретральной резекции простаты этот срок уменьшился до 7,7 (±1,0) дня и 7,0 дня соответственно (p=0,004).
Стрессовое недержание мочи 3-й степени не встретилось в общей когорте пациентов. В группе HIFU отмечено недержание мочи 1-й и 2-й степени у 9,1 и 6,3% пациентов соответственно; в группе ТУРП+HIFU эта частота составила 4,6 и 2,3% (p=0,032). Большинство из этих случаев легкого недержания мочи разрешились в последующие недели.
Инфекции мочевыводящих путей развивались у 27,9% пациентов в группе HIFU и у 11,4% в группе ТУРП+HIFU (p<0,001).
Дополнительные процедуры по ликвидации обструкции требовались у 27,1% пациентов в группе HIFU и в 8% случаев в группе ТУРП+HIFU. Они состояли главным образом в удалении тканевого детрита в первой группе и в коррекции стеноза шейки мочевого пузыря во второй группе.
Через три месяца после лечения пациенты заполняли опросник IPSS. Его результат перед HIFU составлял в среднем 8,54 балла, после — 8,91; перед комбинированным лечением –8,96, после него — 7,77 (p=0,016). Аналогично среднее качество жизни при HIFU изменилось с 4,1 до 3,36, при комбинированном лечении — с 4,0 до 2,86 (p>0,05).
Опросники для оценки половой функции пациентам не предоставлялись, но среди них проводился опрос о состоянии потенции; 60% пациентов в группе HIFU и 68,2% пациентов в группе ТУРП+HIFU не отмечали изменений в эректильной функции до и после операции.
Обсуждение. Первые годы изучения HIFU-аблации в качестве потенциального метода лечения рака предстательной железы были посвящены валидации ее эффективности в серии экспериментов in vitro и in vivo на животных моделях. В дальнейшем был изучен потенциальный положительный эффект от клинического применения этой методики. В настоящее время акцент делается в основном на улучшении непосредственных результатов процедуры [8].
Что касается осложнений этого метода лечения, комбинация трансуретральной резекции и HIFU-аблации простаты демонстрирует очень хорошие результаты в отношении снижения выраженности симптомов нарушенного мочеиспускания и риска развития недержания мочи и инфекций мочевыводящих путей после операции. Эти результаты не подвергаются сомнению, несмотря на относительно короткий период наблюдения, особенно в группе ТУРП+HIFU, так как после HIFU-аблации описываются только острые осложнения.
В связи с быстрым восстановлением нормального мочеиспускания и ранним удалением катетера отмечена меньшая частота инфекций нижних мочевыводящих путей. В отношении снижения частоты недержания мочи стоит отметить, что меньшая необходимость в проведении дополнительных манипуляций после комбинированного лечения еще больше подчеркивает его положительный эффект, поскольку эти дополнительные манипуляции могут вызывать инконтинецию сами по себе.
Результаты оценки эффективности не показывают значимых различий между двумя группами и соответствуют ранее описанным в литературе. Тем не менее эти данные можно подвергнуть сомнению из-за малого срока послеоперационного наблюдения в группе ТУРП+HIFU и значительно меньшей частоте повторных сеансов.
HIFU-аблация, комбинированная с предварительной трансуретральной резекцией простаты, имеет больше преимуществ: во-первых, позволяет удалить кальцинаты переходной зоны железы, которые иначе препятствовали бы ультразвуковой аблации; во-вторых, за счет уменьшения переднезаднего размера органа позволяет произвести полную аблацию простаты в один сеанс [9]. Чтобы подтвердить меньшую необходимость в повторных сеансах, нужно провести исследование с более длительным периодом наблюдения за группой ТУРП+HIFU. Созданная при трансуретральной резекции полость не влияет на распространение ультразвука в ткани, поскольку она остается практически спавшейся после раздувания эндоректального баллона во время процедуры. Сама по себе трансуретральная резекция ненамного увеличивает общую продолжительность вмешатель- ства [10]. Время, затраченное на резекцию, компенсируется уменьшением объема простаты, который должен подвергнуться HIFU-аблации. Кровотечение после трансуретральной резекции простаты уменьшается благодаря коагуляционному действию HIFU. После комбинированного ТУРП+HIFU-лечения схема ведения пациента аналогична таковой после обычной ТУРП, что означает меньший срок пребывания в стационаре, меньший срок дренирования мочевого пузыря и практически мгновенное восстановление трудоспособности без периода восстановления.
Выводы. Таким образом, комбинация трансуретральной резекции и HIFU-аблации простаты в рамках одной хирургической процедуры имеет положительное влияние на риск осложнений лечения без ущерба его эффективности.
Список литературы Комбинирование трансуретральной резекции и HIFU-аблации простаты при лечении локализованного рака
- Попков B.M., Фомкин P.H., Блюмберг Б.И. Прогностические факторы в оценке эффективности результатов лечения больных локализованным раком простаты с помощью HIFU-аблации. Саратовский научно-медицинский журнал 2013; (1): 116-121
- Попков B.M., Фомкин PH., Блюмберг Б.И. Постоперационный мониторинг простатоспецифического антигена (PSA) после лечения высокоинтенсивным сфокусированным ультразвуком (HIFU). Саратовский научно-медицинский журнал 2012; (4): 1001-1007
- D'Amico AV, Whittington R, Malkowicz SB, et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA 1998; 50 (3): 969-974
- Попков B.M., Фомкин PH., Блюмберг Б.И. Возможности прогнозирования рецидива рака простаты после HIFU-аблации с помощью математического моделирования. Саратовский научно-медицинский журнал 2013; (9): 314-320
- Фомкин P.H., Глыбочко П.В., Блюмберг Б.И. Лечение рака простаты у больных пожилого и старческого возраста высокоинтенсивным сфокусированным ультразвуком. Клиническая геронтология 2011; (9): 27-33
- Фомкин P.H., Воронина E.С, Попков, В.M. и др. Патоморфоз рака простаты при лечении высокоинтенсивным сфокусированным ультразвуком (HIFU). Онкоурология 2013; (1): 55-62
- Фомкин P.H., Попков, В.M., Блюмберг Б.И. Сравнительная оценка послеоперационных осложнений после однократной и повторной HIFU-аблации локализованного рака простаты. Медицинский вестник Башкортостана 2013; (2): 222-226
- Фомкин P.H., Блюмберг Б.И. Применение робота HIFU в лечении рака простаты. Уральский медицинский журнал 2012; (3): 48-52
- Фомкин P.H., Воронина E.C., Попков B.M. и др. Трехлетние результаты лечения локализованного рака простаты высокоинтенсивным сфокусированным ультразвуком. Урология 2014; (1): 37-44
- Фомкин P.H., Воронина E.C., Попков, В.M. и др. Прогностическое значение молекулярно-биологических, морфологических и клинических маркеров в оценке эффективности лечения локализованного рака простаты высокоинтенсивным сфокусированным ультразвуком. Экспериментальная и клиническая урология 2013; (4): 29-33.


