Комбинированное лечение больных неоперабельными метастазами колоректального рака печени
Автор: Шабунин Алексей Васильевич, Тавобилов Михаил Михайлович, Греков Дмитрий Николаевич, Дроздов Павел Алексеевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 т.17, 2018 года.
Бесплатный доступ
Цель исследования - улучшить результаты лечения больных с нерезектабельными метастазами колоректального рака печени путем комбинации химиоэмболизации печеночной артерии и радиочастотной аблации. Материал и методы. Проанализированы результаты лечения 60 больных с метахронными нерезектабельными метастазами колоректального рака в печень. Критерии включения: отсутствие экстрапеченочных метастазов; размер метастазов от 3 до 5 см; невозможность проведения резекционного вмешательства. Больные были разделены на основную группу (30 пациентов), куда вошли те, кому проведена комбинация регионарной химиотерапии и радиочастотной аблации, и контрольную группу (30 пациентов), в нее вошли больные, которым проведена радиочастотная аблация. Результаты. Постэмболизационный и постаблационный синдром был у всех больных основной и контрольной групп. Осложнения были у 4 из 60 больных (2 больных в основной группе и 2 больных в контрольной группе (p=1)) - правосторонний гидроторакс (II класс по Clavien-Dindo). Безрецидивная выживаемость в основной группе за первый год составила 96,6 %, за второй - 76,6 %, за третий - 53,3 %. В контрольной группе - 90,0, 53,6 и 30,0 % соответственно (p=0,049). Общая одно-, двух- и трехлетняя выживаемость у больных основной группы составила 100, 90 и 63,3 %. В контрольной группе - 100, 70 и 50,0 % соответственно (p=0,202). Заключение. Применение на практике комбинированного метода позволило улучшить результаты лечения больных с нерезектабельными метастазами колоректального рака печени за счет увеличения общей и безрецидивной выживаемости.
Метастазы печени, колоректальный рак, химиоэмболизация печеночной артерии, радиочастотная аблация, комбинированное лечение
Короткий адрес: https://sciup.org/140254186
IDR: 140254186 | УДК: 616.34-006-033.2-059:611.36 | DOI: 10.21294/1814-4861-2018-17-3-34-40
Текст научной статьи Комбинированное лечение больных неоперабельными метастазами колоректального рака печени
Колоректальный рак (КРР) занимает четвертое место по частоте встречаемости среди всех онкологических заболеваний, уступая лишь раку легких, желудка, предстательной железы у мужчин, гормонозависимых органов у женщин [1]. По частоте смертности колоректальный рак занимает второе место [2]. Согласно National Cancer Institute at the institutes of Health (, в 2014 г. в США зафиксировано 136 830 новых случаев заболевания КРР, что составило 8,2 % от всех онкологических заболеваний. В том же году от КРР умерло 50 310 пациентов, что составило 8,6 % от всех онкологических заболеваний [3]. Резекция печени в пределах здоровых тканей (>1 мм) явля- ется оптимальным способом лечения больных с метастазами КРР в печень: она обеспечивает общую 5-летнюю выживаемость на уровне 40–50 % [4, 5]. Прогрессирование заболевания в печени является основной причиной смерти у этих пациентов [6–8]. Резектабельность метастазов печени, по данным различных авторов, не превышает 20 % [9–11]. В отношении половины больных метастазами колоректального рака отсутствует техническая возможность проведения резекции, а примерно у 37 % больных имеется тяжелая сопутствующая патология, которая не позволяет им провести радикальное оперативное вмешательство в объеме резекции печени [12]. В лечении таких больных
применяются методы локальной деструкции, наиболее распространенным из них является радиочастотная аблация.
Радиочастотная аблация (РЧА) – самая изученная и наиболее часто применяемая методика локальной деструкции для лечения опухолей печени у неоперабельных больных [13]. Несомненным преимуществом РЧА по сравнению с резекционными методами лечения является их относительная безопасность, что позволяет применять ее у пациентов с соматической патологией [14]. Существенным недостатком метода является высокий риск местных рецидивов, который достигает 25–50 % при размере образований более 3 см и до 16 % при размере образований до 3 см. Основной причиной развития местных рецидивов считается неполный коагуляционный некроз после аблации. Частота полных некрозов при размере образования более 5 см составляет менее 50 % [15].
В случае с неоперабельной гепатоцеллюлярной карциномой проблему высокой частоты местных рецидивов после аблации решают применением комбинации методов локальной деструкции и регионарной химиотерапии (ХЭПА) [16], когда на первом этапе применяют ХЭПА, а на втором этапе через различные временные промежутки – радиочастотную аблацию. В 2017 г. опубликован метаанализ, который показал достоверно лучший опухолевый ответ (p<0,00001), лучшую общую (p<0,00001) и безрецидивную (p<0,00001) выживаемость при использовании ХЭПА совместно с РЧА [17]. Недостатком данных исследований являются неодинаковые временные интервалы между этапами лечения (от нескольких дней до 3 нед).
Единственное на данный момент проспективное исследование, оценивающее эффективность комбинации ХЭПА с РЧА у больных нерезекта-бельным колоректальным раком печени, включает 25 пациентов с 36 опухолевыми очагами, средний размер которых составляет 2,2 ± 0,9 см. Общая и безрецидивная 2-летняя выживаемость составила 88 и 63,3 % соответственно. Местные рецидивы наблюдались в 7,9 % [18]. Недостатками данного исследования явились: малая выборка, отсутствие контрольной группы, применение ХЭПА и РЧА в один день, а также средний размер метастазов менее 3 см, который не требует комбинированного лечения.
Таким образом, в настоящее время не стандартизирован протокол комбинированного лечения больных нерезектабельными злокачественными образованиями печени размером от 3 до 5 см путем комбинации химиоэмболизации и радиочастотной аблации. Экспериментальные данные показывают, что комбинация данных методов лечения не позволяет во всех наблюдениях получить полный коагуляционный некроз опухоли [19–21], что диктует необходимость дальнейшего поиска оптимальной комбинации данных методов в лечении больных злокачественными образованиями печени. Кроме того, известно, что метастаз колоректального рака в меньшей степени кровоснабжается артериальной кровью, по сравнению с гепатцеллюлярной карциномой, поэтому эффективность ХЭПА у таких больных снижена, а также колоректальный метастаз имеет большую плотность, чем ГЦР, что снижает эффективность РЧА. Соответственно, можно предположить, что комбинация этих двух методов менее эффективна, чем при лечении ГЦР, что приводит к неполному некрозу опухоли и развитию местного рецидива.
Ранее нами предложен алгоритм комбинированного лечения больных с неоперабельными метастазами колоректального рака печени (патент на изобретение № 2554794), когда на первом этапе проводится химиоэмболизация ветви печеночной артерии, которая воздействует на периферическую часть опухолевого очага, что приводит к уменьшению его размеров, исчезновению сателлитных очагов посредством действия химиопрепарата и редукции кровотока. Через 7 дней после ХЭПА проводится радиочастотная аблация. Уменьшение размеров опухолевого очага, исчезновение сателлитных метастазов и уменьшение эффекта «рассеивания тепла» после ХЭПА позволяют получить необходимую температуру для формирования оптимального размера коагуляционного некроза опухоли во время аблации. Повторный курс ХЭПА, который проводится на 7-й день после аблации, воздействует на периферические отделы опухоли за счет эффекта гиперемии после аблации, что приводит к длительному контакту химиотерапевтического препарата с опухолевой тканью и полному ее некрозу. Данный алгоритм может быть перспективным в лечении больных с неоперабельными метастазами колоректального рака печени.
Материал и методы
В основу исследования включен анализ результатов лечения 60 больных с метахронными нерезектабельными метастазами колоректального рака в печень, которые проходили лечение в отделении хирургии печени и поджелудочной железы в период с 2009 по 2015 г. В исследование включались больные: без наличия экстрапеченочных метастазов; размер метастазов печени находился в пределах от 3 до 5 см; больные не могли подвергнуться резекционному вмешательству в силу тяжелой сопутствующей патологии.
В контрольную группу ретроспективно набрано 30 пациентов, находившихся на лечении в отделении хирургии печени и поджелудочной железы с 2009 по 2013 г. Принятие решения об аблации метастазов проводилось на мультидисциплинар-ном онкоконсилиуме. Кроме того, все пациенты на предоперационном этапе были осмотрены врачом-анастезиологом с целью определения физического статуса пациента по классификации American Society Anesthesiologists (ASA). Всем больным контрольной группы выполнена РЧА метастазов печени под УЗ-наведением. В последующем всем больным проводилась системная адъювантная химиотерапия. Дальнейшее динамическое наблюдение включало определение уровня онкомаркеров (СА 19–9, РЭА), а также проведение одного из методов визуализации (МСКТ, МРТ с внутривенным контрастированием) на 3, 6, 12, 18, 24, 30, 36-й мес после лечения.
В основную группу последовательно набрано 30 пациентов, находившихся на лечении в период с 2013 по 2015 г. Решение о применении комбинированного метода лечения принималось на мульти-дисциплинарном онкоконсилиуме. Все пациенты на предоперационном этапе были осмотрены врачом-анастезиологом с целью определения физического статуса пациента по классификации ASA. После проведения описанного выше комбинированного лечения всем больным проводилась системная адъювантная химиотерапия. Дальнейшее динамическое наблюдение включало определение уровня онкомаркеров (СА 19–9, РЭА), а также проведение одного из методов визуализации (МСКТ, МРТ с внутривенным контрастированием) на 3, 6, 12, 18, 24, 30, 36-й мес после лечения.
Группы были сравнимы по следующим критериям: пол (p=0,610), возраст (p=0,137), локализация первичной опухоли (p=0,549), стадия первичной опухоли (p=0,732), N-статус первичной опухоли (p=0,286), наибольший размер метастаза (p=0,318), предоперационный уровень РЭА (p=0,963), локализация метастаза (p=0,613), время до метастазирования (p=0,706), предоперационная ASA (p=0,744), предшествующая химиотерапия (p=0,647) (таблица).
Таблица
Характеристика больных основной и контрольной групп
|
Характеристика Основная группа (n=30) |
Контрольная группа (n=30) |
p |
|
|
Пол |
|||
|
Муж |
14 |
12 |
0,610 |
|
Жен |
16 |
18 |
|
|
Возраст <70 лет |
11 |
7 |
0,137 |
|
>70 лет |
19 |
23 |
|
|
Первичная опухоль |
|||
|
Толстая кишка |
24 |
22 |
0,549 |
|
Прямая кишка |
6 |
8 |
|
|
Стадия первичной опухоли |
|||
|
I–II стадия |
15 |
13 |
0,732 |
|
III–IV стадия |
15 |
17 |
|
|
Лимфогенная распространенность первичной опухоли |
|||
|
N+ |
15 |
17 |
0,286 |
|
N- |
15 |
13 |
|
|
Размер метастаза: |
|||
|
3–4 см |
9 |
11 |
0,318 |
|
4–5 см |
21 |
19 |
|
|
Уровень РЭА |
|||
|
<60 нг/мл |
18 |
19 |
|
|
>60 нг/мл |
12 |
11 |
0,963 |
|
Локализация метастаза Центральная (S4,5,8) |
14 |
16 |
0,613 |
|
Периферическая |
16 |
14 |
|
|
Время до метастазирования |
|||
|
<12 мес |
13 |
12 18 |
0,706 |
|
>12 мес |
17 |
||
|
ASA Grade 2 |
2 |
2 |
|
|
Grade 3 |
25 |
26 |
0,744 |
|
Grade 4 |
3 |
2 |
|
|
Химиотерапия после резекции толстой кишки |
|||
|
Да |
27 |
28 |
0,647 |
|
Нет |
3 |
2 |
|
Результаты
В послеоперационном периоде постэмболизационный и постаблационный синдромы наблюдались у всех больных основной и контрольной групп. Однако он купировался в течение ближайших 3–5 сут и ни в одном случае не помешал проведению следующего этапа лечения у больных основной группы. У 4 из 60 больных (2 больных в основной группе и 2 больных в контрольной группе) с близким прилежанием метастатического очага к правому куполу диафрагмы после РЧА наблюдался правосторонний гидроторакс. Во всех случаях гидроторакс разрешился на фоне консервативной терапии и не потребовал пункции плевральной полости. По классификации Clavien-Dindo данные осложнения мы отнесли ко II классу. Летальных исходов не было в обеих группах.
Для оценки отдаленных результатов лечения прогнозировали общую и безрецидивную выживаемость. Признаками развития рецидива в печени являлось увеличение в размерах ранее пролеченных метастазов с накоплением контрастного препарата во время одного из визуализационных исследований (МСКТ, МРТ, ПЭТ/КТ), а также рост онкомаркеров (СА 19–9, РЭА). В сомнительных случаях рецидив заболевания подтверждали гистологически, с помощью тонкоигольной биопсии.
За три года наблюдения местный рецидив отмечен у 14/30 больных основной группы. За первый год наблюдения местный рецидив диагностирован у 1/30 пациента, за второй – у 6/30, за третий год – у 7/30. Безрецидивная выживаемость в основной группе за первый год составила 96,6 %, за второй – 76,6 %, за третий – 53,3 %. В контрольной группе местный рецидив отмечен у 21/30 больного. За первый год наблюдения местный рецидив диагностирован у 3/30 пациентов, за второй – у 11/30, за третий год – у 7/30. Безрецидивная выживаемость в контрольной группе за первый год составила 90,0 %, за второй – 53,6 %, за третий – 30,0 % (рис. 1).
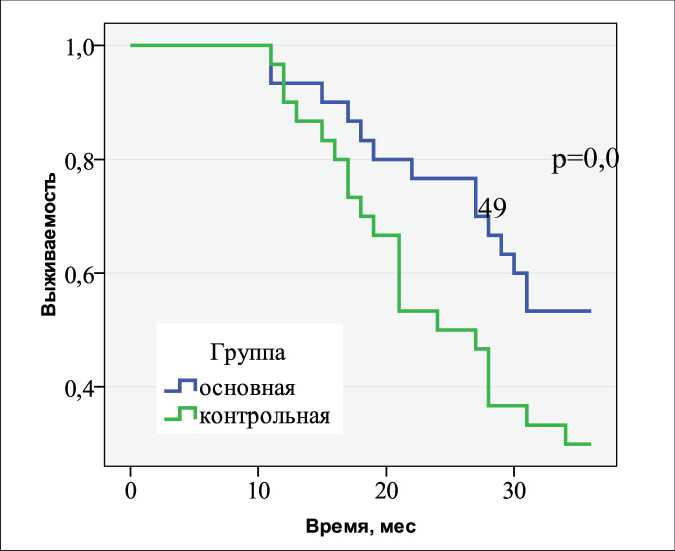
Рис. 1. Выживаемость без развития местного рецидива у больных метастатическим колоректальным раком печени
За трехлетний период наблюдения в основной группе зафиксировано 11 (из 30 больных) летальных исходов. За первый год наблюдения летальных исходов не было, за второй год – 3/30, за третий – 8/30. Общая одно-, двух- и трехлетняя выживаемость у больных основной группы составила 100, 90 и 63,3 % соответственно.
За трехлетний период наблюдения в контрольной группе зафиксировано 15/30 летальных исходов. За первый год наблюдения летальных исходов не было, за второй год – 9/30, за третий – 6/30. Общая одно-, двух- и трехлетняя выживаемость у больных контрольной группы составила 100, 70 и 50,0 % соответственно (рис. 2). Основной причиной летальности явилось прогрессирование основного заболевания.
Обсуждение
У каждого третьего заболевшего раком толстой кишки на момент постановки диагноза выявляют отдаленные метастазы, в первую очередь в печени (по данным зарубежных авторов, в 20–50 %). Кроме того, у порядка 55 % пациентов, получивших потенциально радикальное лечение рака толстой кишки, существует риск прогрессирования в виде метастазов. Печень в 25 % наблюдений является единственным органом, пораженным метастазами [22–24]. Длительное время в литературе, посвященной резекционным вмешательствам по поводу первичного и метастатического поражения печени, фигурировали показатели резектабельности на уровне 20 % [25, 26].
В настоящее время для пациентов с метастазами колоректального рака печени, которые в силу наличия сопутствующей патологии не могут перенести радикальное хирургическое вмешательство, радиочастотная аблация остается единственным
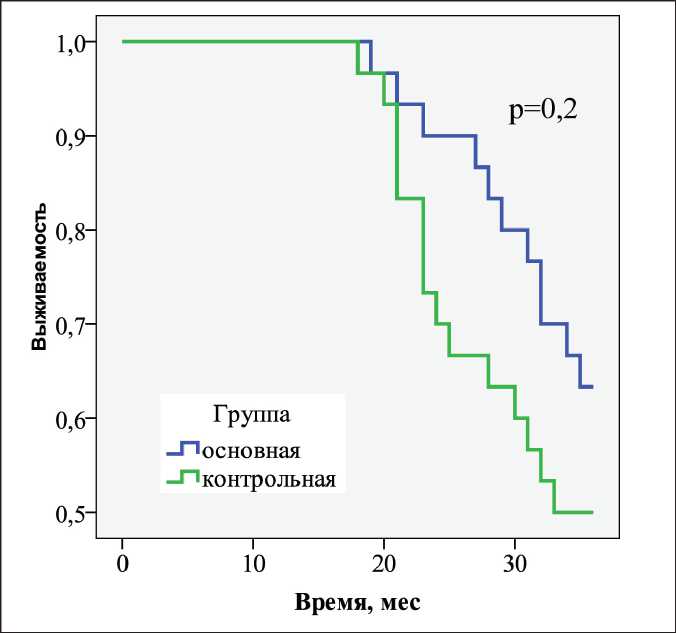
Рис. 2. Общая выживаемость у больных метастатическим колоректальным раком печени эффективным методом лечения, после которой 5-летняя выживаемость составляет 17–51 % в зависимости от селекции пациентов [27–29]. Местный рецидив после аблации образований размером более 3 см – главный недостаток данного метода. Усовершенствование способов лечения пациентов со злокачественными образованиями печени размером более 3 см, которым невозможно выполнить радикальное хирургическое вмешательство, проводят путем комбинации методов регионарной химиотерапии и аблации. Данная методика успешно применяется в лечении больных с нерезектабель-ной гепатоцеллюлярной карциномой, однако мало изучена для лечения больных с метастатическим колоректальным раком печени.
Предложенный нами алгоритм не усиливает интенсивность постэмболизационного и постаблаци-онного синдромов, не влияет на частоту развития
Список литературы Комбинированное лечение больных неоперабельными метастазами колоректального рака печени
- Ferlay J., Soerjomataram I., Dikshit R., Eser S., Mathers C., Rebelo M., Parkin D.M., Forman D., Bray F. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136: E35986. DOI: 10.1002/ijc.29210
- Gillams A.R., Lees W.R. Five-year survival in 309 patients with colorectal liver metastases treated with radiofrequency ablation. Eur Radiol. 2009 May; 19 (5): 1206-13. DOI: 10.1007/s00330-008-1258-5
- Konopke R., Roth J., Volk A., Pistorius S., Folprecht G., Zöphel K., Schuetze C., Laniado M., Saeger H.D., Kersting S. Colorectal liver metastases: An update on palliative treatment options. J Gastrointestin Liver Dis 2012; 21: 83-91.
- Pawlik T.M., Abdalla E.K., Ellis L.M., Vauthey J.N., Curley S.A. Debunkingdogma: surgery for four or more colorectal liver metastases is justified. J Gastrointest Surg. 2006 Feb; 10 (2): 240-8.
- Ardito F., Vellone M., Cassano A., De Rose A.M., Pozzo C., Coppola A., Federico B., Giovannini I., Barone C., Nuzzo G., Giuliante F. Chance of cure following liver resection for initially unresectable colorectal metastases: analysis of actual 5-year survival. J Gastrointest Surg. 2013 Feb; 17 (2): 352-9. DOI: 10.1007/s11605-012-2103-3


