Комбинированное лечение больных раком желудка IV стадии с канцероматозом брюшины
Автор: Маркович В.А., Тузиков С.А., Родионов Е.О., Попова Н.О., Цыганов М.М., Миллер С.В., Подолько Д.В., Цыденова И.А., Ибрагимова М.К., Литвяков Н.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.22, 2023 года.
Бесплатный доступ
Перитонеальный канцероматоз - крайне неблагоприятный вариант прогрессирования рака желудка (РЖ). Рак желудка IV стадии выявляется у 39,8 % первичных пациентов, локальный канцероматоз без других отдаленных метастазов встречается в 18-20 % случаев от общей доли РЖ IV стадии. Цель исследования - оценить эффективность персонализированного назначения химиотерапии в комбинированном лечении больных раком желудка IV стадии с перитонеальным канцероматозом. Материал и методы. Циторедуктивные операции проведены 70 больным РЖ с перитонеальной диссеминацией. В контрольной группе (n=35) проводилась послеоперационная химиотерапия по схеме FOLFOX. В основной группе (n=35) персонифицированная системная и интраперитонеальная химиотерапия назначалась на основании экспрессии генов химиочувствительности и резистентности. Результаты. В основной группе достигнута медиана общей выживаемости 18,7 мес, что выше, чем в группе контроля и в исследованиях, представленных в мировой литературе (CRS + HIPEC). В основной группе за счет персонифицированного подбора режима химиотерапии удалось увеличить медиану времени без прогрессирования (ВБП) на 4,6 мес (29,1 %) и медиану общей выживаемости (ОВ) - на 6 мес (32%); однолетняя выживаемость достигнута у 35 (100 %), 2-летняя - у 9 (27 %), 3-летняя - у 1 (3 %) пациента. Заключение. Разработанный метод лечения рака желудка с перитонеальной диссеминацией позволяет улучшить отдалённые результаты комбинированного лечения за счет увеличения медианы ВБП и ОВ.
Рак желудка, перитонеальный канцероматоз, циторедуктивная хирургия, персонифицированная системная и интраперитонеальная химиотерапия
Короткий адрес: https://sciup.org/140297841
IDR: 140297841 | УДК: 616.33-006.6+616.381-006]-059 | DOI: 10.21294/1814-4861-2023-22-1-24-34
Текст научной статьи Комбинированное лечение больных раком желудка IV стадии с канцероматозом брюшины
Возможности лечения РЖ с перитонеальной диссеминацией ограничены, химиолучевая терапия не показана, системная химиотерапия без «перитонеального контроля» демонстрирует неудовлетворительные результаты [7, 8]. Циторедуктивная хирургия (CRS – CytoReductive Surgery – удаление первичной опухоли и макроскопически видимых метастатических очагов) показала хорошие результаты при колоректальном раке и раке яичников с перитонеальной диссеминацией. Наибольшую эффективность имеет CRS в сочетании с HIPEC (hyperthermic intraperitoneal chemotherapy – внутрибрюшная гипертермическая химиоперфузия) в качестве адъювантного метода [9, 10]. Иначе обстоят дела при лечении больных РЖ с канцероматозом брюшины. Большинство авторов считают нецелесообразным циторедукцию при РЖ с подтвержденной диссеминацией по брюшине, рекомендуя паллиативную химиотерапию [11–13]. В рутинной клинической практике оперативное лечение при РЖ с ПК выполняется по жизненным показаниям (перфорация, угроза фатального кровотечения из распадающейся опухоли, декомпенсированный стеноз) [14].
индекс перитонеального канцероматоза PCI от 13 до 39; ECOG>2, по шкале Карновского – менее 70 %; множественные отдаленные метастазы (печень, легкие, кости и др.); механическая желтуха; инвазия опухоли в головку и тело поджелудочной железы; нарушение функции печени (ЩФ, АСТ, АЛТ более 5 норм, билирубин более 2 норм) и почек (креатинин более 175 мкмоль/л); отказ пациента на включение в исследование.
Больные были распределены на две группы. Контрольная группа (n=35) была сформирована ретроспективно. В ее состав включены больные, прошедшие лечение в период с 2014 по 2017 г., которым выполнялась циторедуктивная операция с последующей стандартной послеоперационной химиотерапией по схеме FOLFOX, без интраперитонеальной химиотерапии («перитонеального контроля»).
В основную группу было проспективно включено 35 пациентов, которым выполнялась циторедуктивная операция, затем проводилась персонифицированная системная и интраперитонеальная химиотерапия, подобранная на основании оценки уровней экспрессии генов АВСС5, BRCA1, TOP1, TOP2α, TUBB3, RRM1, ERCC1 и TYMS методом ПЦР в режиме реального времени в первичной опухоли, метастазах в лимфоузле и брюшине.
Согласно клиническим рекомендациям, при лечении диссеминированного РЖ предпочтение отдается двухкомпонентным режимам химиотерапии (дуплеты), они являются равноэффективными и взаимозаменяемыми [24]. Использование трехкомпонентных режимов химиотерапии затруднено из-за неудовлетворительного соматического статуса у данной категории больных. Алгоритм персонификации химиотерапии [23] представлен на рис. 1, выбрано 5 схем химиотерапии:
– FOLFIRI с интраперитонеальным введением цисплатина: иринотекан 170 мг/м2, внутривенная инфузия 90 мин; лейковорин 400 мг/м2, внутривенная инфузия 2 ч, в 1-й день; 5-фторурацил 400 мг/м2, внутривенная струйно, затем 2400 мг/м2, внутривенная инфузия 46 ч; цисплатин 50 мг интраперитонеально на 200 мл физиологического раствора, во 2-й день, интервал 21 день. Лечение получили 14 (40 %) больных;
– TPFL (модификация DCF) с интраперитонеальным введением цисплатина: 5-фторурацил 500 мг/м2, 3-часовая инфузия, в 1–3-й дни; лейковорин 50 мг струйно внутривенно, в 1–3-й дни перед введением 5-фторурацила; доцетаксел 75 мг/м2, внутривенная инфузия в течение 1 ч, во 2-й день, цисплатин 50 мг внутривенная инфузия в течение 1 ч, во 2-й день; цисплатин 50 мг интраперитонеально на 200 мл физиологического раствора, в 3-й день. Интервал 21 день. Лечение получили 7 (20 %) больных;
– XELIRI с интраперитонеальным введением цисплатина: иринотекан 230 мг/м2, внутривенная
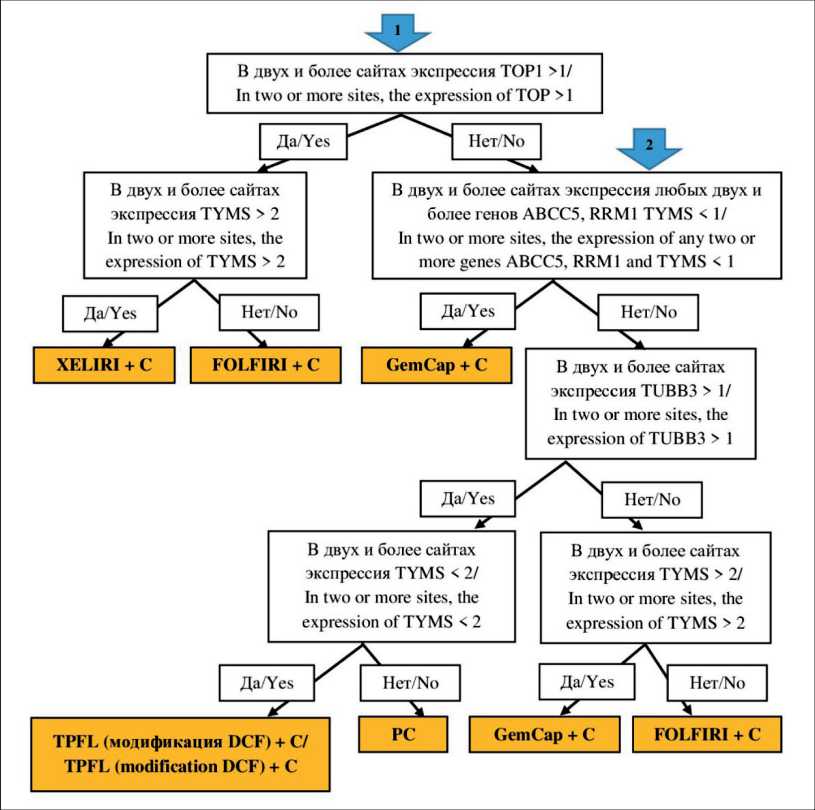
инфузия 60–90 мин, в 1-й день; цисплатин 50 мг интраперитонеально на 200 мл физиологического раствора, во 2-й день; капецитабин 1800 мг/м2 в день, в течение 14 дней. Интервал 21 день. Лечение получили 7 (20 %) больных;
– PC с интраперитонеальным введением цисплатина и паклитаксела: паклитаксел 135 мг/м2, в 1-й день внутривенно, капельно в течение 3 ч; цисплатин 50 мг, во 2-й день интраперитонеально на 200 мл физиологического раствора, паклитаксел 65 мг/м2, в 8-й день интраперитонеально на 200 мл физиологического раствора. Интервал 21 день. Лечение получили 3 (9 %) больных;
– GemCap с интраперитонеальным введением цисплатина: гемзар 800 мг/м2, внутривенная инфузия, в 1-й и 8-й дни; цисплатин 50 мг интраперитонеально на 200 мл физиологического раствора, в 4-й день; капецитабин 1500 мг/м2, в течение 14 дней. Интервал 21 день. Лечение получили 4 (11 %) больных.
Для оценки эффективности циторедуктивных операций у пациентов с РЖ с перитонеальной диссеминацией применяли 3 критерия: D – объем лимфодиссекции, R – резидуальная опухоль по границам резекции и полнота циторедукции (CC Score). В качестве факторов прогноза использовались индекс перитонеального канцероматоза PCI и статус N (табл. 1). Объем циторедуктивных операций в обеих группах был одинаковым (паллиативная гастрэктомия по Ру с лимфодиссекцией D2, перитонэктомией). В основной группе операция дополнялась имплантацией перитонеальной порт-системы, для введения цитостатиков в брюшную полость. Учитывая наличие распространенных опухолевых процессов (тотальное и субтотальное поражение), всем пациентам выполнялась гастрэктомия. Критерии RECIST 1.1 использованы для оценки объективного эффекта на послеоперационную химиотерапию. Послеоперационные осложнения оценивались по классификации Clavien–Dindo; нежелательные явления в процессе послеоперационной химиотерапии – по критериям CTCAE, версия 4.03.
Статистический анализ проведён с использованием прикладного пакета «IBM SPSS Statistics» версии 22.0 (IBM Corp., USA). Для анализа общей выживаемости, безрецидивной выживаемости и медианы до прогрессирования заболевания использовались кривые выживаемости Каплана– Майера. Сравнение достоверности различий между группами проводилось с помощью LogRank test. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты
Сравниваемые группы не имели значимых различий по исходной распространенности процесса и объемам циторедуктивных операций (табл. 2). В обеих группах было одинаковое количество
Òàблицà 1/Table 1
Êðитåðии îцåнêи ñтåпåни диññåминàции и пîлнîты цитîðåдóêции и N-ñтàтóñCriteria for assessing the degree of dissemination and completeness of cytoreduction and N-status
|
Основная группа/ Показатель/Parameter Study group (n=35) |
Контрольная группа/ Control group (n=35) |
p-значение U-критерия Манна–Уитни или χ2-критерия Пирсона/ p-value Mann–Whitney U-test or χ2-Pearson test |
|
|
Индекс перитонеального канцероматоза (PCI ≥12)/Peritoneal Cancer Index (PCI ≥12) |
|||
|
PCI (0–4) |
10 (29 %) |
8 (23 %) |
|
|
PCI (5–8) |
11 (31 %) |
14 (40 %) |
χ2=5,39 р=0,067 |
|
PCI (9–12) |
14 (40 %) |
13 (37 %) |
|
|
R |
– резидуальная опухоль по границе резекции/R – residual tumor along the resection border |
||
|
R0 |
18 (51 %) |
14 (40 %) |
|
|
R1 |
7 (20 %) |
15 (43 %) |
χ2=7,41 р=0,006 |
|
R2 |
10 (29 %) |
6 (17 %) |
|
|
CC Score – шкала оценки полноты циторедукции/Completeness of Cytoreduction Score (CC Score) |
|||
|
CC-0 score |
16 (45 %) |
11 (31 %) |
|
|
CC-1 score |
10 (29 %) |
11 (31 %) |
χ2=2,83 |
|
CC-2 score |
6 (17 %) |
8 (23 %) |
р=0,419 |
|
CC-3 score |
3 (9 %) |
5 (14 %) |
|
|
D – объем лимфодиссекции/D – volume of lymph dissection |
|||
|
D1+ |
13 (37 %) |
16 (45 %) |
χ2=11,94 |
|
D2 |
22 (63 %) |
19 (55 %) |
р=0,003 |
|
N – статус (количество удаленных метастатических лимфоузлов)/N – |
status (number of removed metastatic lymph nodes) |
||
|
N1 |
8 (14 %) |
3 (14 %) |
|
|
N2 |
6 (17 %) |
11 (17 %) |
χ2=3,02 р=0,082 |
|
N3 |
21 (60 %) |
21 (60 %) |
|
Òàблицà 2/Table 2
Îбúåмы îпåðàтивнîгî вмåшàтåльñтвà и пîñлåîпåðàциîнныå îñлîжнåния Extent of surgery and postoperative complications
В сравниваемых группах значимых различий по характеру послеоперационных осложнений не выявлено (табл. 3). В основной группе осложнения IA степени составили 51 %, IB – 20 % (панкреатит у 7 пациентов, купировался медикаментозно), IIA – 11 % (анастомозит у 4 пациентов, купировался медикаментозно), IIB – 9 % (стеноз анастомоза, требовалось выполнение 2–3 процедур баллонной дилатации), IIC – 3 % (недостаточность анастомоза, потребовалось зондовое питание в течение 12 сут, после чего недостаточность анастомоза купировалась), IIIА – 6 % (абсцесс ложа селезенки, проводилось дренирование ложа селезенки под УЗИ-навигацией). В группе контроля IA – 40 %, IB – 11 % (панкреатит у 4 пациентов, купировался медикаментозно), IIA – 17 % (анастомозит у 6 пациентов, купировался медикаментозно), IIB – 6 % (стеноз анастомоза, требовалось выполнение 2–3 процедур баллонной дилатации), IIC – 6 % (недостаточность анастомоза, потребовалась установка пищеводных стентов на два месяца), IIIА – 15 % (абсцесс ложа селезенки у 3 (9 %) пациентов и панкреонекроз хвоста поджелудочной железы у 2 (6 %) пациентов со спленэктомией – дренирование ложа селезенки под УЗИ-навигацией). Случаев послеоперационной летальности в обеих группах не было.
Нежелательные явления (НЖЯ) в процессе химиотерапии в обеих группах носили кратковременный и обратимый характер. Наиболее частым НЖЯ была гематологическая токсичность (45,5 %), выраженность которой соответствовала I–II степе-
,00 5,00 10,00 15,00 20,00 25,00 30,00 35,00 40,00 Время, месяц / Time, month
|
Схема химиотерапии/ Chemotherapy regimen |
Медиана выживаемости без прогрессирования, мес/ Median progression-free survival, month |
|
l.FOLFIRI + C |
18,5 (95 % CI 14,595-22,405) |
|
2. XELIRI + C |
17,2 (95 % CI 13,607-20,793) |
|
3.TPFL + C |
13,8 (95 % CI 10,207-17,393) |
|
4. PC |
14,0 (95 % CI 12,720-15,280) |
|
5. GemCap + C |
11,5 (95 % CI 11,010-11,990) |
|
6. FOLFOX (контроль/control) |
11,5 (95 % CI 11,156-11,844) |
|
Bcero/Total |
12,4 (95 % CI 11,125-13,675) |
П---------- 1---------- 1----------1----------1----------1----------1----------1----------1—
,00 5,00 10,00 15,00 20,00 25,00 30,00 35,00 40,00
Время, месяц / Time, month
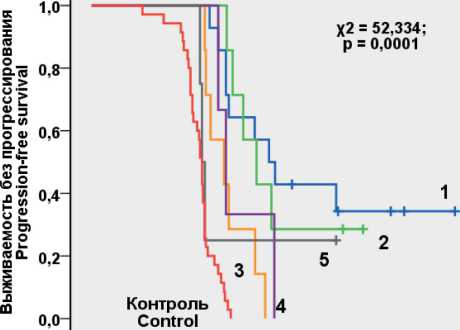
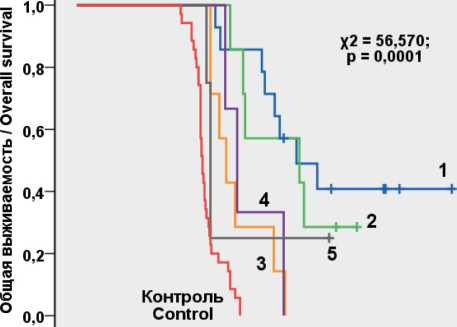
Сроки наблюдения за больными составили от 10 до 37,9 мес. В основной группе медиана ВБП составила 15,8 мес, с интерквартильным размахом (13,5–19,1), в группе контроля – 11,2 (10,3–11,6) мес (р<0,001; χ2=47,662). Медиана ОВ в основной группе составила 18,7 мес, с интерквартильным размахом (15,0–24,3), в контрольной группе – 12,7 (11.3–13.1) мес (р<0,001; χ2=50,731).
В основной группе удалось достичь 1-летней выживаемости у 35 (100 %), 2-летней – у 9 (27 %), 3-летней – у 1 (3 %) пациента. В группе контроля показатели двух- и трехлетней выживаемости не получены, срок одного года после завершения лечения пережили 29 (87 %) больных, у остальных (n=6) пациентов продолжительность жизни менее 1 года (рис. 2). В основной группе даже при разделении на подгруппы, в зависимости от получаемой комбинации цитостатиков, отмечены значимые различия по сравнению с пациентами контрольной группы, которым проводилась эмпирически назначенная схема FOLFOX. Наилучшая выживаемость наблюдалась у пациентов (n=14), получавших персонализированно назначенную схему FOLFIRI с интраперитонеальным введением цисплатина. Из них 6 больных живы и находятся под наблюдением, в том числе 5 – без признаков прогрессирования. Медиана общей выживаемости в этой подгруппе, составила 22,2 (15,9–28,4) мес.
Обсуждение
По данным литературы, медиана общей выживаемости больных РЖ с ПК без лечения составляет 5,6 мес [25]; при системной химиотерапии без циторедукции – 10,2 мес [26]; после циторедуктивных операций в комбинации с системной химиотерапией (в нашем исследовании это группа контроля) – 12,7 мес [27]. По данным A.C. Gamboa et al., при использовании в комбинации CRS + HIPEC при лечении больных РЖ с ПК медиана общей выживаемости составила 14,4 мес, но было показано, что у пациентов с высоким индексом канцероматоза >12 не получено преимуществ от этого метода лечения [28].
Таким образом, медиана ОВ (18,7 мес) по результатам нашего исследования выше, чем в группе контроля и при описанных в мировой ли- тературе исследованиях (CRS + HIPEC). Кроме того, пациенты, персонализированно получавшие схему FOLFIRI с интраперитонеальным введением цисплатина, имели еще большую выживаемость – 22,2 (15,9–28,4) мес. Ранее было показано, что медиана выживаемости без прогрессирования эмпирически назначенных схем химиотерапии с препаратами платины, фторурацила, иринотекана и лекойворина (без проведения циторедуктивной операции) не превышает 6,8 (2,6–11,1) – 11,3 (9,3–13,3) мес [29]. В исследовании китайских авторов пациентам проводили терапию по схемам FOLFIRI или FOLFOX без циторедукции, и медиана общей выживаемости составила 9,9 (6,0–13,5) и 12,0 (10,3–13,7) мес соответственно [30]. Эти данные сравнимы с выживаемостью в нашей группе контроля, в которой пациентам еще и выполнялась циторедукция. Можно полагать, что она не сыграла значительной роли в увеличении выживаемости при эмпирическом назначении схемы FOLFOX. С помощью персонифицированного подбора режима химиотерапии и циторедуктивной операции удалось увеличить медиану ВБП в основной группе на 4,6 мес (на 29,1 %) и медиану ОВ на 6 мес (на 32 %). При этом 9 (27 %) пациентов в основной группе живы по настоящее время, из них у 8 (23 %) не выявлено признаков прогрессирования заболевания при продолжительности наблюдения от 20,9 до 37,9 мес.
Анализ объемов циторедуктивного оперативного вмешательства у этих пациентов показывает, что им была выполнена оптимальная циторедукция: лимфодиссекция D2, R0-резекция, полнота циторедукции – CC0. При этом статус PCI соответствовал 0–4, статус N – 1. Исключение составляет один пациент (прогрессирование на 25,5 мес наблюдения, жив по настоящее время, продолжительность жизни – 31 мес), которому была выполнена неоптимальная циторедукция: исходный PCI=9, выполнена лимфодиссекция D1+ (не удален конгломерат лимфоузлов в области чревного ствола, размером 6 см), R1-резекция (положительный край по дистальной границе резекции), полнота циторедукции – CC2, по результатам гистологического исследования статус N – 3 (метастазы в 13 из 30 удаленных лимфоузлов). В данном случае можно говорить о непосредственной эффективности персонифицированного режима химиотерапии, так как через 6 мес после операции при контрольном обследовании отмечена частичная регрессия неудаленных метастатических лимфоузлов в области чревного ствола, прогрессирование наступило на сроке 25,5 мес в виде двустороннего метастатического плеврита и множественных метастазов в легкие.
Заключение
Список литературы Комбинированное лечение больных раком желудка IV стадии с канцероматозом брюшины
- Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre L.A., Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018; 68(6): 394-424. https://doi.org/10.3322/caac.21492. Erratum in: CA Cancer J Clin. 2020; 70(4): 313.
- Stepanov I.V., Paderov Yu.M., Afanas'ev S.G. Peritoneal'nyi kantseromatoz. Sibirskii onkologicheskii zhurnal. 2014; 5: 45-53.
- Zlokachestvennye novoobrazovaniya v Rossii v 2019 godu (zabolevaemost' i smertnost'). Pod red. A.D. Kaprina, V.V. Starinskogo, G.V. Petrovoi. M., 2020. 252 s. https://doi.org/10.20517/2394-4722.2017.75.
- Boerner T., Piso P. A narrative review of intraperitoneal chemotherapy and cytoreductive surgery (CRS) for peritoneal metastases in gastric cancer. J Gastrointest Oncol. 2021; 12(Suppl 1): 59-67. https://doi.org/10.21037/jgo-20-284.
- Yonemura Y., Prabhu A., Sako S., Ishibashi H., Mizumoto A., Takao N., Ichinose M., Motoi S., Liu Y., Nishihara K., Brandl A., Fushida S. Long Term Survival after Cytoreductive Surgery Combined with Perioperative Chemotherapy in Gastric Cancer Patients with Peritoneal Metastasis. Cancers (Basel). 2020; 12(1): 116. https://doi.org/10.3390/cancers12010116.
- Fujitani K., Yang H.K., Mizusawa J., Kim Y.W., Terashima M., Han S.U., Iwasaki Y., Hyung W.J., Takagane A., Park D.J., Yoshikawa T., Hahn S., Nakamura K., Park C.H., Kurokawa Y., Bang Y.J., Park B.J., Sasako M., Tsujinaka T.; REGATTA study investigators. Gastrectomy plus chemotherapy versus chemotherapy alone for advanced gastric cancer with a single non-curable factor (REGATTA): a phase 3, randomised controlled trial. Lancet Oncol. 2016; 17(3): 309-18. https://doi.org/10.1016/S14702045(15)00553-7.
- Llueca A., Climent M.T., Escrig J., Carrasco P., Serra A.; MUAPOS working group (Multidisciplinary Unit of Abdominal Pelvic Oncology Surgery). Validation of three predictive models for suboptimal cytoreductive surgery in advanced ovarian cancer. Sci Rep. 2021; 11(1): 8111. https://doi.org/10.1038/s41598-021-86928-2.
- Zhang C., Patel A., Hegeholz D., Brown K., Shostrom V., Pottebaum M., Foster J.M. Cytoreductive Surgery with HIPEC is a Safe and Effective Palliative Option in Chemorefractory Symptomatic Peritoneal Metastasis. Ann Surg Oncol. 2022; 29(5): 3337-46. https://doi.org/10.1245/s10434022-11323-8.
- Afanas'ev S.G., Dobrodeev A.Yu. Tsitoreduktivnye operatsii (Nuzhno li udalyat' pervichnuyu opukhol'? Gde predel razumnoi tsitoreduktsii?). Prakticheskaya onkologiya. 2014; 15(2): 93-100.
- Yonemura Y., Fong Y., Gamblin T., Han E., Lee B., Zager J. Role of Hyperthermic Intraperitoneal Chemotherapy (HIPEC) in the Treatment of Peritoneal Metastasis of Gastric Cancer. Cancer Reg Ther. 2020; 113-24. https://doi.org/10.1007/978-3-030-28891-4_10.
- Yonemura Y., Iahibashi H., Sako S., Mizumoto A., Takao N., Ichinose M., Motoi S., Liu Y., Wakama S., Kamada Y., Nishihara K. Advances with pharmacotherapy for peritoneal metastasis. Expert Opin Pharmacother. 2020; 21(16): 2057-66. https://doi.org/10.1080/14656566.2020.1793957.
- Chia C.S., You B., Decullier E., Vaudoyer D., Lorimier G., Abboud K., Bereder J.M., Arvieux C., Boschetti G., Glehen O.; BIG RENAPE Group. Patients with Peritoneal Carcinomatosis from Gastric Cancer Treated with Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy: Is Cure a Possibility? Ann Surg Oncol. 2016; 23(6): 1971-9. https://doi.org/10.1245/s10434-015-5081-3.
- Macedo F., Ladeira K., Longatto-Filho A., Martins S.F. Gastric cancer treated with pressurized intraperitoneal aerosol chemotherapy: revising an option for peritoneal carcinomatosis. J Cancer Metastasis Treat 2018; 4: 8. https://doi.org/10.20517/2394-4722.2017.72.
- Maeda H., Kobayashi M., Sakamoto J. Evaluation and treatment of malignant ascites secondary to gastric cancer. World J Gastroenterol. 2015; 21(39): 10936-47. https://doi.org/10.3748/wjg.v21.i39.10936.
- Sugarbaker P.H. Stomach cancer: prevention and treatment of metastases in the peritoneum. J Treatment of cancer metastases 2018, 4: 7. https://doi.org/10.20517/2394-4722.2017.67.
- Cisło M., Filip A.A., Arnold Offerhaus G.J., Ciseł B., RawiczPruszyński K., Skierucha M., Polkowski W.P. Distinct molecular subtypes of gastric cancer: from Laurén to molecular pathology. Oncotarget. 2018; 9(27): 19427-42. https://doi.org/10.18632/oncotarget.24827.
- Rodionov E.O., Miller S.V., Efteev L.A., Tuzikov S.A., Tsyganov M.M., Deryusheva I.V., Litvyakov N.V., Markovich V.A., Urmonov U.B. Kombinirovannoe lechenie bol'nykh nemelkokletochnym rakom legkogo s personalizirovannym naznacheniem ad"yuvantnoi khimioterapii. Vestnik Avitsenny. 2019; 21(3): 420-5. https://doi.org/10.25005/2074-0581-2019-21-3-420-425.
- Kazantseva P.V., Slonimskaya E.M., Litvyakov N.V. Personalizirovannyi podkhod k naznacheniyu neoad"yuvantnoi khimioterapii bol'nym s lyuminal'nym V rakom molochnoi zhelezy na osnovanii molekulyarno-geneticheskikh kharakteristik opukholi. Zlokachestvennye opukholi. 2015; 4(s2): 354-5.
- Tsyganov M.M., Rodionov E.O., Ibragimova M.K., Miller S.V., Cheremisina O.V., Frolova I.G., Tuzikov S.A., Litviakov N.V. Personalized Prescription of Chemotherapy Based on Assessment of mRNA Expression of BRCA1, RRM1, ERCC1, TOP1, TOP2α, TUBβ3, TYMS, and GSTP1 Genes in Tumors Compared to Standard Chemotherapy in the Treatment of Non-Small-Cell Lung Cancer. J Pers Med. 2022; 12(10): 1647. https://doi.org/10.3390/jpm12101647.
- Litviakov N.V., Ibragimova M.K., Tsyganov M.M., Kazantseva P.V., Doroshenko A.V., Garbukov E.Y., Frolova I.G., Slonimskaya E.M. Amplifications of Stemness Gene Loci-New Markers for the Determination of the Need for Neoadjuvant Chemotherapy for Patients with Breast Cancer. A Prospective Study. J Pers Med. 2021; 11(5): 397. https://doi.org/10.3390/jpm11050397.
- Tsyganov M.M., Rodionov E.O., Deryusheva I.V., Miller S.V., Ibragimova M.K., Pisareva L.F., Kzhyshkovskaya Yu.G., Tuzikov S.A., Cherdyntseva N.V., Litvyakov N.V. Otsenka prognosticheskoi znachimosti ekspressii genov monorezistentnosti v opukholi bol'nykh nemelkokletochnym rakom legkogo posle predoperatsionnoi khimioterapii. Voprosy onkologii. 2017; 63(1): 122-7.
- Markovich V.A., Tuzikov S.A., Popova N.O., Rodionov E.O., Miller S.V., Levonyan L.V., Tsydenova I.A., Ibragimova M.K., Tsyganov M.M., Litvyakov N.V., Podol'ko D.V. Sposob kombinirovannogo lecheniya rezektabel'nogo mestnorasprostranennogo raka zheludka s kantseromatozom bryushiny, s primeneniem personalizirovannoi sistemnoi i intraperitoneal'noi khimioterapii. Patent RF
- № 2773100. Opubl. 30.05.2022.
- Besova N.S., Bolotina L.V., Gamayunov S.V., Kalinin A.E., Kozlov N.A., Malikhova O.A., Nered S.N., Pirogov S.S., Protsenko S.A., Stilidi I.S., Ter-Ovanesov M.D., Tryakin A.A., Khomyakov V.M., Chernykh M.V. Prakticheskie rekomendatsii po lekarstvennomu lecheniyu raka zheludka. Zlokachestvennye opukholi: Prakticheskie rekomendatsii RUSSCO. 2022; 12(3s2): 382-400.
- Kono K., Yong V.P., Okayama H., Shabbir A., Momma T., Ohki S., Takenoshita S., So J. Intraperitoneal chemotherapy for stomach cancer with peritoneal disease: the experience of Singapore and Japan. Gastric Cancer. 2016; 122-7. https://doi.org/10.1007/s10120-016-0660-y.
- Takahashi N., Kanda M., Yoshikawa T., Takiguchi N., Fujitani K., Miyamoto K., Ito Y., Takayama O., Imano M., Mitsumori N., Sakamoto J., Morita S., Kodera Y. A randomized phase II multicenter trial to explore efficacy of weekly intraperitoneal in comparison with intravenous paclitaxel administered immediately after gastrectomy to the patients with high risk of peritoneal recurrence: final results of the INPACT trial. Gastric Cancer. 2018; 21(6): 1014-23. https://doi.org/10.1007/s10120-018-0817-y.
- Chia D.K.A., So J.B.Y. Recent Advances in Intra-peritoneal Chemotherapy for Gastric Cancer. J Gastric Cancer. 2020; 20(2): 115-26. https://doi.org/10.5230/jgc.2020.20.e15.
- Gamboa A.C., Winer J.H. Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy for Gastric Cancer. Cancers. 2019; 11(11): 1662. https://doi.org/10.3390/cancers11111662.
- Bouché O., Raoul J.L., Bonnetain F., Giovannini M., Etienne P.L., Lledo G., Arsène D., Paitel J.F., Guérin-Meyer V., Mitry E., Buecher B., Kaminsky M.C., Seitz J.F., Rougier P., Bedenne L., Milan C.; Fédération Francophone de Cancérologie Digestive Group. Randomized multicenter phase II trial of a biweekly regimen of fluorouracil and leucovorin (LV5FU2), LV5FU2 plus cisplatin, or LV5FU2 plus irinotecan in patients with previously untreated metastatic gastric cancer: a Federation Francophone de Cancerologie Digestive Group Study--FFCD 9803. J Clin Oncol. 2004; 22(21): 4319-28. https://doi.org/10.1200/JCO.2004.01.140.
- Wen F., Zheng H., Zhang P., Zhou J., Chen H., Zhou K., Li Q., Bi F. Patient-based cost-effectiveness analysis of FOLFIRI versus FOLFOX7 for advanced gastric adenocarcinoma in China: A 4-year prospective randomised phase II study. Eur J Cancer Care (Engl). 2020; 29(1). https://doi.org/10.1111/ecc.13196.


