Комбинированное лечение операбельного рака прямой кишки с негативными факторами прогноза: проспективное исследование
Автор: Кочкина С.О., Гордеев С.С., Петров К.С., Мамедли З.З.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 т.20, 2021 года.
Бесплатный доступ
Введение. Неоадъювантная химиотерапия (НАХТ) является потенциальной альтернативой химиолучевой терапии (ХЛТ) у больных раком прямой кишки (РПК) и позволяет провести раннюю профилактику отдаленного метастазирования. Цель исследования – изучить безопасность и эффективность НАХТ у больных раком верхне- и среднеампулярного отделов прямой кишки без поражения мезоректальной фасции. Материал и методы. В период с 2016 по 2019 г. в пилотное проспективное исследование было включено 136 больных раком верхнеампулярного (сmrt2-t4aN+m0, cmrt4aN0m0) и среднеампулярного (cmrt3сN0m0, cmrt2N+m0) отделов прямой кишки. Всем пациентам проводилось 4 курса НАХТ по схеме СарОх. Эффект оценивался на основании МРТ малого таза: при наличии регрессии или стабилизации выполняли хирургическое лечение, при прогрессировании – ХЛТ, затем операцию. После операции всем пациентам планировалось проведение адъювантной химиотерапии до суммарной продолжительности 6 мес. Первичной конечной точкой являлась частота полного лечебного патоморфоза (mandard tRg 1). Вторичные конечные точки включали частоту прогрессирования заболевания, токсичность (Nci-ctc v.5.0), послеоперационные осложнения (clavien-dindo), соблюдение режима химиотерапии и отдаленные результаты лечения. Результаты. У 15 из 130 (11 %) пациентов, которым до операции проводилась только НАХТ, диагностирован полный лечебный патоморфоз tRg 1. Полный курс химиотерапии суммарной продолжительностью 6 мес (НАХТ + адъювантная полихимиотерапия (ПХТ)) получили 99 (72,8 %) пациентов. После неоадъювантной химиотерапии 6 (4,3 %) пациентов были направлены на ХЛТ, из них 5 (3,67 %) в связи с локальным прогрессированием по данным МРТ, 1 (0,7 %) в связи с токсичностью iii степени на фоне 1 курса ПХТ и невозможностью продолжения химиотерапевтического лечения в запланированном объеме. Лучевая терапия у всех пациентов привела к частичной регрессии опухоли. Системного прогрессирования на фоне ПХТ не отмечено ни у одного пациента. Токсичность iii–iV степени была у 7 (5,1 %) пациентов и включала бронхоспазм (n=2, 1,4 %), тромбоцитопению (n=1, 0,7 %), нейтропению (n=1, 0,7 %), периферическую нейропатию (n=1, 0,7 %), кардиотоксичность (n=1, 0,7 %), диарею (n=1, 0,7 %). У 1 (0,7 %) пациентки отмечена токсичность V степени (острый инфаркт миокарда). Резекция R0 выполнена во всех случаях. Послеоперационные осложнения iiia степени встречались у 6 (4,4 %) пациентов, iiiB – у 5 (3,7 %), V степени (смерть) – у 1 (0,7 %) пациента из-за сепсиса на фоне послеоперационной пневмонии. Частота несостоятельности анастомоза составила 3,6 % (n=5). Медиана наблюдения – 31,4 мес. общая выживаемость и безрецидивная выживаемость – 94 и 92,8 % соответственно. Заключение. Неоадъювантная химиотерапия является перспективным вариантом лечения больных раком прямой кишки с негативными прогностическими факторами.
Рак прямой кишки, неоадъювантная химиотерапия, химиолучевая терапия, факторы прогноза, токсичность, общая выживаемость, безрецидивная выживаемость
Короткий адрес: https://sciup.org/140254533
IDR: 140254533 | УДК: 616.351-006.6-08-036:615.28 | DOI: 10.21294/1814-4861-2021-20-4-49-56
Текст научной статьи Комбинированное лечение операбельного рака прямой кишки с негативными факторами прогноза: проспективное исследование
Предоперационная химиолучевая терапия (ХЛТ) показана большинству больных раком среднеампулярного отдела прямой кишки и больным местнораспространенным раком верхнеампулярного отдела прямой кишки [1–3]. Несмотря на улучшение локорегионарного контроля, такая стратегия не приводит к значимому повышению общей выживаемости [4, 5]. В то же время ХЛТ может сопровождаться рядом хронических лучевых реакций. У пациентов после низких резекций прямой кишки, получивших такое лечение, выше частота повторных операций, стойких нарушений работы мочеполовой системы: дисфункции сфинктера, недержание мочи, нарушения сексуальной функции. Кроме того, у больных, получавших химиолучевую терапию, выше риск развития метахронных опухолей [6, 7].
Развитие современных технологий предоперационной диагностики позволяет использовать селективный подход к назначению предоперационной ХЛТ. Широко обсуждается возможность ограничения показаний к ХЛТ, в том числе у пациентов с поражением мезоректальных лимфатических узлов, но отсутствием поражения циркулярной границы резекции [8, 9]. При качественном дооперационном МРТ-стадировании можно более обоснованно проводить селекцию больных с потенциально высоким риском вовлечения границ резекции и выбрать кандидатов для хирургического лечения. Частота локальных рецидивов при селекции пациентов группы промежуточного риска без поражения циркулярной границы резекции, по данным F. Taylor et al., может составлять всего 3,3 % без предоперационного лечения [10]. Данные этих исследований послужили причиной выделе- ния чисто хирургического лечения как возможной опции для ряда больных раком средне- и верхнеампулярного отдела прямой кишки в клинических рекомендациях ESMO, АОР и NCCN [1, 3, 8].
Однако даже при возможности выполнения резекций в объеме R0 прогрессирование рака после радикального лечения остается актуальной и нерешенной проблемой [11]. Кроме того, данные о возможности ограничения использования ХЛТ взяты из исследований с высоким качеством и двойным контролем заключений МРТ. Вопрос о воспроизводимости этих результатов в широкой клинической практике остается открытым.
Основанием для разработки новой схемы лечения послужили данные исследований о применении неоадъювантной химиотерапии (НАХТ). Частота достижения полного морфологического ответа на лечение после предоперационной химиотерапии (ХТ) (7,3–25 %) незначительно уступает аналогичным показателям после ХЛТ [12–15]. Вопрос о том, может ли НАХТ обеспечить дополнительный локальный и системный контроль и сделать безопасным отказ от использования ХЛТ у больных раком прямой кишки группы промежуточного риска, остается открытым.
Цель исследования – изучение безопасности и эффективности НАХТ у больных раком верхне-и среднеампулярного отделов прямой кишки без поражения мезоректальной фасции.
Материал и методы
В период с 2016 по 2019 г. в пилотное проспективное исследование были включены больные раком (гистологически подтвержденная аденокарцинома) верхнеампулярного Т4аN0M0, T2–3N+М0 и среднеампулярного отделов прямой кишки T3cN0M0, Т2/N+М0, CRM-. Все пациенты дали письменное информированное согласие до начала исследования.
Критериями исключения были: возраст старше 80 лет, предшествующая химио- или лучевая терапия, наличие отдаленных метастазов, первичномножественный синхронный или метахронный рак, беременность и лактация, индивидуальная непереносимость компонентов лечения, наличие клинически значимых сопутствующих заболеваний, потенциально требующих изменения плана лечения, ECOG>2.
Всем пациентам проводилось 4 курса неоадъювантной химиотерапии с последующей оценкой эффекта по данным МРТ. При регрессии опухоли или стабилизации проводили хирургическое лечение и в последующем 4 курса адъювантной химиотерапии СарОх. При локальном прогрессировании – курс химиолучевой терапии, операцию, после операции – 2 курса химиотерапии СарОх (число курсов в адъювантном режиме редуцировано ввиду наличия химиотерапевтического компонента лечения в период лучевой терапии).
Основным оцениваемым параметром была частота достижения полного морфологического ответа (рСR). При возможности достижения частоты pCR выше 10 % планировалось продолжить изучение НАХТ в рамках рандомизированного клинического исследования III фазы.
Дополнительными оцениваемыми параметрами были: частота осложнений НАХТ (NCI-CTCAE v.5.0), частота R0 резекций, частота послеоперационных осложнений (Clavien-Dindo), частота проведения химиотерапии в полном объеме (8 курсов СарОх), частота рецидивов, метастазов, 2-летняя общая и безрецидивная выживаемость.
Всем больным перед началом лечения проводили обследование в объеме пальцевого ректального исследования, ректоскопии, компьютерной томографии (КТ) грудной клетки и КТ брюшной полости c внутривенным контрастированием, МРТ малого таза, колоноскопии и определения экспрессии раково-эмбрионального антигена. Для определения стадии заболевания использовали TNM-классификацию (UICC) 7-го пересмотра. Локализацию опухоли определяли с помощью ригидной ректоскопии. Радикальные сфинктеросохраняющие операции выполняли в разном объеме в зависимости от локализации опухоли в прямой кишке. МРТ малого таза повторяли после НАХТ и после ХЛТ, в случае ее проведения.
Всем пациентам проводилось 4 курса НАХТ по схеме: оксалиплатин (130 мг/м2) в 1-й день, капецитабин перорально в дозе 2000 мг/м2/день, разделен на две суточные дозы в течение 14 дней, а затем 7 дней перерыв. При регрессии опухоли по данным МРТ не менее чем на 20 % выполняли хирургическое лечение через 2–4 нед. При регрессии опухоли менее 20 % или локальном прогрессировании проводили курс ХЛТ (РОД 2 Гр, СОД 50 Гр на фоне химиотерапии капецитабином 825 мг/м2 два раза в сут per os в дни лучевой терапии), затем хирургическое лечение через 8–12 нед.
Хирургический доступ (открытый или лапароскопический) определялся оперирующим хирургом, объем операции (тотальная или парциальная мезоректумэктомия) исходя из локализации опухоли. Послеоперационную химиотерапию начинали через 8 нед после операции. Проводили химиотерапию СарОх до общей продолжительности 6 мес (дополнительно 4 курса после НАХТ или 2 курса после НАХТ и ХЛТ).
Контрольные обследования проводили каждые 3 мес. Всякий раз выполняли клинический осмотр, УЗИ брюшной полости и РЭА. Дважды в год выполняли КТ грудной и брюшной полости с внутривенным контрастированием, МРТ малого таза и ежегодно колоноскопию.
Для расчета отдаленных результатов лечения использовали программу SPSS (IBM SPSS Statistics for Macintosh, version 23.0, IBM Corp, Armonk, NY). Показатели общей выживаемости считали со
Таблица 1/table 1
Общая характеристика исследуемой группы general characteristics of the study group
Результаты
В исследование были включены 136 пациентов (табл. 1). Всего было 67 мужчин и 69 женщин, средний возраст составлял 59,3 года (28–85 лет). Все 4 курса НАХТ завершили 129 (94,9 %) пациентов. В связи с осложнениями III степени и выше 5 (3,7 %) пациентам проведено менее 4 курсов НАХТ. Из них 3 (2,2 %) – 3 курса полихимиотерапии (ПХТ), в дальнейшем проведена оценка эффекта и хирургическое лечение или ХЛТ, 2 – по 1 курсу ПХТ (из них 1 пациенту с локализацией опухоли в верхнеампулярном отделе прямой кишки выполнена операция, второму – ХЛТ). В связи с прогрессированием на фоне НАХТ 5 (3,67 %) пациентам выполнена ХЛТ.
Токсичность при НАХТ наблюдалась в 50 (37,7 %) случаях (табл. 2). Частота осложнений III–IV степени составила 5 (3,7 %), 1 (0,7 %) пациентка погибла от острого инфаркта миокарда на фоне НАХТ. Химиотерапию без изменений (4 курса до операции, 4 – после) завершили 99 паци- ентов (72,8 %). Не смогли получить адъювантную химиотерапию по различным причинам 29 (21,3 %) пациентов. Остальным 8 (5,9 %) провели менее 4 курсов адъювантной ПХТ из-за токсичности III степени.
После проведения НАХТ снижение клинической стадии Т – у 37 (28 %) пациентов, увеличение стадии Т отмечено у 4 (3 %) пациентов (табл. 3). После НАХТ снижение клинической стадии N отмечено в 62 (47 %), увеличение клинической стадии N – в 5 (3,8 %) случаях (табл. 4).
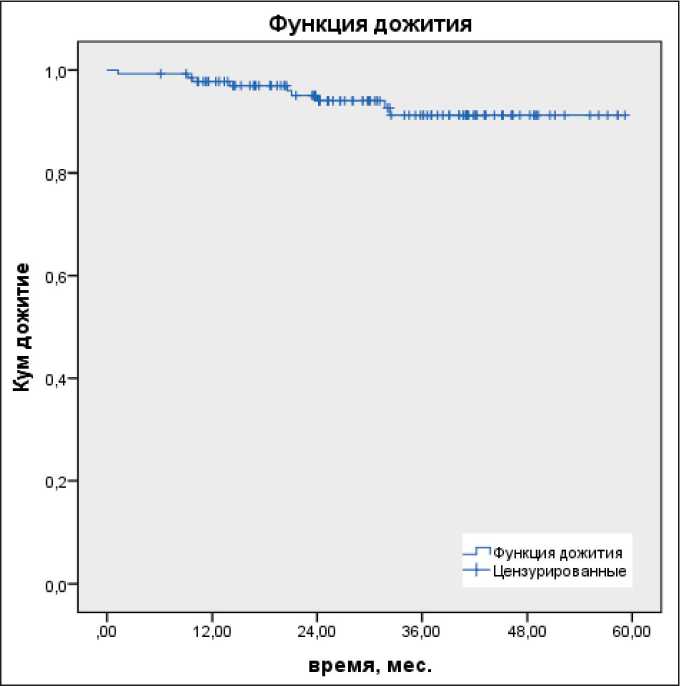
Рис. 1. Общая 2-летняя выживаемость
Fig. 1. Overall 2-year survival
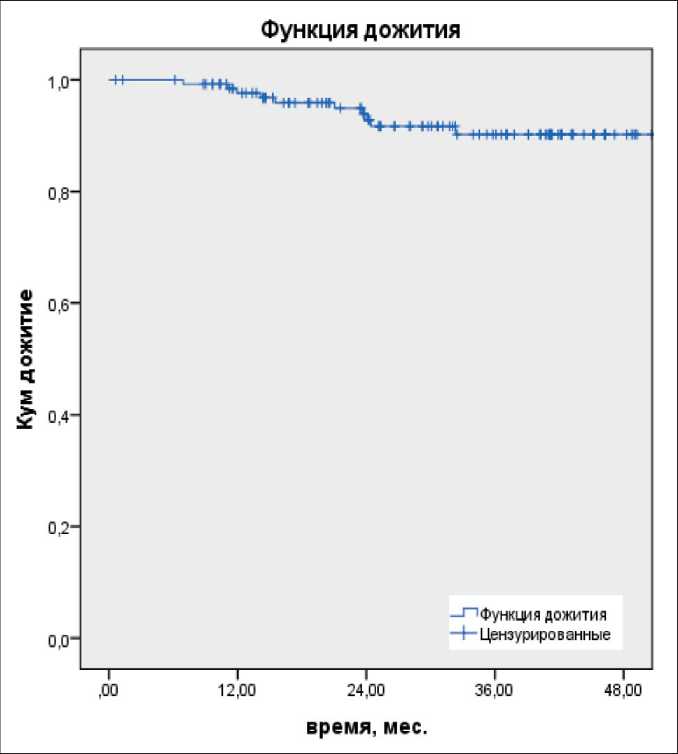
Рис. 2. Безрецидивная 2-летняя выживаемость
Fig. 2. Recurrence-free 2-year survival
|
Осложнения химиотерапии complications of chemotherapy |
Таблица 2/table 2 |
||
|
Токсичность/ Toxicity |
I–II |
Степень/Grade III–IV |
Всего/Total |
|
Максимальная зарегистрированная токсичность/ Maximum toxicity , |
7 (5,1 %) |
50 (37,7 %) |
|
|
Тошнота/Nausea |
33 (24,2 %) |
– |
33 (24,2 %) |
|
Диарея/Diarrhea |
15 (11 %) |
1 (0,7 %) |
16 (11,7 %) |
|
Рвота/Vomiting |
9 (6,6 %) |
– |
9 (6,6 %) |
|
Лейкопения/Leukopenia |
6 (4,4 %) |
– |
6 (4,4 %) |
|
Нейтропения/Neutropenia |
6 (4,4 %) |
1 (0,7 %) |
6 (4,4 %) |
|
Тромбоцитопения/Thrombocytopenia 9 (6,6 %) |
1 (0,7 %) |
10 (7,3 %) |
|
|
Периферическая нейропатия/Peripheral neuropathy 12 (8,8 %) |
1 (0,7 %) |
13 (9,5 %) |
|
|
Кардиотоксичность/Cardiotoxicity – |
1 (0,7 %) |
1 (0,7 %) |
|
|
Клиническая стадия Т до и после проведения НАХТ |
Таблица 3/table 3 |
||
|
clinical stage t before and after Nact |
|||
|
Стадия/Stage mrT |
Снижение стадии ymrT/ Decrease in ymrT stage |
Увеличение стадии ymrT/ Increase in ymrT stage |
Ymr T0 |
|
T2 15 (100 %) |
1 (6,7 %) |
0 |
0 |
|
T3a 11 (100 %) |
6 (54,6 %) |
0 |
1 (9,1 %) |
|
T3b 41 (100 %) |
14(34,2 %) |
4 (9,8 %) |
4 (9,8 %) |
|
T3c 10 (100 %) |
6 (60 %) |
0 |
0 |
|
T4a 59 (43 %) |
10 (17 %) |
0 |
0 |
|
Клиническая стадия N до и после проведения НАХТ |
Таблица 4/table 4 |
||
|
clinical stage N before and after Nact |
|||
|
Стадия/Stage mrN |
Снижение стадии ymrN/ Decrease in the ymrT stage |
Увеличение стадии ymrN/ Increase in ymrT stage |
Ymr N0 |
|
N0 22 (100 %) |
– |
2 (7,4 %) |
25(92,6%) |
|
N+ 108 (100 %) |
62 (47 %) |
3 (4,8%) |
45 (34 %) |
Таблица 5/table 5
Послеоперационные осложнения (clavien–dindo)postoperative complications (clavien–dindo)
|
Осложнение/Complications |
Количество больных/Number of patients |
|
Grade I |
4 (2,9 %) |
|
Grade II |
8 (5,9 %) |
|
Grade IIIa |
6 (4,4 %) |
|
Grade IIIb |
5 (3,7 %) |
|
Grade V |
1 (0,7 %) |
Сфинктеросохраняющие операции выполнены всем больным. Из 135 пациентов у 11 (8,1 %) возникли послеоперационные осложнения III степени, в том числе у 6 (4,4 %) больных – IIIА степени, у 5 (3,7 %) – IIIВ степени, из них несостоятельность анастомоза наблюдалась у 5 (3,6 %) пациентов. Другими распространенными послеоперационными осложнениями были атония мочевого пузыря, раневые инфекции (табл. 5).
Резекция R0 выполнена во всех случаях. Лечебный патоморфоз был оценен в подгруппе пациентов, которые получали только НАХТ, –
130 пациентов. У 15 пациентов из 130 (11,0 %) наблюдался полный лечебный патоморфоз TRG1. У 14 (10,3 %) пациентов не отмечено признаков регрессии опухоли TRG5.
Медиана наблюдения всех пациентов составила 31,4 мес, частота прогрессирования составила 11 (8,1 %). У 2 (1,5 %) пациентов отмечен местный рецидив, отдаленные метастазы – у 12 (8,8 %) больных. Показатели 2-летней общей и безре-цидивной выживаемости составили 94 и 92,8 % соответственно (рис. 1, 2).
Обсуждение
В нашем проспективном исследовании мы оценивали эффективность и безопасность ПХТ по схеме CapОx как в неоадъювантном, так и в адъювантном режимах у больных раком прямой кишки с негативными факторами прогноза без поражения мезоректальной фасции. Эти пациенты являлись потенциальными кандидатами на адъювантную химиотерапию, если стадия cT4 или cN+ будет подтверждена морфологически. Показатель полного лечебного патоморфоза в нашем исследовании (11 %) оказался ниже по сравнению с рядом других исследований, где применялась неоадъювантная химиотерапия по схеме CapOx: в исследовании CORONA I –12,2 % [16], GEMCAD 0801 – 15 % [15]. Однако этот показатель выше, чем в исследовании J. Nishimura et al., 2014 г. (4,3 %), где проводилась неоадъювантная ПХТ по схеме СарОх с бевацизумабом, и в исследовании 2018 г., в котором проводилась ПХТ по схеме СарОх, – 7,3 % [17–19].
Одним из важных оцениваемых параметров была частота завершения полного курса ХТ. Полный цикл адъювантной ПХТ преимущественно за счет переноса части адъювантной химиотерапии (4 курса) в неоадъювантный режим получили 99 (72,8 %) пациентов. В работе T. Kamiya et al. [16] при аналогичной схеме лечения (4 курса ПХТ по схеме СарОх до операции и 4 курса после) частота завершения лечения в группе НАХТ составила 90,3 %. Однако при адъювантной ХТ этот показатель снижался до 51,7 %. По данным K. Danno et al., частота завершения лечения адъювантной ПХТ по схеме CapOx у больных раком толстой кишки III стадии составила 84,7 % при 4 курсах и 48,4 % при 8 курсах ПХТ. Таким образом, перенос адъювантной химиотерапии в предоперационный период может значительно повысить приверженность пациентов к лечению и, таким образом, повлиять на его отдаленные результаты. В нашей работе 2-летняя безрецидивная выживаемость и общая выживаемость составили 92,8 и 94 % соответственно. Эти показатели выше, чем в клиническом исследовании II фазы J. Nishimura et al., где показатели равнялись 71,6 и 92,7 % соответственно [18]. Однако D. Schrag et al. продемонстрировали показатели 4-летней общей выживаемости и без-рецидивной выживаемости, равные 91 и 84 %,
Список литературы Комбинированное лечение операбельного рака прямой кишки с негативными факторами прогноза: проспективное исследование
- Assotsiatsiya onkologov Rossii. Klinicheskie rekomendatsii po lecheniyu raka pryamoi kishki. 2020. 78 s.
- Abraha I., Aristei C., Palumbo I., Lupattelli M., Trastulli S., Cirocchi R., De Florio R., Valentini V. Preoperative radiotherapy and curative surgery for the management of localised rectal carcinoma. Cochrane Database Syst Rev. 2018 Oct 3; 10(10): CD002102. https://doi.org/10.1002/14651858.CD002102.pub3.
- NCCN Guidelines. Rectal cancer. 2020; 12.
- Sebag-Montefiore D., Stephens R.J., Steele R., Monson J., Grieve R., Khanna S., Quirke P., Couture J., de Metz C., Myint A.S., Bessell E., Griffiths G., Thompson L.C., Parmar M. Preoperative radiotherapy versus selective postoperative chemoradiotherapy in patients with rectal cancer (MRC CR07 and NCIC-CTG C016): a multicentre, randomized trial. Lancet. 2009 Mar 7; 373(9666): 811-20. https://doi.org/10.1016/S0140-6736(09)60484-0.
- Kapiteijn E., Marijnen C.A., Nagtegaal I.D., Putter H., Steup W.H., Wiggers T., Rutten H.J., Pahlman L., Glimelius B., van Krieken J.H., Leer J.W., van de Velde C.J.; Dutch Colorectal Cancer Group. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med. 2001 Aug 30; 345(9): 638-46. https://doi.org/10.1056/NEJMoa010580.
- Knowles G., Haigh R., McLean C., Phillips H.A., Dunlop M.G., Din F.V. Long term effect of surgery and radiotherapy for colorectal cancer on defecatory function and quality of life. Eur J Oncol Nurs. 2013 Oct; 17(5): 570-7. https://doi.org/10.1016/j.ejon.2013.01.010.
- Wiltink L.M., Chen T.Y., Nout R.A., Kranenbarg E.M., Fiocco M., Laurberg S., van de Velde C.J., Marijnen C.A. Health-related quality of life 14 years after preoperative short-term radiotherapy and total mesorectal excision for rectal cancer: report of a multicenter randomised trial. Eur J Cancer. 2014 Sep; 50(14): 2390-8. https://doi.org/10.1016/j.ejca.2014.06.020.
- Patel U.B., Taylor F., Blomqvist L., George C., Evans H., Tekkis P., Quirke P., Sebag-Montefiore D., Moran B., Heald R., Guthrie A., Bees N., Swift I., Pennert K., Brown G. Magnetic resonance imaging-detected tumor response for locally advanced rectal cancer predicts survival outcomes: MERCURY experience. J Clin Oncol. 2011 Oct 1; 29(28): 3753-60. https://doi.org/10.1200/JCO.2011.34.9068.
- Park I.J., You Y.N., Agarwal A., Skibber J.M., Rodriguez-Bigas M.A., Eng C., Feig B.W., Das P., Krishnan S., Crane C.H., Hu C.Y., Chang G.J. Neoadjuvant treatment response as an early response indicator for patients with rectal cancer. J Clin Oncol. 2012 May; 30(15): 1770-6. https://doi.org/10.1200/JCO.2011.39.7901.
- Taylor F.G., Quirke P., Heald R.J., Moran B., Blomqvist L., Swift I., Sebag-Montefiore D.J., Tekkis P., Brown G.; MERCURY study group. Preoperative high-resolution magnetic resonance imaging can identify good prognosis stage I, II, and III rectal cancer best managed by surgery alone: a prospective, multicenter, European study. Ann Surg. 2011; 253(4): 711-9. https://doi.org/10.1097/SLA.0b013e31820b8d52.
- Pantel K., Cote R.J., Fodstad O. Detection and clinical importance of micrometastatic disease. J Natl Cancer Inst. 1999 Jul 7; 91(13): 1113-24. https://doi.org/10.1093/jnci/91.13.1113.
- Nishimura J., Hasegawa J., Kato T., Yoshioka S., Noura S., Kagawa Y., Yasui M., Ikenaga M., Murata K., Hata T., Matsuda C., Mizushima T., Yamamoto H., Doki Y., Mori M.; Clinical Study Group of Osaka University (CSGO) Colorectal Group. Phase II trial of capecitabine plus oxaliplatin (CAPOX) as perioperative therapy for locally advanced rectal cancer. Cancer Chemother Pharmacol. 2018 Oct; 82(4): 707-716. https://doi.org/10.1007/s00280-018-3663-z.
- Cercek A., Weiser M.R., Goodman K.A., Reidy D.L., Wong W.D. Guillem J.G., Saltz L. Complete pathologic response in the primary of rectal or colon cancer treated with FOLFOX without radiation. J Clin Oncol. 2010; 28(15_suppl): 3649-3649. https://doi.org/10.1200/jco.2010.28.15_suppl.3649.
- Schrag D., Weiser M.R., Goodman K.A., Gonen M., Hollywood E., Cercek A., Reidy-Lagunes D.L., Gollub M.J., Shia J., Guillem J.G., Temple L.K., Paty P.B., Saltz L.B. Neoadjuvant chemotherapy without routine use of radiation therapy for patients with locally advanced rectal cancer: a pilot trial. J Clin Oncol. 2014; 32(6): 513-8. https://doi.org/10.1200/JCO.2013.51.7904.
- Fernandez-Martos C., Estevan R., Salud A., Pericay C., Gallen M., Sierra E., Brown G. Neoadjuvant capecitabine, oxliplatin, and bevacizumab (CAPOX-B) in intermediate-risk rectal cancer (RC) patients defined by magnetic resonance (MR): GEMCAD 0801 trial. J Clin Oncol. 2012; 30(15_suppl): 3586-3586. https://doi.org/10.1200/jco.2012.30.15_suppl.3586.
- Kamiya T., Uehara K., Nakayama G., Ishigure K., Kobayashi S. Hiramatsu K., Nakayama H., Yamashita K., Sakamoto E., Tojima Y., Kawai S., Kodera Y., Nagino M.; Nagoya Surgical Oncology Group and the Chubu Clinical Oncology Group. Early results of multicenter phase II trial of perioperative oxaliplatin and capecitabine without radiotherapy for high-risk rectal cancer: CORONA I study. Eur J Surg Oncol. 2016; 42(6): 829-35. https://doi.org/10.1016/j.ejso.2016.02.014.
- Danno K., Hata T., Tamai K., Fujie Y., Ide Y., Kim H.M., Ohnishi T., Morita S., Yoshioka S., Kudo T., Nishimura J., Matsuda C., Akamatsu H., Mizushima T., Nezu R., Doki Y., Mori M.; Multi-Center Clinical Study Group of Osaka; Colorectal Cancer Treatment Group (MCSGO). Interim analysis of a phase II trial evaluating the safety and efficacy of capecitabine plus oxaliplatin (XELOX) as adjuvant therapy in Japanese patients with operated stage III colon cancer. Cancer Chemother Pharmacol. 2017 Oct; 80(4): 777-785. https://doi.org/10.1007/s00280-017-3419-1.
- Nishimura J., Hasegawa J., Kato T., Yoshioka S., Noura S., Kagawa Y., Yasui M., Ikenaga M., Murata K., Hata T., Matsuda C., Mizushima T., Yamamoto H., Doki Y., Mori M.; Clinical Study Group of Osaka University (CSGO) Colorectal Group. Phase II trial of capecitabine plus oxaliplatin (CAPOX) as perioperative therapy for locally advanced rectal cancer. Cancer Chemother Pharmacol. 2018 Oct; 82(4): 707-716. https://doi.org/10.1007/s00280-018-3663-z.
- Hasegawa J., Nishimura J., Mizushima T., Miyake Y., Kim H.M., Takemoto H., Tamagawa H., Noura S., Fujii M., Fujie Y., Kato T., Miwa H., Takemasa I., Ikeda M., Yamamoto H., Sekimoto M., Nezu R., Doki Y., Mori M. Neoadjuvant capecitabine and oxaliplatin (XELOX) combined with bevacizumab for high-risk localized rectal cancer. Cancer Chemother Pharmacol. 2014 May; 73(5): 1079-87. https://doi.org/10.1007/s00280-014-2417-9.
- Deng Y., Chi P., Lan P., Wang L., Chen W., Cui L., Chen D., Cao J., Wei H., Peng X., Huang Z., Cai G., Zhao R., Huang Z., Xu L., Zhou H., Wei Y., Zhang H., Zheng J., Huang Y., Zhou Z., Cai Y., Kang L., Huang M., Peng J., Ren D., Wang J. Modified FOLFOX6 With or Without Radiation Versus Fluorouracil and Leucovorin With Radiation in Neoadjuvant Treatment of Locally Advanced Rectal Cancer: Initial Results of the Chinese FOWARC Multicenter, Open-Label, Randomized Three-Arm Phase III Trial. J Clin Oncol. 2016 Sep 20; 34(27): 3300-7. https://doi.org/10.1200/JCO.2016.66.6198.


