Комбинированное лечение рака желудка и ободочной кишки с предоперационной и интраоперационной лучевой терапией
Автор: Цыб А.Ф., Бердов Б.А., Скоропад В.Ю., Евдокимов Л.В., Титова Л.Н.
Рубрика: Научные статьи
Статья в выпуске: 1 т.23, 2014 года.
Бесплатный доступ
В работе проанализированы результаты комбинированного лечения рака желудка и ободочной кишки с предоперационной и интраоперационной лучевой терапией (ИОЛТ). Представлены оригинальные технические и методологические решения. Показано, что интенсивные курсы предоперационного облучения и ИОЛТ в дозе 20 Гр совместимы с любыми оперативными вмешательствами на желудке и толстой кишке, включая расширенные и комбинированные. Анализ отдалённых результатов показал, что комбинированное лечение более эффективно, чем хирургическое в случае местно-распространённых форм, а также когда опухоль имеет строение низкодифференцированного, перстневидно-клеточного и недифференцированного рака. При сроках наблюдения за больными более 15 лет показано отсутствие влияния высоких однократных доз излучения на развития метахронных злокачественных опухолей.
Рак желудка, рак ободочной кишки, комбинированное лечение, предоперационная лучевая терапия, интраоперационная лучевая терапия, метахронные опухоли
Короткий адрес: https://sciup.org/170170146
IDR: 170170146
Текст научной статьи Комбинированное лечение рака желудка и ободочной кишки с предоперационной и интраоперационной лучевой терапией
При облучении большинства глубокорасположенных опухолей подведение к мишени адекватной дозы излучения посредством традиционных методик сопряжено с неизбежным развитием лучевых осложнений в связи с низкой радиотолерантностью окружающих структур. С другой стороны, хирургическое лечение местнораспространённых опухолей сопровождается высокой частотой развития локорегионарных рецидивов, что свидетельствует о нерадикальности большинства операций.
Для преодоления этих ограничений была предложена интраоперационная лучевая терапия, которая интегрирует и неразрывно связывает два основных метода лечения рака – лучевую терапию и хирургию, соединяя их преимущества и нивелируя недостатки.
ИОЛТ заключается в подведении в течение оперативного вмешательства высокой дозы ионизирующего излучения непосредственно на опухоль, либо, в случае выполнения потенциально радикальной операции, на область наибольшего риска развития рецидива – ложе опухоли и зону регионарных лимфатических коллекторов. Оптимальным видом излучения, позволяющим реализовать преимущества ИОЛТ, является высокоэнергетическое электронное излучение. Физические характеристики электронного излучения – быстрое падение дозы на глубине и гомогенное распределение в тканях – позволяют резко снизить по сравнению с фотонным или гамма-излучением интегральную дозу, уменьшив тем самым облучение интактных тканей и, соответственно, риск развития лучевых осложнений. ИОЛТ создает возможность для подведения высоких доз ионизирующего излучения к таким анатомическим областям, к которым подведение соответствующих доз традиционными методами лучевой терапии невозможно, либо сопряжено с неизбежным развитием тяжёлых лучевых осложнений. Задачей ИОЛТ при сочетании с радикальной операцией является уничтожение тех жизнеспособных опухолевых комплексов,
которые могут остаться не удалёнными в лимфатических узлах, области инвазии опухоли в окружающие органы и ткани, а также попасть в рану из повреждённой при мобилизации первичной опухоли, пересечённых кровеносных сосудов и путей лимфооттока. Таким образом, применение ИОЛТ в комбинации с радикальным оперативным вмешательством имеет теоретические предпосылки к уменьшению числа локорегионарных рецидивов при отсутствии выраженных лучевых осложнений. Другим несомненным достоинством метода является значительное сокращение срока лечения.
Впервые идея облучения обнажённой хирургическим путём опухоли была реализована Comas C. и Prio A. в Барселоне в 1905 г. Современная эра развития ИОЛТ началась с клинических исследований в Университете Киото, Япония [5]. В настоящее время метод применяется более чем в 150 специализированных Центрах на всех континентах. Интерес к ИОЛТ не ослабевает, и публикации последних лет отразили наметившиеся ранее новые подходы к её использованию. Во-первых, это интеграция ИОЛТ в многокомпонентные схемы комбинированного лечения в сочетании с расширенными оперативными вмешательствами, пред- или послеоперационной фракционированной лучевой терапией, химиотерапией. Во-вторых, применение высоких однократных доз ионизирующего излучения создает уникальные возможности для включения в лечебные схемы радиомодификаторов [4, 6, 8].
Материал и методы
Для клинического применения ИОЛТ в МРНЦ РАМН был построен и оснащён специальный блок, состоящий из операционной, комнаты дистанционного контроля и каньона ускорителя электронов. Создано оригинальное съёмное устройство для перемещения больного под наркозом с операционного стола на облучательную установку и обратно, набор коллиматоров, а также соответствующих им по размерам и форме металлических ретракторов с ровным и скошенным концом.
Для проведения ИОЛТ использовали электронное излучение отечественного ускорительного комплекса «Микpотpон М», имеющего следующие основные характеристики: номинальная энергия – 8-22 МэВ, мощность поглощённой дозы – 0,83 Гр/с. Процедура ИОЛТ включала в себя выполнение следующих этапов: (1) лапаротомия, ревизия, удаление первичной опухоли, лим-фодиссекция; (2) установка аппликатора, ограничивающего поле облучения; выбор дозы и энергии электронного излучения; (3) транспортировка больного, укладка в каньоне ускорителя с формированием необходимой конфигурации поля облучения; (4) ИОЛТ, дистанционный визуальный и электрокардиоскопический контроль; (5) транспортировка больного в операционную, пластический этап операции. Общее время выполнения ИОЛТ не превышало 30 мин. Объектом ИОЛТ было «ложе» опухоли и зона pегионаpного лимфогенного метастазирования. Использовали круглые поля от 6 до 10 см в диаметре. Однократные дозы составили 20 Гp, энергия пучка электронов ваpьиpовала от 8 до 12 МэВ (рис. 1).
Emotion 6
Ex: 1
Topogram
Se:1/2
Im: 2/2
Cor: 1.0
1.0 T20s
S MRRC RAMS OBNINSK PATIENT Z 050Y M 2007/00285 Aco:
2007 Mar 26 10:32:49.609000
110 0 kV 20.0 mA Tilt: 0.0 5.0 s W:350 L:50
DFOV:53.6x53.6cr^
Длительные, до 10 лет, сроки наблюдения за больными позволили объективно оценить вероятность развития поздних осложнений комбинированного лечения с ИОЛТ. Были изучены функциональное и структурное состояние поджелудочной железы, печени, почек, поскольку эти органы находились в зоне воздействия всех компонентов комбинированного лечения. Функциональное состояние печени, о котором судили на основании биохимических тестов (АЛТ, АСТ, щелочная фосфатаза, билирубин, общий белок, холестерин) у больных обеих групп не претерпевало существенных изменений в течение 1 года после лечения. Увеличение отдельных показателей у ряда больных было связано либо с клинической манифестацией метастатического поражения печени, либо с воспалительными заболеваниями панкреато-билиарной системы (холецистит, панкреатит, др.). Содержание холестерина в сыворотке крови, как показатель липидного обмена, у всех больных находилось в пределах нормальных значений. Нами также не отмечено влияния метода лечения на функцию почек. Как экзокринная, так и эндокринная функция поджелудочной железы в сроки до 1 года после окончания лечения не различалась у больных обеих групп.
В сроки от 5 до 10 лет после лечения было обследовано 58 больных, пролеченных в рамках рандомизированного исследования, по 29 больных из каждой группы. При анализе учитывались клиническая картина, лабораторные показатели, а также структурные изменения органов. Основными методами диагностики были: физикальное обследование, спиральная компьютерная томография, ультразвуковое исследование, радионуклидные исследования, биохимический и общий анализы крови, анализ мочи. При сравнении основной и контрольной групп была выявлена сходная картина как функциональных нарушений (хронический панкреатит, сахарный диабет), так и структурных изменений в поджелудочной железе. Последние у всех больных проявлялись явлениями атрофии и фиброза паренхимы. Интересными представляются результаты анализа функционального состояния почек. Количество выявленных случаев больных хроническим пиелонефритом в контрольной (хирургической) группе было в два раза больше. В то же время в основной группе был отмечен один случай аплазии левой почки, которая, вероятнее всего, явилась конечным результатом хронического пиелонефрита. Исход хронического пиелонефрита во вторичное сморщивание почки, по-видимому, может быть связан с применением комбинированного лечения, на фоне скрытого хронического заболевания, но этот вопрос нуждается в дальнейшем изучении. Частота фиброзных изменений левой почки, которая частично попадает в поле предоперационной лучевой терапии, была одинаковой в обеих группах.
Рак ободочной кишки. Проведён анализ непосредственных и отдалённых результатов лечения 163 больных раком различных отделов ободочной кишки T3-4N0M0 и T1-4N1-2M0 в период с 1994 по 2005 гг. В зависимости от локализации опухоли применяли 2 метода комбинированного лечения: при раке фиксированных отделов ободочной кишки (слепая, восходящий отдел, печёночный угол, селезёночный угол, нисходящий отдел; 40 больных) применяли сочетание предоперационной и интраоперационной лучевой терапии с радикальным оперативным вмешательством; при раке подвижных отделов ободочной кишки (поперечная и сигмовидная кишка; 31 больной) – ИОЛТ + радикальную операцию. В последнем случае предоперационная лучевая терапия не проводилась по причине физиологической подвижности этих сегментов кишки и невозможности точной локализации поля облучения. Для сравнения непосредственных и отдалённых результатов использовали группы хирургического контроля: 33 больных раком фиксированных отделов и 59 больных раком подвижных отделов ободочной кишки. Основное количество больных в обеих группах имело 2 стадию заболевания (T3-4N0M0).
Интенсивное предоперационное облучение СОД 18 Гр за 3 дня проводили на линейном ускорителе «Phillips SL-20» с энергией фотонов 6 МэВ, мишень включала поражённый опухолью сегмент толстой кишки с брыжейкой. Проксимальная, дистальная и латеральные границы полей облучения отстояли от границ опухоли на 4-5 см. Оперативное вмешательство выполняли через 24-48 ч после окончания предоперационной лучевой терапии. Выбор вида и объёма оперативного вмешательства осуществлялся в соответствии с общепринятыми онкологическими принципами.
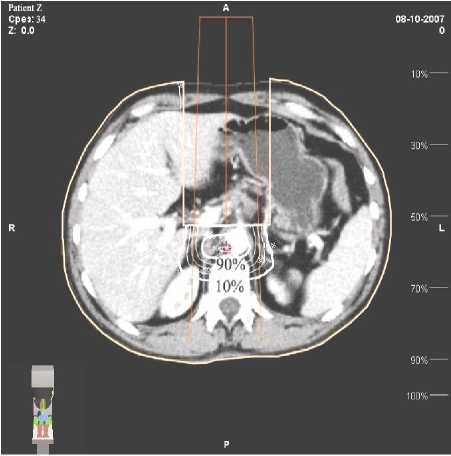
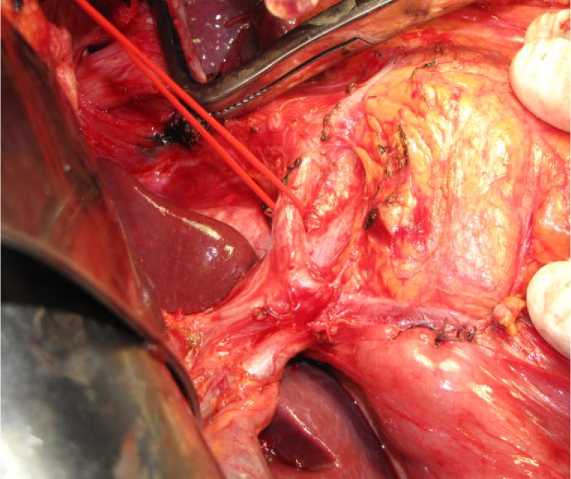
На первом этапе операции удаляли сегмент ободочной кишки с опухолью и клетчаткой с лимфатическими узлами 1-го и 2-го коллекторов. Далее проводилась подготовка к проведению ИОЛТ, установка аппликатора, транспортировка больного в каньон ускорителя электронов. Интактные органы и ткани выводили из поля облучения путём ретракции или частичной мобилизации (двенадцатипёрстная кишка, мочеточники, поджелудочная железа); также использовали дополнительные алюминиевые блоки различных конфигураций. Доза ИОЛТ составила 20 Гр, энергия пучка 8 МэВ, поле круглое 8 см в диаметре. Объектом ИОЛТ являлась клетчатка с лимфоузлами, расположенными по ходу центральных артериальных стволов, кровоснабжающих ободочную кишку: a. и v. mesenterica superior при опухолях, расположенных в правых и поперечной отделах толстой кишки (рис. 3, 4), клетчатка парааортальной зоны с культей a. mesenterica inferior или её стволом в случае перевязки a. et. v. colica sinistra при расположении опухоли в левых отделах ободочной кишки. После окончания интраоперационного облучения больного возвращали в операционную для проведения реконструктивного этапа операции.
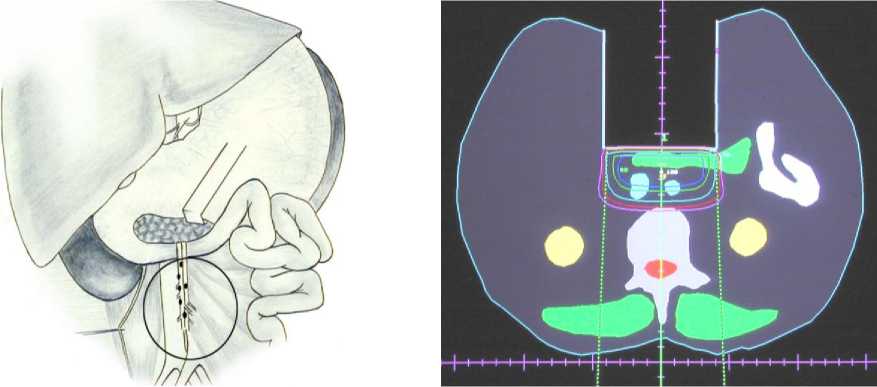
Рис. 3. Мишень ИОЛТ для правой половины ободочной кишки.
Рис. 4. Карта дозового распределения при проведении ИОЛТ больному раком правой половины ободочной кишки.
Из всех больных, получивших интенсивную предоперационную лучевую терапию, только у трёх (7,5%) были отмечены незначительные лучевые реакции: умеренная слабость, тошнота, недомогание в первый день облучения. В группе с пред- и интраоперационным облучением умер один (2,5%) больной, вследствие несостоятельности швов межкишечного анастомоза и развития перитонита. Наиболее частыми осложнениями в раннем послеоперационном периоде во всех группах были гнойно-воспалительные, в том числе - нагноение лапаротомной раны (5-7,5%).
Анализ общей и скорректированной выживаемости показал отчётливое преимущество комбинированного лечения с пред- и интраоперационным облучением перед хирургическим методом у больных раком фиксированных отделов ободочной кишки. Скорректированная 5летняя выживаемость в группе комбинированного лечения составила 87±6,1%, в группе хирургического лечения - 53±11% (р=0,009). Факторный анализ выживаемости по критерию степени дифференцировки опухоли выявил статистически достоверные преимущества комбинированного лечения с пред- и интраоперационным облучением у больных с низко- и недифференцированным раком. Пятилетняя выживаемость в исследуемой группе составила 85,7±13%, в хирургической группе ни один больной не дожил до пятилетнего срока наблюдения (р=0,002). Среди больных высоко- и умеренно-дифференцированным раком достоверных различий выживаемости не было, р=0,49. Также достоверное преимущество комбинированного лечения зафиксировано в группе больных с непоражёнными метастазами регионарными лимфатическими узлами (стадия заболевания T3-4N0M0), 5-летняя выживаемость составила: 88±6,6% и 63,2±10% (р=0,02). Основное количество рецидивов и метастазов наблюдали в первые два года после лечения: в группе с пред- и интраоперационным облучением они были зарегистрированы у 5% больных, в группе хирургического контроля - у 30% (р=0,034). В группе больных с пред- и интраоперационным облучением не было ни одного случая регионарного рецидива в зоне центрального лимфоколлектора. Пятилетняя безрецидивная выживаемость больных с предоперационной лучевой терапией и ИОЛТ составила 76±7,4%, что было статистически достоверно выше аналогичного показателя в группе хирургического контроля - 42±10% (р=0,029). Полученные результаты соотносятся с отечественным и зарубежным опытом [2, 3, 9].
Поздние осложнения изучены у 74 больных, получивших комбинированное лечение с ИОЛТ. У одного больного через три года после комбинированного лечения рака правой половины толстой кишки с ИОЛТ в дозе 20 Гр развилась стриктура правого мочеточника. Попытки стентирования, а также пластики мочеточника успеха не имели, и в последующем больному была выполнена нефрэктомия. Больной наблюдается более 10 лет без признаков рецидива. Несмотря на то, что у всех больных выделяли мочеточники, брали их на держалки и выводили из поля облучения, развитие этого осложнения мы связываем с ИОЛТ, поскольку подобные осложнения описаны и другими авторами [6]. У остальных больных при сроках наблюдения до 15 лет каких-либо поздних осложнений, которые можно было бы связать с лучевым компонентом лечения, выявлено не было.
Метахронные злокачественные опухоли
По данным популяционных исследований, количество больных с полинеоплазиями постоянно увеличивается и становится одной из наиболее серьёзных проблем современной онкологии, с другой стороны, эта тема в мировой и, особенно, отечественной литературе освещена крайне скудно, в том числе и в отношении ИОЛТ. Механизмы развития вторых опухолей могут существенно различаться: генетические нарушения, канцерогенный эффект внешней среды, индукция проводимым лечением и т.д. Клинических исследований, посвящённых развитию полинеоплазий после ИОЛТ, в мировой литературе крайне мало. Azinovic I. и соавт. [6] сообщили о развитии метахронных злокачественных новообразований у 8 (4%) из 195 больных, получивших комбинированное лечение с ИОЛТ, в сроки 15-85 мес. (медиана – 56,5 мес.). Ни одна из вторых опухолей не была в поле ИОЛТ, три находились на границе с полем дистанционной фракционированной лучевой терапии.
Таблица 1 Метахронные злокачественные опухоли
Заключение
Список литературы Комбинированное лечение рака желудка и ободочной кишки с предоперационной и интраоперационной лучевой терапией
- Афанасьев С.Г. Современные подходы к лечению местнораспространённого рака желудка: дис. … д-ра мед. наук. Томск, 2005.
- Воробьев Г.И., Одарюк Т.С., Шелыгин Ю.Л. Диагностика и лечение рака толстой кишки//Русский медицинский журнал. 1998. № 19. С. 1244-1256.
- Воробьев Г.И., Саламов К.Н., Жученко А.П., Паньшин Г.А., Капуллер Л.Л. Результаты предоперационной лучевой терапии у больных раком ободочной кишки//Российский онкологический журнал. 1999. № 6. С. 23-25.
- Завьялов А.А., Мусабаева Л.И., Лисин В.А. и др. Пятнадцатилетний опыт применения интраоперационной лучевой терапии//Сибирский онкологический журнал. 2004. № 2-3. С. 75-85.
- Abe M., Fukuda M., Yamano K., Handa H. Intraoperative irradiation in abdominal and cerebral tumors//Acta Radiol. 1971. V. 10. P. 408-416.
- Azinovic I., Calvo F.A., Puebla F. et al. Long-term normal tissue effects of intraoperative electron radiation therapy (IOERT): late sequelae, tumor recurrence, and second malignancies//Int. J. Radiat. Oncol. Biol. Phys. 2001. V. 49, N 2. P. 597-604.
- Glehen O., Peyrat P., Beaujard A.C., Chapet O., Romestaing P., Sentenac I., Francois Y., Vignal J., Gerard J.P., Gilly F.N. Pattern of failures in gastric cancer patients with lymph node involvement treated by surgery, intraoperative and external beam radiotherapy//Int. J. Radiat. Oncol. Biol. Phys. 2003. V. 67. P. 171-175.
- Shibata S.I., Pezner R., Chu D. et al. A study of radiotherapy modalities combined with continuous 5-FU infusion for locally advanced gastrointestinal malignancies//Eur. J. Surg. Oncol. 2004. V. 30. Р. 650-657.
- Taylor W.E., Donohue J.H., Gunderson L.L., Nelson H., Nagorney D.M., Devine R.M., Haddock M.G., Larson D.R., Rubin J., O’Connell M.J. The Mayo Clinic experience with multimodality treatment of locally advanced or recurrent colon cancer//Ann. Surg. Oncol. 2002. V. 9. P. 177-185.


