Комбинированный способ дифференциальной диагностики кистозных неоплазий поджелудочной железы
Автор: Кошель Андрей Петрович, Дроздов Евгений Сергеевич, Дибина Татьяна Викторовна, Клоков Сергей Сергеевич, Миронова Елена Борисовна, Ракина Юлия Юрьевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 т.17, 2018 года.
Бесплатный доступ
Актуальность. Частота выявления кистозных неоплазий поджелудочной железы (КНПЖ) в последнее время растет. Некоторые из этих образований являются доброкачественными, в то время как другие имеют злокачественный характер. Дифференциальная диагностика доброкачественных и злокачественных КНПЖ остается серьезной клинической проблемой. Цель исследования - разработка комбинированного метода дифференциальной диагностики КНПЖ, а также изучение роли нейтрофильно-лейкоцитарного индекса (НЛИ) как диагностического критерия злокачественных КНПЖ. материал и методы. Произведён ретроспективный анализ лечения 82 пациентов с КНПЖ, проходивших обследование и лечение в период с 2008 по 2018 г. Все пациенты были прооперированы, у 62 из них диагностирован доброкачественный процесс, в 20 случаях обнаружены злокачественные образования на фоне КНПЖ. Произведен анализ НЛИ, уровня СА 19-9 в плазме крови, а также наличия контрастных внутрикистозных образований по данным компьютерной томографии как предикторов злокачественных КНПЖ. Результаты. Наличие контрастных внутрикистозных образований, по данным компьютерной томографии, повышение уровня СА 19-9 более 39 Ед/мл в плазме крови, а также уровня НЛИ >1,867 являются независимыми, статистически значимыми предикторами злокачественных КНПЖ. При сочетании всех трех параметров кистозное образование расценивается как злокачественное. Чувствительность, специфичность и общая точность разработанного комбинированного способа составляют 71,4, 95,6 и 86,5 % соответственно. заключение. Разработанный комбинированный способ дифференциальной диагностики злокачественных КНПЖ является простым в применении, обладает достаточно высокой точностью. Имеется прямая корреляция НЛИ со злокачественными КНПЖ.
Кисты поджелудочной железы, злокачественное новообразование, дифференциальная диагностика, нейтрофильно-лейкоцитарный индекс, прогноз, компьютерная томография, углеводный антиген
Короткий адрес: https://sciup.org/140254224
IDR: 140254224 | УДК: 616.37-006.2-073.756.8-074-079.4 | DOI: 10.21294/1814-4861-2018-17-6-27-34
Текст научной статьи Комбинированный способ дифференциальной диагностики кистозных неоплазий поджелудочной железы
Частота обнаружения кист поджелудочной железы в последнее время резко возросла в результате широкого внедрения в практику новых методов диагностики с высокой разрешающей способностью, вследствие чего отмечается рост числа пациентов с небольшими бессимптомными кистами, дальнейшая тактика в отношении которых зачастую становится весьма сложной клинической проблемой [1]. Кистозные неоплазии поджелудочной железы (КНПЖ) составляют приблизительно 10–15 % всех кистозных панкреатических образований и приблизительно 1 % от всех новообразований поджелудочной железы [2]. Наиболее частыми формами КНПЖ являются: серозные цистаденомы (SCA), внутрипротоковые папиллярно-муцинозные неоплазии (IPMN) и муцинозные цистаденомы (MCA) [3], встречаются также смешанные кистозные образования [4]. IPMN и MCA являются потенциально злокачественными новообразованиями. Они могут приводить к развитию протоковой аденокарциномы или цистаденокарциномы поджелудочной железы.
Напротив, SCA почти всегда являются доброкачественными образованиями, однако в литературе описаны случаи их малигнизации [5].
На современном этапе развития клинической медицины дифференциальная диагностика доброкачественного или злокачественного характера КНПЖ остается серьезной проблемой. Зачастую только хирургическое лечение является методом окончательной диагностики при подозрении на злокачественные КНПЖ [6]. Важно учитывать, что операции на поджелудочной железе являются технически сложными и сопряжены с высокой частотой тяжелых послеоперационных осложнений [7]. Риск чрезмерно агрессивного хирургического лечения (ненужные резекции поджелудочной железы) должен быть тщательно сбалансирован с риском занижения показаний к оперативному лечению (наблюдение пациентов с резектабельны-ми злокачественными или потенциально злокачественными образованиями) [5]. Дифференцировка злокачественных и доброкачественных кистозных новообразований поджелудочной железы до операции играет важную роль в определении лечебной тактики и выбора объема операции [8]. Большинство авторов рекомендуют использование комбинированных диагностических алгоритмов [6].
К сожалению, на основании существующих клинических рекомендаций диагностика и выбор метода лечения КНПЖ остаются сложной задачей [9]. Предоперационная диагностика КНПЖ в значительной степени зависит от рентгенологических и клинических особенностей, которые зачастую обладают низкой чувствительностью, особенно в случае бессимптомных образований [10]. По данным литературы, даже в крупных специализированных медицинских центрах до одной пятой КНПЖ, диагностируемых как злокачественные на дооперационном этапе, при окончательном морфологическом исследовании оказываются доброкачественными [11]. Гипердиагностика часто приводит к ненужным операциям и как следствие серьезным осложнениям [5].
В настоящее время для дифференциальной диагностики КНПЖ используются разнообразные диагностические методы визуализации, такие как компьютерная и магнитно-резонансная томография с контрастным усилением (КТ и МРТ), контраст-усиленная ультразвуковая диагностика (КУЗИ) и эндоскопическая ультрасонография (ЭУС) с тонкоигольной биопсией и аспирацией кистозного содержимого для дальнейшего цитологического исследования [10]. По данным литературы, КТ, МРТ и КУЗИ имеют практически одинаковую диагностическую точность в характеристике кистозных образований поджелудочной железы [12]. Размер, плотность, расположение образования, характеристики стенок кисты, наличие перегородок, узелков и кальцификатов были предложены как потенциальные критерии наличия злокачественного образования [13]. Однако идеальной диагностической методики пока не существует [12].
Определение уровня опухолевых маркеров в крови, таких как СА 19-9 и раково-эмбриональный антиген (РЭА), как было показано на результатах многочисленных исследований, обладают относительно невысокой чувствительностью и специфичностью для дифференциальной диагностики злокачественных КНПЖ (47 %, 88 % и 41 %, 75 % соответственно) [14].
Нейтрофильно-лейкоцитарный индекс (НЛИ) – простой и удобный показатель системного воспалительного ответа. По данным ряда исследований, повышенный показатель НЛИ был определен как независимый прогностический фактор, связанный с плохим прогнозом у пациентов с некоторыми видами злокачественных опухолей [15]. Исследования показали, что повышенный НЛИ коррелирует с плохим прогнозом у пациентов с раком поджелудочной железы, перенесших радикальное или паллиативное хирургическое лечение [16]. Однако отношения между НЛИ и злокачественными КНПЖ изучены недостаточно.
Цель исследования – разработка комбинированного метода дифференциальной диагностики кистозных неоплазий поджелудочной железы, а также изучение роли нейтрофильнолейкоцитарного индекса как диагностического критерия их злокачественности.
Материал и методы
Произведён ретроспективный анализ лечения 82 пациентов с кистозными неоплазиями поджелудочной железы, проходивших обследование и лечение в ОГАУЗ «Медицинский центр им. Г.К. Жерлова» (г. Северск, Томская обл.) и ОГАУЗ «Томский областной онкологический диспансер» в период с 2008 по 2018 г., в том числе 30 (36,6 %) мужчин и 52 (63,4 %) женщины, в возрасте от 21 до 79 лет (средний возраст – 56,5 года). Все пациенты, включённые в исследование, были прооперированы с последующим морфологическим исследованием удаленных препаратов.
По гистологической структуре у 14 (17,2 %) пациентов обнаружена внутрипротоковая папиллярно-муцинозная неоплазия (IPMN), у 34 (41,4 %) – серозная цистаденома (SCA), у 34 (41,4 %) – муцинозная цистаденома (MCA). У 62 (75,6 %) больных по результатам гистологии диагностирован доброкачественный процесс, в 20 (24,4 %) случаях обнаружены злокачественные образования на фоне КНПЖ (пациенты с IPMN и MCA).
В 34 (41,5 %) случаях заболевание протекало бессимптомно, тогда как у 48 (58,5 %) пациентов отмечено наличие одного или нескольких симптомов, включающих боль (дискомфорт) в животе, рвоту, желтуху, потерю массы тела. Средний диаметр КНПЖ составлял 4,75 ± 2,55 см (диапазон от 1,2 до 16 см). В 42 (51,2 %) случаях кисты располагались в головке или перешейке поджелудочной железы, в оставшихся 40 (48,8 %) случаях – в теле и хвосте.
Ни у одного пациента, включенного в исследование, не было признаков респираторных или других инфекционно-воспалительных заболеваний. Всем пациентам проводили рутинное обследование крови (общеклинические, биохимические анализы). НЛИ рассчитывали по стандартной методике путем деления абсолютного количества нейтрофилов на абсолютное количество лейкоцитов. Средний показатель НЛИ у пациентов с КНПЖ – 2,10 ± 1,34 (диапазон от 0,37 до 5,02).
Анализ крови на опухолевые маркеры CA19–9 и раково-эмбриональный антиген (РЭА) проводили на амбулаторном этапе у всех пациентов за неделю до операции. Отклонение от нормальных показателей CA19–9, РЭА в сыворотке крови наблюдали в 23,2 и 12,2 % соответственно.
Всем пациентам на предоперационном этапе проводили КТ органов брюшной полости с внутривенным контрастированием. Оценивали размеры кист, локализацию, структуру и толщину стенки кисты, наличие внутрикистозных пристеночных образований (накапливающих и не накапливающих контраст). Наличие внутри кисты пристеночных контрастных образований по данным КТ с контрастированием обнаружили у 33 (40,2 %) пациентов.
Для статистического анализа фактического материала использовали пакет обработки данных Statistica 10.0 (StatSoft.Inc.). Результаты представлены в виде M±m, где M – среднее значение, m – стандартное отклонение. Для оценки значимости различий средних величин использовался t-критерий Стьюдента. Межгрупповое сравнение категориальных данных осуществляли с помощью критерия Пирсона (χ2). Статистически значимым различием считали уровень p<0,05. Оптимальное пороговое значения НЛИ в дифференциальной диагностике злокачественных КНПЖ и диагностическую эффективность данного показателя оценивали с помощью рабочей характеристической кривой (ROC-анализ), а также определением площади под кривой (AUROC).
Результаты
Исходя из данных гистологического исследования, все пациенты были разделены на две группы: пациенты с доброкачественными и злокачествен- ными образованиями (табл. 1). Пол пациентов и расположение опухоли не могут считаться предиктором злокачественности у пациентов с КНПЖ (р=0,153 и р=0,054 соответственно), однако старшая возрастная категория (>56 лет) коррелирует с наличием злокачественного образования (р=0,002) Наличие различных симптомов заболевания чаще встречалось в группе пациентов со злокачественными образованиями (15/20; 75 %, р=0,086), так же как и повышение уровня СА 19–9 в сыворотке крови (р<0,001). Наличие внутри кисты пристеночных контрастных образований по данным КТ с контрастированием ожидаемо имело высокую корреляцию со злокачественными КНПЖ (р<0,001).
Для того чтобы определить, коррелировал ли показатель НЛИ до операции с наличием у пациента злокачественной КНПЖ, произведено сравнение данного показателя в группах доброкачественных и злокачественных образований. НЛИ у пациентов с доброкачественными КНПЖ был значительно ниже – 1,87 ± 0,84, чем у пациентов со злокачественными образованиями, – 2,81 ± 2,14 (р=0,009).
Оптимальное пороговое значение НЛИ в дифференциальной диагностике злокачественных КНПЖ оценивали путём анализа характеристической кривой (ROC анализ) (рис. 1). Площадь фигуры под кривой составила 0,671. Оптимальной таблица 1
Характеристические данные пациентов, включенных в исследование
|
Показатель |
Доброкачественные образования (n=62) |
Злокачественные образования (n=20) |
χ2 |
р |
|
Возраст, лет |
56,0 ± 11,2 |
60,4 ± 9,9 |
0,7 |
|
|
Пол |
||||
|
Муж Жен |
20 42 |
10 10 |
2,052 |
0,153 |
|
Локализация кист в поджелудочной железе |
||||
|
Головка/перешеек Тело/хвост |
28 34 |
14 6 |
3,734 |
0,054 |
|
Симптомы |
||||
|
Нет |
29 |
5 |
||
|
Есть |
33 |
15 |
2,954 |
0,086 |
|
Диаметр кист, мм |
||||
|
<30 |
27 |
7 |
||
|
≥30 |
35 |
13 |
0,455 |
0,500 |
|
РЭА, нг/мл |
||||
|
≤5 >5 |
57 5 |
16 4 |
2,205 |
0,138 |
|
Са 19–9, Ед/мл |
||||
|
≤39 >39 |
56 6 |
7 13 |
25,998 |
0,001* |
|
Внутрикистозные пристеночные контрастные образования |
||||
|
Нет Есть |
44 18 |
5 15 |
13,287 |
0,001* |
|
НЛИ (среднее) |
1,87 ± 0,84 |
2,81 ± 2,14 |
||
|
≤ 1,876 > 1,876 |
41 21 |
5 15 |
10,387 |
0,001* |
Примечание: * – различия статистически значимы.
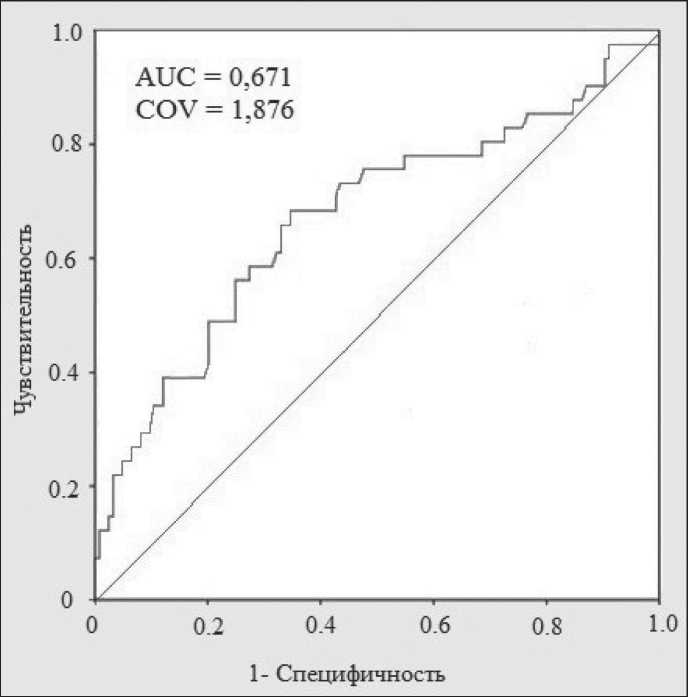
Рис. 1. ROC кривая: диагностическая ценность НЛИ в дифференциальной диагностике злокачественных КНПЖ. AUC – площадь фигуры под кривой, COV – оптимальная точка отсечения
точкой отсечения являлось значение НЛИ=1,876. В соответствии с полученными данными пациенты были разделены на две группы: со значением НЛИ ≤1,876 и >1,876.
Для оценки информативности НЛИ в дифференциальной диагностике злокачественных КНПЖ, а также для выявления дополнительных независимых предикторов злокачественных образований проведен логистический регрессионный анализ с клиническими параметрами, включая НЛИ. Анализ отношения шансов (odds ratio) показал, что, наряду с уровнем НЛИ >1,876, повышенный уровень CA19–9 (>39 Ед/мл), а также наличие внутри кисты пристеночных контрастных образований по данным КТ с контрастированием являются статистически значимыми независимыми предикторами злокачественных КНПЖ (табл. 2).
Основываясь на вышеперечисленных данных, нами разработан способ дифференциальной диагностики кистозных неоплазий поджелудочной железы. Способ заключается в оценке у пациентов с кистозным образованием поджелудочной железы трех показателей: 1) уровня углеводного антигена СА 19–9 в крови, 2) наличия внутри кисты пристеночных контрастных образований по данным компьютерной томографии с контрастированием, 3) измерения НЛИ. При сочетании повышения уровня СА 19–9 более 39 Ед/мл, показателя НЛИ более 1,876 и наличия контраст- таблица 2
|
анализ отношения шансов в дифференциации злокачественных кНПЖ |
|||
|
Факторы |
Отношение шансов |
95 % ДИ |
Р |
|
Возраст (>56 лет) |
1,893 |
0,897–3,993 |
0,094 |
|
Пол (мужской/женский) |
0,476 |
0,171–1,328 |
0,156 |
|
Локализация опухоли |
0.353 |
0,120–1,038 |
0,0586 |
|
Диаметр кисты >30 мм |
1,432 |
0,503–4,082 |
0,5 |
|
Наличие симптомов |
2,636 |
0,853–8,148 |
0,0922 |
|
РЭА >5 нг/мл |
2,85 |
0,684–11,873 |
0,1503 |
|
CA19–9 >39 Ед/мл |
17,333 |
4,984–60,273 |
0,0001* |
|
Внутрикистозные пристеночные |
7,333 |
2,319–23,186 |
0,0007* |
|
контрастные образования |
|||
|
НЛИ >1,876 |
5,857 |
1,872–18,326 |
0,002* |
Примечание: * – различия статистически значимы.
таблица 3
Сравнение точности НЛИ, уровня Са 19–9, наличия внутри кисты пристеночных контрастных образований по данным кт и разработанного комбинированного способа в дифференциальной диагностике злокачественных кНПЖ
Произведено сравнение точности дифференциальной диагностики каждого отдельного критерия, а также разработанного комбинированного диагностического способа. Определены показатели чувствительности, специфичности, прогностич-ности положительного результата, прогностично-сти отрицательного результата и общей точности вышеперечисленных методик в дифференциальной диагностике кистозных образований поджелудочной железы (табл. 3). Полученные результаты показывают достаточно высокую информативность разработанного комбинированного способа в дифференциальной диагностике злокачественных КНПЖ, а также его превосходство над отдельными диагностическими критериями злокачественных КНПЖ. На основании комбинированного способа дифференциальной диагностики в настоящее время нами разработан алгоритм диагностики и лечения пациентов с кистозными неоплазиями поджелудочной железы (рис. 2).
Обсуждение
Частота выявления КНПЖ в последнее время возросла, что, вероятнее всего, связано с широким внедрением и повышением доступности КТ и МРТ. Некоторые из кистозных образований поджелудочной железы обладают потенциалом злокачественности или уже являются злокачественными новообразованиями [3]. Оперативное лечение способно полностью излечить пациента, устранить симптомы заболевания, а также риски малигнизации потенциально злокачественных образований. Однако некоторые КНПЖ являются доброкачественными или медленно растущими, и их потенциал малигнизации является крайне низким. Недавно опубликованные исследования показали, что только 20 % резецированных бессимптомных КНПЖ являются злокачественными [17].
Серозные цистаденомы нередко расположены в теле или хвосте поджелудочной железы и чаще всего встречаются у женщин среднего возраста. Напротив, IPMN чаще встречаются в головке поджелудочной железы у пожилых мужчин, а муцинозные цистаденомы встречаются преимущественно у пожилых женщин [8]. Согласно результатам нашего исследования, пол пациента не может считаться предиктором злокачественности КНПЖ. Пациенты с доброкачественными MCA имеют средний возраст 50 лет, тогда как у пациентов с муцинозной цистаденокарциномой средний возраст составляет 56 лет [3]. В ряде исследований сообщалось, что пациенты со злокачественными КНПЖ были значимо старше пациентов с доброкачественными КНПЖ [10]. Этот факт также подтверждается результатами нашего исследования.
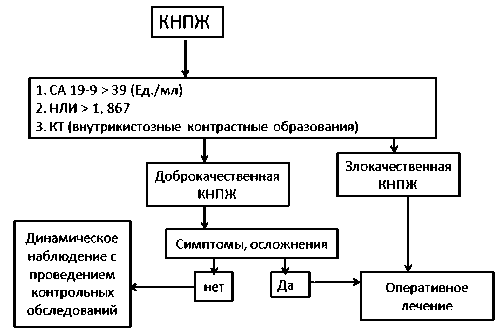
Рис. 2. Алгоритм диагностики и лечения пациентов с кистозными неоплазиями поджелудочной железы
Некоторые авторы рассматривают бессимптомные КНПЖ размером более 3 см в качестве показания к оперативному лечению [8]. С другой стороны, во многих публикациях сообщалось, что размер кисты мало коррелирует со злокачественной природой образования [17]. Sarr et al. не обнаружили различий в среднем размере доброкачественных муцинозных цистаденом и муцинозных цистаде-нокарцином [18]. Lee et al. обнаружили, что 19 % (31/166) КНПЖ менее 3 см оказались злокачественными [19]. В нашем исследовании размер кистозного образования, а также расположение опухоли не были определены как прогностические факторы для злокачественных КНПЖ.
По данным литературы, КТ позволяет правильно дифференцировать только 25–60 % КНПЖ [21]. Присутствие солидного компонента внутри кисты при визуализации является важным предиктором злокачественности, что подтверждается результатами данного исследования.
В клинической практике уровень CA19–9 и РЭА в сыворотке крови являются важными онкомаркерами для пациентов со злокачественными образованиями поджелудочной железы. Уровень СА19–9 в сыворотке повышен более чем у 75 % пациентов с протоковой аденокарциномой поджелудочной железы. Было также установлено, что повышенный уровень CA19–9 специфически коррелирует со злокачественными КНПЖ. Однако, несмотря на то, что специфичность сывороточного CA19–9 высока, чувствительность данного показателя очень низкая [14].
Некоторые исследователи предположили, что ЭУС с тонкоигольной аспирацией и анализом жидкости, полученной из кисты, обещает выявление злокачественных образований с высокой точностью [2]. Однако ЭУС не всегда доступна, методика является инвазивной и зачастую требует общего обезболивания, а цитологическое исследование полученной жидкости обладает низкой чувствительностью [21].
Опубликованы исследования, показывающие диагностическую роль НЛИ при различных типах рака [16]. Считается, что, несмотря на свою неспецифичность, увеличение НЛИ может свидетельствовать о повышенной воспалительной активации в злокачественных КНПЖ. Наше исследование показало, что НЛИ достоверно выше у пациентов со злокачественными КНПЖ, чем у пациентов с доброкачественными образованиями. Также было обнаружено, что значение НЛИ >1,876 является независимым предиктором для дифференциальной диагностики злокачественных КНПЖ. Таким образом, вышеизложенные данные свидетельствуют о том, что высокий уровень НЛИ является вспомогательным предиктором в дифференциации злокачественных КНПЖ.
Список литературы Комбинированный способ дифференциальной диагностики кистозных неоплазий поджелудочной железы
- Lee K.S., Sekhar A., Rofsky N.M., Pedrosa I. Prevalence of incidental pancreatic cysts in the adult population on MR imaging. Am J Gastroenterol. 2010 Sep; 105 (9): 2079-84. DOI: 10.1038/ajg.2010.122
- Atef E., El Nakeeb A., El Hanafy E., El Hemaly M., Hamdy E., El-Geidie A. Pancreatic cystic neoplasms: predictors of malignant behavior and management. Saudi J Gastroenterol. 2013 Jan-Feb; 19 (1): 45-53. DOI: 10.4103/1319-3767.105927
- Паклина О.В., Сетдикова Г.Р., Чекмарева И.А. Морфологическая характеристика кистозных опухолей поджелудочной железы. Анналы хирургической гепатологии. 2012; 17 (1): 26-34. [Paklina O.V., Setdikova G.R., Chekmaryova. I.A. Morphological Characteristic of Pancreatic Cystic Tumors. Annals of Surgical Hepatology. 2012; 17 (1): 26-34. (in Russian)].
- Кошель А.П., Алипов В.В., Базилевич Л.Р., Хващевский А.И., Пурлик И.Л., Дроздов Е.С. Редкое клиническое наблюдение пациента со смешанной серозно-нейроэндокринной кистозной неоплазией поджелудочной железы. Сибирский онкологический журнал. 2018; 17 (3): 115-121. [Koshel A.P., Alipov V.V., Bazilevich L.R., Khvashchevsky A.I., Purlik I.L., Drozdov E.S. A rare clinical case of mixed serous neuroendocrine cystic neoplasm of the pancreas. Siberian journal of oncology. 2018; 17 (3): 115-121. (in Russian)]. -2018-17-3-115-121. DOI: 10.21294/1814-4861
- Plichta J.K., Brosius J.A., Pappas S.G., Abood G.J., Aranha G.V. The changing spectrum of surgically treated cystic neoplasms of the pancreas. HPB Surg. 2015; 2015: 791704. DOI: 10.1155/2015/791704


