Коморбидность в практике пульмонолога: гастроэзофагеальная рефлюксная болезнь, дивертикул Ценкера и бронхолегочная патология (клинический случай)
Автор: Козлова И.В., Шашина М.М., Шаповалова Т.Г., Рябова А.Ю., Белоножко А.Н.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Внутренние болезни
Статья в выпуске: 2 т.16, 2020 года.
Бесплатный доступ
Представлено клиническое наблюдение коморбидного состояния у пациентки 72 лет: на фоне хронической бронхолегочной патологии выявлена гастроэзофагеальная рефлкжсная болезнь и дивертикул Ценкера больших размеров. Заболевания манифестировали одновременно, параллельно прогрессировали, однако не расценивались как коморбидные, что не позволяло оптимизировать их терапию и прогноз.
Бронхолегочная патология, гастроэзофагеальная рефлюксная болезнь, дивертикул ценкера, коморбидность
Короткий адрес: https://sciup.org/149135552
IDR: 149135552 | УДК: 616.233/.24:616.321:616.329-007.64]-07-08(045)
Текст научной статьи Коморбидность в практике пульмонолога: гастроэзофагеальная рефлюксная болезнь, дивертикул Ценкера и бронхолегочная патология (клинический случай)
патогенетически связанных между собой [2, 3]. В последние годы проблема коморбидности активно изучается в разных областях медицины [3]. Так, по материалам более трех тысяч патологоанатомических исследований пациентов с соматической патологией, поступивших в многопрофильные стационары по поводу декомпенсации хронического заболевания, частота коморбидности достигала 94,2% [4]. Проблема коморбидности приобрела важное значение и в пульмонологии. Появляется все больше доказательств, подтверждающих роль гастроэзофагеального рефлюкса (ГЭР) в возникновении респираторных симптомов (кашля, одышки, хрипов, приступов за- трудненного дыхания, рецидивирующих пневмоний) [5]. Эти проявления относят к внепищеводному бронхолегочному синдрому, ассоциированному с гастроэзофагеальной рефлюксной болезнью (ГЭРБ) [6]. Высокий проксимальный заброс желудочного содержимого из пищевода в просвет бронхиального дерева (микроаспирация) является мощным триггером для бронхоконстрикции вследствие активации афферентных волокон, ядер и эфферентных волокон блуждающего нерва и развития в дальнейшем хронического кашля, бронхита, бронхиальной астмы, пневмонита, рецидивирующих бактериальных пневмоний, легочного фиброза [5, 7, 8]. С проблемой коморбидности сталкиваются не только врачи общей практики и терапевтических стационаров, но в первую очередь специалисты профильных отделений, уделяющие преимущественное внимание основной патологии без учета сопутствующих заболеваний [2]. Это подтверждает наше клиническое наблюдение.
Клинический случай. В пульмонологическое отделение многопрофильной городской больницы Саратова была госпитализирована пациентка М. 72 лет с направительным диагнозом «диссеминированный процесс в легких неясного генеза» и жалобами на продуктивный кашель с экспекторацией слизистой мокроты, общую слабость, одышку при физической нагрузке. За год до этого лечилась по поводу пневмонии, в то время проживала в другой стране. В течение последних шести месяцев повторно госпитализировалась в терапевтическое и в пульмонологическое отделения разных стационаров города с двусторонней пневмонией; кроме того, у нее была диагностирована бронхиальная астма. Назначалась терапия, включающая как антибактериальные препараты, так и глюкокортикостероиды, бронхолитики из группы бета2-аго-нистов. Настоящая госпитализация в профильное пульмонологическое отделение состоялась вскоре после выписки из отделения терапии, с целью уточнения диагноза. При сборе анамнеза обращено внимание на наличие симптомов, не связанных с респираторной патологией: изжогу, частую отрыжку и срыгивание непереваренной пищей, избыточное слюноотделение, ощущение комка и распирания в области шеи. Указанные симптомы впервые возникли три года назад, тогда же появился кашель с отделением большого количества слизи. Лечилась амбулаторно по поводу рецидивирующих обострений хронического бронхита. В то же время обращалась к гастроэнтерологу, однако рекомендованную фиброгастроскопию выполнить не смогла из-за затруднения при проведении манипуляции. Гастроэнтерологом был назначен омепразол 20 мг в сутки, который пациентка применяла эпизодически с некоторым положительным эффектом — уменьшением выраженности изжоги.
При осмотре общее состояние расценено как удовлетворительное. Пациентка повышенного питания (ИМТ 29,09кг/м2). При аускультации легких отмечено жесткое дыхание, однако признаков дыхательной недостаточности выявлено не было (ЧД18 в мин, SaO297%). Гемодинамические показатели удовлетворительные. Видимой патологии со стороны систем органов пищеварения, мочевыделения не обнаружено. Обращало на себя внимание наличие умеренной анемии: эритроциты 3,83 млн/мкл, гемоглобин 103 г/л. Лейкоцитарная формула не изменена, СОЭ 14 мм/ч. Биохимический анализ крови без особенностей. При проведении пик-флоуметрии признаков бронхообстуктивного синдрома не выявлено (ПСВ 80% от должной величины, суточный разброс 2%). Рентгенологическое исследование
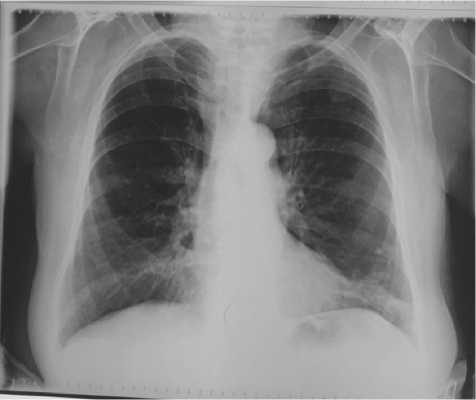
Рис. 1. Рентгенограмма легких в прямой проекции пациентки М. 72 лет, октябрь 2019 г.
легких выявило инфильтративные изменения, которые расценены рентгенологом как проявления двусторонней полисегментарной пневмонии (рис. 1), что вызывало сомнение ввиду отсутствия синдрома интоксикации, изменений лейкоформулы и типичных физикальных признаков.
За полгода до настоящей госпитализации была выполнена компьютерная томография (КТ) легких. Выявлены участки инфильтрации легочной ткани в S4,5 правого легкого и S4,9,10 левого легкого неправильной формы, расположенные субплеврально, с симптомом «воздушной бронхографии», а также очаговый паттерн с центрилобулярным (бронхогенным) распределением, с ветвящимися линейными уплотнениями («дерево в почках») и увеличение паратрахеальные и бифуркационных лимфоузлов. В текущую госпитализацию выполнена КТ легких в динамике (рис. 2).
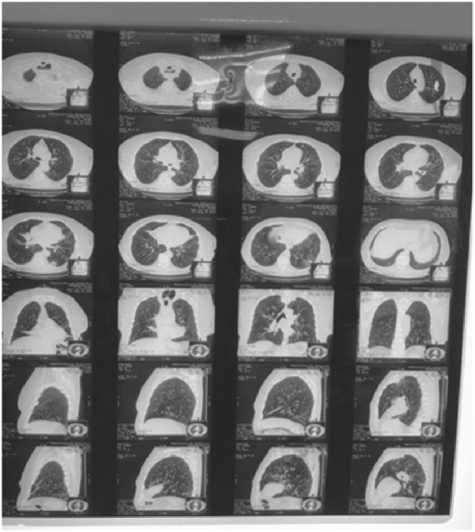
Рис. 2. Компьютерная томограмма легких пациентки М.
72 лет, апрель 2019 г.
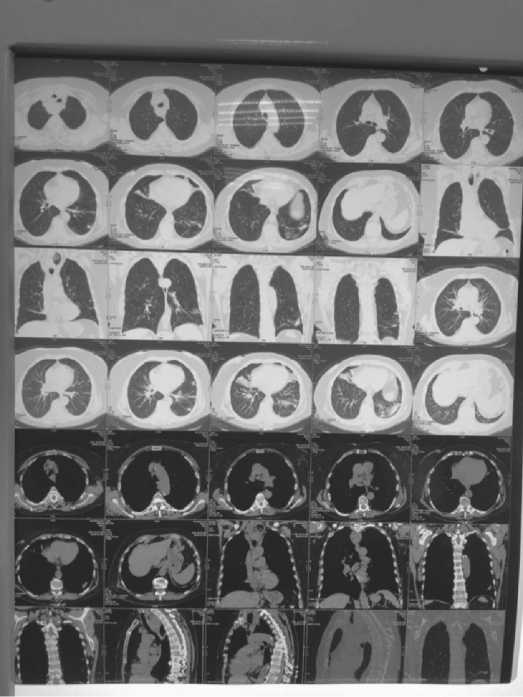
Рис. 3. Компьютерная томограмма лекгих пациентки М.
72 лет, октябрь 2019 г.
Дополнительно обнаружены участки пневмофиброза средней доли правого легкого, S9,10 сегментов левого легкого с формированием фиброателектаза средней доли, а также появление тракционных бронхоэктазов правого и левого легкого.
Выполнена консультация фтизиатра: данных за туберкулез легких не обнаружено. Торакальный
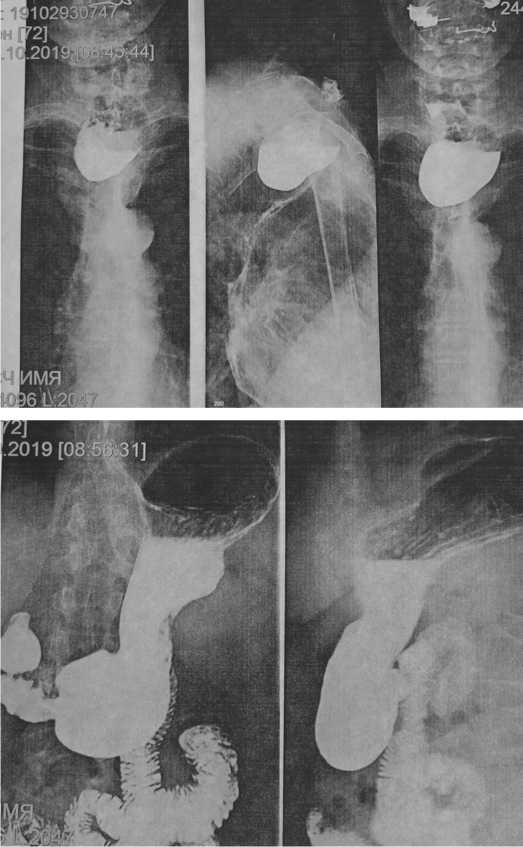
хирург рекомендовал выполнение фибробронхоско-пии и эзофагогастродуоденоскопии, а также плановое оперативное лечение по поводу дивертикула Ценкера. От предложенных эндоскопических исследований пациентка отказалась.
Обсуждение. Выявленная бронхолегочная патология расценена нами как вторичный процесс вследствие воздействия на легочную ткань перманентной регургитации, обусловленной дивертикулом Ценкера больших размеров, гастроэзофагеальным рефлюксом. Известно, что дивертикулы пищевода (ДП) образуются в результате выпячивания подслизистого слоя и слизистой пищевода через дефект его мышечной оболочки [9]. По локализации дивертикулы пищевода делятся на глоточно-пищеводные (верхний отдел пищевода), эпибронхиальные (средний отдел пищевода) и эпифренальные (наддиафрагмальные) [9].
Глоточно-пищеводный дивертикул (дивертикул Ценкера, или гипофарингеальный дивертикул) назван по имени немецкого ученого F.A. Zenker, впервые его описавшего в 1877 г. [10]. Этот дивертикул образуется в слабых местах задней стенки глотки на уровне перстневидного хряща трахеи, т. е. там, где имеются места, не прикрытые мышцами. ДП встречаются достаточно часто, в 3-6% вскрытий [11]. С помощью рентгенологического исследования они выявляются в 1 % случаев от всех рентгенологических исследо- ваний желудочно-кишечного тракта [10]. Частота дивертикула Ценкера составляет 0,1-5% от всех ДП [10]. Дивертикул Ценкера обычно диагностируется у людей пожилого и среднего возраста; у мужчин встречается в 1,5 раза чаще, чем у женщин. Оценочная ежегодная заболеваемость составляет 2 случая на 100 тыс. человек с колебаниями от 0,01 до 0,11% [12]. Предпосылками к формированию дивертикула являются возникающие с возрастом структурные изменения крикофарингеальной мышцы. Отмечаются снижение мышечного компонента, качественные изменения волокон, повышенное образование фиброзной ткани в результате усиления синтеза коллагена. Установлено, что и гастроэзофагеальному рефлюксу способствует крикофарингеальная дисфункция [13]. Высока вероятность связи между желудочно-пищеводным рефлюксом и дивертикулом Ценкера, однако опубликованные наблюдения, отражающие эту связь, немногочисленны [13, 14].
Различают три стадии возникновения и развития глоточно-пищеводных дивертикулов. Первая стадия связана с выпячиванием слизистой оболочки пищевода через слабые участки мышечной оболочки пищевода, вторая — с формированием шарообразного дивертикулярного мешка, распространяющегося книзу и кзади между пищеводом и позвоночником. Третья стадия характеризуется увеличением размеров дивертикула, в результате чего он может опускаться в средостение [13].
Клиническая картина дивертикула Ценкера определяется размерами дивертикула и развившимися осложнениями. Еще в 1958 г. была описана триада симптомов глоточнопищеводных дивертикулов, включающая регургитацию застоявшейся пищи, постоянное наличие в глотке слизи и бурлящий шум при надавливании на глотку [10]. В начальной стадии дивертикул Ценкера небольших размеров (до 2 см) обычно не проявляется какой-либо симптоматикой. Однако по мере увеличения его размеров затрудняется глотание твердой и жидкой пищи, появляется регургитация непереваренной застойной пищи (как правило, через несколько часов после еды) или застойного секрета, скопившегося в дивертикуле. При осмотре у таких пациентов возможно выявление асимметрии шеи после приема пищи, урчание и шум плеска в зоне расположения дивертикула (симптом Купера) [10].
Ю. В. Иванов с соавт. [15] рассмотрели частоту возникающих симптомов у 39 пациентов с дивертикулом Ценкера. Согласно полученным данным, першение и жжение в горле беспокоили всех пациентов. Другие симптомы отмечались реже. Так, боль при глотании регистрировалась в 82,1% случаев, ощущение задержки пищевого комка в 80%, ощущение удушья в 72%, обильное слюноотделение в 70%, сухой кашель в 67%, регургитация, срыгивание принятой накануне пищей в 59%, тошнота в 44% случаев [15]. В других исследованиях фиксировалась возможность малигнизации дивертикула в 7% случаев [13, 14]. Многие авторы указывали, что регургитация и, как следствие, аспирация содержимого дивертикула могут привести к возникновению хронических бронхитов, рецидивирующих пневмоний, абсцессов легких [5, 6, 9]. Рецидивирующие микроаспирации могут проявляться на компьютерной томограмме картиной очаговой диссеминации легочной ткани с центрилобулярным распределением, с наличием симптома «дерева в почках», или «Tree-in-Bud» [16].
Диагностика дивертикула Ценкера основывается на результатах рентгенологического и эндоскопического исследований. Рентгенологическое исследование позволяет наиболее точно определить локализацию, форму и величину дивертикула, эластичность его стенок, характер заполнения и опорожнения, взаимоотношения с соседними органами. Характерным признаком является мешковидное выпячивание с четкими ровными контурами по заднебоковой стенке на границе глотки и пищевода [13, 17]. В настоящее время варианты лечения дивертикула Ценкера включают открытую операцию, трансоральную ригидную или гибкую эндоскопию. Все хирургические вмешательства направлены на восстановление нормального пассажа пищевого болюса на уровне глоточно-пищеводного перехода при помощи миотомии с резекцией дивертикула или без таковой. Тактика лечения определяется с учетом размера дивертикула, состояния пациента и опыта хирурга [12, 15].
Заключение. На протяжении последних трех лет приоритетной проблемой у пациентки была бронхолегочная патология (рецидивирующий бронхит, пневмонии, бронхиальная астма). Несмотря на параллельно существующую ГЭРБ, симптомы которой, как и патологии легких, прогрессировали во времени, взаимосвязь имеющихся заболеваний не рассматривалась. Инфильтративные изменения в легочной ткани сначала трактовались как пневмонические, по поводу которых пациентка получила несколько курсов антибактериальной терапии. Однако после выполнения КТ легких дополнительно выявлены признаки очаговой диссеминации легочной ткани с центрилобулярным распределением, с наличием симптома «дерева в почках», или «Tree-in-Bud». Наиболее вероятная причина появления этого симптома в нашем случае — это рецидивирующие микроаспирации, способствовавшие в дальнейшем формированию фиброзных изменений легочной ткани, включая фи-броателектаз средней доли и тракционные бронхоэктазы. Данное клиническое наблюдение является ярким примером коморбидности — одновременно развивающихся, патогенетически связанных и, вероятно, взаимоотягощающих заболеваний. Очевидно, что без решения проблемы, обусловленной дивертикулом Ценкера больших размеров, невозможно рассчитывать и на успешное лечение бронхолегочной патологии. Следует подчеркнуть необходимость комплексной оценки многочисленных заболеваний, присущих пациентам пожилого возраста, что позволит оптимизировать как лечебную тактику, так и прогноз у данной категории больных.
Список литературы Коморбидность в практике пульмонолога: гастроэзофагеальная рефлюксная болезнь, дивертикул Ценкера и бронхолегочная патология (клинический случай)
- Feinstein AR. Pre-therapeutic classification of comorbidity in chronic disease. Journal Chronic Disease 1970; 23 (7): 455-68.
- Vertkin AL, Skotnikov АС. Comorbidity. Attending Physician 2013; (6): 66-8. Russian (Верткин А. Л., Скотников А. С. Коморбидность. Лечащий врач 2013; (6): 66-8).
- Oganov RG, Simanenkov VI, Bakulin IG, et al. Comorbid pathology in clinical practice: Algorithms for diagnosis and treatment: Clinical recommendations. Cardiovascular Therapy and Prevention 2019; 18 (1): 5-66. Russian (Ога-нов Р. Г., Симаненков В. И., Бакулин И. Г., и др. Коморбидная патология в клинической практике: алгоритмы диагностики и лечения: Клинические рекомендации. Кардиоваскулярная терапия и профилактика 2019;18 (1): 5-66).
- Vertkin AL, Zayratyants OV, Vovk EI. Final diagnosis. Moscow: GEOTAR-Media, 2009; 576 p. Russian (Верткин А. Л., Зайратьянц О. В., Вовк Е. И. Окончательный диагноз. М.: ГЭОТАР-Медиа, 2009; 576 с.).
- Mikhailova ZF. Lung damage in diseases of the gastrointestinal tract. In: Respiratory Medicine: guide: in 3 vols/Chuchalin AG, ed. Moscow: Litterra, 2017; vol. 3; p. 263-74. Russian (Михайлова З. Ф. Поражение легких при заболеваниях желудочно-кишечного тракта. В кн.: Респираторная медицина: рук-во: в 3 т./под ред. А. Г. Чучалина. М.: Литтерра, 2017; т. 3; с. 263-74).
- Maev IV, Yurenev GL, Burkov ST, et al. Extraesophageal manifestations of gastroesophageal reflux disease. Therapeutic Archive 2007; 3: 57-66. Russian (Маев И. В., Юренев Г. Л., Бурков С. Т., и др. Внепищеводные проявления гастроэзофаге-альной рефлюксной болезни. Терапевтический архив 2007; 3: 57-66).
- Golovanova VE, Mikhaleva LM, Barkhina TG, et al. Morphofunctional characteristics of the esophageal mucoa in bronchial asthma of different severity. Russian medico-biological Bulletin n. a. acad. I. P. Pavlov 2012; (2): 25-32. Russian (Голованова В. Е., Михалева Л. М., Бархина Т. Г. и др. Морфофунк-циональная характеристика слизистой оболочки пищевода при бронхиальной астме разной степени тяжести. Российский медико-биологический вестник им. акад. И. П. Павлова 2012; (2): 25-32).
- Akhmedov VA, Gauss OV, Petrov DV. Idiopathic pulmonary fibrosis as a possible extraesophageal manifestation of gastroesophageal reflux disease. Clinical Medicine 2017; 95 (5): 389-93. Russian (Ахмедов В. А., Гаус О. В., Петров Д. В. Идиопатический легочный фиброз как возможное внепищеводное проявление гастроэзофагеальной рефлюкс-ной болезни. Клиническая медицина 2017; 95 (5): 389-93).
- Maev IV, Dicheva DT, Andreev DN. Diverticulum of the gastrointestinal tract: Educational and methodical manual for doctors. Moscow, 2015; 33 p. Russian (Маев И. В., Дичева Д. Т., Андреев Д. Н. Дивертикулы желудочно-кишечного тракта: учеб.-метод. пособие для врачей. М., 2015; 33 с.).
- Ferreira LE, Simmons DT, Baron TH. Zenker's diverticula: pathophysiology, clinical presentation, and flexible endoscopic management. Dis Esophagus 2008; 21 (1): 1-8.
- Maev IV, Dicheva DT, Penkina TV, at al. Diverticulum of the upper gastrointestinal tract. Gastroenterology (Suppl. to Consilium Medicum) 2009; (1): 8-13. Russian (Маев И. В., Дичева Д. Т., Пенкина Т. В. и др. Дивертикулы верхних отделов желудочнокишечного тракта. Гастроэнтерология (Прил. к журн. Consilium Medicum) 2009; (1): 8-13).
- Pavlov IA, Shishin KV, Nedoluzhko lYu, et al. Modern approaches to the treatment of patients with Zenker's Diverticulum (literature review). Doctor Ru 2018; 3 (147): 27-32. Russian (Павлов И. А., Шишин К. В., Недолужко И. Ю. и др. Современные подходы к лечению пациентов с дивертикулами Ценкера (обзор литературы). Доктор Ру 2018; 3 (147): 27-32).
- Herbella FA, Patti MG. Modern pathophysiology and treatment of esophageal diverticula. Langenbecks Arch Surg 2012; 397 (1): 29-35.
- Pasechnikov VD, Chukov SZ. Diverticula of the gastrointestinal tract. Gastroenterology (Suppl. to Consilium Medicum) 2005; (2): 3-13. Russian (Пасечников В. Д., Чу-ков С. З. Дивертикулы желудочно-кишечного тракта. Гастроэнтерология (Прил. к журн. Consilium Medicum) 2005; (2): 3-13).
- Ivanov YuV, Sazonov DV, Panchenkov DN, et al. Zenker's Diverticulum: modern approaches to surgical treatment. Clinical Practice 2016; 7 (3): 17-23. Russian (Иванов Ю. В., Сазонов Д. В., Панченков Д. Н. и др. Дивертикул Ценкера: современные подходы к хирургическому лечению. Клиническая практика 2016; 7 (3): 17-23).
- Collins J, Blankenbaker D, Stern EJ. CT Patterns of Bronchiolar Disease: What is "Tree-in-Bud"? AJR 1998; 171: 365a.
- Krylova EA, Kazakova SS, Avtaeva EV. Gigant Zenker's Diverticulum as the Object X-Ray Examination. Science of the Young (Eruditio Juvenium) 2019; 7 (3): 423-28. Russian (Крылова E. А., Казакова С. С., Афтаева Е. В. Гигантские дивертикулы Ценкера как объект рентгенологического исследования. Наука молодых (Eruditio Juvenium) 2019; 7 (3): 423-28).


