Коморбидность в прогнозировании осложнений хирургического лечения рака желудка
Автор: Суворов В.А., Панин С.И., Коваленко Н.В., Жаворонкова В.В., Постолов М.П., Толстопятов С.Е., Панина А.А., Сулейманов Ш.Р., Везиров Э.Ш., Пешкурова И.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 т.22, 2023 года.
Бесплатный доступ
Цель исследования - изучить результаты и разработать модель прогноза хирургического лечения рака желудка с учетом коморбидности пациентов. материал и методы. Проанализированы результаты лечения 477 (100 %) пациентов со злокачественными опухолями желудка. Стратификация больных на две группы проведена с использованием индекса коморбидности Чарльсон, скорректированной по возрасту - Age-Adjusted Charlson Comorbidity Index (ACCI) (0-4 балла - 311 (65,2 %), более 4 баллов - 166 (34,8 %) пациентов). Субтотальные проксимальные или дистальные резекции желудка проведены 276 (57,9 %) пациентам, гастрэктомия - 178 (37,3 %) больным, субтотальная дистальная резекции желудка или гастрэктомия в эндовидеохирургическом варианте - 19 (4 %), экстирпация культи желудка - 4 (0,8 %) больным. Различий по характеру проведенного оперативного лечения в группах не было. Выявление факторов прогноза и разработку прогностических моделей проводили с применением логистической регрессии, сравнение моделей - путем анализа кривых ошибок (ROC-анализ). Результаты. Частота послеоперационных осложнений III-V степени по классификации Clavien-Dindo была значимо выше во второй группе (9,9 %, 47/477) по сравнению с первой (2,1 %, 10/477) (χ2=64,79, p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Рак желудка, послеоперационные осложнения, коморбидность, индекс коморбидности чарльсон, прогностическая модель
Короткий адрес: https://sciup.org/140302021
IDR: 140302021 | УДК: 616.33-006.6-089-06-037 | DOI: 10.21294/1814-4861-2023-22-4-5-13
Текст научной статьи Коморбидность в прогнозировании осложнений хирургического лечения рака желудка
Цель исследования – изучить результаты и разработать модель прогноза хирургического лечения у пациентов с РЖ с учетом коморбидности.
Материал и методы
Проведен анализ результатов лечения 477 больных с РЖ, оперированных на клинической базе ФГБОУ ВО «Волгоградский государственный медицинский университет» Минздрава России – в ГБУЗ «Волгоградский областной клинический онкологический диспансер» с 1.09.2017 по 1.09.2022.
Изучаемую выборку пациентов разделили на 2 группы (табл. 1), с учетом уровня коморбидности по шкале Чарльсон, скорректированной по возрасту – Age-Adjusted Charlson Comorbidity Index (ACCI). При этом в группу 1 вошли 311 (65,2 %) пациентов с ACCI 0–4 балла, а в группу 2 – 166 (34,8 %) больных с ACCI более 4 баллов. Число сопутствующих заболеваний превышало количество пациентов. В среднем у одного больного выявлено 3 ± 1 ко-морбидных нозологий (медиана – 3, минимум – 0,
максимум – 8 болезней). Сопутствующая патология представлена следующими группами заболеваний: болезни сердечно-сосудистой системы – 334 (70 %), болезни желудочно-кишечного тракта – 225 (47,2 %), болезни дыхательной системы – 58 (12,2 %), болезни эндокринной системы – 36 (7,5 %), болезни опорно-двигательного аппарата – 21 (4,4 %).
Таблица 1/Table 1
|
Группы/Groups |
Значимость различий/ |
||
|
Характеристики/Characteristics |
Группа 1/Group 1 (n=311, 65,2 %) |
Группа 2/Group 2 (n=166, 34,8 %) |
Significance of differences |
Пол/Gender
Примечание: * – критерий χ2 Пирсона; ** – U-критерий Манна–Уитни; *** – критерий χ2 Пирсона с поправкой Бенджамини–Хохберг для множественных сравнений.
Основные характеристики групп сравнения
Main characteristics of comparison groups
Note: * – χ2-Pearson’s test; ** – U-Mann-Whitney’s test; *** – χ2-Pearson’s test with Benjamini–Hochberg’s correction for multiple comparisons
Хирургический доступ и объем вмешательств в группах сравнения
Surgical approach and extent of surgery in comparison groups
Таблица 2/Table 2
|
Группы/Groups |
Значимость различий / |
|
|
Операции/Surgery |
Группа 1/Group 1 Группа 2/Group 2 (n=311, 65,2 %) (n=166, 34,8 %) |
Significance of differences |
Таблица 3/Table 3
Послеоперационные осложнения и летальность в сравниваемых группах Postoperative morbidity and mortality in compared groups
Примечание: * – U-критерий Манна–Уитни; ** – критерий χ2 Пирсона; *** – точный критерий Фишера.
Note: * – U-Mann-Whitney’s test; ** – χ2 Pearson’s test; *** – Fisher’s exact test.
|
Фактор / Factor Возраст/Age |
1 1 I ,_____________▲__________________ |
Скорректированное отношение шансов [95% ДИ| / Adjusted odds ratio [95% CI] U3[0,86;2,24] |
||
|
т |
||||
|
Осложнения до операции / |
||||
|
Complications before operation Время операции / Time of operation |
1 1 |
|||
|
1 1 |
||||
|
Индекс коморбидности / |
1 |
1,56[1,12;2,56] |
||
|
ACCI Лапароскопический доступ / Lapaoscopic approach Мультивисцеральная резекция / Multivisceral |
1 ■ — _ 1 1 ■1 1 1 1 - ■ |
|||
|
0,87[0,77;0,92] |
||||
|
i,/i[i,uy;z,Do] |
||||
|
resection |
1 |
|||
|
Скорректированные отношения шансов (логарифмическая шкала) / Adjusted odds ratios (log scale) |
||||
Рис. 1. Факторы развития послеоперационных осложнений III–V степени по градации Clavien–Dindo
Fig. 1. Factors in the development of postoperative grade Clavien–Dindo Grade III–V complications
Таблица 4/Table 4
Сравнение моделей прогнозирования осложнений III–V степени по Clavien–Dindo Comparison of Clavien–Dindo III–V grade complication prediction models
Статистический анализ проводился с использованием программ Microsoft Excel 2019 и Statistical Package for Social Sciences (SPSS) версии 26. Оценку распределения непрерывных данных проводили с применением теста Колмогорова–Смирнова. Мерой центральной тенденции служили медиана (Me) 25-й и 75-й квартили (Q1 – Q3), среднее (М) и стандартное отклонение (SD). Для характеристики номинальных данных использовали абсолютные значения и процентные доли. При анализе различий групп по количественному признаку применяли тест Манна–Уитни. Для сравнения групп по номинальным бинарным признакам использовали критерий χ 2 Пирсона (при значениях ожидаемого явления более 10), точный критерий Фишера (при значениях ожидаемого явления менее 10). Для сравнения групп по номинальным мультиномиальным признакам применяли критерий χ 2 Пирсона с поправкой Бенджамини–Хохберга для множественных сравнений на post-hoc этапе. Прогнозирование проводилось с применением бинарной логистической регрессии. Для отбора статистически значимых предикторов и построения многофакторных моделей применяли обратный метод Вальда. Оценку чувствительности, специфичности и диагностической эффективности проводили с применением ROC-анализа. Для сравнения ROC-кривых предиктивных моделей использовали тест ДеЛонг.
Результаты
В целом послеоперационная летальность составила 2,1 % (10/477), частота послеоперационных осложнений – 15,1 % (72/477). Среди всех осложнений III–V степень отмечена в 11,9 % (57/477). При этом различия между пациентами основной и контрольной групп по всем постоперационным показателям носили значимый характер (табл. 3). В структуре послеоперационных осложнений у пациентов с более высоким уровнем коморбидности преобладали несостоятельность эзофагоэнтероана-
стомоза – 2,9 % (14/477), несостоятельность культи ДПК – 1,7 % (8/477), пневмония – 1,3 % (6/477), желудочно-кишечное кровотечение – 1,3 % (6/477) и нагноение раны – 1 % (5/477).
Выявленные различия между группами пациентов с низким и высоким уровнем ACCI указывают на то, что коморбидность является важным фактором, влияющим на прогноз. Для оценки количественной меры вклада этого фактора и установления взаимосвязанных с ним других предикторов был проведен прогностический анализ. В качестве прогнозируемого бинарного исхода выбрано развитие осложнений III–V степени по классификации Clavien–Dindo (CD).
В ходе однофакторного анализа установлено, что значимыми предикторами возникновения осложнений III–V степени по CD являются возраст пациента, наличие осложнений опухоли до операции, продолжительность вмешательства, ACCI, хирургический доступ и мультивисце-ральная резекция. При многофакторном анализе, учитывающем взаимное влияние предикторов, значимым влиянием на развитие осложнений III–V степени обладали ACCI, хирургический доступ и мультивисцеральная резекция (рис. 1).
Диагностическая значимость предиктивной модели, учитывающей коморбидность, по сравнению с моделью без учета данного предиктора была оценена с помощью метода анализа кривых ошибок (ROC-кривых), представленных на рис. 2. Для модели, учитывающей фактор коморбидности больного, установлены более высокая чувствительность, специфичность и диагностическая эффективность, чем для модели без учета формализованной оценки сопутствующей патологии. Сравнительные характеристики моделей приведены в табл. 4. Учет коморбидного статуса пациента позволяет значимо увеличить чувствительность прогноза с 61,4 до 71,9 %, специфичность – с 91,7 до 99,8 % и диагностическую эффективность – с 88,1 до 96,4 %. Различия между прогностическими моделями были значимы согласно тесту ДеЛонг.
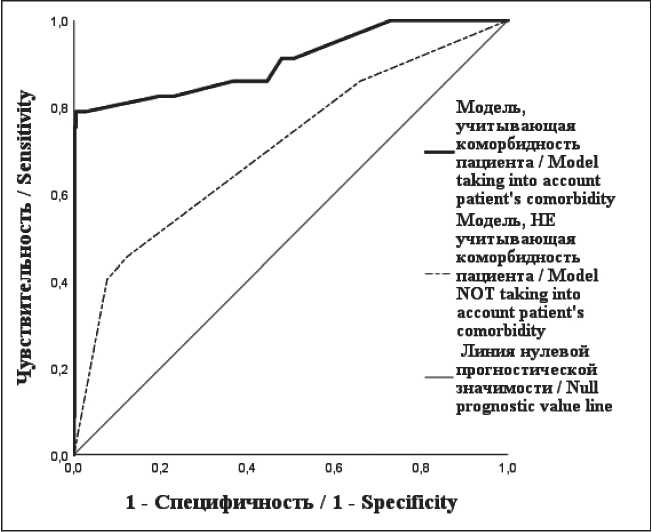
Рис. 2. Сравнительный анализ ROC-кривых вероятности развития послеоперационных осложнений III–V степени по Clavien–Dindo
Fig. 2. Comparative analysis of the ROC-curves of likelihood of postoperative complications of Clavien–Dindo Grade III–V
Корректность разработанной прогностической модели подтверждена с помощью подгруппового анализа. При индексе ACCI более 4 баллов послеоперационные осложнения III–V степени отмечены в 47/166 (28,3 %) случаях, при значении ACCI 4 и менее – в 10/311 (3,2 %) (χ 2 =64,8, p<0,001). Муль-тивисцеральная резекция сопровождалась ростом послеоперационных осложнений с 31/399 (7,8 %) до 26/78 (33,3 %) (χ 2 =40,5, p<0,001). Выполнение операции лапароскопическим доступом уменьшало вероятность осложнений III–V степени Clavien– Dindo с 56/428 (13 %) до 1/49 (2 %) (χ 2 с поправкой Йейтса=4,1, p=0,043).
Обсуждение
Точка cut-off, т. е. граничное значение, отделяющее «низкий» уровень коморбидности от «высокого», остается дискутабельной [6, 15]. В нашем исследовании выбор граничного значения обусловлен литературными данными и результатами собственного ROC-анализа, подтверждающего
существенное ухудшение прогноза у пациентов с уровнем коморбидности выше 4 баллов ACCI. Выбор этого граничного значения при стратификации пациентов на две группы дал возможность выделить и включить в прогностическую концепцию формализованную оценку фактора комор-бидности, вносящего весомый вклад в развитие послеоперационных осложнений. Установленные нами предиктивные закономерности нуждаются в
Список литературы Коморбидность в прогнозировании осложнений хирургического лечения рака желудка
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3): 209–49. doi: 10.3322/caac.21660.
- Павлов Р.В., Тимофеева К.О., Черных М.А., Данилин В.Н. Безопасность и преимущества раннего перорального питания в рамках программы fast-track среди пациентов, перенесших гастрэктомию по поводу рака желудка. Сибирский онкологический журнал. 2022; 21(2): 81–7. [Pavlov R.V., Timofeeva K.O., Chernykh M.A., Danilin V.N. Safety and benefits of early oral nutrition as part of the fast-track program among patients who have undergone gastrectomy for stomach cancer. Siberian Journal of Oncology. 2022; 21(2): 81–7. (in Russian)]. doi: 10.21294/1814-4861-2022-21-2-81-87.
- Злокачественные новообразования в России в 2020 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М., 2021. 239 с. [Malignant tumors in Russia in 2020 (morbidity and mortality). Ed. by A.D. Kaprin, V.V. Starinsky, A.O. Shakhzadova. Moscow, 2021. 239 p. (in Russian)].
- Бесова Н.С., Калинин А.Е., Неред С.Н., Трякин А.А., Гамаюнов С.В. Клинические рекомендации «Рак желудка». 2020. 95 с. [Besova N.S., Kalinin A.E., Nered S.N., Tryakin A.A., Gamaynov S.V. Clinical guidelines «Gastric cancer». 2020. 95 p. (in Russian)].
- Израилов Р.Е., Поморцев Б.А., Хатьков И.Е., Карачун А.М., Пелипась Ю.В., Сапронов П.А., Рябов А.Б., Хомяков В.М., Колобаев И.В., Каннер Д.Ю., Кононец П.В., Кащенко В.А., Васюкова Е., Глузман М., Ландо М.Н., Шинкарев С.А., Брикин В.Н., Жевелюк А.Г., Попов А.Ю., Журавлев П.А., Попов А.Ю., Петровский А.Н., Бойдо С.В., Голуб Д.А., Неймарк А.Е., Данилов И.Н., Маслев В.В. Проспективное многоцентровое исследование по оценке эффективности лапароскопических гастрэктомий у больных с местно-распространенными формами рака желудка. Эндоскопическая хирургия. 2019; 25(5): 10–7. [Izrailov R.E., Pomortsev B.A., Khatkov I.E., Karachun A.M., Pelipas Yu.V., Sapronov P.A., Ryabov A.B., Khomyakov V.M., Kolobaev I.V., Kanner D.Yu., Kononec P.V., Kashchenko V.A., Vasyukova E., Gluzman M., Lando M.N., Shinkarev S.A., Brikin V.N., Zheveliuk A.G., Popov A.Yu., Zhuravlev P.A., Popov A.Yu., Petrovsky A.N., Boydo S.V., Golub D.A., Neymark A.E., Danilov I.N., Maslev V.V. Effectiveness of laparoscopic gastrectomy in patients with locally advanced gastric cancer: a prospective, multicenter study. Endoscopic surgery. 2019; 25(5): 10–7. (in Russian)]. doi: 10.17116/endoskop20192505110.
- Maezawa Y., Aoyama T., Kano K., Tamagawa H., Numata M., Hara K., Murakawa M., Yamada T., Ogata T., Oshima T., Yukawa N., Yoshikawa T., Masuda M., Rino Y. Impact of the Age-adjusted Charlson comorbidity index on the short- And long-term outcomes of patients undergoing curative gastrectomy for gastric cancer. J Cancer. 2019; 10(22): 5527–35. doi: 10.7150/jca.35465.
- Аллахвердян А.С., Анипченко А.Н., Анипченко Н.Н., Тульских Д.А. Непосредственные результаты лапароскопических резекций желудка и гастрэктомий при раке. Современная наука: Актуальные проблемы теории и практики. 2021; (7): 153–6. [Allakhverdyan A.S., Anipchenko A.N., Anipchenko N.N., Tulskikh D.A. Immediate results of laparoscopic partial and total gastrectomies in cancer. Modern Science: Current Problems of Theory and Practice. 2021; (7): 153–6. (in Russian)]. doi: 10.37882/2223–2966.2021.07.03.
- Ахметзянов Ф.Ш., Каулгуд Х.А., Ахметзянова Ф.Ф. Результаты хирургических вмешательств при раке проксимального отдела желудка без перехода на пищевод. Сибирский онкологический журнал. 2021; 20(4): 84–90. [Akhmetzyanov F.Sh., Kaulgud H.A., Akhmetzyanova F.F. Surgical outcomes in patients with proximal gastric cancer without esophageal invasion. Siberian Journal of Oncology. 2021; 20(4): 84–90. (in Russian)]. doi: 10.21294/1814-4861-2021- 20-4-84-90.
- Wang S., Xu L., Wang Q., Li J., Bai B., Li Z., Wu X., Yu P., Li X., Yin J. Postoperative complications and prognosis after radical gastrectomy for gastric cancer: a systematic review and meta-analysis of observational studies. World J Surg Oncol. 2019; 17(1): 1–10. doi:10.1186/S12957-019-1593-9.
- Chen G., Wang J., Chen K., Kang M., Zhang H., Jin X., Lin L., Chen J. Relationship between postoperative complications and the prognosis of gastric carcinoma patients who underwent surgical resection: a systematic review and meta-analysis. Cancer Control. 2021; 28: 1–12. doi: 10.1177/10732748211011955.
- Xu Y., Wang Y., Xi C., Ye N., Xu X. Is it safe to perform gastrectomy in gastric cancer patients aged 80 or older? Medicine. 2019; 98(24): 10–6. doi:10.1097/MD.0000000000016092.
- Mita K., Ito H., Katsube T., Tsuboi A., Yamazaki N., Asakawa H., Hayashi T., Fujino K. Prognostic factors affecting survival after multivisceral resection in patients with clinical T4b gastric cancer. J Gastrointest Surg. 2017; 21(12): 1993–9. doi: 10.1007/S11605-017-3559-Y.
- Dindo D., Demartines N., Clavien P.A. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg. 2004; 240(2): 205–13. doi: 10.1097/01.sla.0000133083.54934.ae.
- Стилиди И.С., Мерзляков В.Ю., Скопин А.И., Байчурин Р.К., Вашакмадзе Л.А., Калинин А.Е., Салимова А.А. Симультанное аорто-коронарное шунтирование и гастрэктомия у больного раком желудка и ишемической болезнью сердца. Клиническая и экспериментальная хирургия. Журнал им. академика Б.В. Петровского. 2021; 9(1): 81–3. [Stilidi I.S., Merzlyakov V.Yu., Skopin A.I., Baychurin R.K., Vashakmadze L.A., Kalinin O.Ye., Salimova A.A. Simultaneous coronary artery bypass and total gastrectomy. Clinical and Experimental Surgery. Petrovsky Journal. 2021; 9(1): 81–3. (in Russian)]. doi: 10.33029/2308-1198-2021-9-1-81-83.
- Tian Y., Jian Z., Xu B., Liu H. Age-adjusted Charlson comorbidity index score as predictor of survival of patients with digestive system cancer who have undergone surgical resection. Oncotarget. 2017; 8(45): 79453–61. doi: 10.18632/oncotarget.18401.
- Комаров Р.Н., Новиков С.С., Осминин С.В., Билялов И.Р., Рябов К.Ю., Заваруев А.В., Базиянц Л.Р., Астаева М.О. Хирургия рака желудка у пациентов с конкурирующей ишемической болезнью сердца (клинические случаи). Российский онкологический журнал. 2021; 26(6): 213–24. [Komarov R.N., Novikov S.S., Osminin S.V., Bilyalov I.R., Ryabov K.Y., Zavaruev A.V., Baziyants L.R., Astaeva M.O. Surgery for gastric cancer in patients with coronary heart disease (clinical cases). Russian Journal of Oncology. 2021; 26(6): 213–24. (in Russian)]. doi: 10.17816/onco111771.
- Удалов Ю.Д., Гордиенко А.В., Самойлов А.С., Бахарев С.А. Прогнозирование и минимизация рисков фатальных исходов планового хирургического лечения онкологических больных с коморбидной соматической патологией. Медицина экстремальных состояний. 2018; 20(2): 136–45. [Udalov Yu.D., Gordienko A.V., Samoilov A.S., Bakharev S.A. Forecasting and risks minimization of fatal adverse outcomes of elective surgical treatment of oncological patients with comorbid somatic pathology. Medicine of Extreme Situations. 2018; 20(2): 136–45. (in Russian)].
- Lin J.X., Huang Y.Q., Xie J.W., Wang J., Lu J., Chen Q.Y., Cao L., Lin M., Tu R.H., Huang Z.N., Lin J.L., Li P., Huang C.M., Zheng C.H. Age-adjusted Charlson Comorbidity Index (ACCI) is a significant factor for predicting survival after radical gastrectomy in patients with gastric cancer. BMC Surg. 2019; 19(1): 53. doi: 10.1186/s12893-019-0513-9.


