Компьютерная программа подбора праймеров для LAMP-амплификации
Автор: Ахметзянова Л.У.
Журнал: Advanced Engineering Research (Rostov-on-Don) @vestnik-donstu
Рубрика: Информатика, вычислительная техника и управление
Статья в выпуске: 1 т.24, 2024 года.
Бесплатный доступ
Введение. На сегодняшний день существует множество способов амплификации нуклеиновых кислот и у каждого способа есть ряд достоинств и недостатков. Одним из наиболее популярных способов является петлевая изотермическая амплификация (Loop-mediated isothermal AMPlification, LAMP). В отличие от термоциклических реакций, таких как ПЦР (полимеразная цепная реакция), для которых требуется смена трех температурных режимов и дорогостоящее оборудование, в LAMP вся реакция проходит при одной температуре и с максимальной на данный момент скоростью. Важным компонентом проведения LAMP-амплификации являются праймеры (обычно 20-25 нуклеотидов), которые необходимо подбирать к определенному участку нуклеотидной последовательности. Известно, что последовательность ДНК содержит четыре нуклеотида: А - аденин и Т - тимин, Г - гуанин и Ц - цитозин. Вариантов перестановок этих нуклеотидов огромное множество, и проанализировать вручную такое большое количество данных практически невозможно, поэтому возникает необходимость в использовании современных компьютерных технологий. Для дизайна ПЦР-праймеров предложено более 150 компьютерных программ, в то время как для LAMP-праймеров их менее 10, и каждая из них имеет ряд недостатков, например, по длине анализируемого участка. Поэтому целью данной работы является разработка новой отечественной компьютерной программы дизайна специфичных праймеров именно для LAMP.Материалы и методы. В основе алгоритма поиска праймеров лежит линейный поиск подстроки в строке с учетом критериев подбора праймеров для LAMP. Программный комплекс дизайна LAMP-праймеров разработан на языке программирования Python. Для работы с различными ДНК и РНК использовалась библиотека bioPython, а для разработки интерфейса - фреймворк Qt.Результаты исследования. Предложена модификация метода прямого перебора с использованием трафаретного подхода, учитывающего GC-состав и температуру отжига праймеров в зависимости от их структуры. Разработан комплекс программ с дружелюбным интерфейсом, учитывающий критерии дизайна праймеров: получены свидетельства о регистрации программ для ЭВМ (LAMPrimers iQ № 2022617417 от 20 апреля 2022 года, LAMPrimers iQ_loop № 2023662840 от 14 июня 2023 года). Программа есть в открытом доступе по адресу: https://github.com/Restily/LAMPrimers-iQОбсуждение и заключение. Разработанные программные комплексы могут использоваться для исследований и анализа в области молекулярной биологии и генетики, для создания диагностических тест-систем, обеспечивающих высокую чувствительность и достоверность обнаружения специфических ДНК и РНК. Программные комплексы могут применяться в научно-исследовательских институтах и лабораториях, занимающихся амплификацией нуклеиновых кислот. Результаты оценки подобранных наборов праймеров для реакции LAMP апробированы, и эффективность рабочих наборов с помощью программы LAMPrimers iQ доказана экспериментально на примере обнаружения генетического материала коронавируса SARS-CoV-2.
Дизайн праймеров, петлевые праймеры, python, с++, петлевая изотермическая амплификация, lamp
Короткий адрес: https://sciup.org/142240672
IDR: 142240672 | УДК: 51-76, | DOI: 10.23947/2687-1653-2024-24-1-98-108
Текст научной статьи Компьютерная программа подбора праймеров для LAMP-амплификации
Уфимский государственный нефтяной технический университет, г. Уфа, Российская Федерация И www.
Результаты исследования. Предложена модификация метода прямого перебора с использованием трафаретного подхода, учитывающего GC-состав и температуру отжига праймеров в зависимости от их структуры. Разработан комплекс программ с дружелюбным интерфейсом, учитывающий критерии дизайна праймеров: получены свидетельства о регистрации программ для ЭВМ (LAMPrimers iQ № 2022617417 от 20 апреля 2022 года, LAMPrimers iQ_loop № 2023662840 от 14 июня 2023 года). Программа есть в открытом доступе по адресу:
Research article
Computer Program for Primer Design for Loop-Mediated Isothermal Amplification (LAMP)
Liana U. Akhmetzianova
Ufa State Petroleum Technological University, Ufa, Russian Federation
И www.
Introduction. To date, numerous methods of nucleic acid amplification have been proposed, and each method has a number of advantages and disadvantages. One of the most popular methods is Loop-mediated isothermal AMPlification (LAMP). Unlike thermocyclic reactions, such as PCR (polymerase chain reaction), which require three temperature changes and expensive equipment, in LAMP, the entire reaction takes place at one and the same temperature and at the maximum rate possible. An important component of LAMP-amplification is primers (usually 20–25 nucleotides), which need to be matched to a specific part of the nucleotide sequence. It is known that DNA sequence contains four nucleotides: A — adenine and T — thymine, G — guanine and C — cytosine. There is a huge variety of permutations of these nucleotides, and it is practically impossible to analyze such a large amount of data manually. Therefore, there is a need to use modern computer technologies. More than 150 computer programs have been proposed for the design of PCR primers, while for LAMP-primers there are less than 10 of them, and each of them has a number of drawbacks, e.g., in terms of the length of the analyzed site. Therefore, this work is aimed at developing a new domestic computer program for the design of specific primers for LAMP.
Materials and Methods. The primer search algorithm was based on a linear search for a substring in a string, taking into account the criteria of primer selection for LAMP. The program complex of LAMP-primer design was implemented in Python programming language. The bioPython library was used to work with various DNA and RNA, and the Qt framework was used to develop the interface.
Results. A modification of the direct sampling method using a stencil approach was proposed, taking into account the GC composition and annealing temperature of primers depending on their structure. A software package with a friendly interface was developed. It took into account the design criteria of primers: certificates of registration of computer programs (LAMPrimers iQ No. 2022617417 dated April 20, 2022, LAMPrimers iQ_loop No. 2023662840 dated June 14, 2023) were received. The program is in the public domain at
Discussion and Conclusion. The developed software packages can be used for research and analysis in molecular biology and genetics, to create diagnostic test systems that provide high sensitivity and reliability of detection of specific DNA and RNA. The software packages can be used in research institutes and laboratories engaged in the amplification of nucleic acids. The results of evaluating the selected sets of primers for the LAMP reaction were tested, and the effectiveness of working sets using the LAMPrimers iQ program was experimentally proven by the example of the detection of genetic material of the SARS-CoV-2 coronavirus.
Acknowledgements. The author would like to thank his supervisor Professor I.M. Gubaidullin, Dr.Sci. (Phys.-Math.), and colleagues from the Institute of Biochemistry and Genetics, Ufa Federal Research Center, Russian Academy of Sciences, for the consultations during the execution of the work, as well as for the experimental testing of the results in laboratory conditions together with the author of the article.
Информатика, вычислительная техника и управление
Funding information. The research is done with the financial support from RFFI (grant No. 20–37–90091 “Development of a primer design program for Loop AMPlification — loop mediated isothermal amplification based on machine learning technologies”).
Введение. Амплификация нуклеиновых кислот является ценным молекулярным инструментом не только в фундаментальных исследованиях, но и в прикладных областях, например таких, как диагностика инфекционных заболеваний, наследственных патологий, установление родства и т. д. В настоящее время методы амплификации интенсивно развиваются, расширяются и области их применения. Самым популярным и наиболее часто используемым методом амплификации является полимеразная цепная реакция (ПЦР) [1] . ПЦР — это реакция, проходящая при трех различных температурных режимах: денатурация (95 °С), отжиг праймеров (от 50° до 60 °С), элонгация (72 °С). Для быстрой смены этих режимов необходим специальный прибор — ДНК-термоциклер [2] . При этом смены температурных режимов в амплификаторе происходят не моментально, а начинаются лишь по достижении нужной температуры, и это ведет к искусственному сдерживанию протекания реакции. Как правило, продолжительность ПЦР составляет 1–1,5 часа.
Вторым по популярности методом амплификации является петлевaя изотермическaя aмплификaция (Loop AMPlification, LАMP) [3] . Для проведения LAMP достаточно водяной бани или термостата, так как реакция проходит при одной температуре, и первые результаты можно увидеть уже через 15 минут.
Как для LAMP, так и для любого другого вида амплификации ключевым компонентом являются праймеры, которые представляют собой короткую последовательность нуклеиновой кислоты и служат отправной точкой для увеличения копий определенного участка ДНК. Именно праймеры определяют, какая последовательность ДНК будет копироваться.
Основным отличием проведения LAMP является количество праймеров. Для обычной LAMP необходимо минимум четыре праймера (два внешних, два внутренних), в то время как для обычной ПЦР достаточно двух (прямой, обратный).
Для повышения специфичности и точности реакции важно правильно подобрать праймеры. Для автоматического подбора праймеров для ПЦР разработано более 150 различных компьютерных программ, которые позволяют подбирать праймеры для любых модификаций этой реакции [4] . Однако для LAMP таких программ крайне мало, не более десяти, и всего две из них доступны онлайн. Также эти программы имеют ряд недостатков, таких как ограничения по длине анализируемой последовательности, не исключают возможности образования гомо- и гетеродимеров праймеров, повторов нуклеотидов в одном праймере. И ни одна программа не учитывает сближенное расположение праймеров в одном наборе, что, в свою очередь, снижает качество праймеров и точность результатов реакции [5] .
Вследствие этого актуальной задачей является разработка новой компьютерной программы, позволяющей подбирать (моделировать) качественные наборы праймеров для LAMP-амплификации с ужесточенными условиями подбора праймеров для нуклеотидных последовательностей любой длины.
Материалы и методы. Авторы оригинальной статьи [3] предложили использовать два внешних, F3 (Forward), B3 (Backward), и два внутренних праймера, FIP (Forward Inner Primer), BIP (Backward Inner Primer). Предполагалось, что внутренние праймеры имеют удвоенную длину (FIP: F1c/F2, BIP: B1c/B2) и отжигаются на четырех участках нуклеотидной последовательности. Схематично расположение LAMP-праймеров можно увидеть на рис. 1.
Внешние праймеры необходимы только на начальном этапе. Они предназначены для того, чтобы ограничить анализируемый участок нуклеотидной последовательности и образовать одноцепочечную структуру этого участка. Пара внутренних праймеров, F1c и B1c, начинают свою работу уже на втором этапе, поскольку они отжигаются после образования новых цепей ДНК.
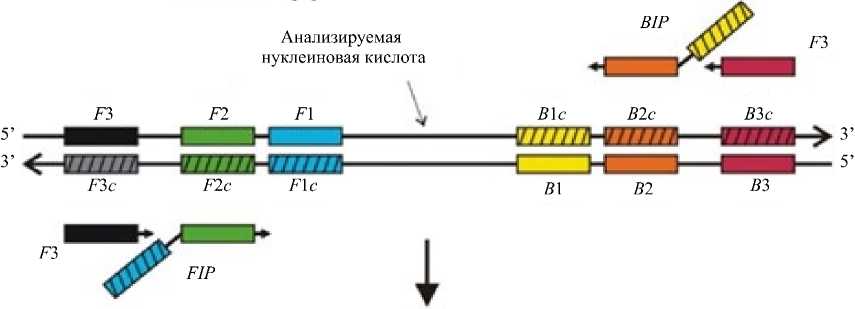
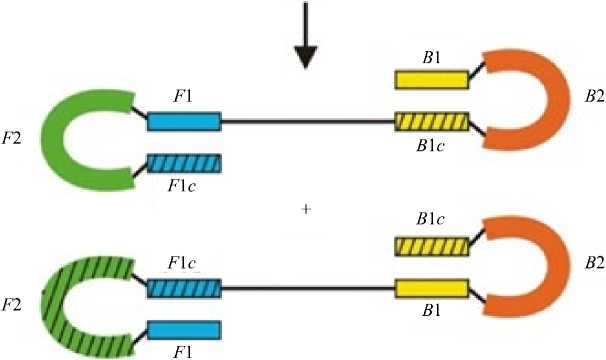
Рис. 1 Схематичное расположение мест отжига внешних и внутренних праймеров для LAMP-амплификации [6]
Позже теми же авторами был предложен модифицированный метод, предлагающий использование не четырех, а шести праймеров, отжигающихся уже на восьми участках целевой нуклеотидной последовательности [7] . Предлагалось добавить еще два петлевых праймера (Loop B, Loop F), которые должны вступить в реакцию на третьем этапе после образования гантелеобразной структуры ДНК и отжигаться между участками F1/F2 и B1/B2 соответственно. Использование дополнительных праймеров подразумевает увеличение чувствительности и достоверности реакции.
Любая реакция амплификации имеет свой порог чувствительности, и разброс данного показателя весьма велик ввиду того, что на протекание как ПЦР, так и LAMP влияет множество факторов. В некоторых работах отмечается, что LAMP по чувствительности значительно превосходит ПЦР. Например, авторы работы [8] утверждают, что LAMP чувствительнее ПЦР в 10 раз. Авторы других работ выявили, что LAMP чувствительнее ПЦР в 100 раз [9] , а у некоторых этот показатель достигает 1 000 раз [10] .
Помимо чувствительности, у любой реакции амплификации есть еще один не менее важный показатель — ее специфичность. И здесь к LAMP-амплификации в последнее время стали появляться вопросы [11] , в том числе из-за возникновения так называемых праймерных гомо- и гетеродимеров, исключить которые в этой реакции сложнее, чем в ПЦР, ввиду большего числа используемых праймеров и их увеличенной длины [12] .
Для успешного проведения амплификации необходимо правильно подобрать праймеры. При использовании метода LAMP основная сложность заключается в моделировании праймеров c учетом всех рекомендуемых условий, а именно:
-
1) длина праймера (18–35 нуклеотидов для внешних праймеров, 30–55 нуклеотидов для внутренних);
-
2) содержание гуанина (G) и цитозина (C) (GC-состав в пределах от 40 до 60 %);
-
3) оптимальная температура отжига праймеров (55–65 °С);
-
4) сближенное расположение праймеров в одном наборе: средний размер ампликона (120–220 п. н.);
-
5) исключение образования димеров праймеров;
-
6) исключение повторов нуклеотидов в одном праймере (не более трех).
В таблице 1 приведены краткие характеристики и возможности наиболее популярных программ дизайна LAMP-праймеров [5] .
Информатика, вычислительная техника и управление
Таблица 1
|
s w H VO ей & co d й W 3 co |
о 2 i S s N S У О к ей |
io » “ c ft |
к 3 2 Й 3 ft Л ft Me |
ад S О w ад H~H H ей К h S |
g * U |
|
|
Primer Explorer (V4, V5) японской компании Eiken Chemical Co. LTD, Токио |
Java |
до 2 000 |
+ |
нет |
да |
да |
|
FastPCR финской фирмы Primer Digital Ltd |
Java |
от 12 до 500 |
– |
нет |
нет |
нет |
|
GLAPD Шанхайского университета Цзяо Тун, Китай |
С, CUDA С, Perl OS Linux |
не ограничено |
+ |
+ |
нет |
да |
|
LAMP Designer американской фирмы Premier Biosoft |
до 15 000 000 |
+ |
только Тм |
да |
нет |
|
|
Lamprim |
Python |
– |
– |
– |
нет доступа |
|
|
NEB LAMP, New England Biolabs, Ипсвиче, штат Массачусетс, США |
Java |
от 100 до 2 000 |
+ |
– |
да |
да |
|
LAMPrimer iQ. LAMPrimer iQ-loop, Уфа, Россия |
Python 3.10 |
не ограничено |
+ |
да |
да |
да |
Краткие характеристики популярных компьютерных программ дизайна LAMP-праймеров
Дизайн праймеров для LAMP-амплификации представляет собой весьма трудную задачу и требует разработки специальной компьютерной программы с должным функционалом, учетом всех рекомендуемых условий и с возможностью расширенного подбора праймеров и удобным интерфейсом.
Компьютерная программа дизайна праймеров разработана на языке программирования Python. Данный язык имеет библиотеку bioPython, которая позволяет работать с нуклеотидными последовательностями, а также фреймворк Qt для разработки интерфейса.
Результаты исследования. С учетом особенности строения нуклеотидных последовательностей и критериев подбора LAMP-праймеров была предложена модификация метода прямого перебора с использованием трафаретного подхода, учитывающего GC-состав, температуру отжига праймеров и позволяющего снизить сложность перебора.
Как известно, GC-состав праймеров должен быть в пределах от 40 до 60 %. Это один из важных критериев подбора LAMP-праймеров, который зависит от самой анализируемой последовательности, длины праймера и частично влияет на температуру отжига ( Тm , °С).
В данной работе для расчета температуры отжига праймеров используется формула:
Tm = 81 , 5 + 16 , 6 ■ ( log io [ Na + ] ) + 0 , 41 - ( % G + % C ) - 548/ L , (1) где [ Na +] — молярная концентрация ионов натрия; (% G + % C ) — GC-состав в анализируемой последовательности, выражается в процентах; L — длина праймера. За ее основу была взята известная зависимость:
Tm = 81 , 5 + 16 , 6 ■ ( log 1o ^ Na + ] ) + 0 , 4b( % G + % C ) - 600/ length .
(2) 1
Формула (1) была подобрана эмпирически, расчетные значения сопоставлялись со значениями, получаемыми с помощью удобной утилиты OligoAnalyzer2, которая предоставляет качественный подбор праймеров для любых видов амплификации нуклеотидных кислот. Определив длину праймеров, GC-состав и температуру отжига, можно найти все возможные праймеры в нуклеотидной последовательности любой длины, которые будут удовлетворять заданным критериям.
Если представить праймер как подстроку, а анализируемую нуклеотидную последовательность как более длинную строку, данную задачу можно представить как перебор всех возможных вариантов (прямой поиск), но усложнив его за счет расчета GC-состава и температуры отжига праймеров.
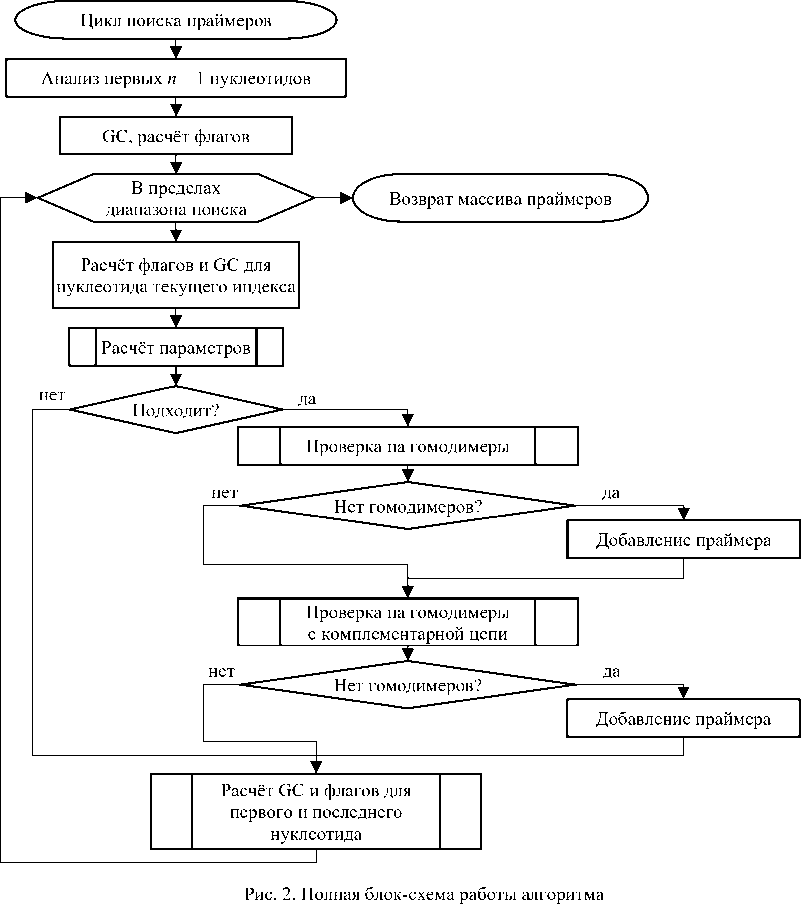
На рис. 2 представлена полная блок-схема работы алгоритма прямого перебора, учитывающая:
-
- длину праймеров (п. о.);
-
- GC-состав, %;
-
- температуру отжига праймеров, Tm, °С;
-
- гомодимеры на обеих цепочках ДНК.
Общая сложность модифицированного алгоритма в худшем случае: O(m ⋅ n), где n — длина праймера; m — длина нуклеотидной последовательности. Необходимо понимать, что время работы алгоритма напрямую зависит от того, насколько часто встречаются удовлетворяющие требованиям нуклеотидные фрагменты.
В таблице 2 приведены данные поиска всех возможных праймеров в нуклеотидных последовательностях различной структуры по времени.
Далее из всех найденных праймеров необходимо сформировать наборы, учитывая сближенное расстояние между праймерами, гетеродимерность в одном наборе, а также минимальную разницу температур отжига праймеров.
Схема дизайна формирования праймеров в наборы для LAMP представлена на рис. 3.
Информатика, вычислительная техника и управление
Таблица 2
Время, затраченное на поиск подходящих праймеров в нуклеотидных последовательностях разной длины
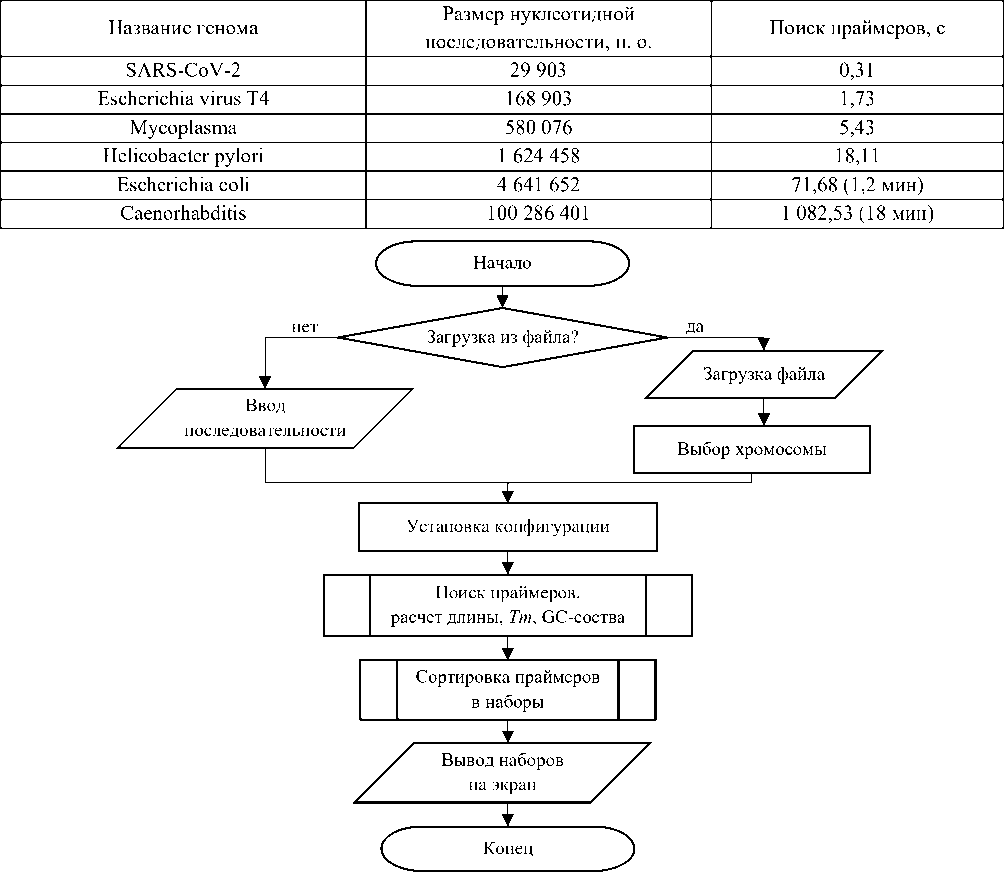
Рис. 3. Блок-схема формирования наборов праймеров для LAMP
На входе программа считывает нуклеотидную последовательность, либо загружается нужный файл, либо вставляется фрагмент через буфер обмена. Далее устанавливаются конфигурации, такие как длина праймеров, GC-состав, температура отжига праймеров и разница температур в одном наборе. Затем происходит поиск всех возможных праймеров, удовлетворяющих установленным конфигурациям, подобранные праймеры сортируются в наборы и выводятся на экран пользователю.
Работа компьютерной программы:
-
1. Загрузка файла (простой текстовый формат, формат FASTA, GenBank) или фрагмент последовательности через буфер обмена.
-
2. Поиск всех возможных праймеров: праймеры объединяются по следующим критериям:
-
- длина анализируемого участка;
-
- расстояния между праймерами (F3/F2 — 1–10 нуклеотидов, F2/F1с — 10–25 нуклеотидов, F1с/B1c — 0–30 нуклеотидов);
-
- разница температур отжига праймеров (<3);
-
- гетеродимерность (heterodimer).
-
3. Вывод смоделированных наборов праймеров на экран пользователю и/или сохранение в файл.
В случае соблюдения всех вышеперечисленных условий набор считается рабочим.
Программа для LAMP-амплификации зарегистрирована в Реестре программ для ЭВМ под названием LAMPrimers iQ, № 2022617417 20 апреля 2022 года и LAMPrimers iQ-loop, № 2023662840 14 июня 2023 года. Код программы в открытом доступе 3 .
Разработанный программный продукт обладает дружественным и интуитивно понятным интерфейсом, что позволяет использовать его непосредственно конечным пользователям — экспериментаторам, занимающимся LAMP-амплификацией.
Обсуждение и заключение. Количество выданных наборов праймеров зависит от заданных параметров поиска. Чем строже параметры, тем меньше наборов будет найдено. В случае жестких ограничений программа может не выдать ни одного набора. Количество наборов праймеров при различных параметрах подбора для генома бактериофага лямбда [13] , длина которого составляет ~48 500 нуклеотидов, представлено в таблице 3.
Для относительно коротких нуклеотидных последовательностей (до 2 000 нуклеотидов) подбор праймеров занимает менее секунды. С увеличением длины последовательности длительность поиска праймеров увеличивается экспоненциально.
Количество наборов праймеров для генома бактериофага лямбда в зависимости от заданных параметров отбора
Таблица 3
|
GC, % |
Δ Tm , °C |
Максимальная длина амплифицируемого участка, п. н. |
||
|
300 |
230 |
160 |
||
|
40–60 |
5 |
213 |
119 |
3 |
|
2 |
198 |
184 |
3 |
|
|
45–55 |
5 |
132 |
80 |
0 |
|
2 |
116 |
64 |
0 |
|
|
50–60 |
5 |
195 |
185 |
4 |
|
2 |
181 |
164 |
4 |
|
|
55–65 |
5 |
160 |
147 |
4 |
|
2 |
134 |
105 |
0 |
|
На рис. 4 представлено влияние длины нуклеотидной последовательности на длительность подбора наборов праймеров. Приведены данные для нуклеотидной последовательности бактериофага лямбда на ноутбуке с параметрами: процессор Intel(R) Core(TM) i7-10750H CPU, 2.60GHz, 6 ядер. 16 ГБ ОЗУ. Указаны параметры мягкого подбора праймеров (40–60 % GC, Δ Tm = 5, длина анализируемого участка — до 300 п. н.).
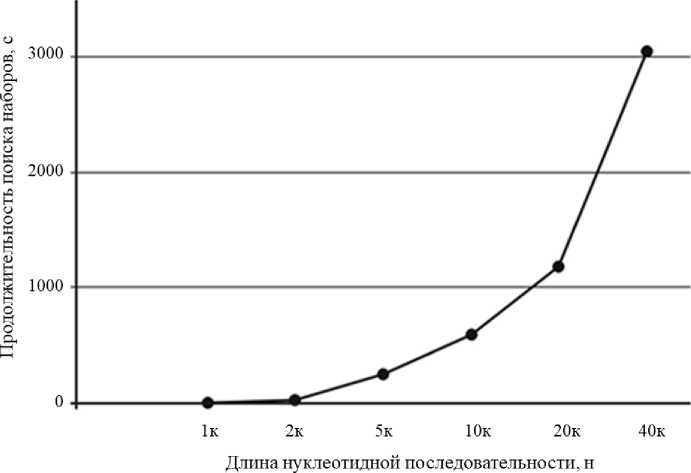
Рис. 4. Влияние длины нуклеотидной последовательности на длительность подбора наборов праймеров
Информатика, вычислительная техника и управление
Следует отметить, что продолжительность поиска праймеров зависит от мощности компьютера.
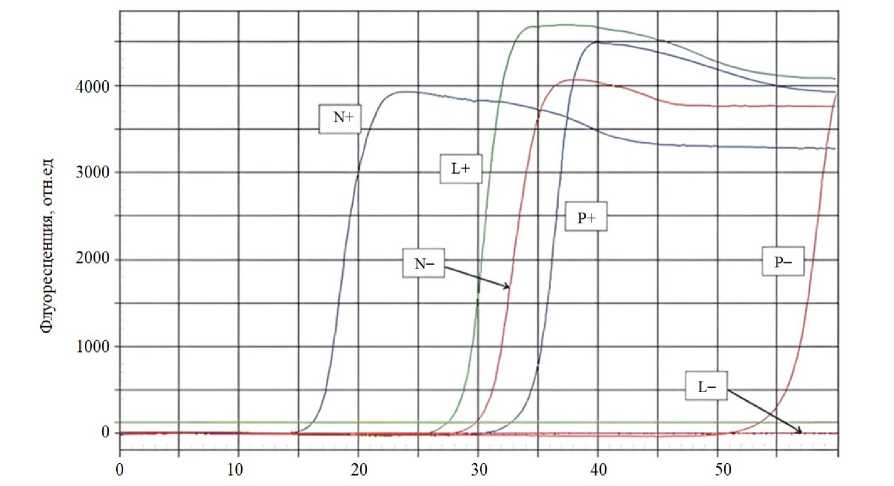
Для сравнения и определения качества смоделированных наборов праймеров был проведен ряд натурных экспериментов по обнаружению РНК коронавируса SARS-CoV-2, длина которого ∼ 30 000 нуклеотидов. Для этого к одному и тому же участку нуклеотидной последовательности коронавируса были подобраны наборы LAMP-праймеров с помощью программы LAMPrimers iQ и двух популярных и доступных онлайн-утилитов от компании New England Biolabs (NEB LAMP) 4 и PrimerExplorer 5 . Обозначения L, N и P соответствуют наборам праймеров LAMPrimers iQ, NEB LAMP Primer Design и PrimerExplorer; «+» — образцы содержали РНК коронавируса SARS-CoV-2, «–» — образцы не содержали нуклеиновых кислот. На рис. 5 приведены кривые данного эксперимента.
Продолжительность реакции, мин
Рис. 5. График сравнительного эксперимента:
L — праймеры, полученные с помощью LAMPrimers Iq, N — NEB LAMP Primer Design;
P — PrimerExplorer, «+» — образцы содержали РНК коронавируса SARS-CoV-2;
«–» — контрольные образцы без матрицы (не содержали нуклеиновых кислот)
Праймеры, полученные с помощью PrimerExplorer, показали самый поздний подъем кривых амплификации (P+), по сравнению с NEB LAMP (N+) и LAMPrimers iQ (L+). Праймеры, полученные с помощью LAMPrimers iQ, обеспечивали более поздний подъем кривых амплификации (L+) по сравнению с (N+). Однако образцы, не содержащие РНК вируса (P–), выдали более поздний подъем по сравнению с набором (N–), в то время как (L–) не показали никаких подъёмов даже после 50 минут, тем самым обеспечивая самую высокую надежность обнаружения вирусной РНК.
Проведенные эксперименты показали более высокую точность и специфичность наборов праймеров, подобранных с помощью компьютерной программы LAMPrimers iQ, вызванную снижением скорости протекания реакции с образцами отрицательного контроля. Кривые амплификации имели более поздние подъемы или не имели их вообще, даже по истечении 50 минут продолжительности реакции.
Список литературы / References
Список литературы Компьютерная программа подбора праймеров для LAMP-амплификации
- Гильмиярова Ф.Н., Колотьева Н.А., Гусякова О.А., Сидорова И.Ф. Полимеразная цепная реакция. История открытия. Новый этап развития. Консилиум. Лабораторная диагностика. 2017;154(4): 17-21. URL: https://cYberleninka.rU/article/n/polimeraznava-tsepnaYa-reaktsiYa-istoriYa-otkrvtiYa-novYY-etap-razvitiya/viewer (дата обращения: 05.11.2023). GilmiYarova FN, KolotYeva NA, GusYakova OA, Sidorova IF. Pofymerase Chain Reaction. Histoty of Discoveiy. New Stage of Development. Konsilium. Laboratornaya diagnostika. 2017;154(4):17-21. URL: https://cYberleninka.ru/article/n/polimeraznaYa-tsepnaYa-reaktsiYa-istoriYa-otkrvtiYa-novYY-etap-razvitiYa/viewer (accessed: 05.11.2023). (In Russ.).
- Гарафутдинов Р.Р., Баймиев А.Х., Малеев Г.В., Алексеев Я.И., Зубов В.В., Чемерис Д.А. и др. Разнообразие праймеров для ПЦР и принципы их подбора. Биомика. 2019;11(1):23-70. URL: https://biomicsi.ru/upload/iblock/ddf/bmcs19111023 1 .pdf?vsclid=lruepfV4zf297918053 (дата обращения: 05.11.2023). Garafutdinov RR, Baymiev AKh, Maleev GV, Alexeyev Yal, Zubov VV, Chemeris DA, et al. Diversity of PCR Primers and Principles of Their Design. Biomics. 2019;11(1):23-70. URL: https://biomicsi.ru/ upload/iblock/ddf/bmcs19111023 1 .pdf?vsclid=lruepfv4zf297918053 (accessed: 05.11.2023).
- Notomi T, Okayama H, Masubuchi H, Yonekawa T, Watanabe K, Amino N, et al. Loop-Mediated Isothermal Amplification of DNA. Nucleic Acids Research. 2000;28(12):e63 https://doi.org/10.1093/nar/28.12.e63
- Чемерис Д.А., Кирьянова О.Ю., Губайдуллин И.М., Чемерис А.В. Дизайн праймеров для полимеразной цепной реакции (краткий обзор компьютерных программ и баз данных). Биомика. 2016;8(3):215-238. URL: https ://biomicsi .ru/upload/iblock/b05/3 .pdf (дата обращения: 05.11.2023). Chemeris DA, Kiryanova OYu, Gubaydullin IM, Chemeris AV. Design of Primers for Polymerase Chain Reaction (Brief Review of Software and Databases). Biomics. 2016;8(3):215-238. URL: https://biomicsi.ru/ upload/iblock/b05/3.pdf (accessed: 05.11.2023).
- Ахметзянова Л.У., Давлеткулов Т.М., Гарафутдинов Р.Р., Губайдуллин И.М. Применение алгоритма Ахо-Корасик для подбора праймеров для петлевой изотермической амплификации. Математическая биология и биоинформатика. 2022;17(2):250-265. https://doi.org/10.17537/2022.17.250 Akhmetzianova LU, Davletkulov TM, Garafutdinov RR, Gubaydullin IM. Application of the Aho-Korasik Algorithm for the Selection of Primers for Loop Isothermal Amplification. Mathematical Biology and Bioinformatics. 2022;17(2):250-265. https://doi.org/10.17537/2022.17.250
- Akhmetzianova LU, Davletkulov TM, Sakhabutdinova AR, Chemeris AV, Gubaydullin IM, Garafutdinov RR. LAMPrimers iQ: New Primer Design Software for Loop-Mediated Isothermal Amplification (LAMP). Analytical Biochemistry. 2023;684:115376. https://doi.org/10.1016/i.ab.2023.115376
- Nagamine K, Hase T, Notomi T. Accelerated Reaction by Loop-Mediated Isothermal Amplification Using Loop Primers. Molecular and Cellular Probes. 2002;16(3):223-229. https://doi.org/10.1006/mcpr.2002.0415
- Zhiyong Chen, Yuxue Liao, Xuemei Ke, Jie Zhou, Yixiong Chen, Lulu Gao, et al. Comparison of Reverse Transcription Loop-Mediated Isothermal Amplification, Conventional PCR and Real-Time PCR Assays for Japanese Encephalitis Virus. Molecular Biology Reports. 2011;38(6):4063-4070. https://doi.org/10.1007/s11033-010-0525-0
- Nkere CK, Oyekanmi JO, Silva G, Bomer M, Atiri GI, Onyeka J, et al. Chromogenic Detection of Yam Mosaic Virus by Closed-Tube Reverse Transcription Loop-Mediated Isothermal Amplification (CT-RT-LAMP). Archives of Virology. 2018;163(4):1057-1061. https://doi.org/10.1007/s00705-018-3706-0
- Wang C, Shen X, Lu J, Zhang L. Development of a Reverse Transcription-Loop-Mediated Isothermal Amplification (RT-LAMP) System for Rapid Detection of HDV Genotype 1. Letters in Applied Microbiology. 2013;56(3):229-235. https://doi.org/10.1111/lam. 12039
- Hardinge P, Murray JAH. Lack of Specificity Associated with Using Molecular Beacons in Loop Mediated Amplification Assays. BMC Biotechnology. 2019;19(1):55. https://doi.org/10.1186/s12896-019-0549-z
- Бодулев О.Л., Сахаров И.Ю. Изотермические методы амплификации нуклеиновых кислот и их применение в биоанализе. Биохимия. 2020;85(2):174-196. https://doi.org/10.31857/S0320972520020037 Bodulev OL, Sakharov IYu. Isothermal Nucleic Acid Amplification Techniques and Their Use in Bioanalysis. Biochemistry. 2020;85(2):174-196. https://doi.org/10.31857/S0320972520020037 ~
- Ребольская Ю.А., Васенко Е.А., Мельник С.В., Сабиров Д.Х., Сарыгина Е.В. Бактериофаг лямбда как модельный объект в генетических исследованиях. В: Труды X Международной студенческой научной конференции «Студенческий научный форум-2018». Москва. 2018. URL: https://scienceforum.ru/- * 2018/article/2018002259 (дата обращения: 09.10.2023). ^
- Rebolskaya YuA, Vasenko EA, Melnik SV, Sabirov DKh, Sarygina EV. Bacteriophage Lambda as a Model Object « in Genetic Research. In: Proc. XInt. Student Electronic Sci. Conf. "Student Scientific Forum-2018". Saratov: LLC 5 Nauchno-izdatel'skii tsentr "Akademiya Estestvoznaniya"; 2018. URL: https://scienceforum.ru/2018/article/2018002259 § (accessed: 09.10.2023). (In Russ.).


